wraz z zranieniem zdrowej tkanki rozwija się przewidywalny postęp zdarzeń fizjologicznych. Postęp ten można podzielić na fazy zapalenia, proliferacji i dojrzewania. Każda faza charakteryzuje się sekwencyjnym opracowaniem charakterystycznych cytokin przez określone komórki. Zobacz zdjęcia poniżej.
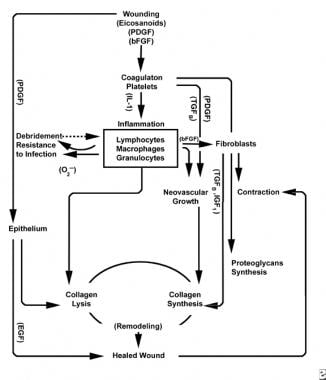 Schematy procesu gojenia się ran.
Schematy procesu gojenia się ran. 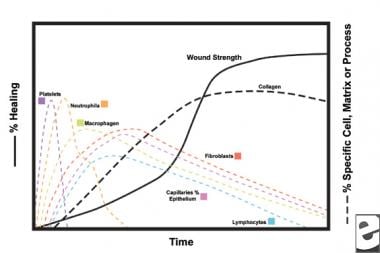 charakterystyka komórkowa procesu gojenia się ran.
charakterystyka komórkowa procesu gojenia się ran. Faza zapalna
Faza zapalna uruchamia jednocześnie mechanizmy hemostatyczne i szlaki, które tworzą klinicznie rozpoznawalne kardynalne objawy stanu zapalnego: rubor (zaczerwienienie), Kalor (ciepło), guz (obrzęk), dolor (ból) i functio laesa (utrata funkcji).
uszkodzenie tkanki naczyniowej inicjuje kaskadę koagulacji zewnętrznej poprzez uwolnienie wewnątrzkomórkowego wapnia i czynnika tkankowego, które aktywują czynnik VII. otrzymana wtyczka fibryny osiąga hemostazę wspomaganą przez odruchowe zwężenie naczyń. Wtyczka ta działa jako siatka do agregacji płytek krwi, najczęstszego i” sygnaturowego ” typu komórki wczesnej fazy zapalnej.
płytki krwi opracowują szereg substancji prozapalnych, takich jak adenozynodifosforan, czynnik wzrostu tkanki beta (TGF-ß) i czynniki wzrostu pochodzenia płytkowego (PDGF). Te czynniki wzrostu działają na otaczające komórki i stymulują chemotaksję neutrofili, monocytów i fibroblastów do obszaru urazu.
uszkodzone tkanki, poprzez aktywowaną fosfolipazę a, jednocześnie katalizują kwasy arachidonowe do produkcji wazoaktywnych prostaglandyn i tromboksanu, zwanych łącznie eikozanoidami. Eikozanoidy pośredniczą w działaniu wpływającym na tworzenie się płytek, przepuszczalność naczyń i chemotaksję komórkową, aby wpływać na gojenie się ran. Na przykład tromboksan A2 pośredniczy w skurczu naczyń krwionośnych i agregacji płytek krwi.
po początkowym zwężeniu naczyń klasyczne objawy zapalenia objawiają się zwiększoną przepuszczalnością naczyń. Rubor jest wynikiem rozszerzenia naczyń krwionośnych, w którym pośredniczy prostacyklina (PGI2), prostaglandyna a (PGA), prostaglandyna D (PGD) i prostaglandyna E (PGE). Guz i Kalor rozwijać jako naczyniowych szczelin śródbłonka powiększyć, umożliwiając wyjście białka osocza i płynu do przestrzeni śródmiąższowej. Zmiany te są nasilane przez PGE2 i prostaglandynę F2a (PGF2a) i umożliwiają wnikanie komórek zapalnych do obszaru urazu, w tym komórek, które się rozwijają. Dolor jest wykrywany jako pgi2, PGE i PGE2 działają na nocyceptory obwodowe.
w drugim etapie fazy zapalnej leukocyty zastępują płytki krwi jako dominujący typ komórki, przyciągany przez chemotaksję. Białe krwinki (WBC) są dominującymi komórkami przez pierwsze 3 dni po zranieniu; ich liczba osiąga szczyt po około 48 godzinach. Polimorfonukleocyty (PMN) są pierwszymi, które rozpoczynają działania bakteriobójcze przy użyciu mediatorów zapalnych i metabolitów wolnych rodników tlenowych. Jednak normalne gojenie się ran może wystąpić bez PMN. Inny leukocyt, pomocniczy limfocyt T, opracowuje interleukinę-2 (IL-2). IL-2 Promuje dalszą proliferację komórek T w celu zwiększenia odpowiedzi immunogennej na obrażenia.
gdy leukocyty PMN zaczynają słabnąć po 24-36 godzinach, krążące monocyty wchodzą do rany i dojrzewają do makrofagów tkankowych. Komórki te oczyszczają ranę na poziomie mikroskopowym i wytwarzają szeroką gamę ważnych substancji, takich jak IL-1 i podstawowy czynnik wzrostu fibroblastów (bFGF). IL-1 stymuluje proliferację komórek zapalnych i promuje angiogenezę poprzez replikację komórek śródbłonka. bFGF jest czynnikiem chemotaktycznym i mitogennym dla fibroblastów i komórek śródbłonka. W przeciwieństwie do PMNs, zubożenie makrofagów poważnie upośledza gojenie się ran, ponieważ oczyszczanie, proliferacja fibroblastów i angiogeneza zmniejszają się.
pod koniec cyklu zapalnego, rozwijające się środowisko eikozanoidów w ranie oddziałuje z obecnymi typami komórek, powodując syntezę fibroblastów kolagenu i substancji mielonej (ze zwiększonego stosunku PGF2a do PGE2). Dodatkowo, czynniki wzrostu pochodzące z makrofagów są obecnie na optymalnym poziomie, silnie wpływając na napływ fibroblastów, a następnie keratynocytów i komórek śródbłonka do rany. Jak komórki jednojądrzaste nadal zastępują WBC i makrofagi, rozpoczyna się faza proliferacyjna.
Faza proliferacyjna
dwa do trzech dni po zranieniu, fibroblasty migrują do wewnątrz z marginesów rany nad matrycą włóknistą utworzoną podczas fazy zapalnej. W pierwszym tygodniu fibroblasty zaczynają wytwarzać glikozaminoglikany i proteoglikany, substancję gruntową dla tkanki granulacyjnej, a także kolagen, w odpowiedzi na zsyntetyzowane makrofagi bFGF i TGF-ß, a także PDGF.
fibroblasty szybko stają się dominującym typem komórek, osiągając szczyt w 1-2 tygodniach. Wytwarzają nie tylko cząsteczki kolagenu, ale także cytokiny , takie jak PDGF, TGF-ß, bfgf, czynnik wzrostu keratynocytów i insulinopodobny czynnik wzrostu-1. Fibroblasty montują również cząsteczki kolagenu w włókna, które są usieciowane i zorganizowane w wiązki. Kolagen jest głównym składnikiem tkanki łącznej ostrej rany, a produkcja netto trwa przez następne 6 tygodni. Rosnąca zawartość kolagenu rany koreluje ze wzrostem wytrzymałości na rozciąganie.
keratynocyty i komórki śródbłonka również namnażają się w tym czasie, ostatecznie produkując autokrynne czynniki wzrostu, które utrzymują ich wzrost. Ekspansja śródbłonka przyczynia się do angiogenezy, ponieważ nienaruszone naczynia wytwarzają pąki w tkance granulacyjnej. Neowaskularyzacja ułatwia wzrost linii postępującej fibroblastów do rany, dostarczając im niezbędnych składników odżywczych i cytokin.
degradacji skrzepu fibrynowego i matrycy tymczasowej towarzyszy odkładanie się tkanki granulacyjnej (substancja gruntowa, kolagen, naczynia włosowate), która trwa aż do zakrycia rany. Zmniejszenie poziomu kwasu hialuronowego (w substancji gruntowej) i zwiększenie poziomu siarczanu chondroityny spowalnia migrację i proliferację fibroblastów, jednocześnie indukując różnicowanie fibroblastów, przechodząc do fazy dojrzewania gojenia się ran.
Faza dojrzewania
przez pierwsze 6 tygodni Nowa produkcja kolagenu dominuje w procesie gojenia się ran, zdeponowana losowo w tkance granulacyjnej ostrej rany. W miarę dojrzewania rany kolagen jest przebudowywany w bardziej zorganizowaną strukturę o zwiększonej wytrzymałości na rozciąganie. Stopniowo kolagen typu I zastępuje typ III, aż do osiągnięcia normalnego stosunku skóry 4:1. W miarę jak trwa przebudowa, kolagenoliza metaloproteinazy matrycowej osiąga stan równowagi z syntezą kolagenu. Wytrzymałość na rozciąganie płyty przy 80% pierwotnej wytrzymałości około 1 rok po injury.
powierzchowne do tej aktywności, komórki nabłonkowe nadal migrują do wewnątrz od krawędzi rany, aż wada jest pokryta. W tym momencie hamowanie kontaktowe indukuje transformację fibroblastów w miofibroblasty, które zawierają kurczliwe włókna aktyny. Następuje skurcz rany, zastępując uszkodzoną objętość tkanki nową tkanką, chociaż dokładna rola miofibroblastu nie została w pełni wyjaśniona.
środki odstraszające do gojenia się ran
ostre rany zazwyczaj przechodzą uporządkowany i terminowy proces naprawczy, który skutkuje trwałym przywróceniem integralności anatomicznej i funkcjonalnej. Jednak różne czynniki fizjologiczne i mechaniczne mogą upośledzać odpowiedź gojenia, co powoduje przewlekłą ranę, która nie przechodzi przez zwykły postęp stopniowy. Miejscowe zakażenie, niedotlenienie, uraz, ciała obce, lub ogólnoustrojowe problemy, takie jak cukrzyca, niedożywienie, niedobór odporności, lub leki są najczęściej odpowiedzialne.
wszystkie rany są zanieczyszczone, ale najbardziej skutecznie oprzeć się infekcji inwazyjnej. Gdy stężenie przekracza 100 000 (105) organizmów na gram tkanki lub układ odpornościowy zostaje osłabiony, często dochodzi do infekcji. Cellulitis wydłuża fazę zapalną, utrzymując wysoki poziom prozapalnych cytokin i proteaz tkankowych, które degradują tkankę granulacyjną i czynniki wzrostu tkanek, oraz opóźniając odkładanie się kolagenu.
Oczyszczanie (chirurgiczne, enzymatyczne i / lub zmiany opatrunkowe) i antybiotyki są podstawą leczenia antybiotykami. Oczyszczanie usuwa dewitalizowaną tkankę, która może być źródłem endotoksyn hamujących migrację fibroblastów i keratynocytów do rany. Ciała obce mogą również wymagać usunięcia, ponieważ obecność Jedwabnego szwu zmniejsza liczbę bakterii potrzebnych do podżegania do infekcji 10 000-krotnie. (Szczegółowy opis techniki znajduje się w artykule referencyjnym Medscape usuwanie ciała obcego.)
niedotlenienie komórkowe opóźnia gojenie się ran za pomocą różnych środków. Sieciowanie fibrilu kolagenowego wymaga tlenu do hydroksylowania proliny i lizyny i zawodzi, gdy ciśnienie w tkance jest poniżej 40 mm Hg. Bakteriobójcze działanie fosforylacji oksydacyjnej leukocytów cierpi również w środowisku niedotlenienia, zmniejszając próg infekcji. Środki mające na celu poprawę dostarczania tlenu zależą od etiologii. Należy zaprzestać używania tytoniu, który powoduje skurcz naczyń krwionośnych i zwiększa przyleganie płytek krwi. Angioplastyka lub tętnicze bypass szczepienia mogą być wymagane w przypadku choroby naczyń obwodowych. W przypadkach niewydolności serca może być wskazane zastosowanie środków wspomagających w celu poprawy perfuzji ogólnoustrojowej. Wartość hematokrytu poniżej 15% należy leczyć i przywrócić euvolemię w razie potrzeby. Zastój żylny lub niewydolność limfatyczna może być poprawiona przy użyciu odzieży uciskowej.
choroba układowa może znacznie przedłużyć lub przerwać gojenie się ran. Glikozylacja w cukrzycy upośledza neutrofilów i makrofagów fagocytozę bakterii, przedłużając fazę zapalną. Faza proliferacyjna jest również przedłużona w tej samej chorobie, ponieważ erytrocyty stają się mniej giętkie i mniej zdolne do dostarczania tlenu do rany w celu metabolizmu tkanek i syntezy kolagenu.
niedożywienie powoduje zmniejszenie proliferacji fibroblastów, upośledzenie neowaskularyzacji i zmniejszenie odporności komórkowej i humoralnej. Rany wywierają zwiększone zapotrzebowanie metaboliczne, szczególnie w tkance granulacyjnej. Aminokwasy, takie jak metionina, prolina, glicyna i lizyna, są niezbędne do prawidłowego funkcjonowania komórek i naprawy ran skórnych. Kwasy tłuszczowe są krytycznymi składnikami błon komórkowych i są substratem dla eikozanoidów, które pośredniczą w procesie zapalnym. Niezbędne kwasy tłuszczowe linolenowy i kwas linolowy muszą być dostarczane w diecie, ponieważ organizm ludzki nie jest w stanie de novo syntezy tych cząsteczek.
odpowiednie witaminy i minerały muszą być dostępne dla metabolizmu komórkowego, działając jako sygnały komórkowe i kofaktory. Witamina C (kwas askorbinowy) i żelazo są wymagane do hydroksylacji lizyny i proliny, które sieciują i stabilizują potrójną strukturę helisy kolagenu; miedź odgrywa również rolę w stabilizowaniu kolagenu. Witamina A (kwas retinowy) odgrywa ważną rolę w modulowaniu produkcji i degradacji kolagenu i jest szczególnie ważna w epitelializacji. Silny przeciwutleniacz, witamina E (alfa tokoferol) wydaje się przyspieszać gojenie skóry i kości u zwierząt, a suplementacja może odgrywać rolę u ludzi. Niedobór metali śladowych, zwłaszcza cynku, wiąże się również ze złym gojeniem się ran; należy to odpowiednio uzupełnić.
Ovid rzekomo napisał: „leki czasami leczą, czasami zabijają.”Jest to z pewnością prawdą w odniesieniu do gojenia się ran. Kortykosteroidy tępić procesy całej fazy zapalnej. Witamina A (miejscowo lub 25 000 j. m./d doustnie) łagodzi szkodliwe działanie kortykosteroidów, ale hepatotoksyczność może wynikać z długotrwałego stosowania (tj. >1 mo). Niesteroidowe leki przeciwzapalne (NLPZ) również zakłócają metabolizm kwasu arachidonowego, a tym samym gojenie się ran. Dodatkowo NLPZ hamują czynność płytek krwi, jeden z najwcześniejszych procesów w fazie zapalnej.
badanie przeprowadzone przez Sutcliffe i wsp. sugerowało, że upregulation białka złącza szczeliny connexin jest wspólne dla ran przewlekłych. Badając connexin w trzech rodzajach ran-żylnej nodze, stopie cukrzycowej i wrzodach ciśnieniowych—badacze odkryli, że każdy rodzaj rany wykazywał regulację naskórkowej connexin 43, connexin 26 i connexin 30, a także skórnej connexin 43.