wprowadzenie
żylna choroba zakrzepowo-zatorowa (VTE), w tym zakrzepica żył głębokich (DVT), zatorowość płucna (PE) i zakrzepica żył splanchnicznych, jest częstym powikłaniem raka.1 rozwój choroby zakrzepowo-zatorowej związanej z chorobą nowotworową wiąże się z obniżoną jakością życia i stanowi znaczne obciążenie ekonomiczne zarówno dla pacjenta, jak i systemu opieki zdrowotnej.2 ŻChZZ jest drugą najczęstszą przyczyną zgonów pacjentów ambulatoryjnych otrzymujących chemioterapię i wykazano, że jest niezależnym predyktorem śmiertelności w populacji pacjentów z chorobą nowotworową.3,4 leczenie ŻChZZ związanych z rakiem może być trudne, ponieważ ryzyko nawracających ŻChZZ i krwawień związanych z leczeniem przeciwzakrzepowym jest wysokie pomimo odpowiedniego postępowania.Ponadto interakcje z lekami i choroby współistniejące z nowotworami, takie jak zaburzenia czynności nerek i (lub) wątroby, zmniejszone przyjmowanie doustne, nudności i wymioty wywołane chemioterapią oraz małopłytkowość również zwiększają złożoność leczenia, ograniczając wybór leku przeciwzakrzepowego.
badania kliniczne oceniające heparynę o małej masie cząsteczkowej w leczeniu VTE związanych z rakiem
długotrwałe stosowanie heparyny o małej masie cząsteczkowej (LMWH) w leczeniu VTE u pacjentów z czynnym rakiem jest zalecane jako leczenie pierwszego rzutu na podstawie wyników wielu otwartych randomizowanych kontrolowanych badań klinicznych (rcts).W dwóch największych opublikowanych do tej pory badaniach, CLOT (porównanie heparyny o małej masie cząsteczkowej z doustnym leczeniem przeciwzakrzepowym w zapobieganiu nawrotowej żylnej chorobie zakrzepowo-zatorowej u pacjentów z chorobą nowotworową) i CATCH (porównanie ostrych metod leczenia hemostazy nowotworowej), porównywano LMWH z leczeniem antagonistą witaminy K u pacjentów z czynnym rakiem i ostrą objawową proksymalną ZŻG lub ZP. Patrz Tabela 1 dla charakterystyki wyjściowej i Tabela 2 dla wyników badań.8,9 w obu badaniach stosowano projekt badania otwartego, ten sam docelowy Międzynarodowy współczynnik znormalizowany (INR) w ramieniu kontrolnym antagonisty witaminy K, tę samą definicję aktywnego raka i ten sam czas trwania leczenia oraz miały porównywalne kryteria kwalifikowalności pacjentów.
Tabela 1: projekt badania i charakterystyka wyjściowa badań połowu i skrzepu
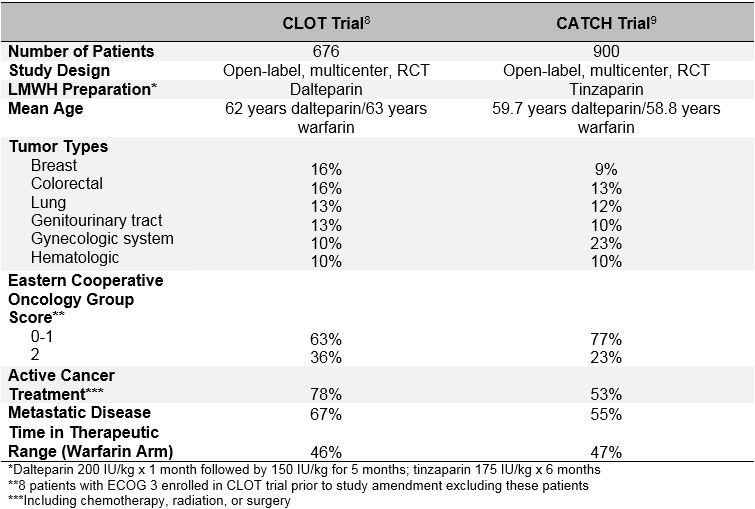
Tabela 2: Wyniki badań skrzepu i połowów

w badaniu CLOT, opublikowanym w 2003 r., randomizowano 676 pacjentów do grupy otrzymującej dalteparynę (200 J. M./kg mc. na dobę przez 1 miesiąc, a następnie 150 J. M./kg mc. na dobę przez 5 miesięcy) lub antagonistę witaminy K (warfarynę lub acenokumarol z docelowym INR 2,5 przez łącznie 6 miesięcy, z początkowym okresem 5-7 dni pokrywającym się z dalteparyną 200 J. M./kg mc.).8 U 27 pacjentów (7,0%) randomizowanych do grupy otrzymującej dalteparynę i u 53 pacjentów (15%) randomizowanych do grupy otrzymującej antagonistę witaminy K (współczynnik ryzyka 0,48; 95% przedział ufności, 0, 30-0, 77; P = 0, 002). W obu grupach nie obserwowano różnic w częstości występowania dużego krwawienia (6 vs.4%; p = 0,27), jakiegokolwiek krwawienia (15 vs.19%; p = 0,09) lub zgonu (39 vs. 41%; p = 0,53).
w badaniu CATCH, opublikowanym ponad 10 lat później w 2015 r., 900 pacjentów przydzielono losowo do grupy otrzymującej tinzaparynę (175 J. M./kg mc. na dobę bez zmniejszenia dawki) lub warfarynę (docelowy INR 2,0-3,0 przy początkowej dawce tinzaparyny 175 J. M./kg mc. przez 5-10 dni) przez łącznie 6 miesięcy.9 pierwszorzędowy złożony punkt końcowy nawracającej ŻChZZ, w tym incydentalna proksymalna ZŻG i ZP, wystąpił u 31 pacjentów (6,9%) w ramieniu tinzaparyny i u 45 pacjentów (10%) w ramieniu warfaryny (HR 0,65; 95% CI, 0,41-1,03; p = 0,07). Objawowa zakrzepica żył głębokich wystąpiła u znamiennie mniejszej liczby pacjentów leczonych tinzaparyną (2,7 vs. 5,3%; HR 0,48; 95% CI, 0,24-0,96; p = 0,04). Chociaż częstość występowania dużych krwawień była podobna w obu ramionach, obserwowano istotne zmniejszenie liczby klinicznie istotnych, innych niż duże krwawień w przypadku stosowania tinzaparyny (10, 9 vs. 15, 3%; HR 0, 58; 95% CI, 0, 40-0, 84; P = 0, 004). Śmiertelność była podobna w obu grupach, przy czym około jedna trzecia pacjentów umierała w okresie badania (33,4 vs.30,6%; p = 0,54). Chociaż tinzaparyna nie zmniejszyła znacząco pierwszorzędowego złożonego punktu końcowego nawracającej ŻChZZ, wyniki badania CATCH potwierdzają stosowanie długotrwałego LMWH jako preferowanego leczenia ŻChZZ związanych z rakiem, ze względu na mniejsze ryzyko klinicznie istotnego dużego krwawienia i znaczące zmniejszenie nawracającej ŻChZZ.
niepowodzenie badania połowowego w celu osiągnięcia istotności statystycznej dla pierwszorzędowego punktu końcowego może być spowodowane niższym niż oczekiwano powtarzającym się częstością ŻChZZ obserwowanym w ramieniu warfaryny. Jednym z możliwych wyjaśnień tej obserwacji może być poprawa zarządzania warfaryną w badaniu połowowym. Jednak podobne poziomy kontroli INR w obu badaniach przemawiają przeciwko temu (Czas w zakresie terapeutycznym wynosił 46% W ZAKRESIE skrzepu w porównaniu do 47% W przypadku połowu; czas powyżej zakresu terapeutycznego wynosił 24% W ZAKRESIE skrzepu w porównaniu do 27% W przypadku połowu). Bardziej prawdopodobnym wyjaśnieniem jest tendencja w wyborze „mniej chorych” pacjentów do rejestracji w badaniu CATCH. Chociaż w badaniach CATCH i skrzep stosowano podobne kryteria włączenia i wykluczenia, istnieją kluczowe różnice w wyjściowych cechach obu populacji pacjentów, szczególnie w odniesieniu do czynników ryzyka zakrzepowego i prognostycznego. Wyższy odsetek pacjentów uczestniczących w badaniu dotyczącym skrzepu otrzymywał aktywne leczenie przeciwnowotworowe (72% skrzepu vs 53% CATCH), miał wcześniejszą żylną żylną chorobę (11% skrzepu vs 6% CATCH), miał objawy choroby przerzutowej (67% skrzepu vs. 55% połowu) i miał gorszy stan osiągów (wynik Wschodniopomorskiej grupy onkologicznej 2 W 36% połowu vs 23% połowu). Ponadto śmiertelność podczas 6-miesięcznego okresu leczenia była również wyższa w populacji skrzepów (39% skrzepów w porównaniu z 32% złowionych). Tak więc populacja pacjentów z CATCH miała prawdopodobnie mniejsze ryzyko nawrotu ŻChZZ w porównaniu z pacjentami badanymi w badaniu skrzepów. Jest wysoce prawdopodobne, że badacze nie zapisali pacjentów do CATCH, jeśli uważali, że LMWH będzie bardziej korzystne niż warfaryna, co prowadzi do selektywnej rekrutacji pacjentów, u których prawdopodobieństwo nawracającej żylnej choroby zakrzepowo-zatorowej jest mniejsze.
badania oceniające bezpośrednie doustne leki przeciwzakrzepowe w żylnej chorobie nowotworowej
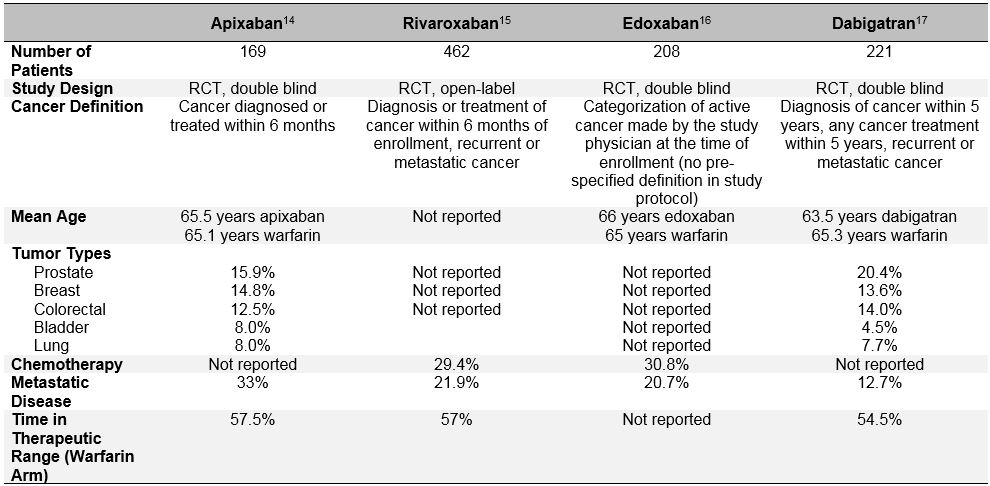
tendencja doboru pacjentów jest jeszcze bardziej widoczna w ostatnich randomizowanych badaniach oceniających skuteczność i bezpieczeństwo stosowania bezpośrednich doustnych leków przeciwzakrzepowych (doacs) w leczeniu ostrej żylnej choroby zakrzepowej.Te doustne leki przeciwzakrzepowe były szeroko badane w ciągu ostatniej dekady w zakresie migotania przedsionków, leczenia ŻChZZ i zapobiegania ŻChZZ. W przełomowych badaniach klinicznych III fazy dotyczących leczenia ostrych ŻChZZ konsekwentnie wykazano, że DOACs nie są gorsze od warfaryny (łączne ryzyko względne 0,90; 95% CI, 0,77-1.06) w zapobieganiu nawrotowej żylnej chorobie zakrzepowo-zatorowej i mają podobne lub zmniejszone ryzyko wystąpienia poważnych krwawień (łącznie RR 0,40; 95% CI, 0,45-0,83).Wśród tych pacjentów, którzy zostali sklasyfikowani jako „rak” lub „rak czynny” w tych badaniach, DOACs wydaje się również działać podobnie jak warfaryna.12 jednak bardziej dogłębna analiza tych danych post-hoc ujawnia istotne odchylenia od wyboru pacjenta i kwestionuje uogólnienie wyników badania DOAC na” prawdziwych ” pacjentów z rakiem z VTE. Oprócz niejednorodnych definicji „aktywnego raka” stosowanych w tych badaniach, które różniły się od badań skrzepu i CATCH, ważne czynniki determinujące nawracające ŻChZZ i krwawienie były również bardzo różne u pacjentów z DOAC z rakiem od badań specyficznych dla raka LMWH (Tabela 3). Należą do nich obecność przerzutów i jednoczesne stosowanie leczenia przeciwnowotworowego. Ogromne różnice w umieralności w okresie badania dowodzą również, że bardzo różne grupy pacjentów z „rakiem” zostały włączone do badań DOAC w porównaniu z LMWH. Ponadto, w przeciwieństwie do LMWH, która wiąże się ze znacznym zmniejszeniem ryzyka nawrotowych ŻChZZ w porównaniu z antagonistami witaminy K (RR 0,52; 95% CI, 0,36-0.W metaanalizie 1132 pacjentów z rakiem włączonych do programu badań klinicznych Einsteina, HOKUSAI-VTE (Edoksaban w porównaniu z warfaryną w leczeniu objawowej żylnej choroby zakrzepowo-zatorowej), RECOVER (skuteczność i bezpieczeństwo stosowania dabigatranu w porównaniu z warfaryną w 6-miesięcznym leczeniu ostrej objawowej żylnej choroby zakrzepowo-zatorowej) i AMPLIFY (apiksaban w leczeniu początkowej zatorowości płucnej i zakrzepicy żył głębokich w leczeniu pierwszego rzutu) RCTs (RR 0, 66; 95% CI, 0, 39-1, 11).Wszystkie te rozważania powinny ostrzegać przed niezaznaczonym stosowaniem DOACs u pacjentów z czynnym rakiem i ostrą, objawową żylną żylną chorobą nowotworową.
Tabela 3: Projekt badania i charakterystyka wyjściowa podgrup pacjentów z rakiem z badań III fazy DOAC
wnioski
wszystkie główne wytyczne konsensusu oparte na dowodach zalecają LMWH w początkowym i długoterminowym leczeniu ŻChZZ związanych z rakiem.6,7,13 zalecenie to opiera się na obserwacji, że LMWH nie tylko jest skuteczniejsza niż warfaryna w zapobieganiu nawrotowym żylnym zapaleniu żył, ale oferuje również dodatkowe korzyści w porównaniu z lekami doustnymi, w tym stabilne działanie przeciwzakrzepowe u pacjentów ze słabym przyjmowaniem doustnym, brakiem interakcji z lekami i doświadczeniem klinicznym w leczeniu przeciwzakrzepowego leczenia towarzyszącego zabiegom inwazyjnym i małopłytkowości. Chociaż DOACs nie są obecnie zalecane w leczeniu ŻChZZ u pacjentów z rakiem, RCTs porównujące rywaroksaban i edoksaban z LMWH są obecnie w toku i pomogą wyjaśnić ich rolę w ŻChZZ związanych z rakiem.6,13
- Khorana AA, Dalal m, Lin J, Connolly GC. Częstość występowania i czynniki predykcyjne żylnej choroby zakrzepowo-zatorowej (VTE) wśród ambulatoryjnych pacjentów z nowotworami wysokiego ryzyka poddawanych chemioterapii w Stanach Zjednoczonych. Rak 2013;119: 648-55.
- Kourlaba G, Relakis J, Mylonas C, et al. Humanistyczne i ekonomiczne obciążenie żylnej choroby zakrzepowo-zatorowej u chorych na raka: przegląd systematyczny. Koagul Fibrynolysis Krwi 2015;26: 13-31.
- Kuderer NM, Ortel TL, Francis CW. Wpływ żylnej choroby zakrzepowo-zatorowej i przeciwzakrzepowej na raka i przeżycie raka. J Clin Oncol 2009;27: 4902-11.
- Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. Choroba zakrzepowo-zatorowa jest główną przyczyną zgonów pacjentów z chorobą nowotworową otrzymujących ambulatoryjną chemioterapię. J Thromb 2007; 5: 632-4.
- Prandoni P, Lensing AW, Piccioli A, et al. Nawracająca żylna choroba zakrzepowo-zatorowa i powikłania krwotoczne podczas leczenia przeciwzakrzepowego u pacjentów z nowotworami i zakrzepicą żylną. Blood 2002;100: 3484-8.
- Lyman GH, Bohlke K, Khorana AA, et al. Żylna choroba zakrzepowo-zatorowa profilaktyka i leczenie u pacjentów z rakiem: American society of clinical oncology clinical practice guideline update 2014. J Clin Oncol 2015; 33: 654-6.
- Streiff MB, Holmstrom B, Ashrani A, et al. Żylna Choroba Zakrzepowo-Zatorowa Związana Z Rakiem, Wersja 1.2015. J Natl Compr Canc Netw 2015;13: 1079-95.
- Lee AY, Levine MN, Baker Ri, et al. Heparyna niskocząsteczkowa a kumaryna w zapobieganiu nawracającej żylnej chorobie zakrzepowo-zatorowej u pacjentów z chorobą nowotworową. N Engl J Med 2003; 349: 146-53.
- Lee AY, Kamphuisen PW, Meyer G, et al. Tinzaparyna vs warfaryna w leczeniu ostrej żylnej choroby zakrzepowo-zatorowej u pacjentów z czynnym rakiem: randomizowane badanie kliniczne. JAMA 2015; 314: 677-86.
- Carrier M, Cameron C, Delluc a, Castellucci L, Khorana AA, Lee AY. Skuteczność i bezpieczeństwo leczenia przeciwzakrzepowego w leczeniu ostrej zakrzepicy związanej z nowotworami: przegląd systematyczny i metaanaliza. Thromb Res 2014; 134: 1214-9.
- van Es N, Coppens m, Schulman s, Middeldorp S, Büller HR. bezpośrednie doustne leki przeciwzakrzepowe w porównaniu z antagonistami witaminy K w ostrej żylnej chorobie zakrzepowo-zatorowej: dowody z badań fazy 3. Blood 2014;124: 1968-75.
- Vedovati MC, Germini F, Agnelli G, Becattini C. bezpośrednie doustne leki przeciwzakrzepowe u pacjentów z ŻChZZ i rakiem: przegląd systematyczny i metaanaliza. Chest 2015;147: 475-83.
- Kearon C, Akl EA, Ornelas J, et al. Leczenie przeciwzakrzepowe w chorobie VTE: Wytyczne klatki piersiowej i raport Panelu Ekspertów. Chest 2016;149: 315-52.
- Agnelli G, Büller HR, Cohen A, et al. Doustny apiksaban do leczenia żylnej choroby zakrzepowo-zatorowej u pacjentów z chorobą nowotworową: wyniki badania AMPLIFY. J Thromb 2015;13: 2187-91.
- Prins MH, Lensing AW, Brighton TA, et al. Rywaroksaban doustny w porównaniu z enoksaparyną z antagonistą witaminy K w leczeniu objawowej żylnej choroby zakrzepowo-zatorowej u pacjentów z chorobą nowotworową (EINSTEIN-DVT i EINSTEIN-PE): zbiorcza analiza podgrup dwóch randomizowanych kontrolowanych badań klinicznych. Lancet Haematol 2014; 1: e37-46.
- Raskob GE, van Es N, Segers A, et al. Edoksaban stosowany w żylnej chorobie zakrzepowo-zatorowej u pacjentów z rakiem: wyniki analizy podgrupy równoważności randomizowanego, podwójnie zaślepionego badania Hokusai-VTE. Lancet Haematol 2016; 3: e379-87.
- Schulman S, Goldhaber SZ, Kearon C, et al. Leczenie dabigatranem lub warfaryną u pacjentów z żylną chorobą zakrzepowo-zatorową i rakiem. Thromb 2015;114: 150-7.
tematy kliniczne: Anticoagulation Management, Arrhythmias and Clinical EP, Cardio-Oncology, Pulmonary Hypertension and Venous Thromboembolism, Anticoagulation Management and Atrial Fibrillation, Anticoagulation Management and Venothromboembolism, Atrial Fibrillation/Supraventricular Arrhythmias
Keywords: Kardiotoksyny, kardiotoksyczność, heparyna, niska masa cząsteczkowa, warfaryna, leki przeciwzakrzepowe, Międzynarodowy Współczynnik znormalizowany, acenokumarol, dalteparyna, antytrombiny, żylna choroba zakrzepowo-zatorowa, czynniki ryzyka, migotanie przedsionków, pacjenci ambulatoryjni, personel badawczy, jakość życia, Pirydony, Pirazole, pirydyny, Tiazole, zakrzepica żylna, zatorowość płucna, zakrzepica, trombocytopenia, współistniejąca choroba zakrzepowo-zatorowa, nowotwory
< powrót do ogłoszenia