rak płaskonabłonkowy głowy i szyi (SCCHN) jest szóstym najczęściej występującym nowotworem na świecie z ~600 000 przypadków diagnozowanych rocznie. Ostatnie 20 lat przyniosły bogactwo danych z badań klinicznych, co zmieniło standardy opieki nad leczeniem SCCHN. Historycznie, słaba lokalna kontrola choroby i całkowity czas przeżycia stanowiły impuls dla wielu badań klinicznych oceniających terapię multimodalną u pacjentów z SCCHN. Skomplikowana anatomia i krytyczne funkcje funkcjonalne i społeczne regionu głowy i szyi nie mają wątpliwości również motywowane znaczące wysiłki w celu identyfikacji alternatyw dla onkologicznej resekcji nowotworów złośliwych w tym regionie. W tym przeglądzie podsumowujemy historyczny rozwój skojarzonej terapii chemioradiacyjnej w leczeniu SCCHN, dostarczamy aktualizację najnowszej literatury w tej dziedzinie i omawiamy współczesne pytania kliniczne, które przyszłe badania mogą rozwiązać.
Chemioradiacja równoległa—od leczenia eksperymentalnego do preferowanego
badania kliniczne dotyczące roli skojarzonego leczenia chemioradiacyjnego SCCHN datuje się na co najmniej późne lata 60., a wczesne badania badają sekwencyjne i jednoczesne stosowanie pojedynczych środków, w tym fluorouracylu (5FU), bleomycyny, cisplatyny, metotreksatu i mitomycyny.1 takie badania wykazały słabą odpowiedź na samą chemioterapię w monoterapii, wskazując na cisplatynę jako najskuteczniejszy preparat w monoterapii z 25-30% odsetkiem odpowiedzi.W kolejnych 2-4 badaniach oceniano rolę wieloczynnikowej chemioterapii i wykazano znaczną poprawę odpowiedzi na chorobę do 70% W przypadku skojarzonej cisplatyny i bleomycyny 5 oraz >90% W przypadku cisplatyny i infuzji ciągłej 5FU.Co ważne, te wczesne badania wskazywały na potencjalne korzyści dla przeżycia wynikające z dodania chemioterapii do tradycyjnych ostatecznych metod leczenia radioterapii i / lub chirurgii w przypadku SCCHN i skłoniły do dalszych badań w większych randomizowanych badaniach fazy III.
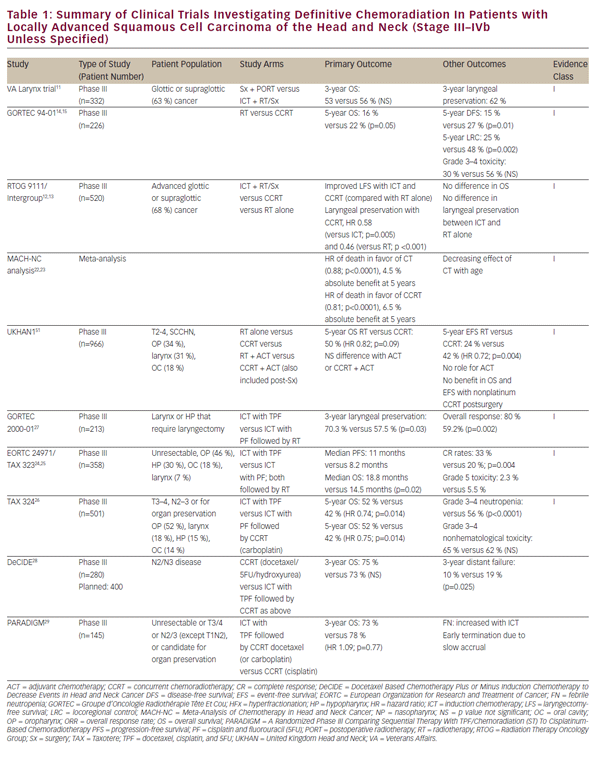
wraz z udoskonaleniem schematów chemioterapeutycznych rozważano możliwość ostatecznego i oszczędzającego narząd podejścia do chemioradiacji u pacjentów z miejscowo zaawansowanym SCCHN. Praca ta była początkowo rozwijana przez serię badań jedno-instytucjonalnych wykazujących żywotność ostatecznej chemioradiacji jako alternatywy dla chirurgii w przypadku guzów krtani i nadglottycznych.8-10 historycznie ważne badanie Veteran Affairs Laryngeal Cancer Study ostatecznie wykazało, że chemioterapia indukcyjna (ICT), a następnie radioterapia, może osiągnąć zachowanie narządów u pacjentów z SCCHN bez pogorszenia ogólnego przeżycia.Badanie to ustaliło uzasadnienie dla przełomowego badania radioterapia Oncology Group (RTOG) 9111, które dotyczyło odpowiedniego uporządkowania chemioterapii i radioterapii u pacjentów z miejscowo zaawansowanym rakiem nadglottycznym lub głośnikowym krtani. Pacjentów randomizowano do następujących grup: ICT, a następnie radioterapia; równoczesna chemioradiacja (CCRT); albo samo promieniowanie.12,13 wyniki badania RTOG 9111 wykazały wyższość CCRT pod względem kontroli chorób lokoregionalnych i zachowania krtani, podczas gdy nie zaobserwowano różnic w przeżywalności Ogólnej w trzech grupach. Następnie w badaniu Groupe d ’ Oncologie Radiothérapie tête Et Cou (GORTEC) 94-01 randomizowano pacjentów z miejscowo zaawansowanymi guzami pierwotnymi jamy ustnej i gardła do radioterapii lub CCRT z karboplatyną/5FU i wykazano poprawę lokalnej kontroli choroby, jak również całkowite przeżycie.14,15 podobną poprawę przeżywalności i kontroli w miejscu położenia odnotowano u pacjentów z nosogardzieli leczonych CCRT.16-21 raport z metaanalizy chemioterapii w raku głowy i szyi (MACHNC) zasugerował ogólną korzyść z przeżycia w wysokości 6,5% po 5 latach z CCRT, ale nie z ICT lub chemioterapią adiuwantową.22,23 w tej metaanalizie zaobserwowano, że wpływ chemioterapii na przeżywalność zmniejsza się wraz z wiekiem u osób w wieku powyżej 50 lat, przy czym nie wykazano wyraźnych korzyści u osób w wieku 71 lat i starszych. Łącznie, chociaż badania te różnią się kryteriami włączenia i wykluczenia, klinicznymi punktami końcowymi i metodami leczenia (patrz Tabela 1), potwierdzają one korzyść z CCRT w porównaniu z samą radioterapią jako ostatecznego leczenia miejscowo zaawansowanego SCCHN.
Chemioterapia Indukcyjna Poprzedzająca (Chemo) Promieniowanie-Realna Strategia?
chociaż bezpośrednie porównanie z CCRT wykazało niższość tik pod względem lokalnej kontroli choroby w badaniu klinicznym RTOG 9111,12 pozostaje zainteresowanie tym podejściem terapeutycznym. Dane pochodzące z RTOG 9111 wskazują na równoważność tych podejść pod względem wysokiej jakości toksyczności, co utrudnia uzasadnienie wyboru tik ze względu na tolerancję pacjenta. Niemniej jednak badania kontynuacyjne dotyczące RTOG 9111 miały na celu rozwinięcie platformy ICT w celu uczynienia z tego bardziej opłacalną opcję leczenia. Badanie EORTC 24971 / TA X 32324, 25 wykazało poprawę całkowitego przeżycia po dodaniu docetakselu (TPF) do schematu tik cisplatyny i 5FU (PF) stosowanego w badaniu RTOG 9111 u pacjentów z nieoperacyjnym SCCHN. W badaniu TA x 324 podobnie oceniano TPF w porównaniu z PF w ustalaniu CCRT i zastępowaniu karboplatyny raz w tygodniu cisplatyną w tych schematach. Badanie to wykazało poprawę kontroli choroby w okolicy i na odległość, jak również poprawę całkowitego przeżycia po TPF w porównaniu z PF.Dodatkowe badanie kontrolne (GORTEC 2000-01) z udziałem miejscowo zaawansowanego raka krtani i gardła potwierdziło lepszą odpowiedź na chorobę i zachowanie krtani przy indukcji TPF w porównaniu z PF, ale nie wykazało żadnego wpływu na przeżycie.Chociaż badania te różnią się pod względem kryteriów włączenia i wykluczenia, klinicznych punktów końcowych i metod leczenia (patrz Tabela 1), łącznie potwierdzają wyższość TPF nad tik opartymi na PF. Niemniej jednak brakuje bezpośredniego porównania tik ze standardowym systemem CCRT opartym na cisplatynie.
metaanaliza MACH-NC, jak wcześniej zauważono, sugerowała niższość TIK w porównaniu z CCRT pod względem całkowitego przeżycia i kontroli choroby w regionie.Należy jednak zauważyć, że korzyści płynące z TIK były wyraźniejsze niż korzyści płynące z CCRT pod względem częstości występowania przerzutów odległych.Może to odzwierciedlać wyraźną rolę chemioterapii w tych metodach leczenia. Równoczesna chemioterapia może odgrywać dominującą rolę radiosensybilizującą, co skutkuje dominującym wpływem na miejscową kontrolę choroby, podczas gdy wieloskładnikowe tik mogą zapewnić skuteczne leczenie ogólnoustrojowe w przypadku choroby mikro-przerzutowej. Ta obserwacja generująca hipotezę sugeruje potencjalnie komplementarny charakter tych zabiegów i wzbudziła zainteresowanie ich połączeniem. Do tej pory wysiłki zmierzające do zbadania połączenia ICT i CCRT doprowadziły do słabych wyników memoriałowych i niejednoznacznych (badania DeCIDE i paradygmatu).28,29 trwające randomizowane badanie III fazy porównuje tik z PF lub TPF, a następnie CCRT oparte na cisplatynie z samym CCRT jako leczenie pierwszego rzutu miejscowo zaawansowanego SCCHN (NCT00261703). Wyniki powyższych badań dotyczących CCRT i ICT są również podsumowane w tabeli 1.
Chemioradiacja adiuwantowa
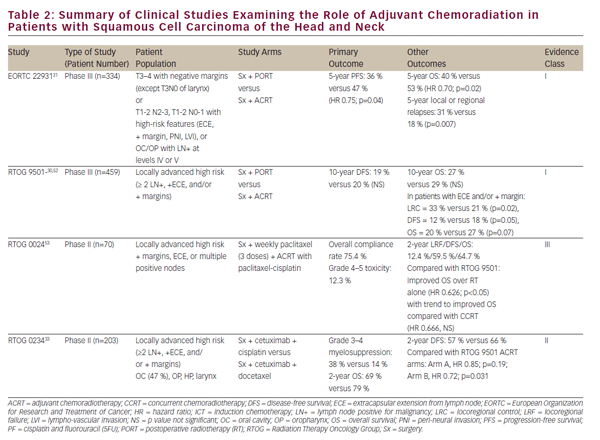
w wyżej wymienionych badaniach klinicznych ustalono CCRT jako realne ostateczne leczenie zachowania narządów w miejscowo zaawansowanym SCCHN. Niemniej jednak, ostateczne resekcja onkologiczna pozostaje ważną opcją leczenia dla zlokalizowanej choroby i istotną częścią terapii multimodalności dla zaawansowanych nowotworów jamy ustnej, krtani i gardła. Rola chemioradiacji w leczeniu adiuwantowym po resekcji onkologicznej została w dużej mierze określona w dwóch randomizowanych badaniach fazy III-EORTC 22931 i RTOG 950130,31(patrz Tabela 2). W badaniach tych oceniano stosowanie radioterapii pooperacyjnej w porównaniu z chemioradiacją adiuwantową cisplatyną podawaną co 3 tygodnie przez trzy cykle u pacjentów z SCCHN pooperacyjnych. W obu badaniach wykazano poprawę kontroli choroby w regionie oraz czas przeżycia bez progresji choroby, podczas gdy w badaniu EORTC wykazano również poprawę czasu przeżycia całkowitego. Analiza post-hoc tych dwóch badań sugerowała, że korzyści z adiuwantowego CCRT były największe u pacjentów z dodatnim marginesem chirurgicznym i (lub) rozszerzeniem zewnątrztorebkowym (ECE) z wyciętych węzłów chłonnych.Rola adiuwantowego CCRT u pacjentów z bliskimi marginesami chirurgicznymi jest mniej jasna i została potwierdzona przez EORTC 22931, który obejmował pacjentów z marginesem chirurgicznym ≤5 mm. Z drugiej strony RTOG 9501 obejmował pacjentów na podstawie dodatnich, ale nie bliskich marginesów. Analiza Post-hoc nie sugeruje widocznych korzyści z CCRT u pacjentów spełniających kryteria włączenia tylko do jednego z tych badań.W podobny sposób adiuwant CCRT nie był odpowiednio badany u pacjentów w podeszłym wieku, ponieważ osoby w wieku powyżej 70 lat były wykluczone z EORTC 22931 i stanowiły jedynie niewielką mniejszość (5%) pacjentów z RTOG 9501.30,31
Pursuant to EORTC 22931 and RTOG 9501, adjuvant CCRT has now become standard-of-care treatment in high-risk postoperative SCCHN patients. The phase II RTOG 0234 study has explored alternative adjuvant chemoradiation treatment regimens, randomizing patients with multiple involved lymph nodes, ECE, or positive margins to the epidermal growth factor receptor (EGFR) antibody, cetuximab, plus docetaxel or cetuximab plus cisplatin. This study demonstrated an apparent survival benefit from concurrent adjuvant cetuximab and docetaxel.Wyniki tego intrygującego badania II Fazy wymagają zatwierdzenia w badaniu III fazy przed włączeniem do praktyki klinicznej.
radioterapia frakcjonowanie wpływ na Chemioradiację
w celu zwiększenia skuteczności, wcześniejsze badania kliniczne badały alternatywne Schematy frakcjonowania w przypadku radioterapii z równoczesną chemioterapią lub bez niej u pacjentów z SCCHN. Badania RTOG 9003 i Danish Head and Neck Cancer Group (DAHANCA) wykazały poprawę w Kontroli Chorób w regionie z przyspieszonymi lub hiperfrakcjonowanymi schematami radioterapii, gdy promieniowanie jest stosowane samodzielnie.34,35 późniejsza metaanaliza sugerowała nawet niewielką korzyść z przeżycia z hiperfrakcjonowania promieniowania, gdy jest ono stosowane jako jedyny sposób leczenia.Jednakże w przypadku równoczesnej chemioterapii, badania RTOG 0129 i GORTEC 99-02 nie wykazały poprawy wyników klinicznych po zastosowaniu radioterapii przyspieszonej w porównaniu z konwencjonalną.37,38 Hiperfrakcjonowane CCRT, w porównaniu z samym hiper-frakcjonowanym promieniowaniem, spowodowało poprawę kontroli choroby w lokalizacji w badaniu pojedynczej instytucji z Duke University i badaniu fazy III z Jugosławii, przy czym ostatnie badanie wykazało również poprawę przeżycia całkowitego i przeżycia bez przerzutów na odległość.39,40 badania te wskazują, że korzyści z CCRT utrzymują się w przypadku hiperfrakcjonowanej radioterapii. Do tej pory nie przeprowadzono bezpośredniego porównania konwencjonalnie frakcjonowanego CCRT i hiperfrakcjonowanego CCRT. Należy jednak zauważyć, że metaanaliza MACH-NC nie wykazała żadnej różnicy w wyniku leczenia pacjentów leczonych CCRT przy użyciu konwencjonalnych lub zmienionych technik frakcjonowania.
toksyczność—koszt Chemioradiacji
zgodnie z wieloma poprzedzającymi ją badaniami prowadzonymi przez jedną instytucję, RTOG 9111 wykazał, że korzyści płynące z chemioterapii, niezależnie od tego, czy jest ona podawana sekwencyjnie, czy równocześnie z napromieniowaniem, są kosztem dodatkowej toksyczności.Podobnie, w Warunkach adiuwantu, zarówno badania kliniczne EORTC 2291, jak i RTOG 9501 wykazały przybliżone podwojenie toksyczności stopnia 3 przy chemioradiacji w porównaniu z samym promieniowaniem.30,31 taki trend utrzymuje się nawet w ustawieniu hiperfrakcjonowanej radioterapii.Chociaż spodziewana częstość występowania jakiejkolwiek specyficznej toksyczności, określona na podstawie badań historycznych, jest prawdopodobnie zawyżona w obecnej epoce wysoce konformalnych technik radioterapii, takich jak radioterapia modulowana intensywnością (IMRT). Dwa małe, randomizowane badania wykazały znaczne zmniejszenie częstości i ciężkości kserostomii z zastosowaniem IMRT w porównaniu z konwencjonalną trójwymiarową radioterapią konformalną w przypadku nowotworów głowy i szyi(modulowana intensywność Oszczędzania przyusznic w porównaniu z konwencjonalną radioterapią w badaniach raka głowy i szyi i Tata Memorial Hospital).41,42 najnowsze badania badające CCRT pozwalają na dostarczanie leczenia w oparciu o IMRT jako standardowe podejście w zarządzaniu SCCHN. Pozostaje zobaczyć, jaki wpływ IMRT będzie miał na wskaźniki toksyczności w połączeniu z chemioterapią w tych większych randomizowanych badaniach.
ulepszone techniki radioterapii w połączeniu z rosnącym znaczeniem i dostępnością opieki wspomagającej i usług pomocniczych, takich jak patologia mowy i opieka stomatologiczna, jeszcze bardziej ograniczają częstość występowania poważnych niehematologicznych toksyczności. Jednak toksyczność spodziewana po CCRT jest nadal wyższa niż w przypadku samej radioterapii. Ta trwała toksyczność odzwierciedla kliniczny „koszt” połączenia chemioterapii i radioterapii. W tym kontekście najważniejsze jest, aby lekarze kompleksowo oceniali pacjentów, aby ustalić, że potencjalne korzyści wynikające z CCRT uzasadniają ten koszt. Zastosowanie terapii radioterapeutycznej z pojedynczą modalnością u pacjentów z wyraźnymi współistniejącymi chorobami/niskim wyjściowym stanem sprawności lub z niskim ryzykiem we wczesnym stadium choroby może być rozsądnym podejściem w celu maksymalizacji współczynnika terapeutycznego. Ta analiza ryzyka i korzyści staje się jeszcze ważniejsza wraz z pojawieniem się molekularnych środków ukierunkowanych, które oferują realną alternatywę dla jednoczesnego leczenia.
pojawiająca się rola środków ukierunkowanych molekularnie
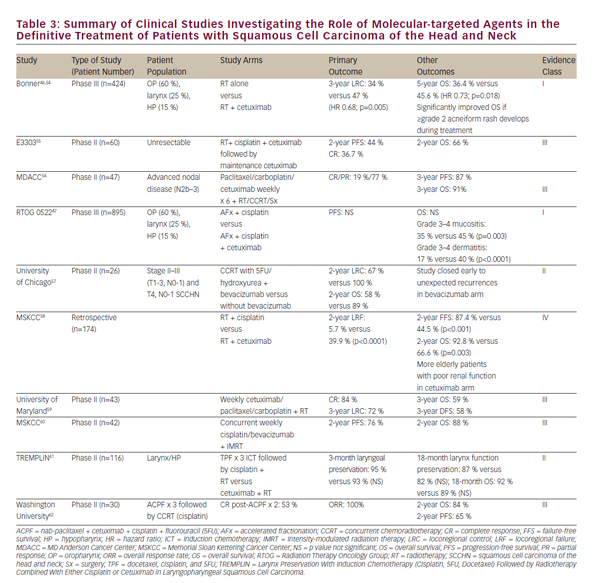
toksyczność leczenia chemioradiacyjnego, jak również chęć dalszej poprawy wyników klinicznych, sprzyjały rosnącemu zainteresowaniu rolą środków ukierunkowanych molekularnie w leczeniu SCCHN. EGFR jest nadekspresowany lub zmutowany w 80-90% guzów SCCHN i jest to związane ze zmniejszoną odpowiedzią na radioterapię i gorszymi wynikami klinicznymi.43-45 In 2006, Bonner et al. raportowany w przełomowym badaniu z udziałem pacjentów z miejscowo zaawansowanym SCCHN leczonych zarówno samym promieniowaniem, jak i promieniowaniem równoległym z przeciwciałem EGFR, cetuksymabem. W badaniu tym wykazano, że jednoczesne stosowanie cetuksymabu i promieniowania zwiększało kontrolę choroby w regionie i całkowite przeżycie bez nasilania częstych działań toksycznych promieniowania.Badanie to określiło rolę jednoczesnego stosowania cetuksymabu i promieniowania u pacjentów, którzy nie są kandydatami do cisplatyny.
późniejsze badania miały na celu porównanie CCRT z jednoczesnym cetuksymabem z cisplatyną. Badania retrospektywne i wczesnej fazy różnią się w tej ocenie i randomizowane porównanie fazy III jest w toku w RTOG 1016. W badaniu RTOG 0522 oceniono potencjalną dodatkową korzyść cetuksymabu w porównaniu ze schematem CCRT47 opartym na cisplatynie. Badanie to wykazało, że po dodaniu do standardowego CCRT opartego na platynie, cetuksymab nie powodował dalszej poprawy czasu wolnego od progresji choroby ani całkowitego przeżycia. W okresie pooperacyjnym RTOG 0920 będzie oceniał radioterapię adiuwantową z cetuksymabem lub bez cetuksymabu w miejscowo zaawansowanym resekcyjnym SCCHN, podczas gdy w badaniu II/III fazy RTOG 1216 będzie oceniał adiuwantowy CCRT z równoczesną cisplatyną w porównaniu z docetakselem w porównaniu z docetakselem i cetuksymabem w przypadku SCCHN wysokiego ryzyka.
przeprowadzono lub trwają liczne badania kliniczne wczesnej fazy dodatkowych leków ukierunkowanych molekularnie wraz z promieniowaniem do leczenia SCCHN. Wybór z nich podsumowano w i>Tabela 3. Z wyjątkiem badań nad cetuksymabem, żaden inny środek ukierunkowany molekularnie nie rozwinął się do punktu wpływającego na obecną praktykę poza badaniami klinicznymi. Chociaż perspektywa stosowania leków ukierunkowanych molekularnie jest obiecująca, równoczesna chemioterapia cisplatyną o wysokiej dawce pozostaje preferowaną rekomendacją poziomu 1 aktualnych wytycznych National Comprehensive Care (NCCN) dla CCRT.
terapia Chemioradiacyjna w raku głowy i szyi—ewoluujący paradygmat
w ciągu ostatnich 20 lat pojawiła się chemioradiacja jako standard opieki w ostatecznym leczeniu SCCHN. U odpowiednio wyselekcjonowanych pacjentów możliwe do udowodnienia korzyści z tego leczenia w zakresie przeżycia przewyższają ryzyko wystąpienia dodatkowych działań toksycznych. Jednak ważne pytania pozostają dotyczące optymalnego wykorzystania chemioradiacji. W wielu badaniach klinicznych zbadano potencjalną przydatność kliniczną tik u pacjentów z miejscowo zaawansowanym SCCHN i chociaż badania te wykazały poprawę schematów tik kosztem toksyczności, żadne z nich nie wykazało ostatecznie istotnej poprawy klinicznej w porównaniu z CCRT opartym na cisplatynie.
przyszłe badania będą bez wątpienia kontynuować badania nad alternatywnymi schematami chemioterapii i schematami dawkowania, a także metodami frakcjonowania radioterapii, dawkowania i podawania w celu udoskonalenia istniejących technik. Co więcej, wraz z dalszym rozwojem nowych chemioterapeutyków ukierunkowanych na molekularne, przyszłe badania prawie na pewno zdefiniują rosnącą rolę tych czynników w leczeniu SCCHN. Szczególnie intrygujące może być zastosowanie tych środków w Warunkach indukcji przed CCRT, gdzie mogą one celować w chorobę mikro-przerzutową i zmniejszać odległe nawroty choroby bez nakładania ograniczeń związanych z toksycznością na wskaźniki ukończenia CCRT. Podczas gdy zastosowanie CCRT ewoluuje, uzasadnione jest również kontynuowanie badań nad odpowiednią rolą chirurgii w SCCHN. Postępy zarówno w chirurgii robotycznej, jak i metodach leczenia chemioradiacyjnego zapewniają equipoise dla takiego badania. Obecne wytyczne praktyczne zalecają chemioradiację adiuwantową u pacjentów pooperacyjnych z dodatnim marginesem lub EKG, podczas gdy leczenie adiuwantowe w monoterapii lub z uwzględnieniem chemioradiacji jest zalecane u pacjentów pooperacyjnych z pierwotną chorobą węzłową pT3 lub pT4, pN2 lub pN3, zajęciem węzłów chłonnych na poziomie IV lub V, lub z inwazją okołonerową lub limfo-naczyniową. Dodatkowe badania identyfikujące przedoperacyjne radiograficzne i kliniczne predyktory wysokiego ryzyka u pacjentów ze wczesnym stadium SCCHN okażą się cenne w kierowaniu leczeniem takich pacjentów, którym można oszczędzić interwencji chirurgicznej z podejściem do ostatecznego leczenia chemioradiacyjnego z góry.
niedawne rozpoznanie zakażenia wirusem brodawczaka ludzkiego (HPV) jako przyczyny i korzystnego czynnika prognostycznego SCCHN pochodzącego z jamy ustnej i gardła48 i potencjalnie innych miejsc zmienia koncepcję SCCHN jako jednostki chorobowej. W retrospektywnej analizie RTOG 0129, 3-letnie całkowite przeżycie u pacjentów z guzami dodatnimi na obecność HPV wynosiło 82,4% w porównaniu z 57% W przypadku choroby z ujemnym wynikiem HPV (p49,50 w związku z tym przyszłe badania będą koniecznie podzielone na podstawie statusu HPV lub dostosowane do podgrupy pacjentów z dodatnim lub ujemnym wynikiem HPV, co prowadzi do rosnącej schizmy w podejściu do leczenia. Już podnoszona jest perspektywa zbadania mniej toksycznych metod leczenia guzów HPV-dodatnich i bardziej agresywnych ostatecznych metod leczenia guzów HPV-ujemnych w celu uwzględnienia wyraźnych różnic w ich odpowiednich odpowiedziach na obecne sposoby leczenia. RTOG 1016 jest jednym z takich badań oceniających pacjentów z dodatnim HPV pod kątem de-intensyfikacji leczenia za pomocą jednoczesnego stosowania cetuksymabu z radioterapią w porównaniu ze standardowym CCRT opartym na cisplatynie. Interakcja specyficznych schematów leczenia i szczególnych środków ukierunkowanych molekularnie ze statusem HPV nowotworu bez wątpienia okaże się podatnym gruntem dla przyszłych badań. Okaże się, jaki wpływ będzie miała rosnąca epidemia HPV i obecne programy szczepień na wyniki kliniczne i metody leczenia pacjentów z SCCHN.