- wprowadzenie
- wyniki
- sterownik DBH-Cre oznacza i jest ograniczony do wyrażających TH regionów noradrenergicznych w pniu mózgu, które są hamowane przez podawanie CNO
- zaburzenie neuronów noradrenergicznych za pośrednictwem CNO-hM4D u dorosłych myszy
- zaburzenie CNO-hM4D neuronów DBH-Cre powoduje deficyt Hiperkapniczny
- ::P_hM4D i kontrola rodzeństwa u zwierząt przyzwyczajonych do wstrzyknięć 10 mg/kg CNO, zauważyliśmy znaczne zmniejszenie VE / VO2 (p = 0,0235), spowodowane zmniejszeniem RR (p = 0,00036) I VE (P = 0,037) (ryc. 5). Jednak w przeciwieństwie do innych kohort, nie było różnicy między DBH-Cre; RC::P_hM4D a zwierzętami kontrolnymi rodzeństwa w tych parametrach: RR (-12,72 vs.-10,22%, p = 0,6268), VE (-24,88 vs. -23,94%, p = 0,4150) lub VE/VO2 (-15,4 vs. -22,55%, p = 0,4643). 5 Rysunek 5. Zarówno DBH-Cre; RC::P_hM4D zwierzęta i grupy kontrolne rodzeństwa, którym podawano 10 mg/kg CNO, wykazują deficyt hiperkapniczny. Po podaniu CNO, DBH-CRE; RC::P_hM4D kontrole zwierząt i rodzeństwa nie wykazują zmian w wentylacji powietrza w pomieszczeniu i zmniejszenia RR (a), VE (C) I VE/VO2 (E) w Warunkach hiperkapnicznych bez znaczących zmian VT (B), VO2 (D), częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętościowej (I) oraz temperatury (J). Zwierzęta przyzwyczajone i Niehabituowane typu dzikiego, którym wstrzyknięto sól fizjologiczną, nie wykazały żadnych zmian Presaliny i Postsaliny
- stosunek stężenia klozapiny do CNO jest wyższy w mózgu niż w surowicy
- dyskusja
- materiały i metody
- zatwierdzenie etyczne
- Hodowla, tło genetyczne i utrzymanie myszy
- Histologia
- Elektrofizjologia
- pletyzmografia
- chromatografia cieczowa-Spektrometria Mas
- gromadzenie i analiza danych
- pletyzmografia
- statystyki
- pletyzmografia
- chromatografia cieczowa-Spektrometria Mas
- Etyka
- author Contributions
- finansowanie
- Oświadczenie o konflikcie interesów
- podziękowania
wprowadzenie
sieci neuronowe, które leżą u podstaw odruchu chemosensorycznego układu oddechowego, są głównym celem zrozumienia etiologii kilku zaburzeń behawioralnych i fizjologicznych. Istnieje hipoteza, że zaburzone odruchy chemosensoryczne odgrywają rolę zarówno w zaburzeniach wrodzonych, jak i dorosłych, w tym w zespole nagłej śmierci niemowląt (SIDS), wrodzonym Zespole centralnej hipowentylacji (CCHS), centralnym bezdechu sennego, nieprawidłowym oddychaniu w zespole Retta i zespole hipowentylacji otyłości (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi et al., 2013). Zgodnie z hipotezą fałszywego alarmu uduszenia uważa się, że nieodpowiednia aktywacja chemosensoryczna lub nadwrażliwość odgrywają rolę w podgrupach pacjentów cierpiących na zaburzenia paniczne (Klein, 1993). Dysfunkcja Chemosensory może również odgrywać rolę w chorobach neurodegeneracyjnych poprzez zaburzenia snu w oddychaniu, które jest związane z przyspieszoną progresją (Hakim et al., 2012; Verbraecken and McNicholas, 2013; Bahia and Pereira, 2015; Snyder et al., 2017). Tak więc lepsze zrozumienie sieci chemosensorycznych pnia mózgu dostarczy ważnych wskazówek do wielu patologii behawioralnych i fizjologicznych.
farmakogenetyczne receptory projektantów aktywowane wyłącznie przez designerskie leki (DREADDs) (Armbruster et al., 2007) zostały wykorzystane w wielu badaniach mapujących populacje nerwowe w chemoreflexie oddechowym (oddychanie odpowiedzią na podwyższony poziom CO2 we krwi). Technologia DREADD w połączeniu z międzysektorowym rozmieszczeniem genetycznym została wykorzystana do wyciszenia wysoce ukierunkowanych populacji neuronalnych podczas obserwacji czynności oddechowych u świadomych i niepohamowanych myszy przez nasze laboratorium i inne, unikając wielu nieporozumień z wcześniejszych podejść do mapowania obwodów (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Te i większość innych badań prawie zawsze zawierały tylko CNO bez ekspresji DREADD, które nie wykazywały żadnych chemosensorycznych lub innych efektów oddechowych, argumentując, że CNO nie miało żadnego poza docelowego wpływu na oddychanie u świadomych i nieskrępowanych myszy pomimo zastosowanej dużej dawki, 10 mg / kg. Niemniej jednak stwierdzono w kilku innych badaniach, że CNO i jego produkty metabolizmu pleców mogą mieć poza celowy wpływ na zachowanie i poruszanie się w różnych testach, ale wyjście oddechowe nie zostało uwzględnione (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gomez et al., 2017; Ilg et al., 2018; Mahler and Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez i Knackstedt, 2018). Wykazano również, że CNO i jego metabolity nie są równoważnie dystrybuowane między układem krążenia a mózgiem(Gomez et al., 2017).
drugi, nierozwiązany problem wynika ze stresu wywołanego przez paradygmat eksperymentalny, w tym trzymania zwierząt w komorze pletyzmograficznej całego ciała, manipulowania, iniekcji dootrzewnowej i pomiarów temperatury odbytnicy. We wcześniejszych badaniach Dredd respiratory, naiwne myszy wprowadzono do małej komory (140-400 mls) i pozwolono im się zaaklimatyzować 20-40 minut przed pozyskaniem danych (Ray i wsp ., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Nie jest jednak jasne, czy ten czas jest wystarczający do zminimalizowania wywołanych stresem zmian oddechowych, które mogą działać jako czynnik oddziałujący z działaniem klozapiny.
w naszych badaniach nad rolą układu noradrenergicznego (NA) w kontroli oddechowej staraliśmy się wykorzystać dobrze ugruntowaną RC::P_hm4d allel DREADD (Ray et al., 2011) to test the role of NA neurons in baseline and hypercapnic respiration in unrestrained adult animals using whole-body plethysmography. Ponieważ neurony noradrenaliny i NA są również znane z odgrywania centralnej roli w odpowiedziach na stres (Valentino and Van Bockstaele, 2008; Chen et al., 2018), przeprowadziliśmy serię badań, aby porównać ekstensywne przyzwyczajenie (wielokrotne narażenie na paradygmat eksperymentalny, w którym zwierzę dowiaduje się, że doświadczenie nie jest groźne lub możliwe do przeżycia) i wysokie vs. Niskie (1 mg/kg) dawki CNO z wcześniej opublikowanymi protokołami DREADD(Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Tutaj po raz pierwszy pokazujemy, że wysokie ogólnoustrojowe dawki CNO są zdolne do wywoływania efektów poza celem na autonomiczną funkcję oddechową u świadomych myszy. Ujawniamy również, że poza-docelowy wpływ CNO na chemosensoryczną wydajność oddechową jest skutecznie demaskowany przez rozległe przyzwyczajenie i dlatego nie byłoby widoczne we wcześniejszych badaniach kontrolnych CNO, które nie przyzwyczajały zwierząt przed pomiarem oddechowym, wykorzystując tylko krótki okres aklimatyzacji przed zebraniem danych. Łącznie wyniki te sugerują, że wcześniej zmapowane populacje neuronów mogą pośrednio wpływać na kontrolę oddechową poprzez potencjalne role w regulacji odpowiedzi na stres. W szczególności, Dane te zgadzają się z ostatnimi doniesieniami sugerującymi, że CNO nie jest biologicznie obojętny w dużych dawkach poprzez metaboliczną konwersję do klozapiny (MacLaren et al., 2016; Gomez et al., 2017) i że off-target efekty behawioralne mogą objawiać się nie tylko z perturbacji obwodów behawioralnych, ale także z zakłóceń do podstawowych obwodów autonomicznych i homeostazy.
wyniki
sterownik DBH-Cre oznacza i jest ograniczony do wyrażających TH regionów noradrenergicznych w pniu mózgu, które są hamowane przez podawanie CNO
aby zbadać ekspresję i swoistość linii DBH-Cre, użyliśmy schematu hodowli pojedynczej rekombinazy (Fig.1A), w którym przekroczyliśmy sterownik do linii Ai9 (Madisen et al., 2010), który wyraża flokowane tdTomato. Barwienie przeciwciałem hydroksylazy tyrozynowej (TH) wykazało, że ekspresja tdtomato w pniu mózgu była ograniczona do regionów ekspresji th, w tym do locus coeruleus, A5, A1, A2, A7, jąder SubCV i subcd zgodnie z oczekiwaniami (Fig. Aby potwierdzić, że neurony na wyrażające receptor hM4D reagują na CNO, wykonaliśmy nagrania na neuronach locus coeruleus (LC), gdzie zaobserwowaliśmy hamowanie wypalania neuronów po zastosowaniu kąpieli CNO (N = 3, Fig.
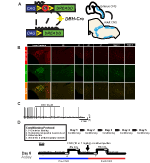
Rysunek 1. Schemat hodowli i protokoły oddechowe. RC::Allel P_hM4D łączy się z linią dopaminy-beta-hydroksylazy (DBH)-Cre w celu uzyskania specyficznej dla komórki ekspresji receptora hM4D w neuronach noradrenergicznych (NA) (a). Fluorescencyjna ekspresja tdTomato w DBH-Cre; koronowe sekcje mózgu Ai9 współwystępują z hydroksylazą tyrozynową (TH) w jądrach pnia mózgu (B). In slice recording of Na locus coeruleus before and after CNO application, demonstrating DREADD receptor functionality in targeted neurons (C). Protokół oddechowy. Habituowane myszy poddawane są 5-dniowemu protokołowi habituacji, który obejmuje manipulowanie, pomiar temperatury sondy doodbytniczej, wstrzyknięcie soli fizjologicznej i ekspozycję na komorę pletyzmograficzną. W szóstym dniu zarówno wyhodowane, jak i niehabituowane myszy poddano testowi hiperkapnicznemu, w którym zwierzę umieszcza się w komorze oddechowej i pozwala się zaaklimatyzować w wyjściowych warunkach powietrza w pomieszczeniu. Zwierzę jest następnie narażone na 20 minut 5% CO2, a następnie na 20 minut powietrza w pomieszczeniu. Zwierzę jest następnie wstrzykiwane dootrzewnowo CNO lub solą fizjologiczną, a następnie kolejne 20 minut powietrza w pomieszczeniu po wstrzyknięciu, 20 minut 5% CO2 i 20 minut powietrza w pomieszczeniu. Otwarte pola wyznaczają czasy zbierania Danych (D).
zaburzenie neuronów noradrenergicznych za pośrednictwem CNO-hM4D u dorosłych myszy
aby zbadać rolę neuronów NA w oddychaniu wyjściowym i hiperkapnicznym, zastosowaliśmy system DREADD hamujący RC: P_hM4D skrzyżowany ze sterownikiem DBH-Cre. Z wykorzystaniem pletyzmografii całego ciała (Ray et al., 2011), mierzyliśmy reakcje wentylacyjne niepohamowanych dorosłych zwierząt w Warunkach powietrza w pomieszczeniu (21% O2/79% N2) i hiperkapnic (5% CO2/21% O2/74% N2) przed i po podaniu CNO (rysunek 1D). Aby rozwiązać problem dawkowania CNO i potencjalnego stresu wywołanego przez nasz eksperymentalny projekt, zwierzęta poddano jednemu z czterech warunków: (1) unhabituated i wstrzyknięto 10 mg/kg CNO; (2) habituated i wstrzyknięto 10 mg/kg CNO; (3) unhabituated i wstrzyknięto 1 mg/kg CNO; lub (4) habituated i wstrzyknięto 1 mg/kg CNO. Przyzwyczajenie polegało na 5-dniowym procesie obejmującym manipulację, badanie temperatury doodbytniczej, wstrzyknięcie soli fizjologicznej i ekspozycję na komorę pletyzmograficzną każdego dnia przez 30 minut, podczas gdy wcześniej nieleczone zwierzęta były narażone tylko na 20-45 minutowy okres aklimatyzacji Komory bezpośrednio przed zebraniem danych, jak to miało miejsce we wcześniejszych badaniach (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sun and Ray, 2017; Sun et al., 2017). Mierzone parametry oddechowe obejmowały częstość oddechu RR, objętość pływów (VT), wentylację minutową (VE), zużycie tlenu (VO2), wentylację minutową znormalizowaną do zużycia tlenu (VE/VO2), częstotliwość bezdechu, częstotliwość westchnienia oraz współczynniki zmienności dla odstępu międzyodrzwiowego i amplitudy (niestabilność okresowa i objętościowa). Jako dodatkową kontrolę porównaliśmy również zwierzęta przyzwyczajone i niehabituowane typu dzikiego, którym podawano sól fizjologiczną.
zaburzenie CNO-hM4D neuronów DBH-Cre powoduje deficyt Hiperkapniczny
w trzech warunkach, DBH-CRE; RC::Zwierzęta P_hM4D wykazały zmniejszenie VE I VE/VO2 po podaniu CNO, podczas gdy grupy kontrolne rodzeństwa nie wykazały różnic w wartościach przed i po CNO. Niehabituowane zwierzęta, którym wstrzyknięto 10 mg/kg CNO, wykazały znamienny spadek RR (-12,17%, p = 0,034) i VT (-30,87%, p = 0,0016), co skutkowało zmniejszeniem VE (-38,64%, p = 0,0031) i nieznacznym zmniejszeniem VO2 (-14,25%, p = 0,042) (ryc. 2). Zmniejszenie VE było większe niż zmniejszenie VO2, co skutkowało ogólnym zmniejszeniem VE/VO2 (-26,89%, p = 0,0095). Niehabituowane zwierzęta, którym wstrzyknięto 1 mg/kg CNO, wykazywały tendencję do zmniejszonego RR (-12,88%, p = 0,066) i znacznie zmniejszonego VT (-16,52%, p = 0,00085) I VE (-28,08%, p = 0,0070), co prowadziło do ogólnego zmniejszenia VE/VO2 (-22,23%, p = 0,016) (ryc. 3). Wreszcie, u zwierząt przyzwyczajonych, którym podawano 1 mg/kg CNO, zaobserwowano zmniejszenie RR (-10,77%, p = 0,074), tendencję do zmniejszenia VE (-25,07%, p = 0,074) i zmniejszenie ogólnego VE/VO2 (-23,70%, P = 0,024) (rycina 4). W żadnej kohorcie nie obserwowano istotnych zmian częstości bezdechów, częstotliwości Westchnień, okresowej lub objętościowej niestabilności ani temperatury.
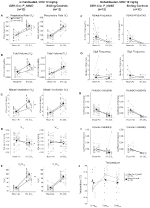
Rysunek 2. Unhabituated DBH-Cre; RC:: P_hM4D zwierzęta, którym podawano 10 mg/kg CNO wykazują deficyt hiperkapniczny, podczas gdy kontrola rodzeństwa nie wykazuje zmian. Po podaniu CNO, DBH-Cre; RC::P_hM4D zwierzęta nie wykazują zmian w wentylacji powietrza w pomieszczeniu i zmniejszenia RR (A), VT (B), VE (C), VO2 (D) I VE/VO2 (E) w Warunkach hiperkapnicznych bez zmian częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętości (I) oraz temperatury (J). Kontrola rodzeństwa nie wykazała różnic we wszystkich wartościach przed i po CNO.
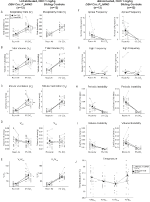
Rysunek 3. Unhabituated DBH-Cre; RC:: P_hM4D zwierzęta, którym podawano 1 mg/kg CNO wykazują deficyt hiperkapniczny, podczas gdy kontrola rodzeństwa nie wykazuje zmian. Po podaniu CNO, DBH-Cre; RC::P_hM4D zwierzęta nie wykazują znaczących zmian w wentylacji powietrza w pomieszczeniu lub RR (A) i wykazały zmniejszenie VT (B), VE (C) I VE/VO2 (E) w Warunkach hiperkapnicznych bez zmian VO2 (D), częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętości (I) oraz temperatury (J). Kontrola rodzeństwa nie wykazała różnic we wszystkich wartościach przed i po CNO.
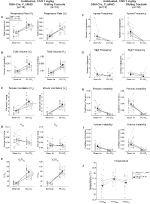
Rysunek 4. Habituated DBH-Cre; RC:: P_hM4D zwierzęta, którym podawano 1 mg/kg CNO, wykazują deficyt hiperkapniczny, podczas gdy kontrola rodzeństwa nie wykazuje zmian. Po podaniu CNO, DBH-CRE; RC:: p_hm4d zwierzęta nie wykazują zmian w wentylacji powietrza w pomieszczeniu i zmniejszenia RR (A) I VE/VO2 (E) w Warunkach hiperkapnicznych bez znaczących zmian VT (B), VE (C), VO2 (D), częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętościowej (I) oraz temperatury (J). Kontrola rodzeństwa nie wykazała różnic we wszystkich wartościach przed i po CNO.
::P_hM4D i kontrola rodzeństwa u zwierząt przyzwyczajonych do wstrzyknięć 10 mg/kg CNO, zauważyliśmy znaczne zmniejszenie VE / VO2 (p = 0,0235), spowodowane zmniejszeniem RR (p = 0,00036) I VE (P = 0,037) (ryc. 5). Jednak w przeciwieństwie do innych kohort, nie było różnicy między DBH-Cre; RC::P_hM4D a zwierzętami kontrolnymi rodzeństwa w tych parametrach: RR (-12,72 vs.-10,22%, p = 0,6268), VE (-24,88 vs. -23,94%, p = 0,4150) lub VE/VO2 (-15,4 vs. -22,55%, p = 0,4643).
5
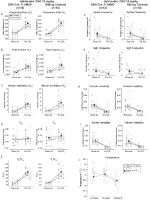
Rysunek 5. Zarówno DBH-Cre; RC::P_hM4D zwierzęta i grupy kontrolne rodzeństwa, którym podawano 10 mg/kg CNO, wykazują deficyt hiperkapniczny. Po podaniu CNO, DBH-CRE; RC::P_hM4D kontrole zwierząt i rodzeństwa nie wykazują zmian w wentylacji powietrza w pomieszczeniu i zmniejszenia RR (a), VE (C) I VE/VO2 (E) w Warunkach hiperkapnicznych bez znaczących zmian VT (B), VO2 (D), częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętościowej (I) oraz temperatury (J).
Zwierzęta przyzwyczajone i Niehabituowane typu dzikiego, którym wstrzyknięto sól fizjologiczną, nie wykazały żadnych zmian Presaliny i Postsaliny

Rysunek 5. Zarówno DBH-Cre; RC::P_hM4D zwierzęta i grupy kontrolne rodzeństwa, którym podawano 10 mg/kg CNO, wykazują deficyt hiperkapniczny. Po podaniu CNO, DBH-CRE; RC::P_hM4D kontrole zwierząt i rodzeństwa nie wykazują zmian w wentylacji powietrza w pomieszczeniu i zmniejszenia RR (a), VE (C) I VE/VO2 (E) w Warunkach hiperkapnicznych bez znaczących zmian VT (B), VO2 (D), częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętościowej (I) oraz temperatury (J).
chociaż nie zaobserwowano fenotypów w grupach kontrolnych, w których wstrzyknięto 1 mg/kg CNO, zajęliśmy się możliwością, że sam zastrzyk spowodował fenotyp obserwowany w grupach kontrolnych, w których wstrzyknięto 10 mg/kg CNO, testując zwierzęta przyzwyczajone i niehabituowane typu dzikiego, w których wstrzyknięto sól fizjologiczną (ryc. 6). Zarówno w kohortach wyhodowanych, jak i niehabitualizowanych zwierzęta nie wykazywały żadnych różnic w parametrach oddychania po podaniu presaliny i postsaliny. Nie zaobserwowano istotnych zmian w częstości bezdechów, częstotliwości Westchnień, okresowej lub objętościowej niestabilności ani temperatury.
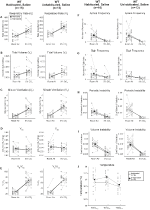
Rysunek 6. Zarówno niehabituowane, jak i wyhodowane zwierzęta typu dzikiego, którym podawano sól fizjologiczną, nie wykazują różnic między wartościami przed i po wstrzyknięciu. Po podaniu soli fizjologicznej zarówno niehabituowane, jak i przyzwyczajone zwierzęta typu dzikiego nie wykazały żadnych zmian w Warunkach powietrza w pomieszczeniu lub hiperkapnicznych w RR (A), VT (B), VE (C), VO2 (D), VE/VO2 (E), częstotliwości bezdechu (F), częstotliwości westchnienia (G), okresowej (H) lub niestabilności objętościowej (I) oraz temperaturze (J).
stosunek stężenia klozapiny do CNO jest wyższy w mózgu niż w surowicy
aby określić biodostępność CNO i klozapiny, mierzyliśmy ich stężenia w surowicy i mózgu za pomocą spektrometrii masowej. Trzydzieści minut po dootrzewnowym wstrzyknięciu CNO u myszy, CNO występuje w mniejszej względnej obfitości w porównaniu z jego metabolitem wstecznym klozapiną w surowicy i mózgu dla wszystkich badanych dawek, 0,1 mg/kg (surowica P = 0,0054, mózg p = 0,0001) (Fig.mózg P = 0.0005) (rys. 7C). Podczas analizy stosunku klozapiny do CNO wartości te były zawsze powyżej zera i były wyższe w mózgu niż w surowicy (nośnik P > 0, 5, 0, 1 mg/kg p > 0, 5, 1 mg/kg p = 0, 0018, 10 mg/kg p = 0, 0160) (Fig.
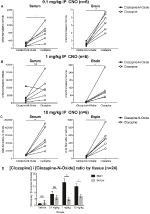
Rysunek 7. Stosunek stężeń klozapiny do CNO jest większy w mózgu niż w surowicy. Próbki surowicy i mózgu pobrano od myszy typu dzikiego 30 minut po podaniu CNO w 3 różnych dawkach 0,1 mg/kg (a), 1 mg/kg (B), 10 mg / kg (C). Poszczególne punkty danych przedstawiają względną obfitość klozapiny-N-tlenku lub klozapiny otrzymanej przez LC-MS. przedstawiono również stosunek klozapiny do CNO dla każdej dawki i SEM (D).
dyskusja
wstępnym celem tego badania było zbadanie roli neuronów DBH-Cre w fizjologii układu oddechowego po ostrych zaburzeniach u niepohamowanych i świadomych dorosłych zwierząt. Ponieważ noradrenalina i Neurony NA odgrywają dobrze udokumentowaną rolę w zachowaniach stresowych (Valentino and Van Bockstaele, 2008; Chen et al., 2018), staraliśmy się również zbadać, czy przyzwyczajenie do prawdopodobnego stresującego protokołu fizjologicznego miałoby wpływ na wcześniej obserwowane fenotypy układu oddechowego. W protokole pletyzmograficznym całego ciała, stosowanym w naszym laboratorium i innych, zwierzęta są traktowane, badane doodbytniczo pod kątem temperatury, wystawiane na nowe środowisko (komora pletyzmograficzna) i wstrzykiwane dootrzewnowo. Wcześniejsze badania wykazały, że obsługa i przyzwyczajenie do iniekcji i innych „rutynowych” procedur może modyfikować parametry behawioralne i fizjologiczne, w tym oddychanie(Misslin et al., 1982; Andrews and File, 1993; Lapin, 1995; Ryabinin et al., 1999). Inne stosowane stresory również modyfikują oddychanie zarówno w warunkach wyjściowych, jak i hiperkapnicznych (Isom i Elshowihy, 1982; Kinkead et al., 2001).
w naszych badaniach wykorzystujących Wysokie dawki CNO odkryliśmy, że hamowanie neuronów NA zdefiniowanych przez DBH-Cre za pośrednictwem HM4D spowodowało zmniejszenie hiperkapnicznego odruchu VE / VO2 w czterech zdefiniowanych kohortach eksperymentalnych, ze zmniejszonym RR, VT I VE, co potwierdza wcześniejsze badania (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et al., 2010). Jednakże, grupa kontrolna z przyzwyczajeniem rodzeństwa, po podaniu dawki 10 mg/kg CNO stosowanej we wcześniejszych badaniach oddechowych, wykazała deficyt wentylacji w Warunkach hiperkapnicznych o takiej samej wielkości, jak u zwierząt DBH-Cre; RC:: P_hM4D. Żadna inna grupa kontrolna rodzeństwa nie wykazała tego fenotypu, w tym kohorta przyzwyczajona, która otrzymała tylko (1 mg / kg CNO) lub sól fizjologiczną. Wyniki te sugerują, że wyższe dawki CNO (10 mg/kg) mają wpływ na odpowiedź hiperkapniczną, która jest demaskowana po intensywnym przyzwyczajeniu, jednocześnie przypuszczalnie zmniejszając poziom stresu u zwierząt, oraz że niższe dawki CNO nie mają wpływu na kontrolę oddechową u zwierząt przyzwyczajonych. Wyniki te są również zgodne z pracą Korsaka et al. who wykazała, że niska dawka CNO (2 mg / kg) nie wywołuje efektów poza celem w zdolności do pracy w teście wysiłkowym, który obejmował wcześniejsze szkolenie(Korsak i wsp ., 2018) oraz Fleury Curado et al. who nie wykazywał specyficznego wpływu niskiej dawki CNO (1 mg/kg) na wydech oddechowy (Fleury Curado i wsp ., 2018).
zwiększony stosunek klozapiny do poziomu CNO w surowicy i w mózgu (Fig.7) jest zgodny z najnowszymi badaniami, które sugerują, że CNO jest łatwo metabolizowany do klozapiny i wykazuje większą przepuszczalność mózgu w porównaniu do CNO u myszy i gdzie indziej (Jann i wsp., 1994; Chang et al., 1998; Guettier et al., 2009; Gomez et al., 2017; Raper et al., 2017). Nie jest jednak jasne, czy obserwowane efekty uboczne są spowodowane CNO lub klozapiną. Ponieważ nasze pomiary hiperkapniczne wystąpiły <30 minut po zastosowaniu CNO, jest prawdopodobne, że działanie układu oddechowego poza celem jest pośredniczone przez klozapinę. Nasze wyniki (rycina 7) pokazują wysoki względny poziom klozapiny w mózgu, chociaż CNO nie jest całkowicie nieobecny. Jednak Huckstepp i współpracownicy zastosowali bezpośrednią aplikację CNO do rdzenia brzusznego u znieczulonych szczurów, aby wykazać, że tylko w powietrzu w pomieszczeniu, a nie w Warunkach hiperkapnicznych lub niedotlenienia, aplikacja CNO ma niewielki efekt, zwiększając częstotliwość i zmniejszając czas wydechowy, ale pozostawiając VT bez zmian, bez wyraźnego efektu obserwowanego podczas hiperkapni(Huckstepp et al., 2015). Biorąc pod uwagę bezpośrednie zastosowanie u znieczulonych szczurów i ramy czasowe eksperymentów, jest prawdopodobne, że małe efekty poza celem były mediowane przez CNO, a nie przez klozapinę.
tylny metabolit klozapina jest powszechnie stosowanym lekiem uspokajającym i przeciwpsychotycznym w schizofrenii z wieloma endogennymi celami, w tym antagonistycznymi działaniami o niskim powinowactwie w receptorach dopaminergicznych D1, D2 i D4, receptorach serotoninergicznych 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 i 5-HT7, receptorach histaminowych H1 oraz receptorach adrenergicznych α1 i α2, między innymi (Fitton and Heel, 1990; Ashby and Wang, 1996). Efekty uboczne widoczne tutaj mogą wynikać z różnych lub połączonych mechanizmów i celów. Klozapina może wpływać na oddychanie jako środek uspokajający. Wcześniejsze badanie wykazało zmniejszenie RR i VT poniżej 5 I 10% CO2 zarówno podczas powolnego snu, jak i szybkiego ruchu gałek ocznych w porównaniu do cichego stanu czuwania u myszy (Nakamura i wsp ., 2007). Alternatywnie, hamowanie ukierunkowanych neuronów wyrażających DREADD może skutkować działaniem antyanxiogennym lub anksjolitycznym podobnym do naszego protokołu przyzwyczajenia, aby ujawnić chemosensoryczne efekty poza celem za pośrednictwem CNO / klozapiny. Oba wyjaśnienia są poparte kilkoma badaniami, które wykazały, że CO2 odgrywa rolę w wrodzonych i wyuczonych reakcjach na strach i zachowaniach związanych z lękiem(Ziemann et al., 2009; Feinstein et al., 2013; Taugher et al., 2014; Dlouhy et al., 2015; Winter et al., 2017). Tak więc neurony ukierunkowane w niektórych z tych badań mogą rzeczywiście odgrywać rolę w kierowaniu anksjogennymi reakcjami behawioralnymi, a nie fizjologicznymi odruchami chemosensorycznymi, ponieważ zarówno układ katecholaminergiczny, jak i serotonergiczny są zaangażowane w zachowania lękowe / lękowe i homeostazę chemosensoryczną (Brust et al., 2014; Hennessy et al., 2017).
i odwrotnie, fenotypy chemosensoryczne obserwowane przy wysokich poziomach CNO mogą być prawdziwe, ponieważ byliśmy w stanie podsumować hiperkapniczny deficyt mediowany przez NA przy dawkach CNO, o rząd wielkości niższej u myszy przyzwyczajonych, podczas gdy grupy kontrolne nie wykazały efektu CNO. Jednak pełne porównania we wcześniejszych badaniach są trudne ze względu na brak, w niektórych przypadkach, zgłoszonych danych VO2, VT, RR I VE/VO2. Na przykład zmiany temperatury ciała lub tempa metabolizmu mogą również wpływać na wiele sposobów na wyjście oddechowe i chemosensoryczne, a temperatura pletyzmografu w komorze była znacznie różna w niektórych przypadkach (34 vs.30°C w naszych badaniach), wpływając na zakres dynamiczny składnika barometrycznego kształtu fali, a tym samym objętość pływu. Warto zauważyć, że nie widzieliśmy ani znaczących zmian w charakterystyce fal oddechowych w żadnym z naszych warunków, ani ostrego zatrzymania krążenia, które zaobserwowano w naszych wcześniejszych badaniach nad wysokimi dawkami, całych rombów(Sun et al., 2017).
nasze wyniki pokazują po raz pierwszy, że CNO ma nieoczekiwany wpływ na hiperkapniczny odruch chemosensoryczny, który jest demaskowany przez rozległe przyzwyczajenie. Co ważne, pomimo wysokiego poziomu, efekt CNO poza celem został wcześniej wykluczony z powodu braku fenotypu w kontrolach rodzeństwa, ale co wykazujemy, staje się jasne po przyzwyczajeniu. Oferujemy poza-docelową charakterystykę CNO w mysim systemie modelowym w celu uzupełnienia badań na szczurach i naczelnych nieludzkich. Wyniki tutaj podnieść możliwość, że dodatkowe CNO pośredniczy, poza celem wpływ na obwody badane lub autonomiczne lub homeostatyczne obwody mogą istnieć, ale mogą być maskowane w innych kontrolowanych eksperymentach. Co ważne, dane te ujawniają, że badacze powinni dążyć do wykorzystania minimalnych dawek ligandu aktywującego możliwego w połączeniu z wysokim poziomem przyzwyczajenia i że odpowiednie kontrole muszą być włączone do chemicznych manipulacji genetycznych, aby w pełni docenić i zinterpretować dane eksperymentalne.
materiały i metody
zatwierdzenie etyczne
badania zostały zatwierdzone przez Baylor College Of Medicine Institutional Animal Care and Use Committee zgodnie z protokołem AN-6171.
Hodowla, tło genetyczne i utrzymanie myszy
utrzymywaliśmy kolonie wszystkich naszych heterozygotycznych szczepów myszy poprzez krzyżowanie wsteczne do myszy C57BL/6J i homozygotycznych szczepów przez krzyżówki rodzeństwa. Do eksperymentów histologicznych DBH-Cremice zostały połączone z homozygotyczną myszą Ai9 (Madisen et al., 2010) (JAX 007909). W przypadku eksperymentów pletyzmograficznych myszy DBH-Cre zostały połączone z homozygotycznym RC:: P_hM4D (Ray et al., 2011) myszy do wyprowadzenia zwierząt, w których wszystkie myszy nosiły allel RC:: P_hM4D. Zwierzęta rodzeństwa, które nie odziedziczyły allelu Cre, były używane jako zwierzęta kontrolne dla potomstwa Cre dodatniego. Rosa26 specyficzne Startery dla myszy Ai9, RC:: P_hM4D i RC:: ePe były 5′-GCACTTGCTCTCCCAAAGTC, 5′-GGGCGTACTTGGCATATGAT i 5′-CTTTAAGCCTGCCCAGAAGA i dają pasmo 495 bp (ukierunkowane) i pasmo 330 bp (wt). Cre-specyficzne dla wszystkich kierowców rhombomere Cre były 5′-ATCGCCATCTTCCAGCAGGCACCATTGCCC i 5′ – GCATTTCTGGGGATTGCTTA i dały pasmo 550 bp, jeśli jest dodatnie. Do eksperymentów LC-MS myszy C57BL/6J uzyskano z Center of Comparative Medicine (CCM), Baylor College Of Medicine.
Histologia
DBH-Cre w wieku od czterech do ośmiu tygodni; AI9 dorosłe myszy były przezskórnie perfuzowane roztworem 0,1 M buforowanej fosforanem soli fizjologicznej (PBS), a następnie 4% paraformaldehydem (PFA) w PBS. Mózgi rozcięto i upuszczono przez 2 godziny w 4% PFA przed płukaniem PBS i wyrównaniem w 20% sacharozie w PBS. Mózgi następnie podzielono na sekcje 30 µm, zamontowano na szkiełkach i oznaczono immunofluorescencyjnymi przeciwciałami. Zabarwiliśmy przez noc przeciwciałem przeciw hydroksylazy tyrozynowej w celu identyfikacji neuronów katecholaminergicznych (1:1000, Millipore AB152), a następnie przez 2 godziny z osłem anty-króliczym cy3 wtórnym (1:500, Jackson 711-165-152) w 0,1% Triton-X w PBS (PBST) z 5% osłem serum. Obrazy zostały zebrane za pomocą pionowego mikroskopu epifluorescencyjnego Zeissa.
Elektrofizjologia
poziome plasterki mózgu zawierające locus coeruleus (300 µm) zostały wycięte za pomocą wibratomu (Leica VT 1000s, Leica Microsystems, Buffalo Grove, IL) od dorosłych myszy DBH-Cre; rr2p; RC::ePe (~1 miesiąc) w 4°C sztucznym płynie mózgowo-rdzeniowym (ACSF). Plastry zanurzano w komorze perfuzowanej natlenionym ACSF (95% O2 i 5% CO2) zawierającym w mM: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 i 10 glukozy (2-3 ml/min). Nagrania pełnokomórkowe przeprowadzono w temperaturze 30°C przy użyciu konwencjonalnych technik patch-clamp i wzmacniacza MultiClamp 700B (Molecular Devices, Union City, CA). Neurony GFP-dodatnie z locus coeruleus zostały wizualnie zidentyfikowane, a następnie zobrazowane za pomocą obrazu podczerwieni z kontrastem różnicowym interferencji na scenie mikroskopu pionowego (Axioskope FS2, Carl Zeiss, Oberkochen, Niemcy). Pipety płatkowe (oporność 4-6 mln j.) napełniono (w mM): 110 K-glukonianem, 10 KCI, 10 HEPES, 10 Na2-fosfokreatyną, 2 MG3-ATP i 0,2 Na3-GTP; pH skorygowano do 7,2, a osmolarność do 300 mOsm. Potencjał utrzymywania wynosił -70 mV. CNO zastosowano w kąpieli.
pletyzmografia
pletyzmografia na świadomych, niepohamowanych myszach została przeprowadzona zgodnie z opisem na dorosłych zwierzętach w wieku od 6 do 12 tygodni (Ray et al., 2011). Habituowane myszy poddawano 5-dniowemu protokołowi habituacji, w którym każdy dzień składał się z kilku minut obsługi, temperatury pobieranej przez sondę doodbytniczą, dootrzewnowego wstrzyknięcia soli fizjologicznej i 30 minut w komorze pletyzmograficznej. Następnie myszy testowano w ciągu 1 tygodnia od ostatniego dnia przyzwyczajenia. Niehabituowane myszy nie były narażone na manipulację ani na komora pletyzmografu. Wszystkie myszy nie były wcześniej leczone CNO i były stosowane tylko raz.
w dniu badania myszy pobierano z klatki domowej, ważono i pobierano temperaturę doodbytniczą. Następnie zwierzęta umieszczano w przepływowej komorze pletyzmograficznej z regulacją temperatury (płaszczem wodnym w temperaturze 30°C) i pozwalano na aklimatyzację przez co najmniej 20 minut w Warunkach powietrza w pomieszczeniu (21% O2/79% N2). Po aklimatyzacji i pomiarze w powietrzu w pomieszczeniu Gaz komorowy zamieniono na hiperkapniczną mieszaninę 5% CO2 / 21% O2/74% N2 przez 20 minut. Gaz komorowy był następnie przełączany z powrotem na powietrze pokojowe na 20 minut. Myszy na krótko usuwano w celu pomiaru temperatury doodbytniczej i iniekcji dootrzewnowej CNO (National Institute of Mental Health Chemical Synthesis and Drug Supply Program) rozpuszczonego w soli fizjologicznej (1 lub 0,1 mg/ml) dla skutecznego stężenia odpowiednio 10 lub 1 mg/kg. Zwierzę wróciło do komory na kolejne 20 min powietrza pokojowego, 20 min hiperkapni i 20 min powietrza pokojowego. Zwierzę zostało następnie usunięte z komory, a temperatura odbytnicy została pobrana natychmiast po zakończeniu eksperymentu.
chromatografia cieczowa-Spektrometria Mas
dwadzieścia cztery myszy typu dzikiego, równomiernie podzielone według płci, zważono i potraktowano 10 mg/kg CNO, 1 mg/kg CNO, 0, 1 mg/kg CNO lub nośnikiem. Trzydzieści minut po wstrzyknięciu próbki krwi pobrano przez nakłucie serca i umieszczono w MIKROTAINERACH BD. Próbki odwirowywano w temperaturze 4°c przy 13 500 obr. / min w wirówce stołowej i pobierano supernatanty. Surowicę i mózgi trzymano w temperaturze -20°C aż do ekstrakcji.
rozpuszczalniki klasy HPLC wodę, chloroform acetonitrylu i metanol oraz kwas mrówkowy klasy spektrometrii masowej otrzymano z Sigma-Aldrich (St.Louis, MO). Roztwór kalibracyjny zawierający wiele kalibrantów w roztworze acetonitrylu, kwasu trifluorooctowego i wody zakupiono od Agilent Technologies (Santa Cruz, CA). Metabolity i wzorce wewnętrzne, w tym kwas N-acetylo-asparaginowy-D3, tryptofan-15n2, kwas glutaminowy-d5, tymina-D4, kwas giberelinowy, Trans-zeatyna, kwas jasmonowy, kwas antranilowy 15N i testosteron-D3 zostały zakupione od Sigma-Aldrich (St.Louis, MO). Microtainer R SST TM otrzymano od Bectona Dickinsona (Franklin Lakes, NJ).
ekstrakcja składała się z 750 µl zimnego metanolu:wody (4:1) zawierającego 20 µl z dodatkiem wzorców wewnętrznych, które dodawano do każdej próbki mózgu (50 mg) i kontroli jakości, a następnie homogenizowano przez 1 min każda. Następnie dodano 750 µl 100% acetonitrylu zawierającego 20 µl wzmocnionych wzorców wewnętrznych do przemywania próbki (100 µl) i kontroli jakości, a następnie sonikowano przez 5 minut. Wszystkie próbki odwirowywano przy 5000 obr. / min przez 10 min w temperaturze 4°C. Otrzymany supernatant zebrano i wstrzyknięto 20 µl do LC-MS.
wszystkie Próbki analizowano przy użyciu 6490 potrójnego kwadrupolowego spektrometru masowego (Agilent Technologies, Santa Clara, CA) sprzężonego z systemem HPLC (Agilent Technologies, Santa Clara, CA) przez wielokrotne monitorowanie reakcji (MRM). Na wykryty metabolit uzyskano około 8-11 punktów danych. Wykryte metabolity to klozapina, CNO i norklozapina (N-demetyl klozapina). W metodzie zastosowano tryb ESI positive. Kolumną HPLC była kolumna ACQUITYUPLC C18 (100 Å, 1,8 µm i 2,1 mm × 100 mm. Milford, MA, USA) o natężeniu przepływu 0,5 ml/min.
gromadzenie i analiza danych
pletyzmografia
pletyzmografia zmiany ciśnienia zostały zmierzone przy użyciu przetwornika różnicy ciśnień Validyne dp45 i komory referencyjnej oraz demodulatora nośnika CD15 i zarejestrowane za pomocą LabChartPro w czasie rzeczywistym. Przebiegi analizowano w trybie offline za pomocą LabChartPro i niestandardowego kodu MATLAB w celu określenia częstości oddechów (RR), objętości pływów (VT) (Ray et al., 2011), minute ventilation (VE), and pattern analysis. Fale oddechowe były zbierane w okresach, gdy zwierzę było w stanie spoczynku, a odczyty były wolne od artefaktów ruchowych. Analizowano co najmniej 1 min skumulowane dane zebrane ze śladów o długości co najmniej 10 s z ostatnich 10 min danego stanu doświadczalnego. Zużycie O2 określono poprzez porównanie składu gazu między kalibracją w pustej komorze a oddychaniem na żywo za pomocą czujnika tlenu i analizatora AEI. Temperatura w komorze była stale monitorowana za pomocą sondy Thermoworks MicroThermo 2 i była rejestrowana za pomocą LabChartPro w czasie rzeczywistym.
pomiary Poincaré ’ ego oraz częstość Westchnień i bezdechów zostały określone za pomocą 1 min śladów wolnych od ruchu z każdego stanu oddychania. Westchnienia definiowano jako oddech o amplitudzie co najmniej dwa razy większej od przeciętnego oddechu. Apneas były definiowane jako interwał międzyodrzwiowy (ibi) co najmniej dwa razy większy od średniego IBI. Współczynnik zmienności (CV) IBI i amplitudy obliczono również na podstawie tego samego 1-minutowego zestawienia śledzenia każdego stanu oddychania (błąd standardowy IBI lub Amplituda/średnia IBI lub Amplituda).
statystyki
pletyzmografia
wyniki (RR, VT, VE, VO2, VE/VO2, liczba apneas i westchnień oraz CV IBI i amplituda) dla powietrza w pomieszczeniu i danych hiperkapnicznych porównano między kohortami DBH-Cre; RC::P_hM4D i kontrolami rodzeństwa przy użyciu liniowego modelu regresji mieszanych efektów z typem zwierzęcia (eksperymentalne (Pre vs.Post Injection) jako stałe efekty i identyfikator zwierzęcia jako efekt losowy. Dane dotyczące temperatury porównano przy użyciu liniowego modelu regresji efektów mieszanych z typem zwierzęcia (eksperymentalne vs. Kontrola) jako stałym efektem. P < 0,05 użyto do wskazania istotności statystycznej, a poszczególne punkty danych, średnia i standardowy błąd średniej są pokazane na wszystkich wykresach.
chromatografia cieczowa-Spektrometria Mas
uzyskany obszar pod pikiem dla każdej próbki został znormalizowany przez kontrolę wewnętrzną, a następnie do pojazdu przed wykonaniem analizy statystycznej. Do porównania względnej obfitości klozapiny i CNO w każdej tkance z podziałem na grupy stężeń użyto testu t niesparowanego.
Etyka
wszystkie eksperymenty zostały zatwierdzone przez Institutional Animal Care and Use Committee of Baylor College Of Medicine. Eksperymenty były zgodne z krajowymi normami opieki i wykorzystania zwierząt doświadczalnych określonymi przez Stowarzyszenie oceny i Akredytacji opieki nad zwierzętami laboratoryjnymi.
js, FS-M, MC-M i RR Js, FS-M i PZ przeprowadziły eksperymenty i przyczyniły się do analizy danych. Js, FS-M, VM, MC-M i RR napisał artykuł.
finansowanie
to badanie było wspierane przez granty R01HL130249 i R01HL130249-S1 od National Heart, Lung, and Blood Institute; March of Dimes Basil O ’ Connor Award; i McNair Medical Institute.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
dziękujemy Dr Shailę K. Mani i Benjaminowi Arekielowi za pomocne dyskusje. Dziękujemy również Baylor College Of Medicine Proteomics Core facility za wykonanie chromatografii cieczowej-spektrometrii masowej.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B in respiratory control: lessons from congenital central hipowentylation syndrome and its mouse models. Respir. Physiol. Neurobiol. 168, 125–132. doi: 10.1016 / j.resp.2009.03.005
CrossRef Pełny tekst / Google Scholar
Andrews, N., and File, S. E. (1993). Postępowanie ze szczurami w wywiadzie modyfikuje behawioralne działanie leków w podwyższonym teście lęku plus-maze. Eur. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., and Roth, B. L. (2007). Rozwijając blokadę, aby dopasować klucz do stworzenia rodziny receptorów sprzężonych z białkiem G silnie aktywowanych przez obojętny ligand. Proc. Natl. Acad. Sci. USA 104, 5163-5168. doi: 10.1073 / pnas.0700293104
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ashby, C. R., and Wang, R. Y. (1996). Farmakologiczne działania atypowego leku przeciwpsychotycznego klozapiny: przegląd. Synapsa 24, 349-394. doi: 10.1002 / (SICI)1098-2396(199612)24:4<349::pomoc-SYN5>3.0.CO; 2-D
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
2015-01-15, 20: 15 Obturacyjny bezdech senny i choroby neurodegeneracyjne: relacja dwukierunkowa. Dement. Neuropsychol. 9, 9–15. doi: 10.1590 / S1980-57642015DN91000003
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Biancardi, V., Bícego, K. C., Almeida, M. C., and Gargaglioni, L. H. (2008). Locus coeruleus neurony noradrenergiczne i CO2 napęd do oddychania. Pflugers Arch. – Eur. J. Fizjol. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Brust, R. D., Corcoran, A. E., Richerson, G. B., Nattie, E., and Dymecki, S. M. (2014). Funkcjonalna i rozwojowa identyfikacja molekularnego podtypu neuronu serotoninergicznego mózgu specjalizującego się w regulacji dynamiki oddechu. Cell Rep. 9, 2152-2165. doi: 10.1016 / j.celrep.2014.11.027
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Chang, W. H., Lin, S. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Odwracalny metabolizm klozapiny i N-tlenku klozapiny u chorych na schizofrenię. Prog. Neuro-Psychofarmakol. Biol. Psychiatria 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Genetyczna identyfikacja populacji neuronów noradrenergicznych zaangażowanych w tłumienie odpowiedzi związanych ze stresem. Mol. Psychiatria 1-16. doi: 10.1038 / s41380-018-0245-8
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Dlouhy, B. J., Gehlbach, B. K., Kreple, C. J., Kawasaki, H., Oya, H., Buzza, C., et al. (2015). Oddychanie hamowane, gdy drgawki rozprzestrzeniają się do ciała migdałowatego i po stymulacji ciała migdałowatego. J. Neurosci. 35, 10281–10289. doi: 10.1523 / JNEUROSCI.0888-15. 2015
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Feinstein, J. S., Buzza, C., Hurlemann, R., Follmer,R. L., Dahdaleh, N. S., Coryell, W. H., et al. (2013). Strach i panika u ludzi z obustronnymi uszkodzeniami ciała migdałowatego. Nat. Neurosci. 16, 270–272. doi: 10.1038 / nn.3323
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Fitton, A., and Heel, R. C. (1990). Klozapina. Przegląd jego właściwości farmakologicznych i zastosowanie terapeutyczne w schizofrenii. Narkotyki 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Fleury Curado, T. A., Pho, H., Dergacheva, O., Berger, S., Lee, R., Freire, C., et al. (2018). Wyciszenie motoneuronów hipoglikemicznych prowadzi do zaburzeń oddychania u szczupłych myszy. Przód. Neurol. 9:962. doi: 10.3389/fneur.2018.00962
CrossRef Pełny Tekst / Google Scholar
Gargaglioni, L. H., Hartzler, L. K., and Putnam, R. W. (2010). Locus coeruleus i Central chemosensitivity. Respir. Physiol. Neurobiol. 173, 264–273. doi: 10.1016 / j.resp.2010.04.024
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). Chemogenetyka ujawniła: obecność DREADD i aktywację poprzez przekształconą klozapinę. Nauka 357, 503-507. 10.1126 / naukaaan2475
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Guettier J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). A chemical-genetic approach to study g protein regulation of beta cell function in vivo. Proc. Natl. Acad. Sci. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
CrossRef Pełny tekst / Google Scholar
Hakim, F., Gozal, D., and Kheirandish-Gozal, L. (2012). Zmiany współczulne i katecholaminergiczne w bezdechu sennym ze szczególnym uwzględnieniem dzieci. Przód. Neurol. 3:7. doi: 10.3389/fneur.2012.00007
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Hennessy, M. L., Corcoran, A. E., Brust, R. D., Chang, Y., Nattie, E. E., and Dymecki, S. M. (2017). Aktywność Tachykinin1-wyrażających neuronów raphe Pet1 moduluje chemoreflex układu oddechowego. J. Neurosci. 37, 1807–1819. doi: 10.1523 / JNEUROSCI.2316-16. 2016
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
(2015). Rola jąder przyfazowych w kontroli oddychania u dorosłych szczurów. J. Neurosci. 35, 1052–1067. doi: 10.1523 / JNEUROSCI.2953-14. 2015
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D., and Bähner, F. (2018). Behawioralne skutki ostrej ogólnoustrojowej małej dawki klozapiny u szczurów dzikiego typu: implikacje dla stosowania DREADDs w neuronauce behawioralnej. Przód. Zachowuj się. Neurosci. 12:173. doi: 10.3389 / fnbeh.2018.00173
CrossRef Pełny tekst / Google Scholar
Isom, G. E., and Elshowihy, R. M. (1982). Interakcja ostrego i przewlekłego stresu z oddychaniem: modyfikacja przez naloxone. Pharmacol. Biochem. Zachowuj się. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Jann, M. W., Lam, Y. W., and Chang, W. H. (1994). Szybkie tworzenie klozapiny u świnek morskich i ludzi po podaniu N-tlenku klozapiny. Arch. Int. Pharmacodyn. Ther. 328, 243–250.
PubMed Abstract / Google Scholar
Joober, R. (2010). Klozapina: wyraźna, słabo poznana i słabo wykorzystana cząsteczka. J. Psychiatria Neurosci. 35, 147–149. doi: 10.1503 / jpn.100055
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Kinkead, R., Dupenloup, L., Valois, N., and Gulemetova, R. (2001). Indukowane stresem tłumienie hiperkapnicznej odpowiedzi wentylacyjnej u obudzonych szczurów. J. Appl. Physiol. 90, 1729–1735. doi: 10.1152 / jappl.2001.90.5.1729
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
Klein, D. F. (1993). Fałszywe alarmy uduszenia, spontaniczne paniki i związane z nimi warunki. Hipoteza integracyjna. Arch. Gen. Psychiatrii 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. V., and Huckstepp, R. T. R. (2018). Rola neuronów przyfazowych w kontroli oddychania podczas ćwiczeń. Sci. REP. 8: 400. doi: 10.1038 / s41598-017-17412-z
CrossRef Pełny tekst / Google Scholar
Lapin, I. P. (1995). Tylko kontrole: wpływ obsługi, wstrzyknięcie pozorowane, i dootrzewnowe wstrzyknięcie soli fizjologicznej na zachowanie myszy w podwyższonym plus-labirynt. J. Pharmacol. Toxicol. Metody 34, 73-77. doi: 10.1016 | 1056-8719 (95)00025-D
PubMed Streszczenie | CrossRef Pełny tekst / Google Scholar
Lavezzi, A. M., Alfonsi, G., and Matturri, L. (2013). Patofizjologia kompleksu ludzkiego locus coeruleus w nagłej niewyjaśnionej śmierci płodu / noworodka. Neurol. Rez. 35, 44-53 doi: 10.1179 | 1743132812y. 0000000108
PubMed Abstract | CrossRef Full Text / Google Scholar
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., España, R. A., et al. (2016). Podawanie N-tlenku klozapiny wywołuje efekty behawioralne u szczurów długoogonowych: implikacje dla projektowania eksperymentów DREADDA. eNeuro 3, 1-14. doi: 10.1523 / ENEURO.0219-16. 2016
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Solidny i wydajny system raportowania i charakteryzacji Cre dla całego mózgu myszy. Nat. Neurosci. 13, 133–140. doi: 10.1038 / nn.2467
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Mahler, S. V., and Aston-Jones, G. (2018). CNO evil? Rozważania dotyczące stosowania dreadds w neuronauce behawioralnej. Neuropsychopharmacology 43, 934-936. doi: 10.1038 / npp.2017.299
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, M. S., Ritchie, J. C., Porter, J. H., et al. (2018). N-tlenek DREADD agonisty klozapiny (CNO) jest odwracalnie metabolizowany do klozapiny i wywołuje u szczurów i myszy interaceptywne działanie stymulujące podobne do klozapiny. Sci. / Align = „center” / 8,3840 doi: 10.1038 / s41598-018-22116-z
CrossRef Pełny tekst / Google Scholar
Misslin, R., Herzog, F., Koch, B., and Ropartz, P. (1982). Wpływ izolacji, manipulacji i nowości na przysadkę mózgową-reakcja nadnerczy u myszy. Psychoneuroendokrynologia 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Nakamura, A., Zhang, W., Yanagisawa, M., Fukuda, Y., and Kuwaki, T. (2007). Czujność zależne od stanu tłumienie hiperkapnic chemoreflex i przesadny bezdech senny u myszy z nokautem oreksyny. J. Appl. Physiol. 102, 241–248. doi: 10.1152 / jappphysiol.00679.2006
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Obonai, T., Yasuhara, M., Nakamura, T., and Takashima, S. (1998). Zmiany neuronów katecholaminowych w pniu mózgu ofiar zespołu nagłej śmierci niemowląt. Pediatrics 101, 285-288. doi: 10.1542 / peds.101.2.285
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ozawa, Y., Takashima, S., and Tada, H. (2003). Zmiany podtypu receptora alfa2-adrenergicznego w pniu mózgu w zespole nagłej śmierci niemowląt. Wczesny Szum. Dev. 75 (Suppl.), S129-S138. doi: 10.1016 / j.pathophys.2004.01.015
CrossRef Pełny tekst / Google Scholar
Padovan-Hernandez, Y., and Knackstedt, L. A. (2018). Zależne od dawki zmniejszenie poruszania się wywołanego kokainą przez klozapinę-N-tlenek u szczurów, u których samo podawanie kokainy w wywiadzie. Neurosci. Lett. 674, 132–135. doi: 10.1016 / j.neulet.2018.03.045
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ramanantsoa, N., Hirsch, M.-R., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Oddychanie bez chemoczułości CO (2) U warunkowych mutantów Phox2b. J. Neurosci. 31, 12880–12888. doi: 10.1523 / JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Egr2-neurony kontrolują reakcję oddechową dorosłych na hiperkapnię. Brain Res. 1511, 115-125. doi: 10.1016 / j.brainres.2012.12.017
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
2010-01-20 19: 40: 40 (2011). Zaburzenia kontroli temperatury układu oddechowego i ciała przy ostrym hamowaniu neuronu serotonergicznego. Nauka 333, 637-642. 10.1126 / nauka1205295
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
Ryabinin, A. E., Wang, Y. M., oraz Finn, D. A. (1999). Różne poziomy immunoreaktywności Fos po wielokrotnym obchodzeniu się ze stresem i wstrzyknięciu u dwóch wsobnych szczepów myszy. Pharmacol. Biochem. Zachowuj się. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Snyder, B., Shell, B., Cunningham, J. T., and Cunningham, R. L. (2017). Przewlekłe niedotlenienie okresowe wywołuje stres oksydacyjny i stan zapalny w regionach mózgu związanych z neurodegeneracją we wczesnym stadium. Physiol. REP. 5, 1-13. doi: 10.14814 / phy2.13258
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Sun, JJ, Huang, T.-W., Neul, Jl, and Ray, RS (2017). Embrionalne geny wstęgomózgowia wyznaczają odrębne populacje homeostatyczne układu sercowo-oddechowego i metabolicznego u dorosłych. Sci. / Align = „left” / 9117 doi: 10.1038 / s41598-017-08810-4
CrossRef Pełny tekst / Google Scholar
Sun, J. J., and Ray, R. S. (2017). TG (Th-Cre)FI172Gsat (TH-Cre) definiuje neurony, które są wymagane do pełnego hiperkapnicznego i niedotlenienia odruchów. Biol. Otwarta 6, 1200-1208. doi: 10.1242 / bio.026823
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Taugher, R. J., Lu, Y., Wang, Y., Kreple,C. J., Ghobbeh, A., Fan, R., et al. (2014). Jądro łoża prążków końcowych jest krytyczne dla zachowań związanych z lękiem wywołanych przez CO2 i kwasicę. J. Neurosci. 34, 10247–10255. doi: 10.1523 / JNEUROSCI.1680-14. 2014
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Valentino, R. J., And Van Bockstaele, E. (2008). Konwergentna regulacja aktywności locus coeruleus jako adaptacyjna reakcja na stres. Eur. J. Pharmacol. 583, 194–203. doi: 10.1016 / j.ejphar.2007.11.062
CrossRef Pełny tekst / Google Scholar
Verbraecken, J., and McNicholas, W. T. (2013). Mechanika oddechowa i kontrola wentylacji w zespole nakładania się i hipowentylacji otyłości. Respir. Res. 14:132. doi: 10.1186/1465-9921-14-132
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Viemari, J.-C. (2008). Modulacja noradrenergiczna sieci neuronowej układu oddechowego. Respir. Physiol. Neurobiol. 164, 123–130. doi: 10.1016 / j.resp.2008.06.016
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Winter, A., Ahlbrand, R., Naik, D., and Sah, R. (2017). Różnicowa wrażliwość behawioralna na inhalację dwutlenku węgla (CO2) u szczurów. Neuroscience 346, 423-433. doi: 10.1016 / j.2017.01.003
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ziemann, A. E., Allen, J. E., Dahdaleh, N. S., Drebot,I. I., Coryell, M. W., Wunsch, A. M., et al. (2009). Ciało migdałowate jest chemosensorem, który wykrywa dwutlenek węgla i kwasicę, aby wywołać zachowanie strachu. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar