- wprowadzenie
- materiały i metody
- pobranie oocytów i mikroiniekcji cRNA
- Izolacja frakcji błonowych i Immunoblotting
- Immunohistochemia
- mikroskopia elektronowa z zamrożonym złamaniem
- Test sparowanych komórek jajowych i oznaczenie ilościowe obszarów kontaktu
- Test impulsowy ciśnienia hydrostatycznego
- inkubacja Kaprynianu
- Analiza statystyczna
- wyniki
- wyrażenie Claudina-5 i integracja z X. błona osocza Oocytowego laevis
- w komórkach Oocytowych wyrażających ekspresję Claudiny-5,
- sparowany Test komórek jajowych do analizy Trans-interakcji Claudiny
- Test impulsu ciśnienia hydrostatycznego ujawnia specyficzne dla Klaudyny połączenie par oocytów
- inkubacja z kaprysem
- dyskusja
- Claudins przyczyniają się do silniejszych właściwości adhezyjnych
- wniosek
- Oświadczenie o dostępności danych
- Etyka
- autorzy
- finansowanie
- konflikt interesów
- podziękowania
- Materiały uzupełniające
wprowadzenie
rodzina białek szczelnych połączeń ma kluczowe znaczenie dla fizjologii komórki, ponieważ brak lub upośledzenie jest związane z chorobami i dysfunkcją wielu narządów i tkanek, jak pokazano np. w uchu wewnętrznym (Wilcox et al., 2001; Florian et al., 2003), nerka (Konrad et al., 2006; Günzel et al., 2009), przewodu pokarmowego (Resnick et al., 2005; Amasheh et al., 2009), naskórek (Furuse et al., 2002; Tebbe et al., 2002) i naczyń włosowatych mózgu (Nitta et al., 2003; Wolburg et al., 2003). Klaudyny reprezentują rodzinę białek przezbłonowych składającą się z co najmniej 27 członków (Mineta et al., 2011). Oprócz czterech domen helisy przezbłonowej, zawierają one dwie zewnątrzkomórkowe pętle (ECL1 i ECL2), krótki N-KONIEC i C-koniec (Suzuki et al., 2014). Specyficzne wzory ekspresji Klaudyny określają i odzwierciedlają selektywną przepuszczalność nabłonka, a zdolność białek Klaudyny do interakcji w cis (w tej samej błonie) i trans (między błonami sąsiedniej komórki) pozwala na tworzenie barier tworzących i tworzących pory ciasnych pasm połączeń (Van Itallie and Anderson, 2006).
Klaudyna-5 jest silnie wyrażona w endotelii kapilarnej i dominuje nad ciasnym skrzyżowaniem (TJ) bariery krew-mózg (BBB), ponieważ ekspresja jest >100 razy wyższa w porównaniu z jakąkolwiek inną klaudyną (Ohtsuki i in., 2007). Ponadto wyraża się w różnych tkankach nabłonkowych, w tym w płucach (Soini, 2011), tkankach zewnątrzwydzielniczych (Comper et al., 2009), jelitowe (Garcia-Hernandez et al., 2017) i dróg moczowych (Koda et al., 2011). Jednak claudin-5 powoduje silniejszą barierę w naczyniach włosowatych mózgu niż w innych tkankach (Reinhold i Rittner, 2017), a jego funkcja jest upośledzona w zaburzeniach neurodegeneracyjnych i neuroinflammatory (Greene i wsp ., 2019). Dlatego claudin-5 ma kluczowe znaczenie dla utrzymania BBB. Ale BBB jest nie tylko ochronny, ale także ogranicza możliwości terapeutyczne, ponieważ leki są utrudnione, aby przeniknąć tę barierę.
Nitta i in. (2003) poinformował, że BBB jest bardziej przepuszczalny dla cząsteczek o wielkości 800 Da u myszy z niedoborem claudin-5 w porównaniu do myszy typu dzikiego(Nitta et al., 2003). Było to zgodne z doświadczeniami transfekcji wykazującymi efekt uszczelniający claudin-5 w monowarstwach komórek Caco-2 (Amasheh et al., 2005).
inną ważną barierą tworzącą klaudynę jest Klaudyna-3, która, jak donoszono, selektywnie uszczelnia barierę przed przejściem jonów zarówno ładunku, jak i nierozładowanych substancji rozpuszczonych (Milatz et al., 2010). Wyraża się również w śródbłonkowym szczelnym złączu naczyń włosowatych mózgu, a jego ubytek funkcjonalny obserwuje się w fazach zapalenia mikrowessela, glejaka i splotu naczyniówkowego u pacjentów ze stwardnieniem rozsianym(Engelhardt i wsp ., 2001; Wolburg et al., 2003).
właściwości bariery można dynamicznie modyfikować, np. wykazano, że inkubacja z kaprylanem sodu szybko i odwracalnie zmniejsza oporność elektryczną przezbłonową w linii komórek jelita ludzkiego HT-29/B6 (Krug i wsp., 2013). Kaprys sodu przejściowo otwiera bariery zawierające claudin-5 w szczelnych skrzyżowaniach komórek nabłonka i śródbłonka (Del Vecchio et al., 2012).
oznacza to, że claudin-5 jest obiecującym celem poprawy dostarczania leku w BBB.
w tym badaniu staraliśmy się wykorzystać heterologiczny system ekspresji oocytów Xenopus laevis (Vitzthum et al., 2019) do analizy interakcji claudin-5 i claudin-3 oraz pertubacji. Ze względu na brak endogennych styków komórek, ten jednokomórkowy system ekspresji umożliwia analizę specyficznych Klaudyn bez ingerencji innych białek szczelnych połączeń.
materiały i metody
pobranie oocytów i mikroiniekcji cRNA
oocytów pobrano od dorosłych samic żab pazurów afrykańskich metodą chirurgicznej laparotomii. W przypadku Anastazji 0.2% MS222 (metanosulfonian 3-aminobenzoesanu etylu, Sigma-Aldrich, Taufkirchen, Niemcy) stosowano jako roztwór do kąpieli przez 5-10 minut w temperaturze 20°C. Po osiągnięciu chirurgicznego znieczulenia wykonano nacięcia skóry i mięśni brzucha, wycięto masę jajnika i usunięto tkankę jajnika. Izolację oocytów przeprowadzono przez trawienie enzymatyczne w temperaturze pokojowej przez 90 minut w 1,5 mg/ml Bioreagentach Fisher Bp2649-1 (Fisher Scientific, Schwerte, Niemcy) rozpuszczonych w roztworze Ringera oocytów (ORi), jak opisano przez Vitzthum i wsp. (2019). Komórki pęcherzykowe usunięto przez inkubację w wolnym od Ca2 + ORi zawierającym (w mM): NaCl (90), KCl (1), EGTA (glikol trietylenowy diaminowy kwas tetraoctowy) (1), 5 HEPES (5); pH 7,4 przez 10 minut na wytrząsarce mechanicznej z prędkością 50 obr. / min. Oocyty stadiów V I VI (>1000 µm) wstrzyknięto (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Stany Zjednoczone) z 1 ng cRNA kodującym wodę ludzką claudin-5, claudin-3 lub wolną od RNazy. Objętość iniekcji wynosiła 50,6 nl na oocyt. Po wstrzyknięciu komórki jajowe inkubowano w temperaturze 16°C przez 3 dni w celu ekspresji białka.
Izolacja frakcji błonowych i Immunoblotting
dziesięć wstrzykniętych oocytów połączono do analizy western blot i zawieszono w buforze homogenizacyjnym 500 µl zawierającym (w mM) MgCl2 (5), NaH2PO4 (5), EDTA (kwas etylenodiaminotetraoctowy) (1), sacharozę (80) i Tris (Tris(hydroksymetylo)aminometan) (20); pH 7.4. Ekstrakty oocytów wirowano dwukrotnie przy 200 obr. / min przez 10 min w temperaturze 4°c w celu usunięcia resztek komórek. Supernatant wirowano przy 13 000 obr. / min przez 30 min w temperaturze 4°c, aby granulować błonę komórkową, jak opisano przez Leduc-Nadeau i wsp. (2007). Granulki zawieszono w buforze homogenizacyjnym o pojemności 80 µl. Oznaczanie ilościowe białka przeprowadzono kolorymetrycznie przy użyciu zestawu do oznaczania białek Pierce 600 nm (Thermo Fisher Scientific, Hennigsdorf, Niemcy)zgodnie z instrukcją producenta w 96-studzienkowej płytce. Czytnik płytkowy (PerkinElmer ENSPIRE Multimode Plate Reader, Waltham, MA, Stany Zjednoczone) dostosowano do 562 nm, A do oceny zastosowano Standard albuminy bydlęcej (Thermo Fisher Scientific, Hennigsdorf, Niemcy) w zakresie od 125 do 2000 µg/ml. Przed immunoblottingiem próbki zmieszano z buforem 4× Laemmli (Bio-Rad Laboratories, Monachium, Niemcy), załadowano na 10% żel poliakrylamidowy SDS i poddano elektroforezie. Do przenoszenia białek użyto membran PVDF i Zablokowano w 5% suchym mleku beztłuszczowym w roztworze soli fizjologicznej buforowanej Tris przez 120 minut. Białka wykryto przez immunoblotting przy użyciu pierwotnych przeciwciał podniesionych przeciwko claudin – 3 lub claudin – 5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Stany Zjednoczone).
skoniugowane peroksydazą kozie przeciwciała anty-królicze i przeciwciała anty-mysie (#7074, # 7076 Cell Signaling Technology, Danvers, MA, Stany Zjednoczone) zostały użyte do wiązania się z pierwotnymi przeciwciałami i dlatego inkubowano przez co najmniej 45 minut w temperaturze pokojowej. Do wykrywania użyto substratu Clarity Western ECL Blotting (#1705061, Bio-Rad Laboratories GmbH, Monachium, Niemcy), A sygnały były wizualizowane przez system ChemiDoc MP (Bio-Rad Laboratories).
Immunohistochemia
wstrzyknięte oocyty utrwalano w 4% PFA (16% paraformaldehydu, E15700, Science Service, Monachium, Niemcy) przez 4 godziny w temperaturze pokojowej, a następnie gradient odwodnienia z 70% etanolu do ksylolu (Carl Roth, Karlsruhe, Niemcy) w ciągu 48 godzin. próbki osadzano w parafinie i przekrojono poprzecznie (5 µm) za pomocą mikrotomu Leica RM 2245 (5 µm).Leica Microsystems Heidelberg, Niemcy). Na krótko przed leczeniem immunohistochemicznym parafinę usunięto za pomocą gradientu ksylolu do etanolu. Nieswoiste miejsca wiązania blokowano stosując 5% koziej surowicy w roztworze soli fizjologicznej buforowanej fosforanem i inkubowano z tymi samymi pierwotnymi przeciwciałami, co w przypadku immunoblottingu. Próbki inkubowano z wtórnymi przeciwciałami Alexa Fluor-488 goat anti-rabbit i Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, Stany Zjednoczone) i zbadano za pomocą konfokalnej laserowej mikroskopii immunofluorescencyjnej (LSM 710, Zeiss, Oberkochen, Niemcy).
mikroskopia elektronowa z zamrożonym złamaniem
przeprowadzono mikroskopię elektronową z zamrożonym złamaniem, jak donoszono niedawno (Greene et al., 2019). W celu utrwalenia wstrzyknięte oocyty inkubowano w aldehydu glutarowym (2,5% w buforze kakodylowym 0,1 M) przez noc w temperaturze 4°C. po przemyciu buforem kakodylowym oocyty przygotowano do zamrożenia. Próbki poddano krioprotekcji w 30% glicerolu i zamrożono w ciekłym azocie. Po szczelinowaniu i zacienieniu platyny i węgla (Baf400d; Balzers, Liechtenstein) pozostały materiał organiczny usunięto za pomocą płukania podchlorynem sodu. Komórki jajowe analizowano w transmisyjnym mikroskopie elektronowym (EM-10, Zeiss, Oberkochen, Niemcy) i fotografowano aparatem cyfrowym (Tröndle GmbH). Analizę morfometryczną ciasnych nici połączeniowych przeprowadzono w powiększeniu 20 000×.
Test sparowanych komórek jajowych i oznaczenie ilościowe obszarów kontaktu
zastosowano Mannitol w celu zmniejszenia wstrzykniętych komórek jajowych i umożliwienia mechanicznego usunięcia błony witellinowej za pomocą kleszczy bez uszkodzenia błony plazmatycznej. 5-10 oocytów umieszczono w szalce Petriego (Średnica 35 mm, Thermo Fisher, Henningsdorf, Niemcy, #153066) wypełnionej ORi. Dodano Mannitol i rozpuszczono do momentu uzyskania hipertonicznego kurczenia się komórek (około 400 mOsmol / l przez 10 minut). Po ręcznej dewitellinizacji oocyty natychmiast przeniesiono do płytki 24-studziennej (1. 86 cm2 powierzchni, TPP Techno Plastic Products, Trastadingen, Szwajcaria, # 92024) zawierający 2 ml ORi. W każdej studzience delikatnie zgrupowano dwie komórki, popychając je pipetą Pasteura (1 ml, Thermo Fisher, Henningsdorf, Niemcy, #PP88SB) i sondą bulwiastą.
pary oocytów z ekspresją Klaudyny-5 (cldn5-cldn5), ekspresją Klaudyny − 3 (cldn3-cldn3), koekspresją Klaudyny-3 i Klaudyny − 5 (cldn3,5-cldn3,5) i oocytami kontrolnymi (control-control) trzymano razem do 48 godzin w ORi w temperaturze 16°C.
zastosowano mikroskopię jasnego pola w celu oznaczenia ilościowego obszaru kontaktu skupionych oocytów po 1, 24 i 48 h. obrazy par oocytów nieleczonych w 24 naczyniach do hodowli odwiertów wykonano w tych punktach czasowych przy użyciu mikroskopu Leica dmi6000 B (Leica Microsystems, Wetzlar, Niemcy). Średnicę powierzchni styku mierzono w skali mikronowej (LAS-AF 3.2.0). Powierzchnie styku są uważane za okrągłe, a zatem powierzchnię styku obliczono za pomocą równania okręgu a=π∙R2.
Test impulsowy ciśnienia hydrostatycznego
membrany Witelliny usuwano mechanicznie, jak opisano wcześniej, a oocyty klastrowały się analogicznie do sparowanego testu oocytowego. Dodatkowo badano mieszane pary oocytów (control-cldn5 i control-cldn3) w teście hydrostatycznego impulsu ciśnienia (HPI). Po 24 godzinach stabilizacji za pomocą jednokanałowej pipety elektronicznej powstał określony impuls hydrostatyczny (EE-300R, Eppendorf Research Pro, software version 2.06.00, Hamburg, Niemcy).
oocyty trzymano w 24 płytkach studzienkowych zawierających 2 ml ORi i sprawdzano Centralne pozycjonowanie przed zastosowaniem objętości pipetowania 250 µl ORi. Prędkość dozowania została równomiernie ustawiona na prędkość maksymalną, co równa się prędkości dozowania 0,9 s. ponadto równomiernie zastosowano kąt (45°) i odległość nakładania (∼1,3 cm). Ciśnienie otoczenia, lepkość ORi i średnica otworu końcówki pipety utrzymywano w stałych warunkach. Do ilościowego oznaczania powierzchni styku zastosowano mikroskopię jasnego pola 30 minut po przyłożeniu ciśnienia hydrostatycznego i porównano ją z obszarami styku przed zastosowaniem. Układ doświadczalny opisano na fig. 1.
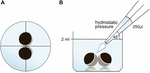
Rysunek 1. Układ doświadczalny testu impulsowego ciśnienia hydrostatycznego (a) schematyczny widok odwiertu z góry: centralne położenie pary oocytów sprawdzano przed zastosowaniem ciśnienia hydrostatycznego. B) schematyczny widok boczny odwiertu: 250 µl ORi dodano za pomocą jednokanałowej pipety elektronicznej. Prędkość dozowania była równomiernie ustawiona na prędkość maksymalną. Kąt (45°) i odległość aplikacji były równomiernie stosowane. Ciśnienie otoczenia, lepkość ORi i średnica otworu końcówki pipety utrzymywano w stałych warunkach.
inkubacja Kaprynianu
w przypadku inkubacji kaprynianu, kaprynian sodu (#c4151, Sigma Aldrich, Taufkirchen, Niemcy) w końcowych stężeniach 50, 100 i 500 µM, lub ORi jako grupa odniesienia, dodano do oocytów 24 godziny po parowaniu. Oocyty trzymano w 24 płytkach studzienkowych zawierających 2 ml ORi, a roztwór kapratu rozpuszczono w określonej objętości addycyjnej 250 µl ORi na studzienkę. Szerokość obszaru styku oznaczano ilościowo po 30, 60 i 120 minutach od dodania.
Analiza statystyczna
analiza statystyczna została wykonana za pomocą JMP Pro 14.0.0 (Nc, Stany Zjednoczone). Dane są przedstawiane jako mediany i wyświetlane jako procentowa zmiana w oparciu o zgrupowaną kombinację w pierwszych punktach badania. Figury 4, 5 są przedstawione jako wykresy pola, przedstawiające pierwszy kwartyl (25-procent), mediana (50-procent) i drugi kwartyl (75-procent). Wąsy są rysowane w dół do 10. percentyla i do 90.percentyla. Rozkład normalny sprawdzano za pomocą testu Shapiro–Wilka.
do wielokrotnego porównania wykorzystano test Kruskala–Wallisa, a następnie korektę Dunna-Bonferroniego. wartości p są podane jako liczby ciągłe.
wyniki
wyrażenie Claudina-5 i integracja z X. błona osocza Oocytowego laevis
aby sprawdzić pomyślną ekspresję i integrację białka claudin-5 z błoną osocza oocytowego, 3 dni po wstrzyknięciu Crna claudin-5, frakcje błonowe analizowano za pomocą immunoblottingu. Wszystkie próbki z trzech pojedynczych zwierząt (d1–d3) ujawniły sygnały specyficzne dla Klaudyny-5 przy 23 kDa, podczas gdy wolne od RNazy oocyty wstrzyknięte wodą nie wykazały specyficznego sygnału dla ekspresji Klaudyny-5 (Fig.2A).
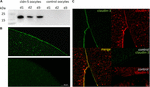
Rysunek 2. Wykrywanie heterologicznie wyrażonych Klaudyn w oocytach Xenopus laevis. A) analiza Immunoblotowa szczelnego połączenia białka claudin-5 w oocytach X. laevis trzech zwierząt (d1-d3). Lizaty błon komórkowych poddano SDS-PAGE, a następnie immunoblotowi na błony PVDF. Błony inkubowano z pierwotnymi przeciwciałami i wtórnymi przeciwciałami sprzężonymi z peroksydazą (N = 3). B) barwienie Immunofluorescencyjne ujawniło specyficzne sygnały claudin-5 (zielone) w błonach komórek jajowych wszystkich komórek jajowych wstrzykniętych cRNA, podczas gdy w kontrolach wstrzykniętych wodą nie wykryto sygnałów specyficznych dla claudin w mikroskopii konfokalnej. Reprezentatywne obrazy oocytów pochodzące od trzech zwierząt. Podziałka: 50 µm. C) Immunofluorescencyjne barwienie komórek Klaudyn-5 i Klaudyn – 3 wyrażających oocyty ujawniło specyficzne sygnały claudyn-3 (zielone) i claudin-5 (czerwone) w błonach komórek jajowych komórek jajowych wstrzykniętych cRNA, podczas gdy w komórkach kontrolnych wstrzykniętych wodą nie wykryto sygnałów specyficznych dla Klaudyn. Kolokalizacja wyrażonych białek Klaudyny w błonie osocza oocytów objawia się podwójnym zabarwieniem immunofluorescencyjnym (żółtym). Pasek skali: 10 µm.
w celu wizualizacji ekspresji białek w błonie osocza przeprowadzono immunohistochemiczne zabarwienia i przeanalizowano za pomocą konfokalnej laserowej mikroskopii skaningowej (Fig.2b). Specyficzne sygnały zostały wykryte i równomiernie rozmieszczone w błonie osocza komórek Klaudyny-5 wyrażających oocyty. Zgodnie z immunoblotami nie wykryto specyficznych sygnałów w błonach osocza komórek oocytów kontrolnych.
Tak więc, po wstrzyknięciu cRNA, Klaudyna-5 została pomyślnie poddana ekspresji i zintegrowana z błoną osocza komórek X. laevis oocytes.
Współekspresja Klaudyny-3 i Klaudyny-5 w parach oocytów ujawniła specyficzne sygnały dla Klaudyny-5 (czerwonej) i Klaudyny-3 (zielonej) w obu komórkach (Fig. Błony osocza oocytów wykazały fuzję sąsiednich komórek dostarczanych przez bezpośrednią interakcję cldn3, 5-cldn3 ,5 (Żółty).
w komórkach Oocytowych wyrażających ekspresję Claudiny-5,
analizowano błony osocza oocytu i wizualizacja nici oocytowych przebiegała pomyślnie (Fig.3). Freeze fracture electron microscopy wykazało plamy morfologii nici w błonach plazmatycznych oocytów claudin-5, a organizacja nici claudin-5 wyrażających oocyty była wysoce zorganizowana i miała kształt kątowy (Fig. 3A). Ciasne nici połączeniowe Wykryto głównie w protoplazmatycznej (P-) powierzchni błony. Oocyty wstrzyknięte Claudin-3 wykazały zaokrąglone, silnie zorganizowane, ciasne pasma połączeń, jak opisano wcześniej (Vitzthum et al., 2019; rys. 3B). Freeze fracture electron microscopy claudin-3 and claudin – 5 coexpressing oocytes revealed fibryls that both bear properties of claudin-3 and claudin-5. Struktura nici fibrilowej współwystępujących oocytów była zarówno zaokrąglona, jak i złożona jako oocyty wyrażające klaudynę-3, ale także nieciągła i bardziej nachylona, jak pokazano dla komórek wyrażających klaudynę-5 (Fig. 3C). Oocyty kontrolne miały typową gładką powierzchnię (Rysunek 3D).
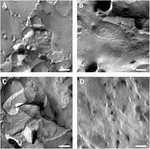
Rysunek 3. Freeze fracture electron microscopy. (A) Freeze fracture electron microscopy reveals tight junction protein cldn-5 as a meshwork of angular nieciągłe fibryle in rows in Xenopus laevis oocytes. (B) Freeze fracture electron microscopy reveals tight junction protein cldn-3 as a meshwork of rounded fibryls in X. laevis oocytes. (C) mikroskopia elektronowa Freeze fracture koekspressing claudin-3 i claudin-5 ujawnia fibryle, które mają właściwości claudin-3 i claudin-5. (D) oocyty kontrolne wtryskiwane wodą mają gładką powierzchnię. Reprezentatywne obrazy oocytów pochodzące od trzech zwierząt. Pasek skali: 250 nm.
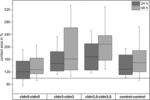
Rysunek 4. Mediana obszarów kontaktu skupionych kombinacji oocytów cldn5-cldn5, cldn3-cldn3,cldn3, 5-cldn3,5 i kontrola-kontrola 24 i 48 h po zgrupowaniu w % obszarów początkowego kontaktu krótko po zgrupowaniu (n = 8-38).

Rysunek 5. Obszary kontaktu Klaudyny-5, Klaudyny-3 i współwystępujące oocyty Klaudyny-3 i Klaudyny-5 w próbie impulsu ciśnienia hydrostatycznego (HPI) po okresie stabilizacji i 30 minut po HPI (n = 16-70, *p < 0,05, **p < 0.01, Kruskal-Wallis, a następnie korekta Dunn-Bonferroni).
sparowany Test komórek jajowych do analizy Trans-interakcji Claudiny
wszystkie złożone kombinacje wykazały zależne od czasu zwiększenie powierzchni kontaktu w mierzonym okresie czasu(Fig.4 i Tabela 1).
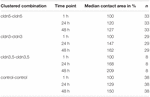
Tabela 1. Obszary kontaktu oocytów w ciągu 48 godzin po klastrowaniu.
powierzchnia kontaktu oocytów kontrolnych wstrzykniętych wodą wzrosła do 129% po 24 godzinach i 150% po 48 godzinach. Klastrowe pary oocytów wykazywały również wzrost obszarów kontaktu do 147% (24 h) i 162% (48 h). Skupione pary oocytów współwystępujące klaudynę-3 i klaudynę-5 wykazały obszary kontaktu 168% (24 h) i 209% (48 h). Skupione pary oocytów wyrażających samą klaudynę-5 wykazały obszary kontaktu 120% (24 h) i 127% (48 h). Dlatego obszary kontaktu we wszystkich badanych kombinacjach były porównywalne.
Test impulsu ciśnienia hydrostatycznego ujawnia specyficzne dla Klaudyny połączenie par oocytów
w oddzielnym podejściu, oocyty wyrażające klaudynę-3 lub klaudynę-5 lub współwystępujące obie Klaudyny były grupowane po mechanicznej dewitellinizacji. Oocyty poddano badaniu stosując HPI, a obszary kontaktu mierzono i obliczano 30 minut po badaniu i porównywano z obszarami początkowymi po 24-godzinnym okresie stabilizacji(ryc. 5 I Tabela 2). Po obciążeniu ciśnieniem hydrostatycznym powierzchnia kontaktu oocytów kontrolnych wtryskiwanych wodą zmniejszyła się do 89%. Skupione pary oocytów wyrażających klaudynę-5, klaudynę-3 lub koekspresujących klaudynę-3 i klaudynę-5 zachowały większe obszary kontaktu (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Obszary kontaktu mieszanych oocytów kontrolnych wstrzykniętych wodą i oocytów wyrażających klaudynę (control-cldn5 i control–cldn3) nie różniły się znacząco od oocytów kontrolnych (93%, p = 0,2900; 83%, P = 0,4455).
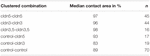
Tabela 2. Test impulsowy ciśnienia hydrostatycznego.
inkubacja z kaprysem
w pilotażowym eksperymencie inkubacyjnym wstrzyknięto oocyty i sparowano w kombinacje albo wyrażające klaudynę-5 (cldn5–cldn5), albo wstrzyknięto wodą wolną od RNazy jako elementy sterujące (control–control). Pary inkubowano z końcowymi stężeniami kapryratu sodu 50, 100 lub 500 µM. Inkubacja par oocytów z ORi służyła jako grupa referencyjna. Oocyty zgrupowano i po 24 h stabilizacji rozpoczęto inkubację i zmierzono szerokości kontaktu 30, 60 i 120 minut po dodaniu (rysunek uzupełniający S1).
dodanie ORi spowodowało początkowe zmniejszenie obszarów kontaktu zarówno w parach oocytów wyrażających klaudynę, jak i wstrzykiwanych wodą, które są rozproszone 60 lub 120 minut po dodaniu. Jest to zarysowane przez paraboliczny kształt linii połączenia między medianą obszarów styku w czasie (czerwone krzywe na rysunku uzupełniającym S1). Jednakże inkubacja z kaprys sodu o stężeniu 100 i 500 µM zwiększyła powierzchnie kontaktowe nieznacznie (100 µM) lub silnie (500 µM) 30 minut po dodaniu kaprys z 5,1 × 105 do 5,2 × 105 µm2 i 4,3 × 105 do 4,9 × 105 µm2.
dyskusja
w niniejszym badaniu zastosowaliśmy klasyczny model do transportu i modelowania chorób człowieka (Tammaro et al., 2009; Nenni et al., 2019), the X. laevis oocytes, for an in-depth analysis of claudin-5 interaction and functional contribution to the junction seal. W tym celu opracowano nowe podejście, wprowadzając HPI do trudnych interakcji w obszarze kontaktu klastrowych oocytów Xenopus.
Claudins przyczyniają się do silniejszych właściwości adhezyjnych
zgodnie z wcześniejszymi wynikami Vitzthum et al. (2019) pojedyncze Klaudyny wyrażone w oocytach nie prowadziły do zwiększenia obszarów kontaktu interakcji w porównaniu z oocytami kontrolnymi. Jednak immunoblot i wizualizacja immunohistochemiczna udowodniły pomyślną ekspresję i integrację z błoną osocza komórek X. laevis. Ponadto zastosowanie konfokalnej laserowej mikroskopii skaningowej pozwoliło na precyzyjną lokalizację wyrażonych Klaudyn w błonie plazmatycznej jako otworkowej zablokowanej Out-of-focus fluorescencji. Nie przeprowadzono kwantyfikacji sygnałów immunohistochemicznych, ponieważ różni się powinowactwo przeciwciał do wiązania ich celów.
(2009) zastosował technikę aspiracji mikropipetowej do zbadania aspektów interakcji claudin-claudin przy użyciu l-fibroblastów transfekowanych okcludyną oznaczoną GFP, cldn-1 i cldn-2. Siła separacji potrzebna do odłączenia dwóch komórek od siebie była większa w komórkach transfekowanych cldn-1 i cldn-2 (odpowiednio∼2,8 i 2,3 nN). Chociaż takie podejście może wydawać się również obiecujące dla analizy interakcji Klaudyna-Klaudyna ekspresji oocytów, wstępne testy wykazały, że oderwanie klastrowych oocytów nie jest możliwe bez zakłócenia błon osocza oocytów.
dlatego, jako nowatorskie podejście, Siła połączeń była mierzona za pomocą HPI. Chociaż HPI nie zapewnia kwantyfikacji siły separacji w wartościach bezwzględnych (np. u Newtona), pozwala to na szybką i opłacalną analizę interakcji Klaudyny bez zakłóceń innych białek szczelnych połączeń (np., okludyna, tricelulina, dżem-a). Klaudyny przyczyniają się do łączenia par oocytów, ponieważ wykazują większy obszar kontaktu w porównaniu do oocytów wstrzykniętych wodą po HPI. Wskazuje to na silną homofilną interakcję trans między komórkami wyrażającymi klaudynę.
Architektura Fibrilu jest specyficzna dla pojedynczych Klaudyn (Colegio et al., 2002). W mikroskopii elektronowej freeze fracture stwierdzono, że claudin-3 tworzy bardziej zaokrągloną siateczkę w kształcie pętli w Xenopus oocytes(Vitzthum et al., 2019; Rysunek 3B) podczas gdy w naszym badaniu claudin-5 utworzył siatkę bardziej kątową i uporządkowaną w rzędach. Zdjęcia wykazały, że szczelne połączenie białka claudin-5 tworzy siateczkę włókien w nieciągłych, kanciastych rzędach w oocytach X. laevis. Jest to zgodne z pasmami claudin-5, o których wiadomo, że występują jako łańcuchy cząstek związanych z fazą P(Piontek i in., 2011). W naszych doświadczeniach, geometryczny kształt włókien zdawał się nie mieć wpływu na właściwości adhezyjne oocytów. Zgodnie z tym stwierdzono, że oporność parakomórkowa nie ma związku z liczbą fibrilu i właściwościami tworzenia fibrilu(Colegio et al., 2002). Ponadto wykazano, że claudin-3 i claudin-5 mają podobną zdolność do homofilnej interakcji trans w komórkach HEK293 (Piontek i wsp ., 2011).
ten model oocytów X. laevis, wyrażający pojedyncze białka szczelnego połączenia, umożliwia obserwację wpływu substancji takich jak kaprynian sodu na tworzenie obszarów kontaktu między skupionymi oocytami. Może on zatem stanowić użyteczne narzędzie do czasowego i ekonomicznego badania przesiewowego substancji wpływających na szczelną barierę przyłączeniową.
stężenia kaprylanu sodu 100 i 500 µM mogą wywierać działanie ochronne na oocyty wyrażające klaudynę-5, powodując zwiększenie obszarów kontaktu po 30 minutach inkubacji.
(2013) wykazał, że inkubacja z kaprylanem sodu doprowadziła do szybkiego i odwracalnego zmniejszenia oporności przezbłonowej w ludzkiej linii komórkowej jelita HT-29/B6. Ponadto, konfokalna laserowa mikroskopia skaningowa wykazała znaczne zmniejszenie claudin-5 w komórkach HT-29 / B6 leczonych średniołańcuchowym laurynianem kwasu tłuszczowego(Dittmann i wsp ., 2014). Pierwsza zewnątrzkomórkowa pętla Klaudyn (ECL1) jest ważna dla właściwości barierowych ciasnego połączenia, podczas gdy druga zewnątrzkomórkowa pętla (ECL2) bierze udział w tworzeniu nici Trans-interakcji (Piontek et al., 2008; Rossa et al., 2014; Greene et al., 2019). Spoiwa Claudin-5 skierowane na ECL1 lub ECL2 claudin-5 mogą indukować wewnątrzkomórkowy wychwyt białka ciasnego połączenia, tym samym udaremniając trans-interakcje claudin-5 w ciasnym uszczelnieniu połączenia między sąsiednimi komórkami i rozluźniając przestrzeń parakomórkową (Hashimoto i in., 2017).
tak więc postawiliśmy hipotezę, że inkubacja z kaprylanem sodu doprowadziłaby do zmniejszenia obszaru kontaktu skupionych komórek claudin – 5 wyrażających oocyty X. laevis. Nieoczekiwanie, zwiększenie stężenia kapryratu sodu (100 i 500 µM) doprowadziło do zwiększenia obszarów kontaktu skupionych oocytów wyrażających klaudynę-5, co wskazuje na ochronne działanie kapryratu sodu na szczelne uszczelnienie złącza. Ponadto, kaprynian sodu jest opisany w celu wywołania skurczu pierścienia okołojunkcyjnego actomyozyny, poszerzającego przestrzeń parakomórkową (Lindmark i wsp ., 1998; Maher et al., 2009). Efekt ten opiera się na fosforylacji regulacyjnego łańcucha lekkiego miozyny poprzez aktywację fosfolipazy C, która prowadzi do rozszczepiania 4,5-bisfosforanu fosfatydyloinozytolu (PIP2) do trójfosforanu inozytolu (IP3) i diacyloglicerolu (Tomita i in., 1995). Kompleks tight junction połączony przez białko rusztowania ZO-1 z cytoszkieletem aktyny jest następnie redystrybuowany z tight junction do cytoplazmy (Lindmark et al., 1998; Turner, 2000). Cytoarchitektura oocytów X. laevis ma kluczowe znaczenie dla regionalizacji cytoplazmatycznej podczas oogenezy (Wylie et al., 1985). Chociaż przed zapłodnieniem ekspresja genu tjp-1, gen kodujący ZO-1 ulega ekspresji tylko 1,9 TPM w stadiach V–VI oocytów (Session et al., 2016). Zmniejszona interakcja Klaudyn z rusztowaniem cytoszkieletowym może zatem wyjaśniać nieoczekiwany wynik inkubacji kapratu. Jest zakres przyszłych badań w celu weryfikacji mechanistycznej podstawy ustalenia.
jednak już wcześniej w literaturze opisano wariant wpływu kaprylanu sodu na przepuszczalność parakomórkową. W tkance plastra Peyera pobranej z jelita dorosłych świń wykryto podobny efekt wzmacniający. Po inkubacji z kaprysem 5 mM stwierdzono znaczne zwiększenie stężenia claudyny-5. W tym badaniu kaprate doprowadził do znacząco wyższego przezbłonkowego oporu elektrycznego (TEER) w nabłonku związanym z pęcherzykiem (Radloff i wsp., 2019).
wniosek
podsumowując, heterologiczna ekspresja białka szczelnego połączenia claudin-5 w X. oocyty laevis pozwalają na nowy wgląd w udział pojedynczych Klaudyn w interakcjach między komórkami i właściwościach zrostów sąsiednich komórek. Tak więc zastosowanie modelu X. laevis tight junction dla claudin-5 umożliwia analizę składników BBB w modelu jednokomórkowym.
Oświadczenie o dostępności danych
zbiory danych wygenerowane dla tego badania są dostępne na żądanie do odpowiedniego autora.
Etyka
zabiegi na zwierzętach były zgodne z wytycznymi niemieckiego ustawodawstwa, za zgodą urzędnika ds. dobrostanu zwierząt na Freie Universität Berlin i pod nadzorem Berlińskiego Inspektoratu Weterynarii (Landesamt für Gesundheit und Soziales Berlin, Zezwolenie G0025/16).
autorzy
wszyscy autorzy przeczytali i zaakceptowali manuskrypt. NB I SA zaprojektowały, zaplanowały i nadzorowały eksperymenty oraz napisały rękopis. NB, LS, VC, RK i PF-B przeprowadzili eksperymenty i analizę danych.
finansowanie
to badanie zostało sfinansowane przez Deutsche Forschungsgemeinschaft, Grant No. AM141 / 11-1 i H. Wilhelm Schaumann Stiftung.
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
Dziękujemy Martinowi Grunau, Giseli Manz, Katharinie Söllig i Susanne Trappe za doskonałą pomoc techniczną. Potwierdzamy wsparcie przez Open Access Publication Initiative Freie Universität Berlin.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć w Internecie pod adresem: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
fig.S1 | obszary kontaktu Klaudyny-5 wyrażające pary oocytów w µm2 podczas inkubacji z kaprylanem sodu w różnych stężeniach (odpowiednio N = 6-8) i oocytami wstrzykniętymi wodą jako kontrolnymi (odpowiednio n = 5-7).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., and Kroesen, A. J. (2009). Zapalenie błony śluzowej woreczka posiada zmienione szczeliny wskazujące na nawrót choroby zapalnej jelit. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Udział Klaudyny-5 W właściwościach barierowych w szczelnych połączeniach komórek nabłonkowych. Tkanka Komórkowa Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C., and Anderson, J. M. (2002). Rola domen zewnątrzkomórkowych Klaudyny w architekturze fibrilów szczelnych i selektywności ładunków parakomórkowych. Mol Biol Cell. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). Wzór ekspresji Klaudyn 5 i 7 odróżnia ciało stałe pseudopapilarne od pancreatoblastoma, acinar cell i endokrynologicznych nowotworów trzustki. Am. J. Surg.Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). Kaprys sodu przejściowo otwiera bariery zawierające klaudynę-5 w szczelnych połączeniach komórek nabłonka i śródbłonka. Mol. Pharm. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed Abstract / CrossRef Full Text / Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., and Amasheh, S. (2014). Laurynian przenika szlak parakomórkowy dla małych cząsteczek w komórce nabłonka jelita modelu HT-29 / B6 poprzez otwarcie szczelnych połączeń przez odwracalną relokację claudin-5. Pharm. Res. Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., and Wolburg, H. (2001). Udział splotu naczyniówkowego w zapaleniu ośrodkowego układu nerwowego. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::pomoc-jemt13>3.0.co;2-5
CrossRef Pełny tekst / Google Scholar
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Klaudyny w szczelnych połączeniach komórek brzeżnych prążka naczyniowego. Biochem. Biophys. Res.Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
CrossRef Pełny tekst / Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Ciasne połączenia oparte na Klaudynie są kluczowe dla bariery naskórkowej ssaków: lekcja od myszy z niedoborem Klaudyny-1. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Garcia-Hernandez, V., Quiros, M., and Nusrat, A. (2017). Nabłonek jelitowy: ekspresja i regulacja w homeostazie i zapaleniach. Ann. N. Y. Acad. Sci. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Greene, C., Hanley, N., and Campbell, M. (2019). Claudin-5: strażnik funkcji neurologicznych. Fluids Barr. CNS 16: 4321.
Google Scholar
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Klaudyna-16 wpływa na przezkomórkowe wydzielanie Cl w komórkach MDCK. J. Fizjol. Lond. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Claudin-5-spoiwa zwiększają przenikanie substancji rozpuszczonych przez barierę krew-mózg w modelu ssaków. J. Pharmacol. Exp. Ther. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Nowa ekspresja claudin-5 w podocytach kłębuszkowych. Cell Tissue Res. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). Mutacje w genie cldn19 (CLDN19) związane są z wyniszczaniem magnezu przez nerki, niewydolnością nerek i ciężkim zajęciem oka. Am. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., and Amasheh, S. (2013). Kaprynian sodu jako środek wzmacniający przenikanie makrocząsteczek przez trójkomórkowe szczelne połączenia komórek jelitowych. Biomateriały 34, 275-282. doi: 10.1016 / j.biomateriały.2012.09.051
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., and Bichet, D. G. (2007). Opracowanie nowej techniki oczyszczania błon plazmatycznych z oocytów Xenopus laevis. Am. J. Fizjol. Cell. 292, C1132–C1136.
Google Scholar
Lindmark, T., Kimura, Y., and Artursson, P. (1998). Wzmocnienie absorpcji poprzez wewnątrzkomórkową regulację szczelnej przepuszczalności połączeń przez średniołańcuchowe kwasy tłuszczowe w komórkach Caco-2. J. Pharmacol. Exp. Ther. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., and Brayden, D. J. (2009). Bezpieczeństwo i skuteczność kaprylanu sodu w promowaniu wchłaniania leku doustnego: Od in vitro do kliniki. ADV. Drug Delivery. Ks. 61, 1427-1449. doi: 10.1016 / j.addr.2009.09.006
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin-3 działa jako składnik uszczelniający szczelnego złącza dla jonów zarówno ładunku, jak i nierozładowanych substancji rozpuszczonych. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j.bbamem.2010.07.014
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Przewidywana ekspansja rodziny claudin multigene. FEBS Lett. 585, 606–612. doi: 10.1016 / j.febslet.2011.01.028
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: ułatwienie stosowania Xenopus do modelowania chorób ludzkich. Przód. Physiol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Rozmiar-selektywne rozluźnienie bariery krew-mózg u myszy z niedoborem Klaudyny-5. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T., and Terasaki, T. (2007). Egzogenna ekspresja Klaudyny-5 indukuje właściwości barierowe w hodowanych komórkach śródbłonka kapilarnego mózgu szczura. J. Cell Physiol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
Piontek J., Fritzsche S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Wyjaśnienie zasad molekularnej organizacji heteropolimerycznych ciasnych nici połączeniowych. Cell Mol. Life Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Powstawanie szczelnych połączeń: determinanty homofilnych oddziaływań między klasycznymi klaudynami. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Radloff, J., Cornelius, V., Markov, A. G., and Amasheh, S. (2019). Kaprys moduluje funkcję bariery jelitowej w nabłonku związanym z pęcherzykami Patyczkowymi świni Peyera. Int. J. Mol. Sci. 20:1418. doi: 10.3390 / ijms20061418
PubMed Abstract / CrossRef Full Text / Google Scholar
Reinhold, A. K., and Rittner, H. L. (2017). Funkcja bariery w obwodowym i centralnym układzie nerwowym-przegląd. Pflug. Arch. Eur. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Fałdowanie i montaż białek claudiny-3 i Claudiny-5 w szczelnym złączu są kontrolowane przez niezachowane pozostałości w segmentach transmembrany 3 (TM3) i pętli zewnątrzkomórkowej 2 (ECL2). J. Biol. Chem. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Streszczenie | CrossRef Pełny tekst / Google Scholar
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Ewolucja genomu u allotetraploidalnej żaby Xenopus laevis. Nature 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins w chorobach płuc. Resp. Res. 12: 70.
Google Scholar
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). Struktura krystaliczna Klaudyny zapewnia wgląd w architekturę ciasnych skrzyżowań. Nauka 344, 304-307. 10.1126 / nauka1248571
PubMed Abstrakt / CrossRef Pełny tekst / Google Scholar
Tammaro, P., Shimomura, K., and Proks, P. (2009). „Xenopus Oocytes as a heterologous expression system for studying ion channels with the patch-clamp technique,” in Potassium Channels: Methods and Protocols, ed. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M.,Assaf, C., et al. (2002). Tight junction proteins: a novel class of integral membrane proteins-expression in human epidermis and in hacat keratinocytes. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Tomita, M., Hayashi, M., and Awazu, S. (1995). Mechanizm zwiększający absorpcję kaprylanu sodu i dekanoilokarnityny w komórkach Caco-2. J. Pharmacol. Exp. Ther. 272, 739–743.
Google Scholar
Turner, J. R. (2000). „Putting the squeeze” on the tight junction: understanding cytoszkielet regulation. Semin. Cell Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Van Itallie, C. M., and Anderson, J. M. (2006). Klaudyn i nabłonkowy transport parakomórkowy. Annu. Rev.Physiol. 68, 403–429. doi: 10.1146 / annurev.physiol.68.040104.131404
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Kwantyfikacja sił pośredniczonych przez integralne białka szczelnego połączenia w adhezji komórka-komórka. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutacje w genie kodującym ciasno złącze claudin-14 powodują autosomalną recesywną głuchotę DFNB29. Cela 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
CrossRef Pełny tekst / Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). Lokalizacja claudin-3 w ciasnych skrzyżowaniach bariery krew-mózg jest selektywnie tracona podczas eksperymentalnego autoimmunologicznego zapalenia mózgu i rdzenia oraz ludzkiego glejaka wielopostaciowego. Acta Neuropathol. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J., and Heasman, J. (1985). Cytoszkielet oocytów Xenopus i jego rola w rozwoju. J. Embriol. Exp. Morph. 89, 1–15.
Google Scholar