- wprowadzenie
- funkcje Multipululacyjne Chymazy
- Chymazy w komórkach tucznych
- wiele funkcji enzymatycznych Chymazy
- enzymatyczna funkcja Chymazy u Nasha
- udział Chymazy w modelach zwierzęcych Nasha
- efekt inhibitora Chymazy w modelach zwierzęcych Nasha
- efekt inhibitora Chymazy w modelach zwierzęcych Nasha
- Mechanizm zapalenia wątroby atenuowany przez Inhibitor Chymazy
- Mechanizm stłuszczenia wątroby atenuowany przez Inhibitor Chymazy
- Mechanizm zwłóknienia wątroby atenuowany przez Inhibitor Chymazy
- wniosek
- author Contributions
- Oświadczenie o konflikcie interesów
wprowadzenie
Bezalkoholowa stłuszczenie wątroby (NAFLD) została uznana za najczęstszą formę choroby wątroby (Angulo, 2002; Clark et al., 2002). Bezalkoholowe stłuszczeniowe zapalenie wątroby (Nash) naśladuje alkoholowe zapalenie wątroby pomimo braku historii picia (Ludwig et al., 1980). NAFLD i NASH są związane z zespołem metabolicznym wynikającym z otyłości, insulinooporności, hiperlipidemii i nadciśnienia. NAFLD jest uważany za najczęstszą chorobę wątroby i zwykle przedstawia się jako proste stłuszczenie wątroby (Tiniakos et al., 2010). Natomiast NASH charakteryzuje się ciężkim stłuszczeniem, zapaleniem płatów i zwłóknieniem wątroby (Powell et al., 1990; Bertot and Adams, 2016). Chociaż mechanizm odpowiedzialny za rozwój Nasha pozostaje niejasny, uważa się, że Nash jest spowodowany procesem „wielokrotnego uderzenia”, z stłuszczeniem wątroby jako „pierwszym uderzeniem” i kolejnymi uderzeniami, takimi jak zapalenie, stres oksydacyjny i endotoksyny (Tilg and Moschen, 2010). NASH jest ściśle związany z zespołem metabolicznym, a kilka badań klinicznych zbadało leczenie terapeutyczne Nasha, koncentrując się na objawach cukrzycy, hiperlipidemii i nadciśnienia (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Nie ustalono jednak powszechnie akceptowanych środków leczniczych.
Chymaza może brać udział w patogenezie zwłóknienia wątroby. Aktywność chymazy była znacznie zwiększona w wątrobie pacjentów z zwłóknieniem lub marskością wątroby i istniała istotna korelacja między poziomem chymazy a stopniem zwłóknienia (Komeda i wsp ., 2008). Chociaż u pacjentów z Nashem nie zgłaszano zwiększonej aktywności chymazy, obserwowano ją w zwierzęcych modelach Nasha(Tashiro i wsp ., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). W przeciwieństwie do tego, hamowanie chymazy przy użyciu inhibitorów o niskiej cząsteczce spowodowało znaczne zmniejszenie stanu zapalnego, stłuszczenia i zwłóknienia w modelach Nasha szczura i chomika(Tashiro i wsp ., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Wyniki te wskazują, że chymaza może być zaangażowana w stan zapalny, stłuszczenie i zwłóknienie podczas rozwoju i progresji Nasha (ryc. 1).
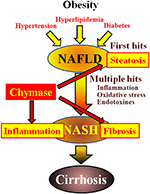
RYSUNEK 1. NAFLD i NASH są związane z zespołem metabolicznym przez otyłość, insulinooporność, hiperlipidemia i nadciśnienie. Uważa się, że Nash rozwija się w procesie „wielokrotnego uderzenia”, ze stłuszczeniem wątroby jako „pierwszym uderzeniem” i kolejnymi uderzeniami, takimi jak zapalenie, stres oksydacyjny i endotoksyny, i charakteryzuje się ciężkim stłuszczeniem, stanem zapalnym i zwłóknieniem. Chymaza może być zaangażowana w postęp stłuszczenia, zapalenia i zwłóknienia wątroby.
funkcje Multipululacyjne Chymazy
Chymazy w komórkach tucznych
Chymazy (EC 3.4.21.39) ulega ekspresji w granulkach wydzielniczych komórek tucznych. Chymaza jest wytwarzana jako nieaktywna prochymaza w granulkach wydzielniczych i wymaga do aktywacji dipeptydylopeptydazy I (DPPI). DPPI jest proteinazą tiolową, a jej optymalne pH wynosi 6,0. Optymalna wartość pH jest zgodna z proponowaną funkcją DPPI w celu aktywacji prochymazy, ponieważ pH w granulkach wydzielniczych jest regulowane przy pH 5,5 (De Young et al., 1987) (Rysunek 2). Jednak chymaza nie ma aktywności enzymatycznej w komórkach tucznych przy tym pH, ponieważ optymalne pH dla chymazy wynosi od 7 do 9 (Takai i wsp ., 1996, 1997). Po aktywacji granulek komórek tucznych przez bodźce takie jak stan zapalny i uraz, chymaza jest uwalniana i wykazuje funkcję enzymatyczną przy optymalnym pH 7,4 (ryc. 2).
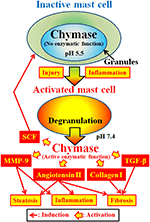
RYSUNEK 2. Chymaza jest przechowywana w wydzielniczych granulkach nieaktywnych komórek tucznych. PH w granulkach utrzymuje się na poziomie pH 5,5, w którym chymaza nie wykazuje aktywności enzymatycznej. Chymaza wykazuje swoje enzymatyczne funkcje, takie jak tworzenie angiotensyny II, MMP-9, TGF-β, kolagenu i i SCF, po uwolnieniu z granulek komórek tucznych, po aktywacji przez stan zapalny i uraz.
wiele funkcji enzymatycznych Chymazy
Chymaza jest proteazą serynową i rozszczepia C-końcową stronę białek po aminokwasach aromatycznych, takich jak Phe, Tyr i Trp w ogóle. Chymaza może rozszczepiać Wiązanie Phe8-His9 nieaktywnego peptydu angiotensyna I i tworzyć jego bioaktywny peptyd angiotensyna II w tkankach ssaków, w tym ludzi (Urata i in., 1990; Takai et al., 1996, 1997). Ponadto chymaza enzymatycznie rozszczepia prekursory metaloproteinazy matrycowej (MMP)-9, przekształcając czynnik wzrostu (TGF) – β i kolagen I do ich aktywnych form (Kofford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Ponadto enzymatyczna funkcja chymazy może wytwarzać czynnik komórek macierzystych (SCF) przez enzymatyczne rozszczepienie nieaktywnej związanej z błoną formy SCF, która indukuje tworzenie dojrzałych komórek tucznych z niedojrzałych komórek tucznych poprzez stymulację receptora c-kit (Longley i in., 1997). Zatem chymaza ma wiele funkcji enzymatycznych, w tym aktywację angiotensyny II, MMP-9,TGF-β, kolagenu i i SCF (Fig.
enzymatyczna funkcja Chymazy u Nasha
angiotensyna II może promować stłuszczenie wątroby i zapalenie poprzez zwiększenie reaktywnych form tlenu (ROS) po stymulacji receptorów angiotensyny II w zwierzęcych modelach Nasha (Hirose i wsp ., 2007; Nabeshima et al., 2009). Angiotensyna II wywołała również zwłóknienie wątroby poprzez indukcję aktyny α – mięśni gładkich (SMA)w komórkach gwiaździstych wątroby (HSCs) (Yoshiji i wsp ., 2001). Donoszono, że MMP-9 indukuje infiltrację neutrofili i makrofagów poprzez degradację matryc międzykomórkowych, takich jak witronektyna i fibronektyna, powodując nasilenie stanu zapalnego (Medina i in., 2006). U pacjentów z Nashem zaobserwowano znaczny wzrost ekspresji genu MMP-9 w wątrobie w porównaniu z prawidłowymi grupami kontrolnymi(Ljumovic i wsp ., 2004). Nadekspresja wątrobowa TGF-β u myszy transgenicznych powodowała ciężkie zwłóknienie wątroby poprzez zwiększenie ekspresji genu prokolagenu I (Casini i wsp ., 1993). Wiadomo, że zarówno tworzenie TGF-β, jak i akumulacja kolagenu I wywołują zwłóknienie wątroby. Aktywacja SCF indukuje wzrost liczby komórek tucznych, a jego funkcja enzymatyczna może prowadzić do zwiększenia aktywności chymazy w tkankach włóknistych (Maruichi et al., 2004). Te enzymatyczne funkcje chymazy mogą być zaangażowane w stłuszczenie, zapalenie i zwłóknienie, z których wszystkie są obserwowane w wątrobie pacjentów Nasha i modelach zwierzęcych (ryc. 2).
udział Chymazy w modelach zwierzęcych Nasha
dieta z niedoborem metioniny i choliny (MCD) była szeroko stosowana w celu wywołania typowego modelu Nasha. W chomikach karmionych dietą MCD obserwowano znaczne zwiększenie stężenia bilirubiny całkowitej, trójglicerydów i kwasu hialuronowego w osoczu (Tashiro i wsp ., 2010). Ponadto w wątrobie obserwowano nagromadzenie komórek zapalnych oraz zwiększenie powierzchni złogów lipidowych i zwłóknienia. W tym modelu Nasha indukowanym przez dietę MCD aktywność chymazy wątrobowej i powiązane czynniki, takie jak angiotensyna II, MMP-9 i kolagen I, były znacząco zwiększone (Tashiro i wsp., 2010; Masubuchi et al., 2013). Niedawno opracowano nowy model Nasha, w którym podatne na udar samoistnie nadciśnienie 5/Dmcr (SHRSP5 / Dmcr) szczury były karmione dietą o wysokiej zawartości tłuszczu i cholesterolu (HFC) (Kitamori et al., 2012). Model ten wykazał objawy zespołu metabolicznego, które są uważane za klinicznie podobne do objawów pacjentów Nasha (Kitamori et al., 2012). W modelu Nasha indukowanym dietą HFC obserwowano nadciśnienie i hiperlipidemię, a w wątrobie wykryto ciężkie stłuszczenie, zwłóknienie i nagromadzenie komórek zapalnych(Miyaoka i in., 2017). Ponadto zaobserwowano znaczne zwiększenie aktywności chymazy wraz z MMP-9, TGF-β i kolagenem i w wątrobie (Miyaoka et al., 2017). Tak więc wydaje się, że istnieje ścisły związek między chymazą a patogenezą Nasha w zwierzęcych modelach Nasha.
efekt inhibitora Chymazy w modelach zwierzęcych Nasha
efekt inhibitora Chymazy w modelach zwierzęcych Nasha
niskocząsteczkowy inhibitor chymazy znacząco atenuował aktywność chymazy i zmniejszał stężenie angiotensyny II, MMP-9 i kolagenu I w wątrobie w modelu MCD chomika Nasha karmionego dietą, gdy podawanie inhibitora rozpoczęto w tym samym czasie co dieta MCD (Tashiro i wsp., 2010; Masubuchi et al., 2013). Inhibitor chymazy znacząco zapobiegał stłuszczeniu wątroby, zwłóknieniu i akumulacji komórek zapalnych w tym modelu Nasha(Tashiro et al., 2010; Masubuchi et al., 2013). Uważa się, że stres oksydacyjny odgrywa rolę w teorii „wielokrotnego trafienia” rozwoju Nasha, a zwiększenie markera stresu oksydacyjnego malondialdehyd został znacznie osłabiony w wątrobie przez inhibitor chymazy (Masubuchi i wsp., 2013). W modelu Nash indukowanym dietą chomika MCD inhibitor chymazy wykazywał działanie łagodzące po podaniu w ustalonym NASH (Masubuchi et al., 2013). Stopień stłuszczenia i zwłóknienia wątroby był zmniejszony w porównaniu do przed podaniem inhibitora chymazy (Masubuchi i wsp ., 2013).
w wątrobie szczurzego modelu Nasha indukowanego dietą HFC, niskocząsteczkowy inhibitor chymazy atenuował poziomy chymazy, a także MMP-9, TGF-β i kolagenu I, które są czynnikami związanymi z chymazą (Miyaoka i in., 2017). Inhibitor chymazy znacząco osłabiał stłuszczenie wątroby i zwłóknienie oraz zmniejszał mieloperoksydazę jako marker stanu zapalnego, zwłaszcza nacieku neutrofilów (Miyaoka i in., 2017). W tym modelu indukowanym dietą HFC przeżywalność grupy otrzymującej placebo wynosiła 0% po 14 tygodniach od rozpoczęcia stosowania diety HFC i wynikała z ciężkiej niewydolności wątroby (Miyaoka et al., 2017). Jednakże Grupa leczona inhibitorem chymazy, w której szczury były leczone inhibitorem chymazy bezpośrednio po rozpoczęciu diety HFC, wykazała 100% przeżywalność po 14 tygodniach. Ponadto odnotowano 50% wskaźnik przeżycia u szczurów leczonych inhibitorem chymazy, począwszy od 8 tygodni po rozpoczęciu karmienia dietą HFC, w którym to momencie ustalono Nasha (Miyaoka et al., 2017).
dlatego inhibitory chymazy mogą być użytecznymi środkami do zapobiegania i poprawy NASH w modelach zwierzęcych. Z drugiej strony angiotensyna II pośrednio Promuje zapalenie wątroby, stłuszczenie i zwłóknienie poprzez zwiększenie ekspresji genów MMP – 9 i TGF-β. Zarówno MMP-9, jak i TGF-β są ściśle zaangażowane w patogenezę Nasha, ale czynniki te niekoniecznie są indukowane tylko przez angiotensynę II (Takai i wsp., 2010). Czynniki inne niż stymulacja angiotensyny II przyczyniają się do zwiększenia ekspresji genu MMP-9 i TGF-β (Takai i wsp., 2010). W takich przypadkach bloker receptora angiotensyny II (ARB) nie jest w stanie złagodzić działania MMP-9 i TGF-β; jednakże inhibitor chymazy może mieć działanie łagodzące poprzez hamowanie aktywacji MMP-9 i TGF-β, co wskazuje na potencjalny przebieg leczenia w celu zapobiegania progresji Nasha.
Mechanizm zapalenia wątroby atenuowany przez Inhibitor Chymazy
inhibitor Chymazy był w stanie zmniejszyć stan zapalny w modelach Nasha indukowanych dietą chomika MCD i szczura HFC (Tashiro i wsp., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Leczenie inhibitorem chymazy znacząco atenuowało aktywność chymazy w wątrobie, a także zmniejszało stężenie angiotensyny II i MMP-9 (Tashiro i wsp., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). W HSC angiotensyna II indukuje wytwarzanie ROS, takich jak nadtlenek wodoru i nadtlenek wodoru poprzez aktywację oksydazy fosforanu dinukleotydu nikotynamidoadeninowego (NADPH) (De Minicis i Brenner, 2007). Inhibitor chymazy powodował zmniejszenie ekspresji genu składnika oksydazy NADPH Rac-1 i markera stresu oksydacyjnego malondialdehydu oprócz zmniejszenia stężenia angiotensyny II w indukowanym przez chomika MCD modelu Nasha (Masubuchi i wsp., 2013). Indukowane przez angiotensynę II zwiększenie ekspresji genu MMP-9 promowanego przez ROS w neutrofilach i makrofagach (Yaghooti i wsp ., 2011; Kurihara et al., 2012). Z tego względu inhibitor chymazy bezpośrednio hamuje aktywację proMMP-9 do MMP-9 i pośrednio zmniejsza ekspresję genu MMP-9 poprzez zmniejszenie stężenia angiotensyny II. MMP-9 rozszczepia składniki macierzy pozakomórkowej, takie jak witronektyna i fibronektyna, prowadzi do rozpadu integralności wątroby i indukuje infiltrację makrofagów i neutrofili (Medina i in., 2006). W modelu Nasha indukowanym dietą HFC zaobserwowano znaczny wzrost ekspresji mieloperoksydazy w makrofagach i neutrofilach w wątrobie i został zmniejszony przez inhibitor chymazy (Miyaoka i in., 2017). Mechanizm zapalenia osłabionego przez inhibitor chymazy może być zatem zależny od zmniejszenia stężenia angiotensyny II i MMP-9 w wątrobie.
Mechanizm stłuszczenia wątroby atenuowany przez Inhibitor Chymazy
angiotensyna II może wpływać na stłuszczenie wątroby poprzez wytwarzanie ROS. W mysim HSC inhibitor oksydazy NADPH znacząco zmniejszał produkcję ROS, a ARB spowalniał rozwój stłuszczenia wątroby poprzez tłumienie produkcji ROS (Hirose et al., 2007; Guimarães et al., 2010). W mysim modelu MCD indukowanym dietą Nasha zaobserwowano znaczne tłumienie stłuszczenia u myszy z niedoborem receptora angiotensyny II(Nabeshima i wsp ., 2009). Zarówno w badaniach in vivo, jak i in vitro wykazano, że angiotensyna II zwiększyła ekspresję genu białka wiążącego sterol (SREBP)-1c i syntazy kwasów tłuszczowych (FAS), które są ważnymi czynnikami w regulacji lipogenezy, po nasileniu ROS (Kim i wsp., 2001; Hongo et al., 2009). W przeciwieństwie do tego, ARB atenuował stłuszczenie wątroby wraz z obniżeniem ekspresji genu SREBP – 1c i FAS poprzez tłumienie ROS w mysim modelu Nasha (Kato et al., 2012). W modelu Nasha indukowanym dietą chomika MCD zaobserwowano znaczne tłumienie ekspresji genów SREBP-1c i FAS po leczeniu niskocząsteczkowym inhibitorem chymazy (Masubuchi i wsp ., 2013). Z tego względu mechanizm łagodzący stłuszczenia wątroby przez inhibitor chymazy może zależeć od zmniejszenia wytwarzania ROS przez zmniejszone wytwarzanie angiotensyny II w wątrobie.
Mechanizm zwłóknienia wątroby atenuowany przez Inhibitor Chymazy
Chymaza może być ściśle związany z postępem zwłóknienia tkanek, ponieważ przyczynia się do tworzenia TGF-β z nieaktywnego prekursora TGF-β, a wiadomo, że TGF-β silnie indukuje wzrost fibroblastów (Takai i in., 2003; Oyamada et al., 2011). Wiadomo, że TGF-β odgrywa kluczową rolę w progresji zwłóknienia u pacjentów Nasha poprzez aktywowany HSC (Williams i wsp ., 2000). Hamowanie funkcji TGF-β poprzez ekspresję genów i sygnalizację spowodowało poprawę zwłóknienia wątroby w modelach eksperymentalnych (George et al., 1999; Arias et al., 2003). W modelu Nasha indukowanym dietą HFC u szczurów, tłumienie aktywności chymazy przez inhibitor chymazy spowodowało zmniejszenie poziomu TGF-β i obszaru włóknistego w wątrobie (Miyaoka et al., 2017). Tak więc zmniejszenie stężenia TGF-β przez inhibitor chymazy może przyczynić się do zapobiegania zwłóknieniu wątroby.
angiotensyna II może również brać udział w indukcji zwłóknienia wątroby. Angiotensyna II indukuje skurcz i proliferację HSC, a także indukuje ekspresję genu TGF-β w fibroblastach in vitro (Kagami i wsp ., 1994; Bataller et al., 2000). Zarówno poziom TGF-β, jak i stopień akumulacji kolagenu i zmian włóknistych obserwowano przez podwiązanie dróg żółciowych u myszy typu dzikiego, jednak były one atenuowane u myszy z niedoborem receptora angiotensyny II(Yang i wsp ., 2005). W modelu Nasha szczura, ARB również atenuowane zwłóknienie wątroby poprzez zmniejszenie ekspresji genu TGF-β (Hirose et al., 2007). Może również istnieć związek między angiotensyną II a zwłóknieniem wątroby inny niż ekspresja genu TGF-β indukowana przez angiotensynę II. U pacjentów z przewlekłym wirusowym zapaleniem wątroby typu C, ARB zmniejszał ekspresję genu kolagenu poprzez ekspresję genu Rac-1 (Colmenero et al., 2009). HSC są uznawane za główne komórki produkujące kolagen w wątrobie, a augmentacja w ekspresji α-aktyny mięśni gładkich (SMA) w HSC silnie indukuje odkładanie się macierzy pozakomórkowej, w tym kolagenu i (De Minicis i Brenner, 2007). Angiotensyna II może indukować ekspresję genu α – SMA u szczurów z HSC. Natomiast blokada angiotensyny II powoduje osłabienie zwłóknienia wątroby wraz ze zmniejszeniem α-SMA(Yoshiji i wsp ., 2001). Chociaż nie oceniano aktywności zarówno chymazy, jak i angiotensyny II u pacjentów z marskością wątroby, obserwowano istotne korelacje między aktywnością chymazy, angiotensyny II i zwłóknieniem wątroby (Komeda i wsp., 2008). W modelu marskości wątroby chomika indukowanym tetrachlorkiem, obserwowano istotne zwiększenie aktywności chymazy i angiotensyny II, które były znacząco atenuowane wraz z marskością wątroby po leczeniu niskocząsteczkowym inhibitorem chymazy (Komeda i wsp ., 2010).
stabilizator komórek tucznych tranilast może hamować aktywację komórek tucznych, blokując uwalnianie chymazy, a tym samym zapobiegając rozwojowi zwłóknienia wątroby w modelu Nasha wywołanym przez cukrzycę szczurów i HFC (Uno i wsp ., 2008). Chymaza promuje proliferację komórek tucznych poprzez aktywację SCF przez jej funkcję enzymatyczną(Longley et al., 1997). W modelach zwierzęcych Nasha inhibitor chymazy zmniejszał wzrost liczby komórek tucznych w wątrobie, co skutkowało zmniejszeniem aktywności chymazy po bezpośrednim hamowaniu przez inhibitor chymazy i pośrednim zmniejszeniu ekspresji chymazy w komórkach tucznych (Masubuchi i wsp ., 2013; Miyaoka et al., 2017).
dlatego inhibitor chymazy może przyczyniać się do zapobiegania zwłóknieniu wątroby poprzez hamowanie aktywacji TGF-β poprzez hamowanie chymazy i (lub) zmniejszanie poziomu TGF-β poprzez zmniejszenie angiotensyny II i proliferację komórek tucznych.
wniosek
zespół metaboliczny obejmujący otyłość, insulinooporność, hiperlipidemię i nadciśnienie tętnicze jest ściśle związany z rozwojem Nasha, a w leczeniu Nasha przeprowadzono badania leków przeciwcukrzycowych, przeciw hiperlipidemicznych i przeciwnadciśnieniowych. Koncepcja tych środków jest złagodzenie objawów zespołu metabolicznego (Georgescu et al., 2009; Park et al., 2010; Mahady et al., 2011). Wcześniejsze doniesienia wykazały, że inhibitor chymazy łagodzi stany zapalne i zwłóknienie bez wpływu na poziom glukozy i lipidów we krwi oraz ciśnienie krwi w zwierzęcych modelach cukrzycy, hiperlipidemii i nadciśnienia tętniczego (Inoue i in., 2009; Takai et al., 2014; Zhang et al., 2016). Dlatego też koncepcja hamowania chymazy polega na bezpośrednim łagodzeniu zapalenia wątroby i zwłóknienia Nasha. Proponujemy, że inhibitor chymazy ukierunkowany na zespół metaboliczny jest potencjalnie potężną strategią tłumienia progresji Nasha.
ST and DJ: written the manuscript. Obaj autorzy przeczytali i zatwierdzili ostateczny manuskrypt.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.