pomimo dramatycznego spadku zachorowalności i śmiertelności związanej z ludzkim wirusem niedoboru odporności typu 1 (HIV-1) po odkryciu inhibitorów proteazy i pojawieniu się w połowie lat 90.skojarzonego leczenia wysoce aktywnymi lekami przeciwretrowirusowymi (ARV), wielu pacjentów nadal nie zakończyło leczenia z powodu oporności i (lub) nietolerancji (1). Oczywiste było, że potrzeba większej liczby arv działających na różnych etapach cyklu życia wirusa, aktywnych przeciwko opornym wirusom i lepiej tolerowanych. Wykazanie kluczowej roli receptorów chemokin CCR5 i CXCR4 w zakażeniu HIV-1 wywołało zainteresowanie tym procesem jako nowym celem ARV (2, 3). CCR5 jest Ko-receptorem dla większości szczepów HIV-1, A wirusy te są określane jako zwrotnikowe CCR5 (R5). Szczepy wirusów wykorzystujące CXCR4 nazywane są CXCR4-tropowymi (X4), podczas gdy szczepy, które mogą wykorzystywać oba receptory, są podwójnie tropowe (4). Wirus pacjenta może często zawierać mieszaniny szczepów R5, X4 i o podwójnym tropie, zwanych łącznie CXCR4-using.
kluczowa rola CCR5 w wejściu na HIV-1, w połączeniu z wykazaniem, że osoby homozygotyczne z delecją 32 par zasad w genie CCR5 (CCR5Δ32), a następnie nie wykazujące ekspresji czynnościowej CCR5, były silnie chronione przed zakażeniem R5 HIV-1, skupiając uwagę na CCR5 jako atrakcyjnym celu (5). Chociaż niektóre badania wykazały subtelny wpływ mutacji CCR5Δ32 na funkcje odpornościowe, takie jak zmniejszone wyniki zapalne u osób zakażonych wirusem zapalenia wątroby typu C i powrót do zdrowia po zapaleniu wątroby typu B u heterozygotów; podczas gdy homozygoty są bardziej podatne na kleszczowe zapalenie mózgu i ciężką chorobę wirusa Zachodniego Nilu, osoby te mają niewielki widoczny niekorzystny wpływ na ich zdrowie (5, 6). To, wraz z faktem, że członkowie nadrodziny receptora sprzężonego z białkiem G są często podatni na rozwój silnych, selektywnych i doustnie biodostępnych leków (7), doprowadziło do rozpoczęcia programów discovery ligandu CCR5 przez wiele grup, w tym zespół z Pfizer Global Research and Development z siedzibą w Sandwich laboratories w Wielkiej Brytanii.
Marawirok (UK-427,857, MVC) został odkryty w wyniku wysokoprzepustowego badania przesiewowego biblioteki związków Pfizer przy użyciu testu wiązania radioligandu chemokiny. Najbardziej obiecujący związek z procesu przesiewowego został zoptymalizowany pod kątem działania przeciw receptorowi, aktywności przeciwwirusowej, właściwości farmakokinetycznych i selektywności wobec ludzkich celów komórkowych dzięki dużemu wysiłkowi Chemii Medycznej, w którym scharakteryzowano prawie 1000 cząsteczek (7). MVC wiąże się w kieszeni transmembrany CCR5 i jest czynnościowym antagonistą o powolnym przesunięciu, który zapobiega internalizacji (7, 8). Ma silne działanie przeciwwirusowe przeciwko szerokiemu zakresowi izolatów HIV-1 (7). Wraz z doskonałym przedklinicznym profilem bezpieczeństwa i dopuszczalną farmakokinetyką spowodowało to, że w grudniu 2000 r.został nominowany jako kandydat kliniczny [7].
zawsze było jasne, że rozwój kliniczny antagonistów CCR5 będzie trudny, ponieważ będą to pierwsze leki ARV ukierunkowane na gospodarza i dlatego wyruszyliśmy na niezbadane terytorium. Aby zapobiec kluczowym problemom, zespół ds. rozwoju klinicznego został utworzony wkrótce po rozpoczęciu programu discovery, a ja zostałem zatrudniony do kierowania zespołem wczesnego rozwoju, dołączając do firmy Pfizer w lutym 1999 roku. Zidentyfikowaliśmy kilka kluczowych wyzwań, którym należy sprostać podczas projektowania programu klinicznego, a także wykazaliśmy Bezpieczeństwo i skuteczność. Pierwszą z nich było to, że nie istniał dostępny na rynku, klinicznie potwierdzony test w celu identyfikacji pacjentów zakażonych R5 HIV-1. Było to krytyczne, ponieważ MVC działa tylko przeciwko szczepom R5 HIV-1 (7). Po drugie, pomimo pozornie zdrowego fenotypu osób z CCR5Δ32 (5, 6), pozostały obawy dotyczące bezpieczeństwa długotrwałego narażenia na antagonistów CCR5, ponieważ blokowanie CCR5 może różnić się od wrodzonego braku receptora CCR5, gdzie układ odpornościowy dojrzał w przypadku braku CCR5 i mogły rozwinąć się mechanizmy kompensacyjne. Wreszcie, u osób zakażonych HIV-1 częstość występowania szczepów HIV-1 stosujących CXCR4 wzrasta wraz z postępem choroby i zmniejszeniem liczby komórek CD4 (9), chociaż nie wykazano związku przyczynowego między wirusem stosującym CXCR4 a zmniejszeniem liczby komórek CD4. Doprowadziło to do obaw, że selektywna presja ze strony antagonisty CCR5 może skłonić populację wirusa do stosowania CXCR4 i spowodować spadek komórek CD4.
badania fazy i z zastosowaniem pojedynczej i wielokrotnej dawki u zdrowych ochotników, przeprowadzone w 2001 r.i w pierwszej połowie 2002 r., wykazały, że MVC jest bezpieczny i dobrze tolerowany w dawkach wielokrotnych do 300 mg dwa razy na dobę (BID), miał profil farmakokinetyczny zgodny z dawkowaniem doustnym raz na dobę (QD) lub dwa razy na dobę, można go łączyć z innymi arv i że dawki ≥100 mg dwa razy na dobę powodowały ekspozycję Powyżej średniej geometrycznej przeciwwirusowego IC90 in vitro (7, 10). W celu wykazania dowodów farmakologicznych, saturację receptora CCR5 mierzono za pomocą specjalnie przygotowanego testu internalizacji MIP-1β ex vivo. Wykazano, że nasycenie zależne od dawki, przy dawkach ≥25 mg QD, prowadzi do zbliżonych do maksymalnego nasycenia, co zwiększa interesującą możliwość, że MVC może być skuteczny w dawkach tak niskich, jak 25 mg QD. Wysycenie receptora utrzymywało się na wysokim poziomie przez kilka dni po przerwaniu podawania, co odzwierciedlało powolne przesunięcie względem receptora in vivo (11).
byliśmy podekscytowani i zachęceni danymi z fazy 1 i szybko przeszliśmy do programu proof of concept fazy 2A. Pacjenci zakażeni HIV-1 byli badani pod kątem obecności wirusa R5 wyłącznie przy użyciu nowego testu tropizmu fenotypowego (Trofile®, Monogram Biosciences, South San Francisco, CA, USA) i otrzymywali MVC w monoterapii przez 10 dni (12). W tym badaniu zmierzono nasycenie receptora CCR5 w celu oceny możliwości zastosowania go jako biomarkera skuteczności i monitorowania terapeutycznego. Oczekiwane dane spełniły nasze oczekiwania i wykazały, że dawki ≥100 mg dwa razy na dobę powodowały średnie maksymalne zmniejszenie RNA HIV-1 o >1.5log10 (Fig.1a), u wszystkich pacjentów, z wyjątkiem jednego pacjenta z wirusem X4, który został błędnie włączony, osiągnięcie redukcji RNA HIV-1 o co najmniej 1log10 (12). To dało nam pewność, że test prawidłowo zidentyfikował pacjentów, którzy mogą reagować na MVC. Nadir HIV – 1 RNA występował 1-5 dni po podaniu ostatniej dawki MVC, zgodnie z przedłużonym wysyceniem receptora, co wykazano w badaniach fazy 1 (12). Dla wszystkich dawek z wyjątkiem 25 mg QD obserwowano wysycenie receptora >80% przez cały okres podawania. Nie stwierdzono jednak korelacji pomiędzy zmniejszeniem miana wirusa a stopniem wysycenia receptora. Najbardziej prawdopodobnym wyjaśnieniem tego jest to, że dla skuteczności przeciwwirusowej wymagane jest bardzo wysokie nasycenie receptorów, a nieodłączna zmienność testu nie pozwala na zróżnicowanie w tym stopniu (11, 12).
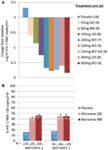
Rysunek 1. Marawirok dowód koncepcji i wyniki skuteczności fazy 3. A) średnia maksymalna zmiana RNA HIV-1 w stosunku do wartości wyjściowych u pacjentów otrzymujących monoterapię MVC. Na podstawie danych i fazy oraz modelowania i symulacji wybrano dawki w zakresie od 25 mg QD do 300 mg dwa razy na dobę (w tym 150 mg dwa razy na dobę po posiłku i na czczo). Oceniano RNA HIV-1, bezpieczeństwo i farmakokinetykę MVC (12). B) motywować 1 i 2 – odsetek pacjentów osiągających RNA HIV-1 <50 kopii/mL w 48. tygodniu. Pacjenci zakażeni HIV-1 z R5 HIV-1 i (lub) opornością potrójnej klasy zostali randomizowani do grupy otrzymującej MVC QD lub dwa razy na dobę lub placebo w skojarzeniu z optymalnym podstawowym schematem przeciwretrowirusowym (ang. optimized background antiretroviral scheme, OBT). P < 0.001 (13, 14).
dane fazy 2A wywołały emocje w całej firmie i zależało nam na jak najszybszym postępie w programie rozwoju klinicznego, ponieważ istniało wysokie zapotrzebowanie medyczne na nowe arv do leczenia pacjentów bez lub z ograniczonymi opcjami leczenia. Obszerny program fazy 1 (w tym wiele badań interakcji lek-lek) i szeroki zakres dawek oceniony w badaniach fazy 2A proof of concept, wraz z modelowaniem i symulacją, dały nam bardzo dobre zrozumienie prawdopodobnej skutecznej dawki MVC w połączeniu z innymi arv. Byliśmy zatem w stanie przejść od razu do badań skuteczności fazy 3 oceniających MVC w dawce 300 mg (lub równoważnej, w zależności od podawanych jednocześnie leków) QD i BID, bez konieczności przeprowadzania samodzielnych badań fazy 2B w zakresie dawek, co znacznie skraca czas rozwoju. Pod koniec 2004 roku zainicjowaliśmy cztery duże badania; MOTIVATE 1 i 2 U wcześniej leczonych pacjentów z R5 HIV-1 (13, 14), MERIT (badanie fazy 3 z włączeniem fazy 2B) u wcześniej nieleczonych pacjentów z R5 HIV-1 (15) oraz badanie a4001029, badanie bezpieczeństwa fazy 2B u wcześniej leczonych pacjentów z wirusem nienależącym do tropików CCR5 (CXCR4-using lub non-phenotypable virus) (16).
było to ogromne przedsięwzięcie, w którym 4794 pacjentów przebadano w ponad 200 ośrodkach w USA, Kanadzie, Europie, Australii, RPA, Meksyku i Argentynie. W tym czasie w badaniach fazy 2B oceniano również dwóch innych małocząsteczkowych antagonistów CCR5 (aplawirok i wikrywirok) (17, 18). Oprócz zwykłych wyzwań związanych z zarządzaniem dużymi badaniami klinicznymi, rzucono nam dwie krzywizny, z których pierwszą było przerwanie aplawiroku z powodu idiosynkratycznej hepatotoksyczności. Spekulowano, że może to być efekt klasy antagonistów CCR5, ponieważ myszy nokautujące CCR5 są bardziej podatne na hepatotoksyczność zależną od konkanawaliny (17). Dodatkowo u pacjenta w badaniu MERIT wystąpiła ciężka hepatotoksyczność. Dane sugerowały, że prawdopodobnie był on związany z izoniazydem lub kotrimoksazolem, ale nie można było wykluczyć roli MVC (15). Dogłębny przegląd wszystkich danych wskazujących na hepatotoksyczność w przypadku MVC i wysoki poziom czujności w przypadku jakichkolwiek sygnałów nie znalazł żadnych dowodów na systematyczny wzrost aktywności enzymów wątrobowych lub innych markerów hepatotoksyczności. Wkrótce potem pojawiły się obawy dotyczące potencjalnego zwiększonego ryzyka wystąpienia niektórych nowotworów złośliwych w następstwie wystąpienia chłoniaka u czterech pacjentów otrzymujących vicriviroc w badaniu ACTG5211 (18). Początkowo istniały obawy, że może to być efekt klasowy oparty na potencjale immunomodulacyjnym antagonistów CCR5, ale przegląd danych z innych badań vicriviroc, jak również trwających badań MVC, nie poparł tej teorii (18).
dane z MOTIVATE 1 i 2 oraz A4001029 były dostępne przed danymi meritum, ponieważ czas trwania badania jest zazwyczaj krótszy w przypadku badań z udziałem pacjentów wcześniej leczonych. Z wielkim podekscytowaniem oczekiwaliśmy na 24-tygodniowe analizy okresowe dla badań MOTIVATE w październiku 2006 r.i byliśmy podekscytowani widząc, że znacznie więcej pacjentów otrzymujących MVC miało RNA HIV-1 <50 kopii/mL (kluczowy wskaźnik skuteczności) w porównaniu do pacjentów otrzymujących placebo OBT. Potwierdzono to danymi z 48. tygodnia, wykazującymi trwałość odpowiedzi (rycina 1B) (13, 14). W przeciwieństwie do tego, pacjenci z wirusem HIV-1 nie wykazującym tropów CCR5, otrzymujący MVC w A4001029, nie wykazywali znaczących korzyści wirusologicznych w porównaniu z placebo (16). Analiza danych dotyczących bezpieczeństwa nie wzbudziła istotnych obaw. W szczególności, nie było dowodów na niekorzystny wpływ na układ odpornościowy, bez zwiększenia liczby epizodów zakażenia lub nowotworów złośliwych u pacjentów leczonych MVC. Ocena tropizmu wirusa po niepowodzeniu wykazała, że >50% pacjentów, u których leczenie MVC nie powiodło się, miało wirusa wykorzystującego CXCR4 po niepowodzeniu, ale nie było dowodów na szkodliwy wpływ na liczbę komórek CD4 (14). Ocena wirusologiczna wykazała, że wirus wykorzystujący CXCR4, który pojawił się pod presją selektywną MVC, pochodził z wcześniej istniejącej mniejszości i nie pojawił się de novo (19). Ogólnie rzecz biorąc, wyniki te wyraźnie wykazały korzyści ze stosowania MVC w leczeniu pacjentów z R5 HIV-1 uprzednio leczonych. Najwyższy wysiłek zespołu zaowocował złożeniem dokumentacji do rejestracji zarówno w USA, jak i w Europie zaledwie 2 miesiące po udostępnieniu tymczasowych danych. MVC (300 mg BID) otrzymał zatwierdzenie do stosowania (w połączeniu z innymi arv) w USA w sierpniu 2007 r., tylko 6.5 lat po tym został nominowany jako kandydat do rozwoju klinicznego. Miesiąc później został również zatwierdzony do stosowania w tej populacji w UE.
analiza badania MERIT w 48. tygodniu była rozczarowująca, ponieważ MVC w skojarzeniu z zydowudyną/lamiwudyną (HIV-1 RNA <50 kopii/mL, 65,3%) nie spełniało wcześniej ustalonych kryteriów równoważności (dolna granica jednostronnego 97,5 przedziału ufności poniżej -10%) z efawirenzem w skojarzeniu z zydowudyną/lamiwudyną (HIV-1 RNA <50 kopii/mL, 69,3%) (15). Jednak pacjenci biorący udział w tym badaniu byli badani pod kątem obecności wirusa R5 przy użyciu oryginalnego testu Trofile. Test ten został w międzyczasie ulepszony, aby był bardziej wrażliwy na wykrywanie mniejszościowych populacji wirusa wykorzystującego CXCR4. Wszystkie próbki przesiewowe dla pacjentów w MERIT były następnie ponownie testowane przy użyciu ulepszonego testu i analizy post hoc, obejmującej tylko pacjentów, którzy mieli wirusa R5, tylko przy użyciu bardziej czułego testu. W tej analizie odsetek odpowiedzi dla MVC i efawirenzu wynosił odpowiednio 68, 3% i 68, 5%, z niższą granicą 97, 5% przedziału ufności powyżej -10% (15). Na podstawie tych danych, MVC został również zatwierdzony do stosowania u pacjentów wcześniej nieleczonych w listopadzie 2009 r.przez United States Food and Drug Administration.
MVC okazał się nie tylko cennym dodatkiem do stale rosnącego arsenarium leków ARV, ale dane z tych badań poprawiły nasze zrozumienie tropizmu HIV i związku między tropizmem a progresją choroby. Dla mnie osobiście był to okres wielkiego podniecenia i satysfakcji, zarówno jako lekarza, jak i naukowca.
author Contributions
Wszystkie dane zostały opublikowane w całości w innym miejscu. Wszystkie badania zostały przeprowadzone zgodnie z zasadami deklaracji Helsińskiej i wszystkimi wytycznymi Międzynarodowej Konferencji na temat harmonizacji Dobrej Praktyki Klinicznej oraz lokalnymi wymogami regulacyjnymi i prawnymi. Wszystkie badania zostały zatwierdzone przez niezależne komitety etyczne, a wszyscy pacjenci wyrazili pisemną świadomą zgodę.
Oświadczenie o konflikcie interesów
Elna Van Der Ryst była pracownikiem Pfizer Global Research and development w czasie tworzenia MVC. Obecnie świadczy usługi doradcze dla firmy Pfizer.
podziękowania
chciałbym podziękować kolegom z Pfizer, którzy przyczynili się do MVC discovery and development program, a także badaczom i pacjentom, którzy uczestniczyli w badaniach klinicznych.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF, et al. Występowanie oporności na leki przeciwretrowirusowe w Stanach Zjednoczonych. AIDS (2004)18: 1393-401. doi: 10.1097/01.aids.0000131310.52526.c7
PubMed Abstract / PubMed Full Text / CrossRef Full Text / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. Wejście HIV-1 do komórek CD4+ odbywa się za pośrednictwem receptora chemokin CC-CKR-5. Nature (1996) 381: 667-73. doi: 10.1038 / 381667a0
PubMed Abstract / PubMed Full Text / CrossRef Full Text / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Kofaktor wejściowy HIV-1: funkcjonalne klonowanie cDNA siedmioczłonowego receptora sprzężonego z białkiem G. Nauka (1996) 272: 872-7. 10.1126 / nauka272.5263.872
CrossRef Pełny Tekst / Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Nowa klasyfikacja HIV-1. Nature (1998) 391:240. doi:10.1038/34571
CrossRef Pełny tekst / Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Oporność na zakażenie HIV – 1 u osób rasy kaukaskiej posiadających zmutowane allele genu receptora chemokin CCR5. Nature (1996) 382: 722-5. doi: 10.1038 / 382722a0
PubMed Abstract / PubMed Full Text / CrossRef Full Text / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Kliniczne zastosowanie inhibitorów CCR5 w HIV i poza nim. J Transl Med (2011) 9 (Suppl 1): S9. doi: 10.1186 / 1479-5876-9-S1-S9
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst / Google Scholar
7. Dorr P, Westby m, Dobbs s, Griffin P, Irvine B, Macartney m, et al. Marawirok (UK-427,857), silny, doustnie biodostępny i selektywny małocząsteczkowy inhibitor receptora chemokin CCR5 o szerokim spektrum działania przeciw ludzkiemu wirusowi niedoboru odporności typu 1. Środki Antymikrobowe Chemother (2005) 49: 4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Pełny Tekst / Google Scholar
8. Kondru R, Zhang J, Ji C,Mirzadegan T, Rotstein D, Sankuratri s, et al. Interakcje molekularne CCR5 z głównymi klasami małocząsteczkowych antagonistów anty-HIV-1 CCR5. Mol Pharmacol (2008) 73: 789-800. doi: 10.1124 / mol.107.042101
PubMed Abstract / PubMed Full Text / CrossRef Full Text / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Receptory chemokin jako Ko-receptory HIV-1: rola w wejściu wirusa, tropizmie i chorobie. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146 / annurev.immunol.17.1.657
PubMed Streszczenie / PubMed Pełny Tekst / CrossRef Pełny Tekst / Google Scholar
10. Abel s, van der Ryst E, Rosario MC, James i, Ridgway C, Medhurst C, et al. Ocena farmakokinetyki, bezpieczeństwa stosowania i tolerancji marawiroku, nowego antagonisty CCR5, u zdrowych ochotników. Br J Clin Pharmacol (2008) 65(S1): 5-18. doi: 10.1111 / j.1365-2125.2008.03130.x
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James i, Jenkins T, Abel s, et al. Analiza farmakokinetyczno-farmakodynamiczna wysycenia receptora CCR5 przez marawirok u zdrowych osób i pacjentów zakażonych HIV. Br J Clin Pharmacol (2008) 65(S1): 86-94. doi: 10.1111 / j.1365-2125.2008.03140.x
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst / Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg a, Staszewski s, Hoepelman AIM, et al. Skuteczność krótkotrwałej monoterapii marawirokiem, nowym antagonistą CCR5 u pacjentów zakażonych HIV-1. Nat Med (2005)11: 1170-2. doi: 10.1038 / nm1319
PubMed Abstract / PubMed Full Text / CrossRef Full Text / Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Marawirok u wcześniej leczonych pacjentów z zakażeniem R5 HIV-1. N Engl J Med (2008) 359: 1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef Full Text / Google Scholar
14. Fätkenheuer G, Nelson M, Lazzarin a, Konourina I, Hoepelman IM, Lampiris h, et al. Analizy podgrup marawiroku w uprzednio leczonym zakażeniu R5 HIV-1. N Engl J Med (2008) 359: 1442-55. doi: 10.1056 / NEJMoa0803154
PubMed Abstract / PubMed Full Text / CrossRef Full Text / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Marawirok w porównaniu z efawirenzem, zarówno w skojarzeniu z zydowudyną/lamiwudyną, w leczeniu pacjentów wcześniej nieleczonych przeciwretrowirusowo z CCR5-tropowym wirusem HIV-1. J Infect Dis (2010)201: 803-13. doi:10.1086/650697
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst / Google Scholar
16. Saag M, Goodrich J, Fätkenheuer G, Clotet B, Clumeck N, Sullivan J, et al. Podwójnie zaślepione, kontrolowane placebo badanie marawiroku u wcześniej leczonych pacjentów zakażonych wirusem HIV-1 innym niż CCR5-tropowy: Wyniki 24-tygodniowe. J Infect Dis (2009)11: 1638-47. doi:10.1086/598965
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst / Google Scholar
17. Nichols WG, Steel HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Hepatotoksyczność obserwowana w badaniach klinicznych aplawiroku (GW873140). Środki Antymikrobowe Chemother (2008) 52: 858-65. doi: 10.1128 / AAC.00821-07
PubMed Streszczenie / PubMed Pełny Tekst / CrossRef Pełny Tekst / Google Scholar
18. Tsibris AM, Paredes R, Chadburn a, Su z, Henrich TJ, Krabrink A, et al. Rozpoznanie chłoniaka i osoczowe obciążenie wirusem Epsteina-Barr podczas terapii vicriviroc: wyniki badań klinicznych AIDS Grupa A5211. Clin Infect Dis (2009) 48: 642-9. doi:10.1086/597007
PubMed Streszczenie / PubMed Pełny tekst / CrossRef Pełny tekst / Google Scholar
19. Lewis M, Simpson P, Fransen s, Huang w, Whitcomb J, Mosley m, et al. Wirus wykorzystujący CXCR4 wykryty u pacjentów otrzymujących marawirok w badaniach fazy III motywacja 1 i 2 pochodzi z wcześniej istniejącej mniejszości wirusa wykorzystującego CXCR4. Antivir Ther (2007) 12: S65.
Google Scholar