- wprowadzenie
- struktura i regulacja ChREBP za pomocą domen LID/Grace
- Aktywacja produktu ChREBP przez metabolity glukozy
- czynniki i Partnerzy ChREBP
- rola produktu ChREBP w metabolizmie węglowodanów i produkcji Hepatokin
- produkt ChREBP jako Regulator syntezy wątrobowych kwasów tłuszczowych i wydzielania VLDL
- regulacja metabolizmu fruktozy przez ChREBP w wątrobie i jelicie
- Regulamin BDK:Oś PPM1K w wątrobie
- ChREBP jest wymagany do regulacji FGF21 za pośrednictwem glukozy
- rola produktu ChREBP w sieci międzyrządowej, która kontroluje homeostazę energetyczną
- rola produktu Chrebp w kontroli równowagi wrażliwości na insulinę
- adipose ChREBP łączy lipogenezę z wrażliwością na insulinę
- Nowa interakcja między lipazą wrażliwą na hormony i produktem ChREBP w tkance tłuszczowej
- wnioski i przyszłe kierunki
- wkład autora
- finansowanie
- Oświadczenie o konflikcie interesów
wprowadzenie
zwiększone spożycie cukrów prostych, takich jak sacharoza i syrop kukurydziany o wysokiej zawartości fruktozy w ostatnich latach doprowadziło do zwiększonego ryzyka chorób metabolicznych, takich jak otyłość, dyslipidemia, cukrzyca typu 2 i/lub bezalkoholowa stłuszczenie wątroby (NAFLD). Wątroba jest głównym organem odpowiedzialnym za konwersję nadmiaru węglowodanów w tłuszcz. Uzyskane trójglicerydy (TG) mogą być pakowane do lipoprotein o bardzo niskiej gęstości (VLDL) i wydzielane do krążenia, przechowywane jako krople lipidów lub metabolizowane przez szlak beta-utleniania. Insulina wydzielana w odpowiedzi na podwyższone stężenie glukozy we krwi, stymuluje ekspresję genów de novo syntezy kwasów tłuszczowych (lipogenezę)poprzez czynnik transkrypcyjny sterolu regulator białka wiążącego-1C (SREBP-1C) (Foretz i wsp., 1999). SREBP-1c działa w synergii z innym czynnikiem transkrypcyjnym zwanym białkiem wiążącym element odpowiedzi węglowodanowej (chrebp), który pośredniczy w odpowiedzi na węglowodany w diecie. Struktura białka ChREBP zawiera niską domenę hamującą glukozę (LID) i element zachowujący aktywację odpowiedzi glukozowej (GRACE) znajdujący się w jej N-końcu (Li i wsp., 2006). Aktywacja domeny GRACE przez metabolity glukozy pobudza aktywność Transkrypcyjną ChREBP i wiąże się z silnie zachowaną sekwencją zwaną węglowodanowym elementem odpowiedzi (ChoRE). ChoRE jest obecny w promotorach genów docelowych ChREBP, które kodują kluczowe enzymy lipogenezy de novo, w tym kinazę l-pirogronianową (l-pk), enzym ograniczający szybkość glikolizy, syntazę kwasów tłuszczowych (Fas), karboksylazę acetylo-CoA (Acc) i desaturazę stearoilo-CoA (Scd1) (Kawaguchi i in., 2001). Niedawne badanie wykazało współzależność między ChREBP (aktywowany przez glukozę) i SREBP-1c (aktywowany przez insulinę) dla pełnej indukcji glikolitycznej i lipogennej ekspresji genów w wątrobie (Linden i wsp., 2018). Wirusowe przywrócenie aktywnej formy jądrowej SREBP – 1C w wątrobie myszy z niedoborem ChREBP (ChREBPKO) znormalizowało ekspresję genów lipogennych, nie wpływając jednocześnie na ratowanie ekspresji genów glikolitycznych. Eksperyment lustrzany, w którym ekspresja ChREBP została indukowana w wątrobie myszy NOKAUTUJĄCYCH SREBP – 1C, uratował ekspresję genu glikolitycznego, ale zaskakująco nie ekspresję genu lipogennego, pomimo dobrze znanej roli ChREBP w kontroli genów syntezy kwasów tłuszczowych. Niemniej jednak, badanie to sugeruje znaczenie podwójnego działania ChREBP i SREBP-1C w genach kontrolnych zaangażowanych w regulację syntezy kwasów tłuszczowych(Linden et al., 2018).
ChREBP jest wysoce wzbogacony w wątrobie i był badany jako główny regulator metabolizmu lipidów (Iizuka i wsp., 2004; Osorio et al., 2016). ChREBP ulega również znaczącej ekspresji w wysepkach trzustkowych, jelicie cienkim, mięśniach szkieletowych oraz w mniejszym stopniu w nerkach i mózgu(patrz Richards et al., 2017 do przeglądu). Co ciekawe, Inna izoforma ChREBP, ChREBPß, pochodząca z alternatywnego promotora pierwszego eksonu, została po raz pierwszy zidentyfikowana w tkance tłuszczowej (Herman et al., 2012), a później opisane w innych typach komórek (patrz Abdul-Wahed et al., 2017 do przeglądu). Jak omówimy, ChREBPß jest opisany jako konstytutywnie aktywna izoforma. Oczekuje się, że przyszłe prace zajmą się odpowiednimi rolami ChREBP i ChREBPß w regulacji metabolizmu glukozy i lipidów, a także określą ich specyficzne i/lub nakładające się na siebie cele.
struktura i regulacja ChREBP za pomocą domen LID/Grace
ChREBP należy do rodziny czynników transkrypcyjnych bHLH/Zip Mondo. Domena N-terminus (pozostałości 1-251) zawiera dwa nuklearny sygnał eksportu (NES) i nuklearny sygnał lokalizacji (NLS) regulujący subkomórkową lokalizację poprzez interakcję z utrzymaniem regionu chromosomu 1 (CRM1), określanym również jako białka exportin 1 i/lub 14-3-3 (Sakiyama i wsp., 2008). Region C-terminus zawiera domenę poliprolinową, domenę bHLH / LZ (pozostałości 660-737) i domenę podobną do leucyny (pozostałości Zip-like, 807-847), które są związane ze współczynnikami i wiązaniem DNA (Yamashita i in., 2001; Fukasawa et al., 2010; Ge et al., 2012). Lokalizacja i aktywacja transkrypcyjna ChREBP zależy od dostępności składników odżywczych. Regulacja ChREBP za pośrednictwem glukozy występuje głównie na poziomie modułu wykrywania glukozy (GSM) lub regionu konserwowanego mondo (MCR), który składa się z domen LID i GRACE, jak wspomniano we wstępie (ryc.; Li i in., 2006; Singh and Irwin, 2016). W 2012 roku Herman et al. (2012) opisał inną izoformę Chrebpa, ChREBPß, która jest transkrybowana z alternatywnego promotora pierwszego eksonu 1b do eksonu 2 (Fig. Transkrypt ten jest tłumaczony z eksonu 4, generując krótsze białko 687 aminokwasów (pełna długość izoformy ChREBP, przemianowanej na α, Zawiera 864 aminokwasy, zwane w rękopisie ChREBP), w których brakuje dwóch domen NES, NLS i LID. ChREBPß jest wysoce aktywny w białej tkance tłuszczowej w sposób zależny od GLUT-4 i sugeruje się, że jest bezpośrednio regulowany przez ChREBPa, ponieważ Sekwencja ChoRE została zidentyfikowana w promotorze eksonu 1β (Herman i wsp ., 2012; rys. 1B). Regulacja ChREBPß przez Chrebpę sugeruje istnienie pętli feed-forward, która potencjalnie zaostrza odpowiedź na glukozę w Warunkach hiperglikemii. Należy jednak wyjaśnić mechanizm (- y) regulacyjny (- e) izoformy ChREBPß, a co ważniejsze jego specyficzną funkcję.
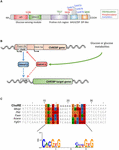
Rysunek 1. A) struktura elementu reakcji węglowodanowej wiążącego białko α (ChREBPa). ChREBPa składa się z 864 aminokwasów i zawiera kilka domen regulacyjnych. Na końcu n białko zawiera moduł wykrywania glukozy składający się z domeny o niskim poziomie hamowania glukozy (LID) i elementu konserwowanego aktywowanego glukozą (GRACE). Białko zawiera również bogatą poliprolinę, bHLH / LZ i domenę podobną do leucyny (Zip-like) znajdującą się na końcu C. Modyfikacje potranslacyjne są wskazane w ich odpowiednich resztach, fosforylacji (czerwonej), acetylacji (niebieskiej) i ostatnio zidentyfikowanych O-Glcnacylacjach (zielonej). B) struktura genu genu ChREBP i wytwarzanie dwóch izoform chrebp α i β. ChREBPß jest transkrybowany z alternatywnego promotora pierwszego eksonu 1b. transkrypt ten jest tłumaczony z eksonu 4, generując krótsze białko 687 aminokwasów, w których brakuje dwóch NES, NLS i domeny LID. Sugerowano, że izoforma ChREBPß może być bezpośrednio regulowana przez ChREBPa, ponieważ Sekwencja ChoRE została zidentyfikowana w promotorze eksonu 1B. obecnie nie wiadomo, czy oba izoformy Chrebpß α i β wiążą się z ChoRE. Rysunek zaadaptowany z Herman et al. (2012). C) Multi-wyrównanie sekwencji konsensusu ChoRE występuje w kilku promotorach genów docelowych ChREBP. Wyrównanie oparte na nukleotydach jest przedstawione na górze rysunku wraz z sekwencją konsensusową opisaną w Poungvarin et al. (2015). Logo odpowiadające sekwencji konsensusu związanej z tym konkretnym wyrównaniem jest również reprezentowane.
Aktywacja produktu ChREBP przez metabolity glukozy
w warunkach na czczo, zależna od glukagonu aktywacja kinazy białkowej a (PKA) (Kawaguchi i wsp ., 2002) fosforyluje ChREBP na resztach Ser196 i Thr666, prowadząc do wiązania ChREBP z białkiem 14-3-3 i jego retencji w cytozolu (Kawaguchi i wsp ., 2001, 2002; Davies et al., 2008). Amp aktywowana kinaza białkowa (AMPK), Centralny czujnik energii komórkowej, również fosforyluje ChREBP na pozostałości Ser568, co z kolei zmniejsza wiązanie ChREBP z promotorami jego docelowych genów (Kawaguchi i wsp ., 2002; Sato et al., 2016). Wykazano, że metabolity wytwarzane podczas postu, takie jak AMP i ciała ketonowe wytwarzane z utleniania kwasów tłuszczowych, odgrywają allosteryczną rolę hamującą, zmieniając powinowactwo do białka ChREBP i 14-3-3, zwiększając złożoną stabilizację i sprzyjając retencji cytozolicznej (Sakiyama et al., 2008; Nakagawa et al., 2013; Sato et al., 2016). W odpowiedzi na węglowodany ChREBP jest regulowany na poziomie transkrypcyjnym, translacyjnym i potranslacyjnym. Zwiększone stężenie glukozy po posiłku sprzyja syntezie pośrednich metabolitów, takich jak ksylulozo-5-fosforan (X5P), początkowo proponowany jako aktywator fosfatazy białkowej 2A (PP2A) (Kawaguchi i wsp., 2001; Kabashima et al., 2003). PP2A został wcześniej opisany jako defosforylowany ChREBP w pozostałości Ser196, umożliwiając jego translokację do jądra, gdzie jest dalej defosforylowany w sposób zależny od X5P i PP2A (na Thr666 i Ser568). Jednak model ten był kwestionowany przez lata, a inne metabolity, takie jak glukozo-6-fosforan (G6P), zostały zaproponowane jako potencjalne aktywatory translokacji/aktywności ChREBP (Dentin et al., 2012). McFerrin et al. (2012) zidentyfikował przypuszczalny motyw wiązania G6P (253-SDTLFT-258) na domenie GRACE, który jest również zachowany w mondoa, Ortologu ChREBP/MondoB (patrz Richards et al., 2017 do przeglądu). Zgodnie z tą hipotezą, G6P może promować allosteryczną zmianę konformacji, która indukuje otwartą konformację dla ChREBP, ułatwiając interakcję ze współczynnikami i późniejszą translokację do jądra (McFerrin et al., 2012).
w jądrze ChREBP można modyfikować poprzez o-Glcnacylację, modyfikację potranslacyjną zależną od metabolizmu glukozy i zidentyfikowaną jako ważną dla aktywności transkrypcyjnej ChREBP (Guinez et al., 2010). O-Glcnacylacja zachodzi na resztach seryny i treoniny poprzez aktywność transferazy o-GlcNAc (OGT), enzymu, który dodaje reszt N-acetyloglukozaminy (GlcNAc) do białek docelowych, modyfikując w ten sposób ich aktywność, stabilność i/lub lokalizację subkomórkową. Yang et al. (2017) niedawno ujawniono kilka reszt ChREBP zmodyfikowanych przez O-Glcnacylację. Mutacje tych reszt w domenach bHLH / ZIP oraz dimeryzacja i domena lokalizacji cytoplazmatycznej (DCD) pozwoliły na identyfikację Thr517 i Ser839 jako istotnych miejsc dla zależnej od glukozy aktywacji ChREBP (Fig.1a). ChREBP można również modyfikować przez acetylację poprzez aktywność acetylotransferazy histonowej p300 (Bricambert i in., 2010). Aktywowany glukozą p300 acetyluje ChREBP na Lys672 i zwiększa jego aktywność transkrypcyjną poprzez zwiększenie jego rekrutacji do sekwencji ChoRE, której optymalną sekwencją wiążącą konsensus jest CAYGYCnnnnnCRCRTG (Fig. Poungvarin et al. (2015) przeanalizowano miejsca wiązania ChREBP przez ChIP-seq w wątrobie i białej tkance tłuszczowej myszy ponownie karmionych dietą o wysokiej zawartości węglowodanów i tłuszczu. Zgłaszali oni, że Wiązanie produktu ChREBP jest wzbogacone w szlaki zaangażowane w sygnalizację insuliny, przylegające połączenia i raka, co sugeruje Nowy udział produktu ChREBP w nowotworach i progresji raka. Ponadto, ostatnie badanie donosiło o znaczeniu ChREBP w raku wątrobowokomórkowym (HCC) (Ribback et al., 2017). Autorzy odkryli, że genetyczna delecja ChREBP (u myszy ChREBPKO) zaburzyła hepatokarcynogenezę spowodowaną nadekspresją kinazy białkowej B/Akt u myszy. Ponadto, hamowanie ChREBP za pośrednictwem siRNA w mysich i (lub) ludzkich komórkach HCC powodowało zmniejszenie proliferacji i apoptozę.
czynniki i Partnerzy ChREBP
w ciągu ostatnich lat zidentyfikowano kilka czynników i/lub partnerów ChREBP (patrz Richards et al., 2017 do przeglądu). Max like protein x (Mlx), czynnik transkrypcyjny bHLH / LZ, był pierwszym zidentyfikowanym jako wspólny partner wiążący rodziny Mondo (Stoeckman et al., 2004). Dimeryzacja ChREBP z Mlx jest wymagana zarówno dla translokacji jądrowej w odpowiedzi na glukozę, jak i wiązania z pierwiastkami ChoRE. Jako partnerów ChREBP opisano także receptory jądrowe, takie jak czynnik jądrowy hepatocytów 4α (HNF4a) i receptor farnezoidalny X (FXR). HNF4a fizycznie oddziałuje z ChREBP poprzez wiązanie się z bezpośrednim regionem repeat-1 (DR-1) na promotorze genów docelowych ChREBP (Adamson i wsp., 2006; Meng et al., 2016). Ponadto wykazano, że transkrypcyjne białka koaktywujące P300 / CBP stabilizują kompleks ChREBP/HNF4a (Burke i wsp ., 2009). Białka koaktywujące transkrypcję P300 / CBP odgrywają centralną rolę w koordynowaniu i integrowaniu wielu zdarzeń zależnych od sygnału z aparatem transkrypcyjnym. Inną kluczową właściwością p300/CBP jest obecność aktywności acetylotransferazy histonowej (HAT), która nadaje p300 / CBP zdolność do wpływania na aktywność chromatyny poprzez modulowanie histonów nukleosomalnych. W ludzkich hepatocytach Wiązanie FXR z kompleksem ChREBP-HNF4a wyzwala uwalnianie ChREBP z CBP / p300, prowadząc do rekrutacji deacetylazy HISTONOWEJ SMRT na promotorze Lpk, działając w ten sposób jako współresor aktywności transkrypcyjnej ChREBP (Caron i wsp., 2013). Ponadto aktywność CBP / p300 Hat modyfikuje ChREBP na Lys 672, prowadząc do jego aktywacji transkrypcyjnej w odpowiedzi na glukozę (Bricambert i in., 2010).
Bricambert i in. (2018) niedawno zidentyfikował homeodomenę roślinną demetylazy histonowej finger 2 (Phf2), która należy do rodziny demetylazy lizyny histonowej (kdm7), jako nowy czynnik ChREBP. Interakcja pomiędzy Phf2 i ChREBP zwiększa aktywację transkrypcyjną ChREBP poprzez wymazywanie znamion metylowych H3K9 na promotorze genów docelowych. Co ciekawe, specyficzna współwerbacja Phf2 i ChREBP do promotora czynnika jądrowego erythroid 2 like 2 (Nrf2) przyczynia się do ochronnego działania Phf2 przeciwko zwiększonym reaktywnym formom tlenu (ROS) i progresji NAFLD w kontekście hiperglikemii (Bricambert et al., 2018).
rola produktu ChREBP w metabolizmie węglowodanów i produkcji Hepatokin
produkt ChREBP jako Regulator syntezy wątrobowych kwasów tłuszczowych i wydzielania VLDL
bezalkoholowa stłuszczenie wątroby jest cechą charakterystyczną zespołu metabolicznego, a badania na ludziach ujawniają, że de novo lipogeneza przyczynia się do około 25% całkowitych lipidów wątrobowych u pacjentów z NAFLD (Donnelly i wsp., 2005). W Stanach insulinoopornych hiperglikemia i hiperinsulinemia zwiększają lipogenezę częściowo poprzez aktywację ChREBP i SREBP-1C. Hamowanie ChREBP w wątrobie otyłych i insulinoopornych myszy ob / ob, poprzez RNAi lub ablację genetyczną prowadzi do odwrócenia stłuszczenia wątroby (Dentin et al., 2006; Iizuka et al., 2006). Zmienione wydzielanie VLDL przez wątrobę również przyczynia się do patogenezy NAFLD. Mikrosomalne białko przenoszące trójglicerydy (MTTP)jest białkiem odpowiedzialnym za montaż i wydzielanie lipoprotein zawierających apolipoproteiny B. Niedobór MTTP u myszy i ludzi powoduje hipolipidemię i stłuszczenie wątroby. Regulacja tego białka była związana z kilkoma wysoce zachowywanymi elementami cis w jego promotorze, w tym krytycznymi dodatnimi i ujemnymi domenami regulacyjnymi (Cuchel et al., 2013; Hussain et al., 2011). Ostatnio ChREBP został wskazany jako potencjalny regulator MTTP, ponieważ brak funkcjonalnego ChREBP w wątrobie hamuje ekspresję Mttp oraz montaż i wydzielanie VLDL (Niwa et al., 2018). Ponieważ jednak na promotorze Mttp nie można jednoznacznie określić żadnego zadania, konieczna będzie dalsza analiza w celu określenia mechanizmu, za pomocą którego ChREBP reguluje Mttp.
regulacja metabolizmu fruktozy przez ChREBP w wątrobie i jelicie
związek między metabolizmem fruktozy i ChREBP został po raz pierwszy udowodniony przez Analizę fenotypową myszy chrebp knockout (myszy ChREBPKO). Doniesiono, że myszy ChREBPKO umierają w ciągu kilku dni od karmienia dietą o wysokiej zawartości fruktozy (HFrD) (Iizuka et al., 2004). Ta główna nietolerancja fruktozy została przypisana zmniejszeniu ekspresji fruktokinazy i kinazy triozowej, dwóch enzymów niezbędnych do metabolizmu fruktozy(Iizuka i in., 2004). Kim i in. (2016) później poinformował znaczenie ChREBP dla skutecznej konwersji fruktozy do glukozy w wątrobie i klirensie fruktozy całego ciała, ale także, przy spożyciu fruktozy, ChREBP może przyczynić się do hiperglikemii poprzez bezpośrednio aktywującą Trans ekspresję g6pc, kluczowego genu glukoneogenezy. Efekt ten może prowadzić do błędnego koła, w którym spożycie fruktozy zaostrza produkcję glukozy, chociaż aktywność ChREBP(Kim et al., 2016). W następnym roku badanie przeprowadzone przez Zhang et al. (2017) poinformował, że myszy ChREBPKO karmione HFrD rozwijają ciężkie uszkodzenie wątroby z powodu nadmiernej aktywacji stresu retikulum endoplazmatycznego i apoptozy hepatocytów za pośrednictwem białka wiążącego ccaat-enhancer-binding protein homologous protein (CHOP). Apoptoza w hepatocytach u tych myszy była najprawdopodobniej związana ze zwiększoną biosyntezą cholesterolu, ponieważ hamowanie tego szlaku poprzez reduktazę HMG-CoA (HMGCR) lub hamowanie SREBP2 uratowało myszy ChREBPKO przed uszkodzeniem wątroby wywołanym przez HFrD. Brak ChREBP był również ostatnio związany z rozregulowaniem metabolizmu sacharozy i fruktozy, co prowadziło do nietolerancji cukru i złego wchłaniania u myszy (Kato et al., 2018). Działania te były związane ze zmniejszoną ekspresją izomaltazy jelitowej sacharozy (SI), która trawi sacharozę w glukozie i fruktozie, transporterów glukozy 5 (Glut5) i 2 (Glut2) oraz enzymu ketohexokinase (Khk), który reguluje fruktolizę (Fig. Dysregulacja tych enzymów może prowadzić do gromadzenia niestrawionej sacharozy i fruktozy z potencjalnymi następstwami w składzie mikroflory jelitowej. Porównanie myszy ChREBPKO i myszy chrebpliverko karmionych HFrD wykazało wcześniej, że sam niedobór chrebpa w wątrobie nie prowadzi do nietolerancji fruktozy, ale że niedobór Chrebpa w jelicie cienkim jest najprawdopodobniej odpowiedzialny za upośledzenie tolerancji fruktozy obserwowane u tych myszy(Kim i wsp ., 2017). W sumie badania te podkreślają znaczenie ChREBP w regulacji metabolizmu fruktozy i podkreślają potrzebę lepszego zrozumienia jego roli i regulacji w jelicie cienkim.
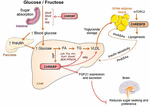
Rysunek 2. ChREBP reguluje wielokrotne szlaki sygnałowe/metaboliczne w odpowiedzi na glukozę i fruktozę. ChREBP ulega ekspresji w kilku tkankach, w tym w jelicie, wątrobie i białej tkance tłuszczowej. W tych typach komórek, w odpowiedzi na glukozę i/lub fruktozę, ChREBP jest aktywowany i indukuje specyficzny program genitalny, jak pokazano na rysunku. W jelicie opisano stymulację ekspresji SI, Glut5, Glut2 i Ketohexokinase (Khk) przez ChREBP (bezpośrednio lub pośrednio) w celu poprawy tolerancji sacharozy i wchłaniania fruktozy. W wątrobie ChREBP jest kluczowym modulatorem ekspresji genu glikolitycznego, lipogennego i mikrosomalnego białka przenoszącego trójglicerydy (Mttp), kontrolując w ten sposób akumulację kwasów tłuszczowych i eksport VLDL z wątroby. ChREBP reguluje również produkcję hepatokin, takich jak czynnik wzrostu fibroblastów 21 (FGF21). Ta oś wątroba-mózg rozszerza funkcję ChREBP wątroby z regulatora wątroby do układowego modulatora wpływającego nie tylko na obsługę substratu w wątrobie, ale także na preferencje żywieniowe. Aktywacja ChREBP w białej tkance tłuszczowej jest związana z poprawą homeostazy metabolicznej poprzez wytwarzanie ochronnych sygnałów krążących. Stwierdzono, że nowa klasa lipidów ssaków charakteryzująca się rozgałęzionym Związkiem estrowym między kwasem tłuszczowym a kwasem hydroksylowo-tłuszczowym (kwas palmitynowy, kwas stearynowy) wywiera korzystny wpływ na homeostazę glukozy poprzez bezpośrednią i inkretynową modulację funkcji komórek β, zwiększony wychwyt glukozy w tłuszczach i zmniejszenie stanu zapalnego. Co ciekawe, mTORC2 został niedawno zidentyfikowany jako nowy regulator izoformy ChREBPß w komórkach tłuszczowych.
Regulamin BDK:Oś PPM1K w wątrobie
pierwszy zaangażowany etap katabolizmu aminokwasów rozgałęzionych (BCAA) jest regulowany przez kompleks dehydrogenazy ketonowej o rozgałęzionych łańcuchach (bckdh), który jest kontrolowany przez dwa enzymy, kinazę dehydrogenazy kwasu alfa-ketonowego o rozgałęzionych łańcuchach (BDK) i fosfatazę białkową, Mg2+/Mn22+ zależną 1k (PPM1K). White et al. (2018) ostatnio związany z ChREBP z regulacją w górę BDK i regulacją w dół PPM1K w wątrobie i zidentyfikował zachowany motyw ChoRE w promotorze obu tych genów. Dodatnia korelacja pomiędzy ekspresją BDK i innymi typowymi genami docelowymi ChREBP (Fasn, Pklr, ChREBPß) zaobserwowano w wątróbkach szczurów karmionych dietą o wysokiej zawartości glukozy lub fruktozy. Na poziomie fizjologicznym wzrost stosunku BDK:PPM1K doprowadził do fosforylacji i aktywacji liazy cytrynianowej ATP (ACLY), stymulując w ten sposób de novo lipogenezę. Wyniki te ujawniają, że BDK i PPM1K mogą być nowymi genami aktywującymi lipogenezę regulowanymi przez ChREBPß. Biorąc pod uwagę ich rolę w regulacji metabolizmu lipidów, glukozy i aminokwasów, BDK i PPM1K można uznać za potencjalne cele terapeutyczne w wątrobie w najbliższej przyszłości (White et al., 2018).
ChREBP jest wymagany do regulacji FGF21 za pośrednictwem glukozy
ChREBP był ostatnio związany z produkcją i wydzielaniem hepatokin, takich jak czynnik wzrostu fibroblastów 21 (FGF21) (Iizuka i wsp., 2009; Dushay et al.,2015, Iroz et al., 2017). FGF21 jest hormonem metabolicznym syntetyzowanym przez wątrobę z wieloma korzystnymi efektami w tkankach obwodowych(Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Do niedawna FGF21 był uważany za hormon na czczo, który zwiększa utlenianie kwasów tłuszczowych, ketogenezę i lipolizę pod kontrolą transkrypcyjną receptora α aktywowanego proliferatorem peroksysomów (PPARa) (Inagaki i wsp., 2007). ChoRE na promotorze Fgf21 zostało wcześniej zidentyfikowane zarówno u myszy (od -74 do -52 bp), jak i u ludzi (od -380 do -366 bp) (Iizuka et al., 2009), ale do niedawna brakowało badań funkcjonalnych. Stwierdzono, że spożycie glukozy i fruktozy prowadzi do szybkiego zwiększenia stężenia FGF21 u zdrowych ochotników i pacjentów z zespołem metabolicznym(Dushay i wsp ., 2015). Dodatkowe badania donosiły również o mechanistycznym związku między FGF21 pochodzącym z ChREBP a preferencją makroskładników poprzez oś wątroba-mózg(Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Ta oś wątroba-mózg rozszerza funkcję ChREBP z regulatora metabolizmu wątrobowego do modulatora systemowego, wpływając nie tylko na obsługę substratów wątroby, ale także na globalne zachowanie żywieniowe (Abdul-Wahed et al., 2017).
rola produktu ChREBP w sieci międzyrządowej, która kontroluje homeostazę energetyczną
rola produktu Chrebp w kontroli równowagi wrażliwości na insulinę
Nasze laboratorium wcześniej poinformowało, że produkt ChREBP działa jako kluczowy modulator składu wątrobowych kwasów tłuszczowych i wrażliwości na insulinę w kontekście bezalkoholowych i alkoholowych chorób wątroby (patrz Abdul-Wahed i wsp., 2017 do przeglądu). U myszy wykazujących nadekspresję produktu ChREBP wystąpiło większe stłuszczenie wątroby niż u myszy z grupy kontrolnej, ale co ciekawe pozostawało wolne od powikłań metabolicznych i nie rozwijało się oporność na insulinę. Analiza lipidomiczna wykazała, że stłuszczenie spowodowane przez ChREBP wiąże się ze zmniejszeniem nasyconych kwasów tłuszczowych i wzrostem jednonienasyconych kwasów tłuszczowych, które, jak wykazano, są związane z korzystnym wpływem chrebp na wrażliwość na insulinę (Benhamed i wsp., 2012). Wyniki te pokazują rolę ChREBP w podziale lipidów i sugerują, że określone gatunki lipidów, gdy są obecne we właściwej lokalizacji i czasie,mogą wywoływać sygnały, które modulują adaptację do stresu metabolicznego (Benhamed et al., 2012; Bricambert et al., 2018). Co ciekawe, Jois et al. (2017) zasugerował również rolę ochronną dla ChREBP wątrobowego w odniesieniu do homeostazy glukozy całego ciała i wrażliwości na insulinę. Myszy ChREBPLiverKO wykazują pogorszoną tolerancję glukozy, a jednocześnie są chronione przed stłuszczeniem wątroby. Delecja ChREBP w wątrobie powodowała również zmiany ekspresji genów w białych i brązowych tkankach tłuszczowych, co sugeruje komunikację między tkankami. Wkład ChREBP w bilans energetyczny całego ciała może zatem polegać na jego regulacji gatunków lipidów i / lub produkcji hepatokin przyczyniających się do koordynacji między tkankami homeostazy energetycznej (Jois et al., 2017).
adipose ChREBP łączy lipogenezę z wrażliwością na insulinę
zaburzenia sygnalizacji insuliny w tkance tłuszczowej są kluczową cechą oporności na insulinę. Badania donoszą, że aktywacja ChREBP w białej tkance tłuszczowej może poprawić homeostazę metaboliczną poprzez wytwarzanie ochronnych sygnałów krążących (Yore et al., 2014; Tang et al., 2016). Stwierdzono, że Klasa lipidów ssaków charakteryzująca się rozgałęzionym Związkiem estrowym między kwasem tłuszczowym a kwasem hydroksy-tłuszczowym, kwas palmitynowy kwas hydroksyl-stearynowy (PAHSA) wywiera korzystny wpływ na homeostazę glukozy poprzez bezpośrednią i inkretynową modulację funkcji komórek β, wychwyt glukozy i zmniejszenie stanu zapalnego (Yore i in., 2014). Podobnie, adipose-specific chrebp knockout (ChREBPadiposeKO), które wykazują niski poziom lipogenezy w tkance tłuszczowej, są odporne na insulinę z upośledzonym działaniem insuliny w wątrobie, mięśniach i białej tkance tłuszczowej zarówno w Warunkach chow, jak i diecie o wysokiej zawartości tłuszczu. Myszy ChREBPadiposeKO mają niższe poziomy Pahsa w surowicy, podczas gdy suplementacja PAHSA, w szczególności izomer 9-PAHSA, ratuje chrebpadiposeko globalną insulinooporność i zapalenie tkanki tłuszczowej, potwierdzając, że utrata tkanki tłuszczowej-ChREBP jest wystarczająca do wywołania insulinooporności (Vijayakumar i wsp ., 2017). Ostatnie badania zidentyfikowały mechanistyczny cel kompleksu rapamycyny 2 (mtorc2) jako nowy regulator ChREBP (zwłaszcza izoformy β) w komórkach tłuszczowych. Swoista ablacja niewrażliwego na rapamycynę towarzysza mTOR (Rictor) w dojrzałych adipocytach zaburzyła stymulowany insuliną wychwyt glukozy w tkance tłuszczowej, prowadząc do obniżonej regulacji ChREBPß i ekspresji genu docelowego biorącego udział w kontroli lipogenezy (Tang i wsp., 2016). W porozumieniu z ważnym crosstalkiem tłuszczowo-wątrobowym, w którym pośredniczy ChREBP, efekty te są związane z wątrobową insulinoopornością i zwiększoną glukoneogenezą. Ogólnie rzecz biorąc, badania te wspierają ważną rolę dla tkanki tłuszczowej ChREBP w wyzwalaniu sygnałów wrażliwych na insulinę (Tang et al., 2016).
Nowa interakcja między lipazą wrażliwą na hormony i produktem ChREBP w tkance tłuszczowej
produkt ChREBP został niedawno zidentyfikowany jako partner enzymu lipolitycznego lipazy wrażliwej na hormony (HSL) w tkance tłuszczowej (Morigny i wsp., 2019). Knockdown HSL w ludzkich adipocytach i tkance tłuszczowej myszy wykazano, aby zwiększyć wrażliwość na insulinę i indukować wydłużenie enzymu kwasu tłuszczowego o bardzo długim łańcuchu (Elovl6). Elov16 jest enzymem mikrosomalnym, który reguluje wydłużenie nasyconych i jednonienasyconych kwasów tłuszczowych C12-16 w sposób zależny od ChREBP (Morigny et al., 2019). Na poziomie mechanistycznym fizyczna interakcja między HSL i ChREBP zaburzyła translokację jądrową ChREBPa i późniejszą indukcję genów ChREBPß i docelowych, w szczególności Elovl6(Morigny et al., 2019). Badanie to ujawnia nową regulację ChREBP w tkance tłuszczowej. Hamowanie interakcji między HSL i ChREBP może prowadzić do potencjalnych strategii terapeutycznych zwiększających wrażliwość komórek tłuszczowych na insulinę.
wnioski i przyszłe kierunki
ChREBP jest obecnie dobrze znanym czujnikiem węglowodanów. Chociaż większość badań poświęcono jego wpływowi na kontrolę szlaków glikolitycznych i lipogennych, Najnowsze dane ujawniły również nowy wkład ChREBP w hepatocyty i komórki tłuszczowe, gdzie może on odegrać kluczową rolę w wytwarzaniu hepatokin i/lub lipokin wyzwalających przesłuchy międzyrządowe. Jak omówiono, nowo zidentyfikowane czynniki (modyfikatory epigenetyczne) i/lub partnerzy (adipose HSL) w tych tkankach mogą również reprezentować potencjalne strategie terapeutyczne dla NAFLD i / lub poprawy ogólnoustrojowej wrażliwości na insulinę. Ostatnie badania potwierdziły również znaczenie ChREBP w regulacji metabolizmu fruktozy i podkreśliły potrzebę lepszego zrozumienia jego roli i regulacji w jelicie cienkim. Wreszcie, określenie specyficznych i / lub nakładających się na siebie celów ChREBPa i ChREBPß w kluczowych typach komórek, jak również określenie ich specyficznego wpływu na wrażliwość na insulinę będzie miało szczególne znaczenie w nadchodzących latach.
wkład autora
wszyscy wymienieni autorzy wnieśli znaczący, bezpośredni i intelektualny wkład w pracę i zatwierdzili ją do publikacji.
finansowanie
laboratorium Postic (U1016-Institut Cochin) jest wspierane przez granty z sieci ChroME (Marie Curie Skłodowska Action H2020-MSCA-ITN-2015-675610), Fundacji Badań Medycznych (FRM) (DEQ20150331744) i ANR-15-CE14-0026-Hepatokind.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.