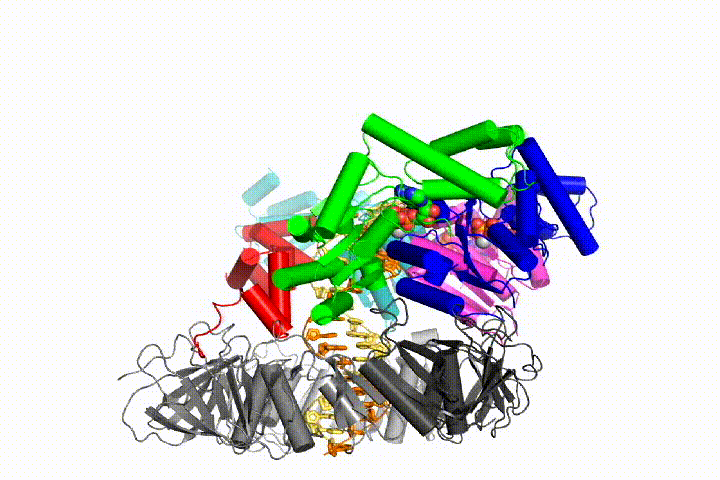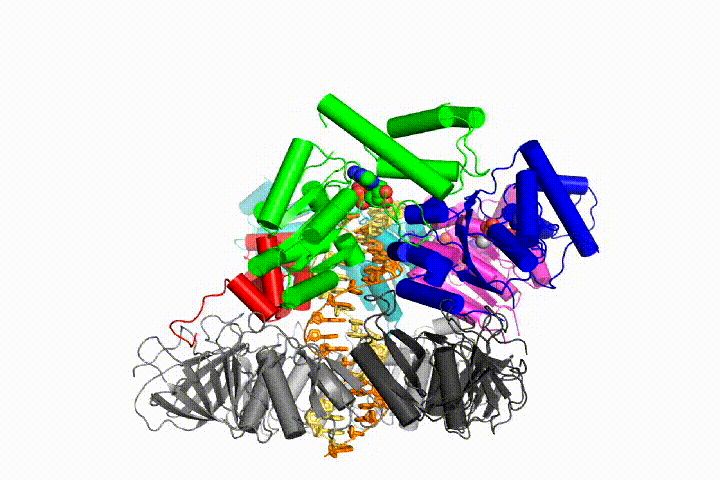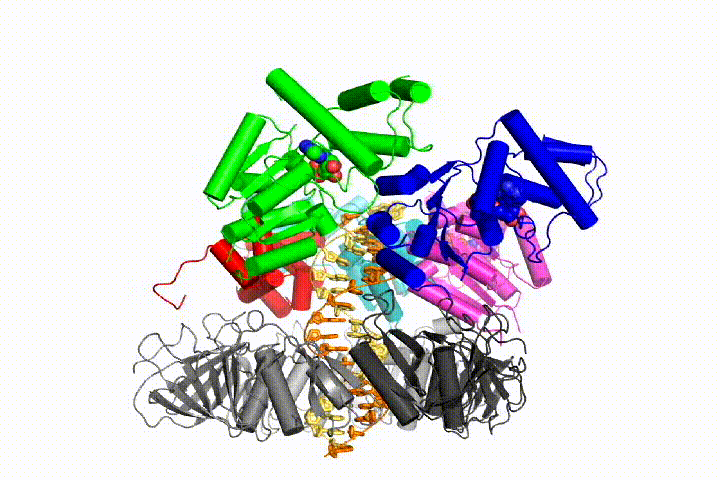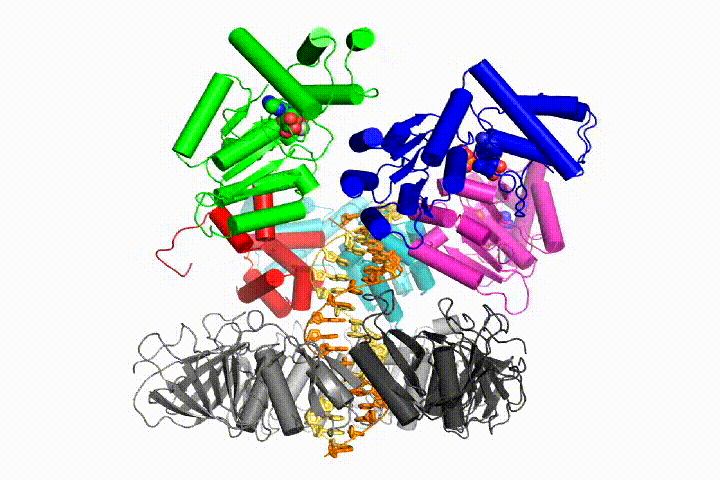
replikacja chromosomalnego DNA wymaga, aby polimerazy DNA były przywiązane do pierścieniowych zacisków przesuwnych, które otaczają DNA i pozwalają na szybką replikację procesywną. Zaciski przesuwne są ładowane na DNA przez kompleks clamp loader, pentameryczny zespół białek z rodziny ATPAZ AAA+.
chcemy zrozumieć funkcję i mechanizm ładowarek zaciskowych w atomowych szczegółach. Ostatnie struktury bakteriofagowego ładowacza zaciskowego T4 w kompleksie z dna z szablonem podkładu i zaciskiem przesuwnym zasugerowały model roboczy mechanizmu ładowacza zaciskowego, jak pokazano poniżej (patrz Kelch et al Science 2011):
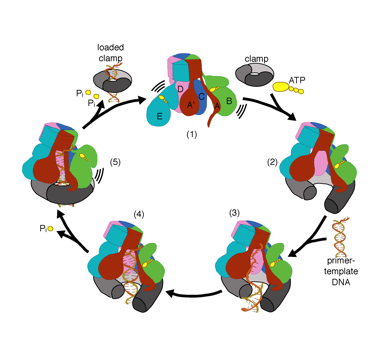
Nasz model przewiduje, że hydroliza ATP rozpoczyna się na końcu spirali AAA+ i przebiega sekwencyjnie w górę spirali, powodując wyrzucenie Ładowarki zaciskowej z DNA i zamkniętego zacisku. Nasza hipoteza jest zilustrowana w animacji trzech kolejnych zdarzeń hydrolizy ATP:
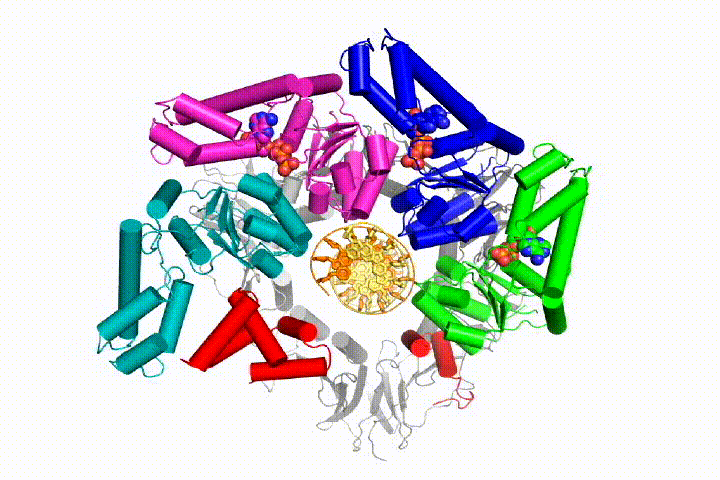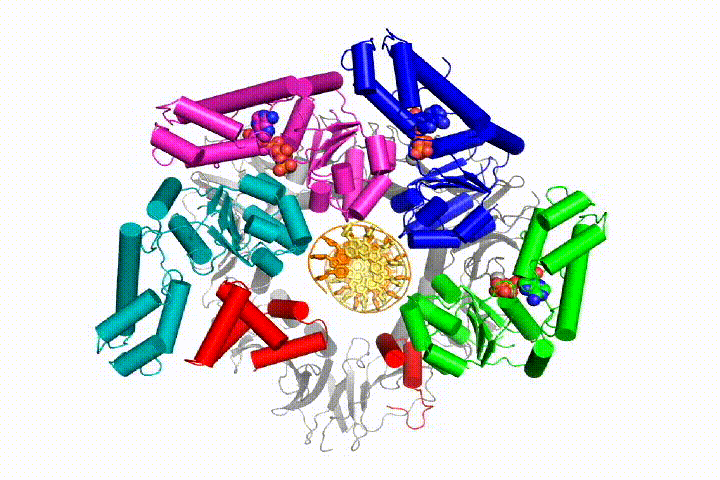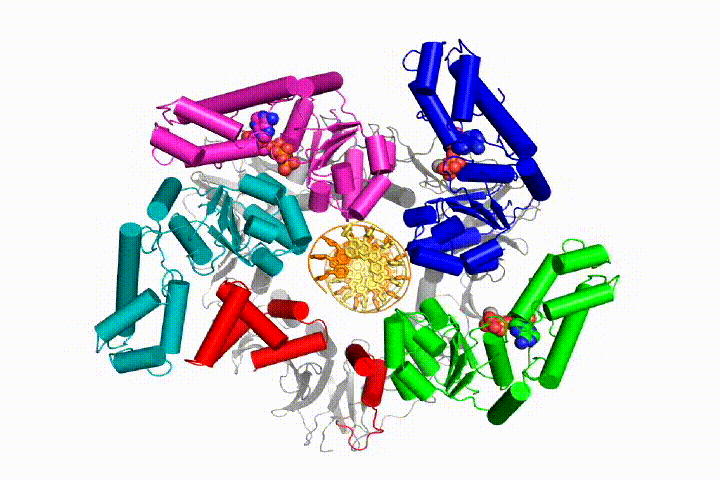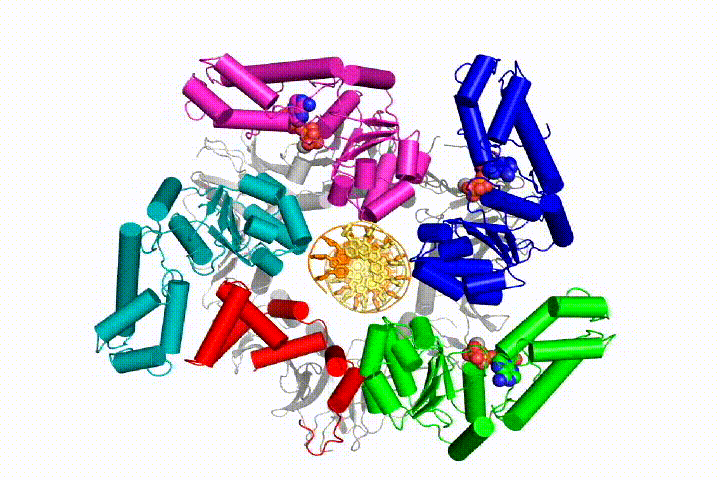
przetestujemy te modele mechanizmu Ładowarki zaciskowej przy użyciu szerokiej gamy metod biochemicznych, biofizycznych i strukturalnych. Zrozumienie mechanizmu clamp loader w szczegółach atomowych będzie miało ważne implikacje dla zrozumienia replikacji DNA, jak również mechanizmu powiązanych zespołów białek AAA+. Ostatecznie przewidujemy wykorzystanie naszego mechanistycznego zrozumienia do opracowania nowych nanodurządzeń i efektorów małocząsteczkowych funkcji AAA+.