nazwa ogólna: chlorowodorek klonidyny
postać dawkowania: tabletka
Drugs.com. Ostatnia aktualizacja: 1 lipca 2020 r.
- przegląd
- skutki uboczne
- dawkowanie
- profesjonalne
- porady
- interakcje
- więcej
- tabletki chlorowodorku klonidyny, USP
- klonidyny opis
- klonidyna – Farmakologia kliniczna
- farmakokinetyka
- wskazania i zastosowanie do klonidyny
- przeciwwskazania
- Ostrzeżenia
- odstawienie leku
- środki ostrożności
- ogólne
- stosowanie w okresie okołooperacyjnym
- informacja dla pacjentów
- interakcje z innymi lekami
- Toksykologia
- Rakotwórczość, mutageneza, upośledzenie płodności
- ciąża
- matki karmiące
- stosowanie u dzieci
- działania niepożądane
- przedawkowanie
- klonidyna Dawkowanie i sposób podawania
- jak dostarczana jest klonidyna
- główny panel wyświetlacza
- główny panel wyświetlacza
- PRINCIPAL DISPLAY PANEL
- więcej o klonidynie
- zasoby konsumenckie
- zasoby Zawodowe
- powiązane Przewodniki leczenia
tabletki chlorowodorku klonidyny, USP
doustne leki przeciwnadciśnieniowe
tabletki 0, 1 mg, 0, 2 mg i 0.3 mg
tylko Rx
informacje o przepisywaniu
klonidyny opis
chlorowodorek klonidyny, USP jest działającym ośrodkowo Alfa-agonistą lekiem hipotensyjnym dostępnym w postaci tabletek do podawania doustnego w trzech dawkach: 0, 1 mg, 0, 2 mg i 0, 3 mg. Tabletka 0,1 mg odpowiada 0,087 mg wolnej zasady.
składniki nieaktywne to: koloidalny dwutlenek krzemu, skrobia kukurydziana, dwuzasadowy fosforan wapnia, hydroksypropyloceluloza, celuloza mikrokrystaliczna, Laktoza jednowodna i magnezu stearynian. Ponadto 0.Tabletki 1 mg zawierają odpowiednio FD & C czerwony nr 40, a tabletki 0,2 mg i 0,3 mg zawierają odpowiednio FD&C żółty nr 6 jako barwne dodatki.
chlorowodorek klonidyny jest pochodną imidazoliny i istnieje jako związek mezomeryczny. Nazwa chemiczna to chlorowodorek 2-(2,6-dichlorofenyloamino) – 2-imidazoliny. Poniżej znajduje się wzór strukturalny:
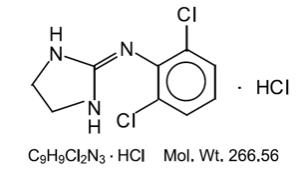
chlorowodorek klonidyny jest bezwonną, gorzką, białą, krystaliczną substancją rozpuszczalną w wodzie i alkoholu.
klonidyna – Farmakologia kliniczna
klonidyna stymuluje alfa-adrenoreceptory w pniu mózgu. Działanie to powoduje zmniejszenie odpływu współczulnego z ośrodkowego układu nerwowego oraz zmniejszenie oporu obwodowego, oporu naczyniowego nerek, częstości akcji serca i ciśnienia krwi. Tabletki chlorowodorku klonidyny działają stosunkowo szybko. Ciśnienie krwi pacjenta zmniejsza się w ciągu 30 do 60 minut po podaniu doustnym, maksymalne obniżenie występuje w ciągu 2 do 4 godzin. Nerkowy przepływ krwi i szybkość przesączania kłębuszkowego pozostają zasadniczo niezmienione. Prawidłowe odruchy postawy są nienaruszone; dlatego objawy ortostatyczne są łagodne i rzadkie.
ostre badania z użyciem chlorowodorku klonidyny u ludzi wykazały umiarkowane zmniejszenie (15% do 20%) pojemności minutowej serca w pozycji leżącej na plecach bez zmiany oporności obwodowej: przy pochyleniu 45′ występuje mniejsze zmniejszenie pojemności minutowej serca i zmniejszenie oporności obwodowej. Podczas długotrwałego leczenia pojemność minutowa serca ma tendencję do powrotu do wartości kontrolnych, podczas gdy oporność obwodowa pozostaje zmniejszona. U większości pacjentów otrzymujących klonidynę obserwowano spowolnienie tętna, ale lek nie zmienia prawidłowej odpowiedzi hemodynamicznej na wysiłek fizyczny.
u niektórych pacjentów może rozwinąć się tolerancja na działanie przeciwnadciśnieniowe, co wymaga ponownej oceny leczenia.
inne badania u pacjentów wykazały zmniejszenie aktywności reniny w osoczu oraz wydalanie aldosteronu i katecholamin. Dokładny związek tych działań farmakologicznych z przeciwnadciśnieniowym działaniem klonidyny nie został w pełni wyjaśniony.
klonidyna Ostro stymuluje uwalnianie hormonu wzrostu zarówno u dzieci, jak i dorosłych, ale nie powoduje przewlekłego podniesienia hormonu wzrostu przy długotrwałym stosowaniu.
farmakokinetyka
farmakokinetyka klonidyny jest proporcjonalna do dawki w zakresie od 100 do 600 µg. Bezwzględna biodostępność klonidyny po podaniu doustnym wynosi 70% do 80%. Maksymalne stężenie klonidyny w osoczu jest osiągane po około 1 do 3 godzinach.
po podaniu dożylnym klonidyna wykazuje dwufazową dyspozycję z okresem półtrwania w dystrybucji wynoszącym około 20 minut i okresem półtrwania w fazie eliminacji wynoszącym od 12 do 16 godzin. Okres półtrwania wydłuża się do 41 godzin u pacjentów z ciężkimi zaburzeniami czynności nerek. Klonidyna przenika przez barierę łożyskową. Wykazano, że przenika przez barierę krew-mózg u szczurów.
po podaniu doustnym około 40% do 60% wchłoniętej dawki jest wydalane w moczu w postaci niezmienionej w ciągu 24 godzin. Około 50% wchłoniętej dawki jest metabolizowane w wątrobie. Ani pokarm, ani rasa pacjenta nie wpływają na farmakokinetykę klonidyny.
działanie przeciwnadciśnieniowe występuje w stężeniach w osoczu od około 0, 2 do 2, 0 ng/mL u pacjentów z prawidłową czynnością wydalniczą. Dalsze zwiększenie stężenia leku w osoczu nie wzmaga działania przeciwnadciśnieniowego.
wskazania i zastosowanie do klonidyny
tabletki chlorowodorku klonidyny, USP są wskazane w leczeniu nadciśnienia tętniczego. Tabletki chlorowodorku klonidyny, USP mogą być stosowane w monoterapii lub jednocześnie z innymi lekami przeciwnadciśnieniowymi.
przeciwwskazania
nie należy stosować tabletek chlorowodorku klonidyny u pacjentów ze stwierdzoną nadwrażliwością na klonidynę (patrz środki ostrożności).
Ostrzeżenia
odstawienie leku
należy pouczyć pacjentów, aby nie przerywali leczenia bez konsultacji z lekarzem. Nagłe przerwanie leczenia klonidyną powodowało, w niektórych przypadkach, objawy takie jak nerwowość, pobudzenie, ból głowy i drżenie, któremu towarzyszył lub towarzyszył szybki wzrost ciśnienia krwi i podwyższone stężenie katecholamin w osoczu. Prawdopodobieństwo wystąpienia takich reakcji na przerwanie leczenia klonidyną wydaje się większe po podaniu większych dawek lub kontynuowaniu jednoczesnego leczenia lekami Beta-adrenolitycznymi i dlatego w takich sytuacjach zaleca się zachowanie szczególnej ostrożności. Po odstawieniu klonidyny zgłaszano rzadkie przypadki encefalopatii nadciśnieniowej, incydentów naczyniowo-mózgowych i zgonów. W przypadku przerwania leczenia klonidyną lekarz powinien stopniowo zmniejszać dawkę w ciągu 2 do 4 dni, aby uniknąć objawów odstawiennych.
nadmierny wzrost ciśnienia krwi po przerwaniu leczenia klonidyną można odwrócić przez podanie doustnego chlorowodorku klonidyny lub dożylne podanie fentolaminy. Jeśli leczenie ma zostać przerwane u pacjentów otrzymujących jednocześnie lek Beta-adrenolityczny i klonidynę, należy odstawić lek na kilka dni przed stopniowym odstawieniem klonidyny.
ponieważ dzieci często chorują na choroby przewodu pokarmowego, które prowadzą do wymiotów, mogą być szczególnie podatne na epizody nadciśnienia wynikające z nagłej niezdolności do przyjmowania leków.
środki ostrożności
ogólne
u pacjentów, u których wystąpiło miejscowe uczulenie kontaktowe na przezskórną klonidynę, kontynuacja leczenia przezskórną klonidyną lub zastąpienie doustnego chlorowodorku klonidyny może być związane z rozwojem uogólnionej wysypki skórnej.
u pacjentów, u których wystąpi reakcja alergiczna na przezskórną klonidynę, zastąpienie doustnego chlorowodorku klonidyny może również wywołać reakcję alergiczną (w tym uogólnioną wysypkę, pokrzywkę lub obrzęk naczynioruchowy.)
sympatykolityczne działanie klonidyny może nasilać dysfunkcję węzła zatokowego i blok przedsionkowo-komorowy (AV), szczególnie u pacjentów przyjmujących inne leki sympatykolityczne. Po wprowadzeniu leku do obrotu istnieją doniesienia o pacjentach z zaburzeniami przewodzenia i (lub) przyjmujących inne leki sympatykolityczne, u których podczas przyjmowania klonidyny wystąpiła ciężka bradykardia wymagająca podania dożylnego atropiny, izoproterenolu i czasowego stymulowania serca.
w nadciśnieniu wywołanym guzem chromochłonnym nie można oczekiwać działania terapeutycznego tabletek chlorowodorku klonidyny.
stosowanie w okresie okołooperacyjnym
podawanie tabletek chlorowodorku klonidyny należy kontynuować w ciągu czterech godzin od operacji, a następnie jak najszybciej wznowić. Podczas zabiegu chirurgicznego należy dokładnie monitorować ciśnienie tętnicze krwi i w razie potrzeby należy zapewnić dodatkowe środki kontroli ciśnienia tętniczego krwi.
informacja dla pacjentów
pacjentów należy ostrzec przed przerwaniem leczenia Klonidynowym chlorowodorkiem w postaci tabletek bez konsultacji z lekarzem.
ponieważ podczas stosowania klonidyny u pacjentów może wystąpić działanie uspokajające, zawroty głowy lub zaburzenia akomodacji, należy zachować ostrożność podczas wykonywania czynności, takich jak prowadzenie pojazdów, obsługa urządzeń lub maszyn. Należy również poinformować pacjentów, że to działanie uspokajające może być nasilone przez jednoczesne stosowanie alkoholu, barbituranów lub innych leków uspokajających.
pacjentów noszących soczewki kontaktowe należy ostrzec, że leczenie tabletkami chlorowodorku klonidyny może powodować suchość oczu.
interakcje z innymi lekami
klonidyna może nasilać depresyjne działanie alkoholu, barbituranów lub innych leków uspokajających. Jeśli pacjent otrzymujący chlorowodorek klonidyny również przyjmuje trójpierścieniowe leki przeciwdepresyjne, hipotensyjne działanie klonidyny może zostać zmniejszone, co wymaga zwiększenia dawki klonidyny. Jeśli pacjent otrzymujący klonidynę również przyjmuje neuroleptyki, mogą wystąpić zaburzenia regulacji ortostatycznej (np. niedociśnienie ortostatyczne, zawroty głowy, zmęczenie).
Monitoruj częstość akcji serca u pacjentów otrzymujących klonidynę jednocześnie z lekami, o których wiadomo, że wpływają na czynność węzła zatokowego lub przewodzenie węzłowe AV, np. naparstnicy, antagonistów kanału wapniowego i beta-adrenolityków. Podczas jednoczesnego stosowania klonidyny z diltiazemem lub werapamilem zgłaszano bradykardię zatokową powodującą hospitalizację i wprowadzenie rozrusznika serca.
Amitryptylina w skojarzeniu z klonidyną nasila objawy zmian rogówki u szczurów (Patrz Toksykologia).
na podstawie obserwacji u pacjentów w stanie delirium alkoholowego zasugerowano, że wysokie dożylne dawki klonidyny mogą zwiększać potencjał arytmogenny (wydłużenie odstępu QT, migotanie komór) dużych dożylnych dawek haloperydolu. Związek przyczynowy i znaczenie dla klonidyny w postaci tabletek doustnych nie zostały ustalone.
Toksykologia
w kilku badaniach z doustnym chlorowodorkiem klonidyny obserwowano zależne od dawki zwiększenie częstości i ciężkości samoistnego zwyrodnienia siatkówki u szczurów albinosów leczonych przez sześć miesięcy lub dłużej. Badania dystrybucji tkanek u psów i małp wykazały stężenie klonidyny w naczyniówce.
ze względu na zwyrodnienie siatkówki obserwowane u szczurów, w trakcie badań klinicznych u 908 pacjentów przeprowadzono badania okulistyczne przed rozpoczęciem leczenia klonidyną oraz okresowo po jej zakończeniu. U 353 z tych 908 pacjentów badania okulistyczne przeprowadzono w okresie 24 miesięcy lub dłużej. Poza pewną suchością oczu nie odnotowano żadnych zaburzeń okulistycznych związanych z lekiem, a według specjalistycznych badań, takich jak elektroretinografia i olśnienie plamki żółtej, funkcja siatkówki nie uległa zmianie.
podawanie chlorowodorku klonidyny w skojarzeniu z amitryptyliną prowadziło do rozwoju zmian rogówki u szczurów w ciągu 5 dni.
Rakotwórczość, mutageneza, upośledzenie płodności
przewlekłe podawanie klonidyny w diecie nie było rakotwórcze odpowiednio szczurom (132 tygodnie) ani myszom (78 tygodni), którym podawano dawkę do 46 lub 70 razy większą od maksymalnej zalecanej dawki dobowej u ludzi w mg/kg mc. (9 lub 6 razy większą od MRDHD w przeliczeniu na mg/m2 pc.). Nie było dowodów genotoksyczności W teście Amesa pod kątem mutagenności ani w teście mikrojąderkowym myszy pod kątem klastogenności.
płodność samców i samic szczurów nie uległa zmianie po podaniu dawek klonidyny do 150 µg/kg mc. (około 3 razy MRDHD). W osobnym doświadczeniu wpływ na płodność samic szczurów miał poziom dawek od 500 do 2000 µg/kg mc. (10 do 40 razy większy od doustnego MRDHD w przeliczeniu na mg/kg mc.; 2 do 8 razy większy od mrdhd w przeliczeniu na mg/m’.)
ciąża
działanie teratogenne: ciąża Kategoria C. badania wpływu na reprodukcję przeprowadzone na królikach w dawkach do około 3 razy większych od doustnej maksymalnej zalecanej dawki dobowej (MRDHD) chlorowodorku klonidyny w tabletkach nie wykazały działania teratogennego ani embriotoksycznego u królików. Jednak u szczurów dawki tak niskie, jak 1/3 doustnego MRDHD (1/15 MRDHD w przeliczeniu na mg/m2 pc.) klonidyny były związane ze zwiększoną resorpcją w badaniu, w którym matki były leczone w sposób ciągły od 2 miesięcy przed kryciem. Zwiększona resorpcja nie była związana z leczeniem w tym samym czasie lub przy wyższych dawkach (do 3-krotności doustnego MRDHD), gdy matki były leczone w dniach od 6 do 15 ciąży. Obserwowano zwiększenie resorpcji po znacznie większych dawkach (40-krotność doustnego MRDHD w przeliczeniu na mg/kg mc.; 4 do 8 razy większa niż MRDHD w mg/m2 pc.) u myszy i szczurów leczonych w dniach 1 do 14 ciąży (najniższa dawka zastosowana w badaniu wynosiła 500 µg/kg mc.).
nie przeprowadzono odpowiednich, dobrze kontrolowanych badań u kobiet w ciąży. Klonidyna przenika przez barierę łożyskową (patrz Farmakologia kliniczna, farmakokinetyka). Ponieważ badania reprodukcji zwierząt nie zawsze są predykcyjne odpowiedzi człowieka, lek ten powinien być stosowany w czasie ciąży tylko wtedy, gdy jest to wyraźnie konieczne.
matki karmiące
ponieważ chlorowodorek klonidyny przenika do mleka kobiecego, należy zachować ostrożność podczas podawania tabletek chlorowodorku klonidyny kobietom karmiącym piersią.
stosowanie u dzieci
Bezpieczeństwo i skuteczność stosowania u dzieci nie zostały ustalone w odpowiednich i dobrze kontrolowanych badaniach klinicznych (Patrz Ostrzeżenia, odstawienie leku).
działania niepożądane
większość działań niepożądanych ma charakter łagodny i zmniejsza się w miarę kontynuowania leczenia. Najczęstsze (które wydają się być zależne od dawki) to suchość w jamie ustnej, występująca u około 40 na 100 pacjentów; senność, około 33 na 100; zawroty głowy, około 16 na 100; zaparcia i sedacja, każde około 10 na 100.
u pacjentów otrzymujących tabletki chlorowodorku klonidyny zgłaszano również mniej częste działania niepożądane, ale w wielu przypadkach pacjenci otrzymywali jednocześnie leki i nie ustalono związku przyczynowego.
ciało jako całość: zmęczenie, gorączka, ból głowy, bladość, osłabienie i zespół odstawienia. Odnotowano również słabo dodatni wynik testu Coombsa i zwiększoną wrażliwość na alkohol.
: Bradykardia, zastoinowa niewydolność serca, zaburzenia elektrokardiograficzne (np. zatrzymanie węzła zatokowego, bradykardia węzłowa, blok przedsionkowo-komorowy wysokiego stopnia i zaburzenia rytmu serca), objawy ortostatyczne, kołatanie serca, zjawisko Raynauda, omdlenia i tachykardia.
zgłaszano przypadki bradykardii zatokowej i bloku przedsionkowo-komorowego, zarówno w przypadku jednoczesnego stosowania naparstnicy, jak i bez niej.
Ośrodkowy Układ Nerwowy: Pobudzenie, niepokój, majaczenie, percepcja urojeniowa, halucynacje (w tym wzrokowe i słuchowe), bezsenność, depresja psychiczna, nerwowość, inne zmiany behawioralne, parestezje, niepokój, zaburzenia snu oraz żywe sny lub koszmary senne.
dermatologiczne: łysienie, obrzęk naczynioruchowy, pokrzywka, świąd, wysypka i pokrzywka.
przewód pokarmowy: ból brzucha, jadłowstręt, zaparcia, zapalenie wątroby, złe samopoczucie, łagodne przemijające nieprawidłowości w badaniach czynności wątroby, nudności, zapalenie przyusznic, rzekoma niedrożność (w tym rzekoma niedrożność okrężnicy), ból gruczołów ślinowych i wymioty.
układ moczowo-płciowy: zmniejszenie aktywności seksualnej, trudności w oddawaniu moczu, zaburzenia erekcji, utrata libido, oddawanie moczu w nocy i zatrzymanie moczu.
Hematologiczne: Małopłytkowość.
metabolizm: Ginekomastia, przemijające zwiększenie stężenia glukozy lub fosfokinazy kreatynowej we krwi i zwiększenie masy ciała.
układ mięśniowo-szkieletowy: skurcze nóg i bóle mięśni lub stawów.
Oro-otolaryngeal: suchość błony śluzowej nosa.
Okulistyka: zaburzenia akomodacji, niewyraźne widzenie, pieczenie oczu, zmniejszone łzawienie i suchość oczu.
przedawkowanie
nadciśnienie tętnicze może rozwinąć się wcześnie, a następnie może wystąpić niedociśnienie, bradykardia, depresja oddechowa, hipotermia, senność, osłabienie lub brak odruchów, osłabienie, drażliwość i zwężenie źrenic. Częstość występowania depresji OUN może być większa u dzieci niż u dorosłych. Duże przedawkowanie może prowadzić do odwracalnych zaburzeń przewodzenia serca lub zaburzeń rytmu serca, bezdechu, śpiączki i drgawek. Objawy przedmiotowe i podmiotowe przedawkowania występują zwykle w ciągu 30 minut do dwóch godzin po ekspozycji. Już 0,1 mg klonidyny wywołuje objawy toksyczności u dzieci.
nie ma swoistego antidotum w przypadku przedawkowania klonidyny. Przedawkowanie klonidyny może prowadzić do szybkiego zahamowania czynności ośrodkowego układu nerwowego, dlatego nie zaleca się wywoływania wymiotów za pomocą syropu ipecac. Po niedawnym i (lub) dużym spożyciu może być wskazane płukanie żołądka. Korzystne może być podanie węgla aktywowanego i (lub) środka oczyszczającego. Leczenie wspomagające może obejmować siarczan atropiny w leczeniu bradykardii, płyny dożylne i (lub)leki rozszerzające naczynia krwionośne w leczeniu niedociśnienia tętniczego. Nalokson może być przydatnym lekiem wspomagającym leczenie depresji oddechowej wywołanej klonidyną, niedociśnienia i (lub) śpiączki; należy monitorować ciśnienie krwi, ponieważ podawanie naloksonu czasami prowadzi do paradoksalnego nadciśnienia. Podawanie tolazoliny przyniosło niespójne wyniki i nie jest zalecane w leczeniu pierwszego rzutu. Dializa nie może znacząco nasilać eliminacji klonidyny.
największe jak dotąd przedawkowanie dotyczyło 28-letniego mężczyzny, który przyjął 100 mg chlorowodorku klonidyny w proszku. U tego pacjenta rozwinęło się nadciśnienie tętnicze, a następnie niedociśnienie tętnicze, bradykardia, bezdech, omamy, półpasiec i przedwczesne skurcze komór. Pacjent w pełni wyzdrowiał po intensywnym leczeniu. Stężenie klonidyny w osoczu wynosiło 60 ng / mL po 1 godzinie, 190 ng/mL po 1,5 godzinie, 370 ng/mL po 2 godzinach i 120 ng / mL po 5,5 i 6,5 godzinie. U myszy i szczurów doustna wartość LD50 klonidyny wynosi odpowiednio 206 i 465 mg/kg mc.
klonidyna Dawkowanie i sposób podawania
Dorośli
dawka tabletek chlorowodorku klonidyny musi być dostosowana do indywidualnej reakcji pacjenta na ciśnienie krwi. Poniżej znajduje się ogólny przewodnik po jego administracji.
dawka początkowa
tabletka 0, 1 mg dwa razy na dobę (rano i przed snem). Pacjenci w podeszłym wieku mogą odnieść korzyści z mniejszej dawki początkowej.
dawka podtrzymująca
w razie potrzeby można w odstępach tygodniowych zwiększać dawkę o 0, 1 mg na dobę, aż do uzyskania pożądanej odpowiedzi. Przyjmowanie większej porcji doustnej dawki dobowej przed snem może zminimalizować przemijające efekty dostosowawcze suchości w jamie ustnej i senności. Najczęściej stosowane dawki terapeutyczne wahały się od 0,2 mg do 0,6 mg na dobę, podawane w dawkach podzielonych.
badania wykazały, że maksymalną skuteczną dawką dobową jest 2, 4 mg, ale rzadko stosowano tak duże dawki.
zaburzenie czynności nerek
mniejsze dawki początkowe mogą być korzystne dla pacjentów z zaburzeniem czynności nerek. Pacjentów należy dokładnie monitorować. Ponieważ podczas rutynowej hemodializy usuwa się tylko minimalną ilość klonidyny, nie ma potrzeby podawania dodatkowej klonidyny po dializie.
jak dostarczana jest klonidyna
tabletki chlorowodorku klonidyny, USP są dostarczane w następujący sposób:
0, 1 mg: różowa tabletka w kształcie „ „.
„.
NDC 58657-647-01 (Butelka 100)
NDC 58657-647-50 (butelka 500)
NDC 58657-647-10 (butelka 1000)
0, 2 mg: pomarańczowa tabletka w kształcie ”  „.
„.
NDC 58657-648-01 (butelka po 100 sztuk)
NDC 58657-648-50 (butelka po 500 sztuk)
NDC 58657-648-10 (butelka po 1000 sztuk)
0, 3 mg: jasnopomarańczowa tabletka w kształcie ”  „.
„.
NDC 58657-649-01 (butelka po 100 sztuk)
NDC 58657-649-50 (butelka po 500 sztuk)
NDC 58657-649-10 (butelka po 1000 sztuk)
Przechowywać w temperaturze 25°C (77°F); wycieki dozwolone do 15°C-30°C (59°F-86 ° F). Dozować w szczelnym, odpornym na światło pojemniku.
Producent:
Yung Shin Pharmaceutical Ind. Co., Ltd.
Tachia, Taichung 43769
Tajwan
:
Method Pharmaceuticals, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
aby zgłosić działanie niepożądane leku, zadzwoń do Method Pharmaceuticals pod numer 1-877-250-3427
zmieniony: 06/20
główny panel wyświetlacza
NDC 58657-647-10
klonidyna
chlorowodorek
tabletki, USP
0,1 mg
tylko RX
1000 tabletek

główny panel wyświetlacza
NDC 58657-648-10
klonidyna
chlorowodorek
tabletki, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| chlorowodorek klonidyny tabletka chlorowodorku klonidyny |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| chlorowodorek klonidyny tabletka chlorowodorku klonidyny |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-Method Pharmaceuticals, LLC (060216698)
więcej o klonidynie
- działania niepożądane
- podczas ciąży lub karmienia piersią
- informacje o dawkowaniu
- wskazówki dla pacjentów
- Zdjęcia leków
- interakcje leków
- Porównaj alternatywy
- Grupa Wsparcia
- cennik & kupony
- 619 recenzje
- klasa leków: leki Przeciwadrenergiczne, działające centralnie
- Ostrzeżenia FDA (1)
zasoby konsumenckie
- informacje dla pacjentów
- … + 5 więcej
zasoby Zawodowe
- informacje o przepisywaniu leku
- klonidyna (profesjonalne porady dla pacjentów)
- klonidyna tabletki o przedłużonym uwalnianiu (FDA)
- wstrzyknięcie klonidyny (FDA)
- plaster klonidyny (FDA)
- tabletki klonidyny (FDA)
inne marki Catapres, kapvay, Catapres-TTS, Duraclon, Nexiclon XR
powiązane Przewodniki leczenia
- lęk
- ADHD
- odstawienie alkoholu
- migotanie przedsionków
- … + 19 więcej
oświadczenie lekarskie