Abstract
Cirrhotisk Kardiomyopati er en nylig anerkjent tilstand som består av myokarddysfunksjon manifestert i cirrhotiske pasienter i fravær av tidligere hjertesykdom. De underliggende patogenetiske mekanismene inkluderer et «miokardiotoksisk» miljø som fører til et stumt hjerte respons på stress, enten fysisk eller farmakologisk. Denne tilstanden er nå bedre forstått og kan diagnostiseres støttet klinisk, ved laboratorie elektrokardiografi og ekkokardiografi kriterier. Klinisk, systolisk inkompetanse er mest tydelig når cirrhotiske pasienter er plassert under stress, enten fysisk eller farmakologisk. Til tross for å være godt forstått, er det mangel på kunnskap til en skikkelig praktisk anvendelse. Nylige saksrapporter har antydet AT CCM må behandles tidlig fordi DET kan være en utløsende faktor for cirrhosekomplikasjoner. Studier er nødvendig for å identifisere potensielle behandlinger som endrer den naturlige historien til hjertesykdom hos cirrhotiske pasienter, spesielt i faser der pasientene er asymptomatiske.
Nøkkelord
levercirrhose, hjertesvikt, kardiomyopati
Innledning
Cirrhotisk kardiomyopati (CCM) er En hjertedysfunksjon preget av suboptimal kontraktil respons på stress og nedsatt diastolisk funksjon i fravær av tidligere hjertesykdom . I dag har forskning foreslått at cirrhotiske pasienter har en iboende hjertedysfunksjon som kan påvirke utviklingen av nyresvikt i avansert leversykdom .
siden 2002 har funnene om sirkulasjonsdysfunksjon i leversykdom utviklet seg gjennom diagnostiske metoder, og understreker viktigheten av identifisering AV CCM i klinisk praksis . Det er imidlertid fortsatt et gap av kunnskap om håndtering av denne tilstanden . Tilstedeværelsen av myokarddysfunksjon i cirrhose øker risikoen for hepatorrenal syndrom (HRS) og uønskede hjertehendelser, og det er relatert til høyere dødelighet .
Vi gjennomgikk Den tilgjengelige litteraturen I PubMed angående markørene for cirrhosekomplikasjoner og samspillet mellom hjerte og lever. Formålet med denne gjennomgangen er å diskutere behovet for tidlig å spore OG behandle CCM, siden DET kan være en utløsende faktor for cirrhosekomplikasjoner, og dermed gi ny innsikt i klinisk praksis.
Definisjon og prevalens
CCM beskriver hjerte kronisk dysfunksjon hos cirrhotiske pasienter til tross for ingen tidligere strukturell hjertesykdom . Det er definert av ett eller flere av følgende: strukturelle abnormiteter i hjertekamrene; diastolisk dysfunksjon; normal eller forstørret systolisk funksjon i ro, men dårlig kontraktil respons på stress; og elektrofysiologiske endringer . Disse avvikene kan observeres hos opptil 50% av cirrhotiske pasienter .
Fysiopatologi
Cirrhose fysiopatologi er kjent ved overproduksjon av nitrogenoksid (NO) i splanchniske kar og påfølgende systemisk vasodilatasjon. Denne mekanismen utløser rennin-angiotensin-aldosteronsystemet (RAAS) og aktivering av sympatisk nervesystem og øker serumets vasopressinnivå, noe som fører til en hyperdinamisk tilstand som kan påvirke fra cellulær til klinisk setting.
disse pasientene har økt serumkarbonmonoksid (CO) sekundært til sympatisk hyperaktivitet og inflammatoriske cytokiner. DET er en økning I CO, assosiert med høye NO-nivåer, akkumulering av endokannabinoider og andre vasodilatorer. Disse stoffene øker cyklisk guanosinmonofosfat (cGMP) leves, som hemmer cyklisk adenosinmonofosfat (cAMP) i kardiomyocitter, ansvarlig for kalsiumtilstrømning og større kontraktil kraft (Figur 1,2). Analyse av myokardceller viser en reduksjon i plasmatisk membranfluiditet på grunn av kolesterolavsetning, noe som vanskeliggjør samspillet mellom stoffer som beta-adrenerge reseptorer og G-proteiner . Den ventrikulære myocitten kan også ha en reduksjon i kaliumkanalfunksjonen, noe som fører til en suboptimal hjerteavslapping og følgelig diastolisk dysfunksjon .
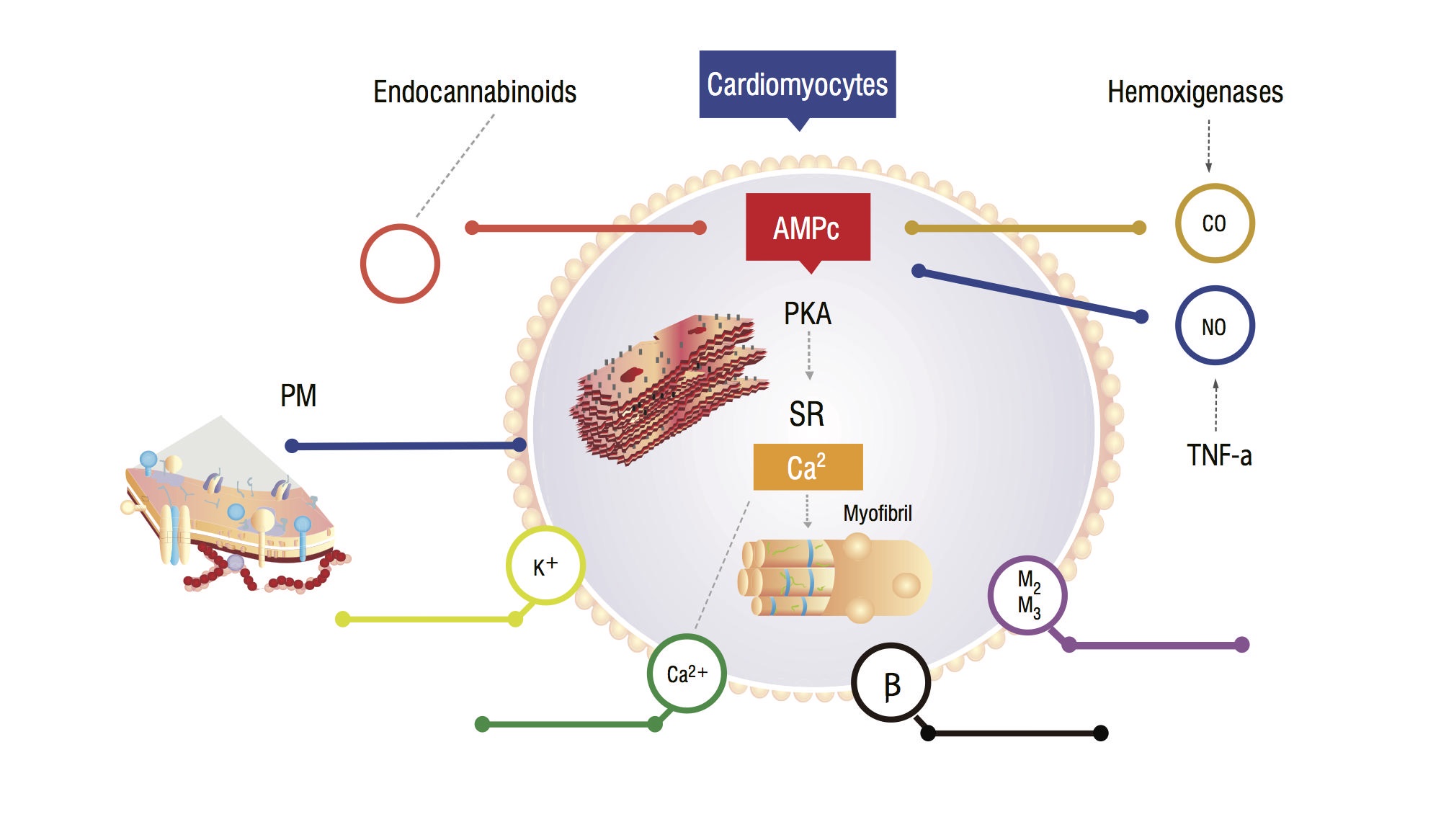
Figur 1. Fysiopatologisk modell av kardiomyocyt som viser hoved signalveier som fører til en blunded myokardial respons på stress. PM: Plasmamembran; CO: Karbonoksid; No: Nitrogenoksid; Tnf-a: Tumor nekrosefaktor alfa; SR: Sarkoplasmatisk retikullum; AMPc: Syklisk adenosinmonofosfat; Pka: Proteinkinase A.
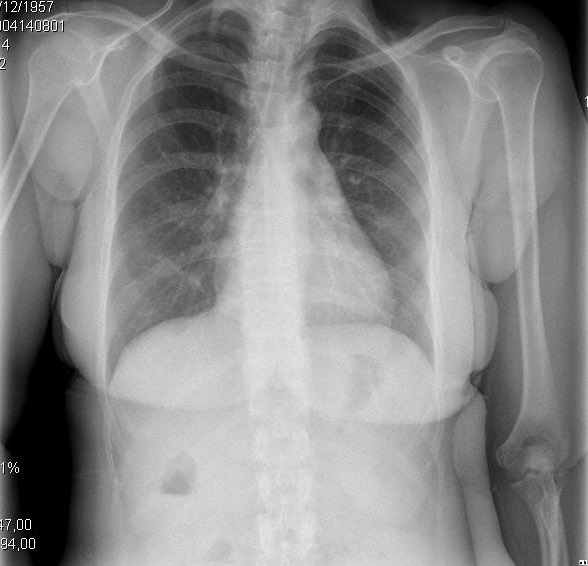
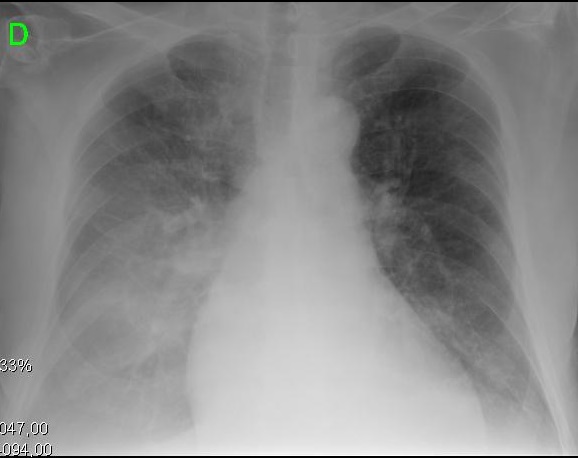
Figur 2. Kliniske og radiologiske presentasjoner av ulike evolusjonære stadier av cirrhotisk kardiomyopati. A. Venstre bilde viser liten pleural effusjon og CTI på 0,50. B. høyre bilde viser en alvorlig lunge lunger og CTI på 0,67.
Tabell 1. Kliniske og komplementære kriterier for DIAGNOSTISERING AV CCM. Tilpasset fra fra referanse 29 med tillatelse.
de vedvarende beta-adrenerge stimuli induserer nedregulering og reduserer hjerte-reseptorens tetthet, modifiserer signalkaskader som er ansvarlige for kalsiumkanalaktivering ; utfallet er en nedsatt kontraktil funksjon . Klinisk repercussion av denne banen er en stump myokardfunksjon og en økning i hjertebiomarkører .
Identifisering AV CCM er avhengig av subtile kliniske trekk som kan bli avslørt etter hvert som sykdommen utvikler seg, eller kan bli tydelig tydelig i spesifikke kliniske scenarier av belastning, og blir en utfordring med hensyn til om og når man skal behandle.
Naturhistorie og diagnose
Diagnostiske kriterier er oppsummert i tabell 1 og er avhengig av kliniske, bildediagnostiske og biomarkører.
Kliniske trekk
Kliniske trekk VED CCM kan forekomme hos pasienter med tilsynelatende normal hjertefunksjon, siden kronisk tilpasning av kardiomyocytten til cirrhotisk miljø fører til alle de cellulære modifikasjonene .
Cirrhotiske pasienter utvikler seg med natrium-og væskeretensjon, perifer vasodilatasjon, sympatisk hyperaktivitet og akkumulering av» miokardiotoksiske » stoffer som krever en adaptiv prosess av kardiomyocyt. Denne kontinuumbalansen kan brytes og avdekke latent hjertesvikt i stress situasjoner, for eksempel levertransplantasjon, transjugulær intrahepatisk portosystemisk shunt eller infeksjoner .
selv om cirrhotisk kardiomyopati har en tendens til å være en kronisk tilstand, viser studier at kliniske tegn på myokarddysfunksjon kan reversere i opptil 15 måneder etter vellykket levertransplantasjon, samt qt-forlengelsen .
Laboratoriefunn
siden hjertedysfunksjon kan reflekteres av inflammatoriske biomarkører, blir nye hjerte-og proinflammatoriske markører nylig studert og korrelert med utviklingen av komplikasjoner som fører til økt dødelighet .
Nyere studier beskriver korrelasjon mellom nivåer av prohormon AV ANP (proANP) og b-type natriuretisk peptid( BNP), copeptin og høysensitiv troponin T (hs-TnT), samt løselig urokinase-type plasminogenaktivatorreseptor (suPAR) og høysensitivt C-reaktivt protein (hs-CRP) og kardiovaskulære komplikasjoner ved cirrhose. Imidlertid blir den kliniske bruken fortsatt evaluert .
Natriuretisk peptid utskilles av kardiomyocytter som respons på volum-eller trykkoverbelastning, eller myokardisk iskemi, for å kompensere RAAS effekt i natrium-og vannbalanse . BNP kan være en av de mest tilgjengelige biomarkørene som muliggjør en tidlig anerkjennelse av hjerteinnblanding . Det er serumkonsentrasjonen er høyere jo mer alvorlig lever og hjertesykdommer .
Lovende studier sier at høye nivåer av adrenomedullin også ses i cirrhose med eller uten klinisk hjerteinnblanding; dette stoffet frigjøres i blodstrømmen for å fungere som en vasodilator og har som mål å redusere etterbelastning . Galektin-3, den siste studerte biomarkøren forhøyet hos cirrhotiske pasienter, har vært assosiert med myokardfibrose og kan korrelere med alvorlighetsgrad av cirrhose. Denne markøren viser seg å være mer følsom enn BNP i evalueringen av diastolisk dysfunksjon, men er mindre spesifikk .
Elektrokardiogram
Elektrokardiografiske (EKG) abnormiteter kan oppdages tidlig hos en asymptomatisk CCM-pasient og kan korrelere med ventrikulære arytmier og plutselig død . DET vanligste ekg-funnet er forlengelse AV qt-intervallet, som kan observeres hos ca. 30-40% av cirrhose-pasientene, hovedsakelig Child-Pugh B Eller C, uavhengig av cirrhose-etiologi .
DETTE EKG-mønsteret kan være sekundært til kardiomyocytter-repolariseringsavvik i kaliumkanaler og reduksjon i konsentrasjonen av disse kanalene i plasmamembranen, som respons på mindre endringer i portaltrykket . Ioniske kanaler dysfunksjoner forårsaker dermed myokardceller aksjonspotensial forlengelse, noe som resulterer i lengre ventrikulær systole og QT . Lengre sammentrekningstid innebærer nedsatt avslapning, forårsaker diastolisk dysfunksjon .
Elektromekanisk frakobling er beskrevet som en dyssynkroni mellom elektrisk stimulus og systolisk mekanisk respons i hjertet, som tar til progressivt tap av myokardfunksjon og kongestiv hjertesvikt hos disse pasientene1 . Den kronotropiske inkompetansen er preget av manglende evne til sinusnoden til å reagere på fysiologiske eller farmakologiske stimuli, et determinant faktum I CCM fysiopatologi. Disse endringene er også sekundære til portalhypertensjon, autonom dysfunksjon, hyperdynamisk sirkulasjon og tilstedeværelsen av proinflammatoriske faktorer som påvirker pasientens myokard .
Ekkokardiogram
Ekkokardiogram gir relevante data om hjertefunksjonen og brukes som diagnostiske kriterier for cirrhotisk kardiomyopati .
hovedfunnene hos disse pasientene er endediastolisk venstre ventrikkel (LV) forstørrelse, reduksjon av topphastighet og systolisk deformitetshastighet; økt endediastolisk venstre ventrikulært trykk, uten passende LVEF-ekspansjon. Venstre atrium (LA) utvidelse i mer enn 34 mL / m2 kan tyde på kronisk diastolisk dysfunksjon, og når det er forbundet med reduksjon AV LV-masse, kan det tyde på verre prognose . LA evaluering kan gjøres gjennom to dimensjon ekkokardiografi og speckle sporing .
Vanlige funn observert i hjertedoppler ekkokardiografi indikerer myokardial avslapning svekket hos cirrhotiske pasienter: reduksjon Av e / a ratio (< 1), og forlenget E – bølge retardasjon tid (DT) og isovolumetrisk avslapping tid (IVRT) > 80ms.Jo mer alvorlig er diastolisk dysfunksjon, kortere ER IVRT og mitral DT, og høyere Er e / A-hastighetsforholdet, karakteriserer avansert diastolisk dysfunksjon, økt LA-trykk og verre funksjonsklasse.
Nyere studier med global longitudinell stamme (GLS) evaluering viser at dette kan være en nyttig metode for tidlig påvisning av hjertedysfunksjon hos cirrhotisk pasient, hovedsakelig systolisk dysfunksjon i ro .
e / a-forhold kan være en pålitelig parameter i diagnosen diastolisk dysfunksjon hos cirrhotiske pasienter, selv med verdier påvirket av graden av hydrering av pasienten, selv om den kan variere på grunn av ascites og volumoverbelastning . I mellomtiden representerer isovolumetrisk avslapningstid, selv om den er svært følsom, ikke LV-fyllingen og varierer ettersom hjertefrekvensen endres .
en mild systolisk dysfunksjon og en diastolisk dysfunksjon kan presenteres uavhengig av graden av cirrhose. Imidlertid er den diastoliske dysfunksjonen funnet oftest hos cirrhotiske pasienter og går generelt foran den tidligere .
Diskusjon
denne gjennomgangen tar for seg en økende identifikasjon og forståelse av fysiopatologi PÅ CCM, det er korrelasjon med dårlig prognose hos cirrhotiske pasienter og oppstår bekymring om terapeutisk tilnærming.
denne artikkelen oppsummerte de diagnostiske kriteriene (Tabell 1) som allerede er etablert i medisinsk litteratur, med vekt på de nye biomarkørene som er studert for diagnostisk komplementering. Studier har vist at myokarddysfunksjon eksisterer i ulike stadier av levercirrhose. Det har blitt beskrevet at hvis pasienten har høy BNP og ventrikulær dysfunksjon på ekkokardiogrammet, er behandling av nyresvikt svært vanskelig; på den annen side er tidlig inngrep hos pasienter som ennå ikke har etablert hjertesykdom et område som ennå ikke er utforsket.
Tabell 1. Kliniske og komplementære kriterier for DIAGNOSTISERING AV CCM. Tilpasset fra fra referanse 29 med tillatelse.
Kliniske trekk
ingen kardiopulmonale symptomer ved hvile
Lav funksjonell hjertereserve
Hiperadrenerg tilstand med natrium-og væskeretensjon
Biomarkører (troponin I, pro-bnp og bnp, andre)
Eletrokardiografi
Elektrofysiologiske abnormiteter (qt-forlengelse og andre)
Ekkokardiografiske kriterier
Diastolisk evaluering
e / a-forhold < 1.0 (alder korrigert)
Langvarig isovolumisk avslapningstid (> 80msec)
Forlenget retardasjonstid (> 200msec)
venstre ventrikulær hypertrofi
Systolisk evaluering
Ejeksjonsfraksjon i ro < 55%
Kontraktile underskudd i stress
tegn og symptomer på leversvikt tendens til å være sent, med subtile kliniske og laboratorie manifestasjoner, noen ganger vanskelig å tolke. Spesialisten, eller til og med legen, kan møte en pasient med dyspnøklage, uten patologisk jugulær hevelse, normale innledende kardiologiske eksamener, men med høy BNP, som kan representere ET tilfelle AV CCM.
i motsetning til andre studier foreslår vår gruppe et fremskritt på dette feltet, siden forståelsen av hjertesykdom samtidig med cirrhose kan tillate en tidlig terapeutisk inngrep av komplikasjoner som kan tilskrives udiagnostisert myokardfeil. Levertransplantasjon og TIPS er spesielle kliniske innstillinger som kan deflagrate hjertesvikt hos disse pasientene. Etter hvert som pasientene overlever lenger etter disse prosedyrene, vil klinikere bli utsatt for forverrede hjerteparametere .
vi tror at tidlig terapeutisk intervensjon I CCM er lovende, når det manifesteres av komplikasjoner som ildfaste TIMER, før det presenteres klart lungebelastning som kan tilskrives myokardfeil. Litteratur støtter at situasjoner med fysisk eller farmakologisk stress, eller infeksjoner, forbundet med latent cirrhotisk kardiomyopati, kan føre TIL HRS, som kan være ildfast mot konvensjonelle behandlinger og forbundet med verre prognose hvis systolisk dysfunksjon er tilstede .
vår erfaring tyder på at presentasjon AV HRS er et ledd for å starte behandlingen av myokardkomponenten. Denne utviklingen TIL TIMER forstås siden EKSISTENSEN AV CCM er en utløsende og vedvarende faktor AV TIMER, så HVIS CCM nærmer seg tidlig i denne sammenheng, KAN TIMER ha en bedre prognose .
vår gruppe har vært en pioner i behandlingen av pasienter med en klinisk DIAGNOSE AV CCM i progresjon TIL shr refraktær til konvensjonelle behandlinger, der bruk av dobutamin som redningsterapi for nyrefunksjon var vellykket. Målet er å anvende denne teoretiske kunnskapen i påvente av denne komplikasjonen hos pasienter med leversykdom i sluttstadiet .
Til Tross for å være godt forstått, er det mangel på kunnskap til en skikkelig praktisk anvendelse. EN høy grad av klinisk mistanke er nødvendig for å gjenkjenne CCM hos den asymptomatiske pasienten uten tilsynelatende funksjonelle begrensninger, men med subklinisk cellulær og strukturell hjertesykdom.
Studier er nødvendig for å identifisere potensielle behandlinger som endrer den naturlige historien til hjertesykdom hos cirrhotiske pasienter, spesielt i faser der pasientene er asymptomatiske. Dette representerer et kunnskapsområde som ennå ikke er utforsket, spesielt om fremtidige terapeutiske alternativer.
Interessekonflikter
forfatterne erklærte at det ikke er noen interessekonflikter angående publisering av dette papiret.
Økonomisk støtte
Ingen.
- Sampaio F, Pimenta J (2016) Venstre ventrikulær funksjonsvurdering i cirrhose: Nåværende metoder og fremtidige retninger. Verden J Gastroenterol 22: 112-125.
- Shin WJ, Sang JG, Jun IG, Måne YJ, Kwon HM, Et al. (2016) Effekt av ventrikulo-arteriell kobling på transplantasjonsutfall i cirrhotics: Analyse av trykkvolumkurveforhold. J Hepatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, Et al. (2016) Diastolisk Dysfunksjon I Levercirrhose: Prognostisk Prediktor I Levertransplantasjon? Transplantasjon Proc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, Et al. (2016) Overlevelse ved 2 år blant levercirrhotiske pasienter påvirkes av venstre atrialvolum og venstre ventrikulær masse. Lever Int.
- Mø S, Henriksen JH (2002 )Cirrhotisk kardiomyopati: en patofysiologisk gjennomgang av sirkulasjonsdysfunksjon ved leversykdom. Hjerte 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, Et al. (2016) Cirrhotisk Kardiomyopati: Et Annet Tilfelle Av En Vellykket Tilnærming Til Behandling Av Hepatorenal Syndrom. Sak Rep Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) et perspektiv på cirrhotisk kardiomyopati. Transplantasjon Proc 43: 1649-1653.
- Ma Z, Lee SS( 1996) Cirrhotisk kardiomyopati: komme til hjertet av saken. Hepatologi 24: 451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, Et al. (2010) Cirrhotisk kardiomyopati. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) Cirrhotisk kardiomyopati og levertransplantasjon. Lever Transpl 6: S44-52.
- Wiese S, Mortensen C, Gø Jp, Christensen E, Andersen O, Et al. (2014) Hjerte-og proinflammatoriske markører forutsier prognose ved cirrhose. Lever Int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) Evaluering av hjertefunksjoner hos cirrhotiske barn ved hjelp av serum hjerne natriuretisk peptid og vev Doppler imaging. Ann Pediatr Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) Cirrhotisk kardiomyopati?: Implikasjoner for perioperativ styring av levertransplanterte pasienter 7: 507-20.
- Farr M, Schulze PC (2015) Nylige Fremskritt I Diagnose og Behandling av Cirrhose-Assosiert Kardiomyopati Hos Levertransplantasjonskandidater: Avansert Ekkoavbildning, Hjertebiomarkører og Avansert Hjertesviktbehandling. Clin Med Insights Cardiol 8: 67-74.
- Licata A, Corrao S, Petta S, Genco C, Cardillo M, et al. (2013) nt pro BNP plasmanivå og atriell volum er knyttet til alvorlighetsgraden av levercirrhose. PLoS En 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactin – 3 og hjerne natriuretisk peptid versus konvensjonell ekkokardiografi ved tidlig påvisning av cirrhotisk kardiomyopati. Turk J Gastroenterol 27: 367-74.
- Wong F, Siu S, Liu P ,Blendis lm (2001) hjerne natriuretisk peptid: er Det en prediktor for kardiomyopati i cirrhose? Clin Sci (Lond) 101: 621-628.
- Wong F (2009) Cirrhotisk kardiomyopati. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, Et al. (2003) Forlengelse Av QTc-intervallet hos pasienter med cirrhose. Ann Gastroenterol 16: 155-8.
- Mozos I (2015) Arytmi risiko i levercirrhose. Verden J Hepatol 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, Et al. (2016) Cirrhotisk Kardiomyopati: Et Annet Tilfelle Av En Vellykket Tilnærming Til Behandling Av Hepatorenal Syndrom. Sak Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) QT-spredning: Måling og tolkning.
- Pá A, Czifra A, Vit@lis Z, Papp M, Paragh G, et al. (2014) Patofysiologisk og klinisk tilnærming til cirrhotisk kardiomyopati. J Gastrointestin Lever Dis 23: 301-310.
- Castro Hevia J, Antzelevitch C, Reveté Iá F, Dorantes S Hryvnchez M, Dortiskeó Balea F, et al. (2006) tpeak-Tend og tpeak-Tend dispersjon som risikofaktorer for ventrikulær takykardi / ventrikulær fibrillering hos pasienter med Brugada-syndromet. J Am Coll Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) Evaluering Av tp-e-intervall Og tp-e/QT-forhold hos pasienter med kronisk hepatitt B. Praha Med Rep 114: 239-245.
- Jewell Dp (2006) Nye pasienter, nye leksjoner, ny tenkning i inflammatorisk tarmsykdom: World Congress Of Gastroenterology Symposium, Montreal, Canada. Kolorektal Dis 8 Tillegg 1 (s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) Cirrhotisk kardiomyopati: en kardiologs perspektiv. Verden J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) Cirrhotisk kardiomyopati: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.