- Introduksjon
- Resultater
- Dbh-Cre Driver Merker Og Er Begrenset TIL Th-Uttrykke Noradrenerge Regioner I Hjernestammen Som Er Hemmet AV Cno Administrasjon
- CNO-hM4D-Mediert Forstyrrelse Av Noradrenerge Nevroner Hos Voksne Mus
- CNO-hM4D Forstyrrelse AV Dbh-Cre-Nevroner Resulterer I Et Hyperkapnisk Underskudd
- Tilvente Søskenkontroller Injisert med 10 mg/kg CNO Viste Et Hyperkapnisk Ventilasjonsunderskudd
- Habituerte Og Uhabituerte Villtype-Dyr Injisert Med Saltvann Viste Ingen Endringer Presaline Og Postsaline
- Klozapin Til CNO Konsentrasjonsforhold Er Høyere I Hjernen Enn I Serum
- Diskusjon
- Materialer Og Metoder
- Etisk Godkjenning
- Avl, Genetisk Bakgrunn Og Vedlikehold Av Mus
- Histologi
- Elektrofysiologi
- Plethysmografi
- Væskekromatografi-Massespektrometri
- Datainnsamling Og Analyse
- Plethysmografi
- Statistikk
- Plethysmografi
- Væskekromatografi-Massespektrometri
- Etikkerklæring
- Forfatterbidrag
- Finansiering
- Interessekonflikt
- Takk
Introduksjon
nevrale nettverk som ligger til grunn for respiratorisk chemosensory refleks er et primært mål for å forstå etiologien til flere atferdsmessige og fysiologiske lidelser. Perturbed chemosensory reflekser er antatt å spille en rolle i både medfødte og voksne lidelser, inkludert Plutselig Barnedødssyndrom (SIDS), Medfødt Sentral Hypoventilasjonssyndrom (CCHS), sentrale søvnapneaer, unormal pust I Rett Syndrom Og fedme hypoventilasjonssyndrom (Obonai et al., 1998; Odd et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi et al., 2013). Under den falske kvelningsalarmhypotesen antas upassende kjemosensorisk aktivering eller overfølsomhet å spille en rolle i undergrupper av pasienter som lider av panikklidelse (Klein, 1993). Kjemosensorisk dysfunksjon kan også spille en rolle i nevrodegenerative sykdommer gjennom søvnforstyrret pust som er forbundet med akselerert progresjon (Hakim et al., 2012; Verbraecken Og McNicholas, 2013; Bahia Og Pereira, 2015; Snyder et al., 2017). Dermed vil en bedre forståelse av hjernestammen kjemosensoriske nettverk gi viktige ledetråder til en rekke atferdsmessige og fysiologiske patologier.
Farmakogenetiske designer reseptorer utelukkende aktivert av designer narkotika (DREADDs) (Armbruster et al., 2007) har vært ansatt i en rekke studier for å kartlegge nevrale populasjoner i luftveiene chemoreflex (puste respons på forhøyede blod CO2 nivåer). DREADD-teknologi i kombinasjon med interseksjonell genetisk distribusjon har blitt brukt til å stille svært målrettede nevronpopulasjoner mens man observerer respiratorisk funksjon i bevisste og uhemmet mus av laboratoriet vårt og andre, og unngår mange forvirringer fra tidligere kretskartleggingsmetoder (Ray et al ., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sol Og Ray, 2017; Sol et al., 2017). Disse og de fleste andre studier nesten alltid inkludert CNO bare ikke-DREADD uttrykke søsken kontroller som viste ingen chemosensory eller andre respiratoriske effekter, og hevder AT CNO hadde ingen off-target effekter på å puste i bevisste og uhemmet mus til tross for den høye dosen som brukes, 10 mg / kg. Ikke desto mindre ble DET funnet i flere andre studier at CNO og dets tilbake metabolisme produkter kunne ha off-target effekter på atferd og bevegelse i en rekke analyser, men respiratorisk utgang ble ikke adressert (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Jørgen et al., 2017; Ilg et al., 2018; Mahler og Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez Og Knackstedt, 2018). DET ble også vist AT CNO og dets metabolitter ikke er ekvivalent fordelt mellom sirkulasjonssystemet og hjernen (Gomez et al., 2017).
en annen, uadressert bekymring oppstår fra stress indusert av den eksperimentelle paradigme, inkludert å holde dyr i en helkropps barometrisk plethysmography kammer, håndtering, intra-peritoneal injeksjon, og rektal temperaturmålinger. I tidligere DREADD respiratoriske studier ble naï mus introdusert i et lite kammer (140-400 mls)og tillatt å akklimatisere 20-40 min før datainnsamling (Ray et al ., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sol Og Ray, 2017; Sol et al., 2017). Det er imidlertid ikke klart om denne tiden er tilstrekkelig til å minimere stressinduserte respiratoriske endringer som kan virke som en interaksjonsfaktor med effekten av klozapin.
i våre studier for å undersøke NORADRENERGE (NA) – systemets rolle i respirasjonskontroll, søkte vi å benytte den veletablerte RC::P_hM4D DREADD allel (Ray et al., 2011) for å teste ROLLEN TIL NA-nevroner i baseline og hyperkapnisk respirasjon hos uhemmet voksne dyr ved hjelp av helkroppsplethysmografi. Fordi noradrenalin og NA nevroner er også kjent for å spille en sentral rolle i stressresponser (Valentino Og Van Bockstaele, 2008; Chen Et al., 2018), gjennomførte vi en rekke studier for å sammenligne omfattende habituation (flere eksponeringer til det eksperimentelle paradigmet hvor dyret lærer at opplevelsen ikke er truende eller overlevende) og høy vs. lav (1 mg/kg) cno doser med tidligere publiserte DREADD protokoller (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sol Og Ray, 2017; Sol et al., 2017). Her viser vi for første gang at høye systemiske doser AV CNO er i stand til å fremkalle off-target effekter på en autonom respiratorisk funksjon hos bevisste mus. Vi avslører også at off-target effekten AV CNO på chemosensory respiratory output er effektivt avslørt av omfattende habituation og ville derfor ikke være tydelig i tidligere cno kontroll studier som ikke tilvenne dyr før respirasjonsmåling, utnytte bare en kort akklimatisering periode før datainnsamling. Sammen tyder disse resultatene på at tidligere kartlagte nevronpopulasjoner indirekte kan påvirke respiratorisk kontroll gjennom potensielle roller i å regulere stressresponser. Spesielt samsvarer disse dataene med nyere rapporter som tyder på AT CNO ikke er biologisk inert ved høye doser via metabolsk konvertering til klozapin (MacLaren et al., 2016; Jørgen et al., 2017) og at off-target atferdsmessige effekter kan manifestere seg ikke bare fra forstyrrelse av atferdskretser, men også fra forstyrrelser til underliggende autonome kretser og homeostase.
Resultater
Dbh-Cre Driver Merker Og Er Begrenset TIL Th-Uttrykke Noradrenerge Regioner I Hjernestammen Som Er Hemmet AV Cno Administrasjon
for å undersøke uttrykk og spesifisitet AV DBH-Cre linje, vi brukte en enkelt rekombinase avl ordningen (Figur 1a) der vi krysset sjåføren Til Ai9 linje (Madisen et al ., 2010), som uttrykker en floxed tdTomato. Farging med et tyrosinhydroksylase (TH) antistoff viste at ekspresjonen av tdtomat i hjernestammen var begrenset TIL th-uttrykksregioner, inkludert locus coeruleus, a5, A1, A2, A7, SubCV og SubCD kjerner som forventet (Figur 1b). For å bekrefte AT NA-nevroner som uttrykker hM4D-reseptoren, var lydhør overfor CNO, utførte vi opptak på locus coeruleus (LC) – nevroner, hvor vi observerte en inhibering av nevronfyring ved CNO-badapplikasjon (n = 3, Figur 1C).
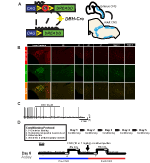
Figur 1. Avl skjematiske og respiratoriske protokoller. RC::P_hm4d allel kombineres med en dopamin-beta-hydroksylase (DBH)-Cre-linje for å oppnå cellespesifikt ekspresjon av hM4D-reseptoren i noradrenerge (NA) nevroner (A). Fluorescerende uttrykk for tdTomato I DBH-Cre; ai9 koronale hjerneseksjoner co-uttrykker med tyrosin-hydroksylase (TH) i hjernestammen NA kjerner (B). I skive opptak AV NA locus coeruleus før OG etter cno søknad, demonstrere DREADD reseptor funksjonalitet i målrettede nevroner (C). Åndedrettsprotokoll. Habituated mus blir utsatt for en 5-dagers habituated protokoll bestående av håndtering, rektal sonde temperaturmåling, saltinjeksjon og eksponering for plethysmography chamber. På den sjette dagen, både habituated og unhabituated mus under en hyperkapnisk analyse hvor dyret er plassert i luftveiene og tillatt å akklimatisere under baseline romluftforhold. Dyret blir deretter utsatt for 20 min 5% CO2 etterfulgt av 20 min romluft. Dyret injiseres deretter intraperitonealt med CNO eller saltvann, etterfulgt av ytterligere 20 minutter med romluft etter injeksjon, 20 minutter med 5% CO2 og 20 minutter med romluft. Åpne bokser avgrense datainnsamlingstider (D).
CNO-hM4D-Mediert Forstyrrelse Av Noradrenerge Nevroner Hos Voksne Mus
for å undersøke ROLLEN TIL NA-nevroner under baseline og hyperkapnisk respirasjon, brukte VI rc:P_hM4D-hemmende DREADD-system krysset MED dbh-Cre-driveren. Ved hjelp av hele kroppen plethysmography (Ray et al., 2011), målte vi ventilasjonsresponsen hos uhemmet voksne dyr under romluft (21% O2/79% N2) og hyperkapniske (5% CO2/21% O2/74% N2) forhold før Og etter CNO administrasjon (Figur 1d). For å håndtere CNO-dosering og potensielt stress indusert av vår eksperimentelle design, ble dyr utsatt for en av fire tilstander: (1) unhabituated og injisert med 10 mg/kg CNO; (2) habituated og injisert med 10 mg/kg CNO; (3) unhabituated og injisert med 1 mg/kg CNO; eller (4) habituated og injisert med 1 mg/kg CNO. Habituation besto av en 5-dagers prosess som innebar håndtering, rektal temperaturprobe, saltinjeksjon og eksponering for plethysmografikammeret hver dag i 30 min, mens naï dyr bare ble utsatt for en 20-45 min kammerakklimateringsperiode umiddelbart før datainnsamling som gjort i tidligere studier (Ray et al ., 2011, 2013; Brust et al., 2014; Hennessy et al., 2017; Sol Og Ray, 2017; Sol et al., 2017). Målte respirasjonsparametere inkluderte respirasjonsfrekvens RR, tidevannsvolum( VT), minuttventilasjon (VE), oksygenforbruk (VO2), minuttventilasjon normalisert til oksygenforbruk (VE/VO2), apnø-frekvens, sukk-frekvens og variasjonskoeffisienter for interbreatintervall og amplitude (periodisk og volumstabilitet). Som en ekstra kontroll sammenlignet vi også habituated og unhabituated wildtype dyr injisert med saltvann.
CNO-hM4D Forstyrrelse AV Dbh-Cre-Nevroner Resulterer I Et Hyperkapnisk Underskudd
under tre av betingelsene, DBH-Cre; RC::P_hm4d-dyr viste en reduksjon I VE og VE/VO2 etter ADMINISTRERING AV CNO, mens søskenkontroll viste ingen forskjeller i pre-og post-cno-verdier. Uhabiterte dyr injisert med 10 mg/kg CNO viste en signifikant redusert RR (-12,17%, p = 0,034) og VT (-30,87%, p = 0,0016), noe som resulterte I en reduksjon I VE (-38,64%, p = 0,0031) og en svak reduksjon I VO2 (-14,25%, p = 0,042) (Figur 2). Reduksjonen I VE var større enn reduksjonen I VO2, noe som resulterte i en samlet reduksjon I VE / VO2 (-26,89%, p = 0,0095). Uhabiterte dyr injisert med 1 mg/kg CNO viste en trend mot redusert RR (-12,88%, p = 0,066) og signifikant redusert VT (-16,52%, p = 0,00085) OG VE (-28,08%, p = 0,0070), noe som førte til en samlet reduksjon I VE/VO2 (-22,23%, p = 0,016) (Figur 3). Til slutt viste habituerte dyr injisert med 1 mg/kg CNO en redusert RR (-10,77%, p = 0,074), trend mot redusert VE (-25,07%, p = 0,074) og redusert TOTAL VE/VO2 (-23,70%, p = 0,024) (Figur 4). Ingen signifikante endringer i apnø frekvens, sukk frekvens, periodisk eller volum ustabilitet, eller temperatur ble sett i noen kohort.
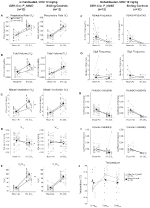
Figur 2. Unhabituated DBH-Cre; RC:: p_hm4d dyr administrert 10 mg/kg CNO viser et hyperkapnisk underskudd mens søsken kontroller viser ingen endring. Etter CNO administrasjon, DBH-Cre; RC::P_hm4d dyr viser ingen endring i romluftventilasjon og reduksjoner I RR (A), VT (B), VE (C), VO2 (D) og VE/VO2 (E) under hyperkapniske forhold uten endringer i apnefrekvens (F), sukkfrekvens (G), periodisk (H) eller volumstabilitet (I) og temperatur (J). Søsken kontroller viste ingen forskjell i alle pre – og post-CNO verdier.
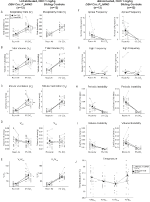
Figur 3. Unhabituated DBH-Cre; RC:: p_hm4d dyr administrert 1 mg/kg CNO viser et hyperkapnisk underskudd mens søsken kontroller viser ingen endring. Etter CNO administrasjon, DBH-Cre; RC::P_hm4d dyr viser ingen signifikant endring i romluftventilasjon eller RR (A) og viste reduksjoner I VT (B), VE (C) og VE/VO2 (E) under hyperkapniske forhold uten endringer I VO2 (D), apnefrekvens (F), sukkfrekvens (G), periodisk (H) eller volumstabilitet (I) og temperatur (J). Søsken kontroller viste ingen forskjell i alle pre – og post-CNO verdier.
Figur 4. Habituated DBH-Cre; RC:: p_hm4d dyr administrert 1 mg / kg CNO viser et hyperkapnisk underskudd mens søsken kontroller viser ingen endring. Etter CNO administrasjon, DBH-Cre; RC:: P_hM4D dyr viser ingen endring i romluftventilasjon og reduksjon I RR (A) og VE/VO2 (E) under hyperkapniske forhold uten signifikante endringer I VT (B),VE (C), VO2 (D), apnefrekvens (F), sukkfrekvens (G), periodisk (H) eller volumstabilitet (I) og temperatur (J). Søsken kontroller viste ingen forskjell i alle pre – og post-CNO verdier.
Tilvente Søskenkontroller Injisert med 10 mg/kg CNO Viste Et Hyperkapnisk Ventilasjonsunderskudd
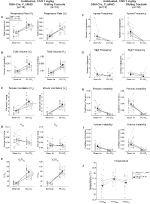
i BEGGE DBH-Cre; RC::P_hM4D og søsken kontroll habituated dyr injisert med 10 mg/kg CNO, merket vi en signifikant reduksjon I VE/VO2 (p = 0,0235) mediert av reduksjoner I RR (p = 0,00036) OG VE (p = 0,037) (Figur 5). I motsetning til de andre kohortene var DET imidlertid ingen forskjell MELLOM DBH-Cre; RC::P_hM4D og søsken kontrolldyr i disse parametrene: RR (-12,72 vs. -10,22%, p = 0,6268), VE (-24,88 vs. -23,94%, p = 0,4150) eller VE/VO2 (-15,4 vs. -22,55%, p = 0,4643).
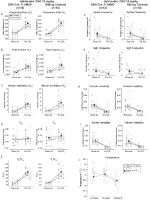
Figur 5. Begge habituated DBH-Cre; RC::P_hm4d dyr og søsken kontroller administrert 10 mg/kg AV CNO viser en hyperkapnisk underskudd. Etter CNO-administrasjon viser dbh-Cre; RC::P_hM4D dyr og søskenkontroller ingen endring i romluftventilasjon og reduksjon I RR (A), VE (C) og VE/VO2 (E) under hyperkapniske forhold uten signifikante endringer I VT (B), VO2 (D), apnefrekvens (F), sukkfrekvens (G), periodisk (H) eller volumstabilitet (I) og temperatur (J).
Habituerte Og Uhabituerte Villtype-Dyr Injisert Med Saltvann Viste Ingen Endringer Presaline Og Postsaline
selv om ingen fenotyper ble observert i kontroller injisert med 1 mg/kg CNO, tok vi opp muligheten for at injeksjonen selv forårsaket fenotypen observert i kontroller injisert med 10 mg/kg CNO ved å teste habituerte og uhabituerte villtype-dyr injisert med saltvann (Figur 6). I både habituated og unhabituated kohorter viste dyr ingen forskjell i respiratoriske parametere presaline og postsaline administrasjon. Ingen signifikante endringer i apnø frekvens, sukk frekvens, periodisk eller volum ustabilitet, eller temperatur ble sett.
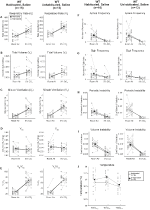
Figur 6. Både unhabituated og habituated wildtype dyr administrert saltvann viser ingen forskjell mellom før-og etter injeksjonsverdier. Etter administrering av saltvann viste både uhabiterte og tilvante villtyper ingen endringer under romluft eller hyperkapniske forhold i RR (A), VT (B), VE (C), VO2 (D), VE/VO2 (E), apnefrekvens (F), sukkfrekvens (G), periodisk (H) eller volumstabilitet (I) og temperatur (J).
Klozapin Til CNO Konsentrasjonsforhold Er Høyere I Hjernen Enn I Serum
for å bestemme biotilgjengeligheten AV CNO og klozapin, målte vi deres konsentrasjoner i serum og hjerne via massespektrometri. Tretti minutter etter en intraperitoneal injeksjon av CNO hos mus, er CNO funnet i lavere relativ overflod sammenlignet med sin tilbake-metabolitt klozapin i serum og hjerne for alle testede doser, 0,1 mg/kg (serum p = 0,0054, hjerne p = 0,0001) (Figur 7A), 1 mg/kg (serum p > 0,05, hjerne p = 0,0197) (Figur 7B), og 10 mg/kg (serum p = 0,0036, hjerne p = 0.0005) (Figur 7C). Når totale klozapin til CNO-forhold ble analysert, var de alltid over null og var høyere i hjernen enn i serum (kjøretøy p > 0,5, 0,1 mg / kg p > 0,5, 1 mg/kg p = 0,0018, 10 mg/kg p = 0,0160) (Figur 7D).
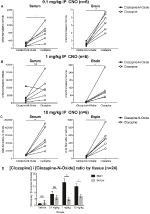
Figur 7. Klozapin til CNO konsentrasjonsforhold er høyere i hjernen enn i serum. Serum – og hjerneprøver ble samlet fra villtype-mus 30 min etter ADMINISTRERING AV CNO ved 3 forskjellige doser 0,1 mg/kg (A), 1 mg/kg (B), 10 mg/kg (C). Individuelle datapunkter representerer den relative mengden av klozapin-N-oksid eller klozapin oppnådd VED LC-MS. Klozapin til CNO-forhold for hver dose, OG SEM er også vist (D).
Diskusjon
det opprinnelige målet med denne studien var å undersøke ROLLEN TIL DBH-Cre-nevroner i respiratorisk fysiologi etter akutt forstyrrelse hos uhemmet og bevisste voksne dyr. Fordi noradrenalin og NA-nevroner spiller en veldokumentert rolle i stressadferd (Valentino Og Van Bockstaele, 2008; Chen Et al., 2018), søkte vi også å undersøke om habituering til en sannsynlig stressende fysiologisk protokoll ville ha en effekt på respiratoriske fenotyper som tidligere ble observert. I hele kroppen PLETHYSMOGRAPHY DREADDPROTOKOLL som brukes i vårt laboratorium og andre, håndteres dyr, rektalt probed for temperatur, utsatt for et nytt miljø (plethysmography chamber) og intraperitonealt injisert. Tidligere studier har vist at håndtering og habituation til injeksjon og andre «rutinemessige» prosedyrer kan endre atferdsmessige og fysiologiske parametere, inkludert respirasjon (Misslin et al ., 1982; Andrews og Fil, 1993; Lapin, 1995; Ryabinin et al., 1999). Andre anvendte stressorer modifiserer også respirasjon under både baseline og hyperkapniske ventilatoriske forhold (Isom og Elshowihy, 1982; Kinkead et al., 2001).
i våre studier ved bruk av høye doser CNO, fant vi at hM4D-mediert hemming AV dbh-Cre-definerte NA-nevroner resulterte i redusert hyperkapnisk refleks I VE/VO2 i fire definerte eksperimentelle kohorter, med redusert RR, VT og VE, som støtter tidligere studier (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et al., 2010). Habituated søsken kontroller gitt en 10 mg/kg DOSE AV CNO brukt i tidligere respiratoriske studier viste imidlertid et ventilasjonsunderskudd under hyperkapniske forhold av samme størrelsesorden som sett I dbh-Cre; RC::P_hM4D dyr. Ingen andre kontrollgrupper av søsken viste denne fenotypen, inkludert den habituerte kohorten som kun fikk (1 mg/kg CNO) eller saltvann. Disse resultatene tyder på at høyere CNO-doser (10 mg / kg) har en effekt på hyperkapnisk respons som ikke maskeres etter utstrakt tilvenning, samtidig som det formodentlig reduserer stressnivået hos dyr, og at lavere cno-doser ikke har noen effekt på respirasjonskontroll hos tilvente dyr. Disse utfallene er også i samsvar med Arbeid Fra Korsak m.fl. who viste at lavdose CNO (2 mg / kg)ikke gir off-target effekter i arbeidskapasitet i en treningsanalyse som inkluderte tidligere trening (Korsak et al.(2018) Og Fleury Curado et al. who viste ingen lavdose CNO (1 mg/kg) spesifikke effekter på respiratorisk utgang (Fleury Curado et al., 2018).
den økte ratio av klozapin til CNO nivåer i serum og i hjernen (Figur 7) er i samsvar med nyere studier som tyder på AT CNO er lett tilbake metaboliseres til klozapin og viser større hjerne permeabilitet i forhold TIL CNO i mus og andre steder (Jann et al., 1994; Chang et al., 1998; Guettier et al., 2009; Jørgen et al., 2017; Jørgen et al., 2017). Det er imidlertid ikke klart om de observerte off-target-effektene skyldes CNO eller klozapin. Siden våre hyperkapniske målinger skjedde <30 min etter CNO-påføring, er det sannsynlig at de ikke-målte respiratoriske effektene er mediert av klozapin. Våre resultater (Figur 7) viser høye relative nivåer av klozapin i hjernen, selv OM CNO ikke er helt fraværende. Huckstepp og kollegaer brukte imidlertid direkte CNO-applikasjon til ventral medulla hos bedøvede rotter for å demonstrere at BARE ved romluft, og ikke under hyperkapniske eller hypoksiske utfordringer, HAR CNO-applikasjon en liten effekt, økende frekvens og avtagende ekspiratorisk varighet, men forlater VT uendret, uten klar effekt observert under hyperkapnia(Huckstepp et al ., 2015). Gitt den direkte applikasjonen i bedøvede rotter og tidsramme for eksperimenter, er det sannsynlig at de små off-target-effektene som ble sett, ble mediert AV CNO og ikke av klozapin.
tilbakemetabolitten klozapin er et vanlig sedativ og antipsykotisk legemiddel ved schizofreni med mange endogene mål, inkludert antagonistiske effekter med lav høy affinitet ved d1 -, D2-og d4-dopaminergreceptorer, 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 og 5-HT7 serotonergreceptorer, h1-histaminreseptorer og α1 og α2 adrenerge reseptorer, blant andre (Fitton and Heel, 1990; Ashby and Wang, (1996). Off-target effekter sett her kan skyldes forskjellige eller kombinerte mekanismer og mål. Klozapin kan påvirke respirasjonen som et beroligende middel. En tidligere studie viste redusert RR og VT under 5 og 10% CO2 under både langsom bølgesøvn og rask øyebevegelses søvntilstander sammenlignet med den stille våken tilstand hos mus (Nakamura et al., 2007). Alternativt kan inhibering av målrettede DREADD-uttrykkende nevroner resultere i en antianxiogen eller anxiolytisk effekt som ligner på vår habituation-protokoll for å avsløre CNO/clozapin-medierte kjemosensoriske off-target-effekter. Begge forklaringene støttes av flere studier som har vist AT CO2 spiller en rolle i medfødte og lærte fryktresponser og angstrelatert atferd (Ziemann et al., 2009; Jørgen et al., 2013; Taugher et al., 2014; H. Et al., 2015; Vinter et al., 2017). Dermed kan nevroner målrettet i noen av disse studiene faktisk spille en rolle i å drive anxiogene atferdsresponser i stedet for fysiologiske kjemosensoriske reflekser, da både katekolaminerge og serotonerge systemer er involvert i frykt/angstadferd og kjemosensorisk homeostase (Brust et al., 2014; Hennessy et al., 2017).
Omvendt kan de kjemosensoriske fenotypene observert med høye CNO-nivåer være ekte, da vi var i stand til å rekapitulere DET NA-medierte hyperkapniske underskuddet ved cno-doser, en størrelsesorden lavere i habituated mus, mens kontrollgrupper viste ingen CNO-effekt. Imidlertid er fullstendige sammenligninger på tvers av tidligere studier vanskelige på grunn av mangel på rapporterte VO2 -, VT -, RR-og VE/VO2-data. For eksempel kan endringer i kroppstemperatur eller metabolisk hastighet også påvirke respirasjons-og kjemosensorisk utgang på en rekke måter, og at plethysmografkammertemperaturer var svært forskjellige i noen tilfeller (34 vs. 30°C i våre studier), som påvirker det dynamiske området til den barometriske komponenten av bølgeformen og dermed tidevannsvolumet. Spesielt så vi ingen merkbare endringer i respiratoriske bølgeformegenskaper i noen av våre forhold eller akutt kardio-respiratorisk stans som ble observert i våre tidligere høye doser, hele rhombomere studier (Sun et al., 2017).
våre resultater viser for første gang At CNO har en uventet effekt på hyperkapnisk kjemosensorisk refleks som er avslørt av omfattende habituation. Viktigere, til tross for høye nivåer, EN CNO off-target effekt hadde tidligere blitt utelukket på grunn av mangel på fenotype i søsken kontroller, men som vi viser blir klart ved tilvenning. Vi tilbyr en off-target karakterisering AV CNO i musemodellsystemet for å utfylle studier i rotte og ikke-menneskelige primater. Resultatene her øker muligheten for at ytterligere CNO-medierte, off-target-effekter på kretsene under studien eller til autonome eller homeostatiske kretser kan eksistere, men kan maskeres i andre kontrollerte eksperimenter. Det er viktig at disse dataene viser at etterforskere bør streve for å bruke de minimale dosene av aktiverende ligand som er mulig i kombinasjon med høye nivåer av habituation, og at de riktige kontrollene må inkluderes i kjemiske genetiske manipulasjoner for å fullt ut sette pris på og tolke eksperimentelle data.
Materialer Og Metoder
Etisk Godkjenning
Studier ble godkjent Av Baylor College Of Medicine Institutional Animal Care And Use Committee under protokoll AN-6171.
Avl, Genetisk Bakgrunn Og Vedlikehold Av Mus
vi opprettholdt kolonier av alle våre heterozygote musestammer ved å krysse TIL C57BL/6J mus og homozygote stammer ved søskenkors. For histologiske eksperimenter BLE DBH-Cremice parret med den homozygote ai9-musen (Madisen et al., 2010) (JAX 007909). For plethysmografi eksperimenter, DBH-Cre mus ble parret med homozygot RC:: P_hM4D (Ray et al., 2011) mus for å utlede dyr, hvor alle musene bar RC:: P_hM4D allelet. Søsken dyr som ikke arvet Cre allelet ble brukt som kontroll dyr Til Cre positive avkom. Rosa26 spesifikke primere For Ai9, RC:: P_hM4D, OG RC:: ePe mus var 5 ‘- GCACTTGCTCTCTCCCAAAGTC, 5 ‘- GGGCGTACTTGGCATATGAT, og 5 ‘ – CTTTAAGCCTGCCCAGAAGA og gi en 495 bp band (målrettet) og 330 bp band (wt). Cre-spesifikke primere for alle rhombomere Cre-drivere var 5′-ATCGCCCATCTTCCAGCAGGCGCCC og 5’ – GCATTTCTGGGGATTGCTTA og ga et 550 bp-bånd hvis det var positivt. FOR lc-MS-eksperimenter ble c57bl / 6J-mus oppnådd Fra Senter For Sammenlignende Medisin (CCM), Baylor College Of Medicine.
Histologi
Fire til åtte uker GAMLE DBH-Cre; Ai9 voksne mus ble transkardialt perfusert med 0,1 m fosfatbufret saltvann (PBS) og deretter med 4% paraformaldehyd (PFA) I PBS. Hjerner ble dissekert ut og slippe fast for 2 h i 4% PFA før EN PBS skylling og likevekt i 20% sukrose I PBS. Hjerner ble deretter delt inn i 30 µ seksjoner, montert på lysbilder og merket med immunfluorescerende antistoffer. Vi farget over natten med anti-tyrosinhydroksylase antistoff for å identifisere katekolaminerge nevroner (1:1,000, Millipore AB152) etterfulgt av 2 timer med esel anti-kanin Cy3 sekundær (1:500, Jackson 711-165-152) i 0,1% Triton-X I PBS (PBST) med 5% eselserum. Bilder ble samlet på Et Zeiss oppreist epifluorescent mikroskop.
Elektrofysiologi
Horisontale hjerneskiver som inneholdt locus coeruleus (300 µ) ble kuttet med en vibratome (Leica VT 1000S, Leica Microsystems, Buffalo Grove, IL) fra voksne DBH-Cre; RR2P; RC::ePe-mus (~1 måned gammel) i 4°C kunstig cerebrospinalvæske (ACSF). Skivene ble nedsenket i et kammer perfusert MED oksygenert ACSF (95% O2 og 5% CO2) som inneholdt i mM: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NAHCO3 og 10 glukose (2-3 ml/min). Hele celleopptak ble utført ved 30°C ved bruk av konvensjonelle patch-klemme teknikker og En MultiClamp 700b forsterker (Molecular Devices, Union City, CA). GFP-positive nevroner fra locus coeruleus ble visuelt identifisert og deretter avbildet av infrarød differensialinterferens kontrastvideo på scenen av et oppreist mikroskop (Axioskop FS2, Carl Zeiss, Oberkochen, Tyskland). Plasterpipetter (motstand 4-6 ME) ble fylt med (i mM): 110 K-glukonat, 10 KCI, 10 HEPES, 10 Na2-fosfokreatin, 2 Mg3-ATP og 0,2 Na3-GTP; pH ble justert til 7,2 og osmolaritet til 300 mOsm. Holdepotensialet var -70 mV. CNO ble badet brukt.
Plethysmografi
Plethysmografi på bevisste, uhemmet mus ble utført som beskrevet på 6-til 12 uker gamle voksne dyr (Ray et al., 2011). Habituated mus ble utsatt for en 5-dagers habituation protokoll med hver dag bestående av flere minutters håndtering, temperatur tatt av rektal sonde, intraperitoneal saltinjeksjon og 30 min i plethysmografi kammeret. Mus ble deretter testet innen 1 uke etter den siste dagen av habituation. Unhabituated mus ble ikke utsatt for håndtering eller plethysmograph kammeret. Alle musene ble naï TIL CNO og brukes bare en gang.
på testdagen ble mus tatt fra sitt hjembur, veid og rektal temperatur ble tatt. Dyrene ble deretter plassert i et gjennomstrømmende, temperaturkontrollert (vannkappe på 30°C) plethysmografikammer og fikk lov til å akklimatisere seg i minst 20 minutter i romluft (21% O2/79% N2) forhold. Etter akklimatisering og måling under romluft ble kammergassen byttet til en hyperkapnisk blanding av 5% CO2 / 21% O2 / 74% N2 i 20 minutter. Kammergass ble deretter byttet tilbake til romluft i 20 minutter. Musene ble kort fjernet for rektal temperaturmåling og intra-peritoneal injeksjon AV CNO (National Institute Of Mental Health Chemical Synthesis And Drug Supply Program) oppløst i saltvann (1 eller 0,1 mg/ml) for en effektiv konsentrasjon på henholdsvis 10 eller 1 mg/kg. Dyret ble returnert til kammeret for en annen 20 min romluft, 20 min hyperkapni og 20 min romluft. Dyret ble deretter fjernet fra kammeret, og rektal temperatur ble tatt umiddelbart etter avslutningen av forsøket.
Væskekromatografi-Massespektrometri
tjuefire villtype-mus, jevnt fordelt etter kjønn, ble veid og behandlet med 10 mg/kg CNO, 1 mg/kg CNO, 0,1 mg/kg CNO eller kjøretøy. Tretti minutter etter injeksjon ble blodprøver samlet via hjertepunktur og plassert I Bd-Mikrobeholdere. Prøver ble sentrifugert ved 4°C ved 13 500 o / min i benketoppsentrifuge, og supernatanter ble samlet inn. Serum og hjerner ble holdt på -20°C til ekstraksjon.
hplc klasse løsemidler vann, acetonitril kloroform, og metanol og masse-spektrometri-grade maursyre ble oppnådd Fra Sigma-Aldrich (St. Louis, MO). Kalibreringsløsning som inneholder flere kalibranter i en løsning av acetonitril, trifluoreddiksyre og vann ble kjøpt Fra Agilent Technologies (Santa Cruz, CA). Metabolitter og interne standarder, inkludert n-acetyl asparaginsyre-d3, tryptofan-15n2, glutaminsyre-d5, tymin-d4, gibberellinsyre, trans-zeatin, jasmonsyre, 15n antranilsyre og testosteron-d3 ble kjøpt Fra Sigma-Aldrich (St. Louis, MO). Microtainer R SST TM ble hentet Fra Becton Dickinson (Franklin Lakes, NJ).
Ekstraksjon besto av 750 µ iskald metanol: vann (4: 1) som inneholdt 20 µ spikede interne standarder som ble lagt til hver hjerneprøve (50 mg)og kvalitetskontroller og deretter homogenisert i 1 min hver. Deretter ble 750 µ av 100% acetonitril inneholdende 20 µ spikede interne standarder lagt til vaskeprøve (100 µ) og kvalitetskontroller og deretter sonikert i 5 min. Alle prøvene ble sentrifugert ved 5000 o / min i 10 min ved 4°C. Den resulterende supernatanten ble samlet inn, og 20 µ ble injisert i LC-MS.
Alle prøver ble analysert ved hjelp av 6490 trippel quadrupole massespektrometer (Agilent Technologies, Santa Clara, CA) koblet TIL HPLC-systemet (Agilent Technologies, Santa Clara, CA) ved multiple reaction monitoring (MRM). Omtrent 8-11 datapunkter ble anskaffet per detektert metabolitt. Metabolitter som ble påvist var klozapin, CNO og norclozapin (n-desmetylklozapin). ESI positiv modus ble brukt i metoden. Hplc-kolonnen var ACQUITYUPLC C18-kolonne (100 Å, 1.8 µ og 2.1 mm × 100 mm. Milford, MA, USA) med en strømningshastighet på 0,5 ml / min.
Datainnsamling Og Analyse
Plethysmografi
Plethysmografi trykkendringer ble målt ved hjelp Av En Validyne DP45 differansetrykktransduser og referansekammer OG CD15 carrier demodulator og registrert Med LabChartPro i sanntid. Bølgeformer ble analysert offline Ved Hjelp Av LabChartPro og tilpasset skrevet MATLAB-kode for å bestemme respiratorisk hastighet( RR), tidevannsvolum (Vt) (Ray et al., 2011), minuttventilasjon (VE) og mønsteranalyse. Respiratoriske bølgeformer ble samlet offline i perioder da dyret var i ro, og avlesningene var fri for bevegelsesartefakter. Et minimum av 1 min kumulative data samlet fra spor minst 10 s lang fra den siste 10 min av en gitt eksperimentell tilstand ble analysert. O2 forbruk ble bestemt ved å sammenligne gassammensetningen mellom kalibrering i et tomt kammer og levende pust ved hjelp AV en aei oksygen sensor og analysator. Kammertemperaturen ble kontinuerlig overvåket ved Hjelp Av En ThermoWorks MicroThermo 2 og sonde og ble registrert Med LabChartPro i sanntid.
Poincaré Målinger og sukk og apnefrekvens ble bestemt ved bruk av 1 min bevegelsesfrie spor fra hver pustetilstand. Sukk ble definert som et pust med amplitude på minst dobbelt så stor som gjennomsnittlig pust. Apneaer ble definert som ET interbreatintervall (IBI) minst dobbelt så stort som gjennomsnittet IBI. VARIASJONSKOEFFISIENTEN (CV) FOR IBI og amplitude ble også beregnet ut fra samme 1-min-spor kompilering av hver pustetilstand (standardfeil IBI ELLER amplitude/gjennomsnittlig IBI eller amplitude).
Statistikk
Plethysmografi
Resultater (RR, VT, VE, VO2, VE/VO2, antall apneaer og sukk, OG Cver AV IBI og amplitude) for romluft og hyperkapniske data ble sammenlignet MELLOM DBH-Cre; RC::P_hM4D kohorter og søskenkontroller ved hjelp av en lineær blandet effekt regresjonsmodell med dyretype (eksperimentell vs. kontroll) og cno administrasjon (pre vs. Post Injeksjon) Som Faste Effekter Og Dyr Id Som En Tilfeldig Effekt. Temperaturdata ble sammenlignet ved hjelp av en lineær blandet effekt regresjonsmodell med dyretype (eksperimentell vs. kontroll) som en fast effekt. En p < 0,05 ble brukt til å indikere statistisk signifikans, og individuelle datapunkter, gjennomsnitt og standardfeil av gjennomsnittet vises på alle diagrammer.
Væskekromatografi-Massespektrometri
det oppnådde området under toppen for hver prøve ble normalisert av internkontrollen og deretter til kjøretøyet før statistisk analyse ble utført. Uparet t-test ble brukt til å sammenligne den relative overflod av klozapin og CNO i hvert vev ved konsentrasjonsgruppe.
Etikkerklæring
Alle eksperimenter ble godkjent av Institutional Animal Care And Use Committee Of Baylor College Of Medicine. Forsøkene var i samsvar med nasjonale standarder for omsorg og bruk av forsøksdyr fastsatt Av Association For Assessment and Accreditation Of Laboratory Animal Care.
Forfatterbidrag
js, FS-M, MC-M og RR utviklet og designet eksperimentene. JS, FS-M og PZ utførte forsøkene og bidro til å analysere dataene. JS, FS-M, VM, MC-M og RR skrev papiret.
Finansiering
denne studien ble støttet av tilskudd R01HL130249 OG R01HL130249-S1 Fra National Heart, Lung, And Blood Institute; March Of Dimes Basil O ‘ Connor Award; Og McNair Medical Institute.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Takk
vi takker Drs. Shaila K. Mani og Benjamin Arenkiel for nyttige diskusjoner. Vi takker Også Baylor College Of Medicine Proteomics Core facility for utførelse Av Væskekromatografi-Massespektrometri.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., Et al. (2009). PHOX2B i respiratorisk kontroll: leksjoner fra medfødt sentralt hypoventilasjonssyndrom og dets musemodeller. Pusterom. Physiol. Neurobiol. 168, 125–132. doi: 10.1016 / j.resp.2009.03.005
CrossRef Full Text | Google Scholar
Andrews, N., Og Fil, S. E. (1993). Håndtering historie av rotter endrer atferdseffekter av narkotika i forhøyet pluss-labyrint test av angst. Eur. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed Abstrakt / Fulltekst / Google Scholar
Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Og Roth, B. L. (2007). Utvikler låsen for å passe nøkkelen til å skape en familie Av G-proteinkoblede reseptorer som aktiveres kraftig av en inert ligand. Proc. Natl. Acad. Sci. USA 104, 5163-5168. doi: 10.1073 / pnas.0700293104
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Ashby, C. R. Og Wang, R. Y. (1996). Farmakologiske virkninger av det atypiske antipsykotiske legemidlet clozapin: en gjennomgang. Synapse 24, 349-394. doi: 10.1002 / (SICI)1098-2396(199612)24:4<349::HJELP-SYN5>3.0.CO; 2-D
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Bahia, C. M. C. d. S., Og Pereira, J. S. (2015). Obstruktiv søvnapne og nevrodegenerative sykdommer: en toveis relasjon. Dement. Neuropsykol. 9, 9–15. doi: 10.1590 / S1980 – 57642015dn91000003
PubMed Abstrakt | Kryssref Full Tekst | Google Scholar
Biancardi, V., Bí, K. C., Almeida, M. C., Og Gargaglioni, L. H. (2008). Locus coeruleus noradrenerge nevroner og CO2 driver til å puste. Pflugers Arch. – Eur. J. Physiol. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
PubMed Abstrakt / Fulltekst / Google Scholar
Brust, Rd, Corcoran, Ae, Richerson, Gb, Nattie, E., Og Dymecki, Sm (2014). Funksjonell og utviklingsmessig identifikasjon av en molekylær subtype av hjernen serotonerg neuron spesialisert seg på å regulere puste dynamikk. Celle Rep. 9, 2152-2165. doi: 10.1016 / j.celrep.2014.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
W. H., Lin, S. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Reversibel metabolisme av klozapin Og klozapin n-oksid hos schizofrene pasienter. Prog. Neuropsykofarmakol. Biol. Psykiatri 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
PubMed Abstrakt / Fulltekst / Google Scholar
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., Et al. (2018). Genetisk identifisering av en populasjon av noradrenerge nevroner involvert i demping av stressrelaterte responser. Mol. Psykiatri 1-16. doi: 10.1038 / s41380-018-0245-8
PubMed Abstrakt / Fulltekst / Google Scholar
A. V., Gehlbach, B. K., Kreple, C. J., Kawasaki, H., Oya, H., Buzza, C., et al. (2015). Åndedrettsvern hemmes når anfallene sprer seg til amygdala og ved amygdala stimulering. J. Neurosci. 35, 10281–10289. doi: 10.1523 / JNEUROSCI.0888-15. 2015
PubMed Abstract | CrossRef Full Text | Google Scholar
I tillegg er Det en rekke av de mest kjente artene som finnes i Verden. (2013). Frykt og panikk hos mennesker med bilateral amygdala skade. Nat. Neurosci. 16, 270–272. doi: 10.1038 / nn.3323
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Fitton, A. Og Heel, R. C. (1990). Klozapin. En gjennomgang av dets farmakologiske egenskaper og terapeutisk bruk i schizofreni. Narkotika 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed Abstrakt / Fulltekst / Google Scholar
A., A., A., A., A., A., A., A., A., A., A., A., A., a., a., a., a., a., a., a., a., a., a., a., a., a., a., a., et al. (2018). Silencing av hypoglossale motoneuroner fører til søvnforstyrret pust i magre mus. Front. Neurol. 9:962. doi: 10.3389 / fneur.2018.00962
CrossRef Full Text | Google Scholar
Gargaglioni, L. H., Hartzler, L. K. Og Putnam, R. W. (2010). Locus coeruleus og sentral kjemosensitivitet. Pusterom. Physiol. Neurobiol. 173, 264–273. doi: 10.1016 / j.resp.2010.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar
J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, l. A., et al. (2017). Kjemogenetikk avslørt: DREADD belegg og aktivering via konvertert clozapin. Vitenskap 357, 503-507. doi: 10.1126 / vitenskap.aan2475
PubMed Abstract | CrossRef Full Text | Google Scholar
Guettier, J. M., Gautam, D., Scarselli, M., Ruiz De Azua, I., Li, J. H., Rosemond, E., et al. (2009). En kjemisk-genetisk tilnærming for å studere g-proteinregulering av betacellefunksjon in vivo. Proc. Natl. Acad. Sci. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
Kryssref Fulltekst | Google Scholar
Hakim, F., Gozal, D., Og Kheirandish-Gozal, L. (2012). Sympatiske og katekolaminerge endringer i sleep apnea med særlig vekt på barn. Front. Neurol. 3:7. doi: 10.3389 / fneur.2012.00007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hennessy, M. L., Corcoran, A. E., Brust, R. D., Chang, Y., Nattie, E. E., Og Dymecki, S. M. (2017). Aktivitet Av Takykinin1-uttrykkende Pet1 raphe-nevroner modulerer respiratorisk kjemorefleks. J. Neurosci. 37, 1807–1819. doi: 10.1523 / JNEUROSCI.2316-16. 2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Huckstepp, R. T. R., Cardoza, K. P., Henderson, L. E., Og Feldman, J. L. (2015). Rolle parafacial kjerner i kontroll av puste i voksne rotter. J. Neurosci. 35, 1052–1067. doi: 10.1523 / JNEUROSCI.2953-14. 2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D., og Bä, F. (2018). Behavioral effekter av akutt systemisk lavdose clozapin i villtype rotter: implikasjoner for bruk Av DREADDs i atferdsmessig nevrovitenskap. Front. Oppfør deg. Neurosci. 12:173. doi: 10.3389 / fnbeh.2018.00173
CrossRef Fulltekst | Google Scholar
Isom, G. E. og Elshowihy, R. M. (1982). Interaksjon av akutt og kronisk stress med respirasjon: modifikasjon av naloxon. Pharmacol. Biochem. Oppfør deg. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed Abstrakt / Fulltekst / Google Scholar
Jann, M. W., Lam, Y. W. Og Chang, W. H. (1994). Rask dannelse av klozapin i marsvin og mennesker etter administrasjon av klozapin-N-oksid. Arch. Int. Pharmacodyn. Ther. 328, 243–250.
PubMed Abstract | Google Scholar
Joober, R. (2010). Clozapin: et tydelig, dårlig forstått og underbrukt molekyl. J. Psykiatri Neurosci. 35, 147–149. doi: 10.1503 / jpn.100055
PubMed Abstract | CrossRef Full Text | Google Scholar
Kinkead, R., Dupenloup, L., Valois, N., Og Gulemetova, R. (2001). Stressindusert demping av hyperkapnisk ventilasjonsrespons hos våkne rotter. J. Appl. Physiol. 90, 1729–1735. doi: 10.1152 / jappl.2001.90.5.1729
PubMed Abstract | CrossRef Full Text | Google Scholar
Klein, D. F. (1993). Falske kvelningsalarmer, spontan panikk og relaterte forhold. En integrerende hypotese. Arch. Gen. Psykiatri 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
PubMed Abstract | CrossRef Full Text | Google Scholar
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. v., Og Huckstepp, R. T. r. (2018). Rollen av parafaciale nevroner i kontrollen av pusten under trening. Sci. Rep. 8:400. doi: 10.1038 / s41598-017-17412-z
Kryssref Fulltekst | Google Scholar
Lapin, I. P. (1995). Kun kontroller: effekt av håndtering, humbug injeksjon og intraperitoneal injeksjon av saltvann på oppførsel av mus i en forhøyet pluss-labyrint. J. Pharmacol. Toxicol. Metoder 34, 73-77. doi: 10.1016 / 1056-8719 (95)00025-D
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavezzi, A. M., Alfonsi, G., Og Matturri, L. (2013). Patofysiologi av det menneskelige locus coeruleus-komplekset i føtal/neonatal plutselig uforklarlig død. Neurol. Res. 35, 44-53. doi: 10.1179 / 1743132812y. 0000000108
PubMed Abstrakt | Kryssref Full Tekst | Google Scholar
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., Españ, R. A., et al. (2016). Clozapin n-oksid administrasjon produserer atferdseffekter i long-evans rotter: implikasjoner for å designe DREADD eksperimenter. eNeuro 3, 1-14. doi: 10.1523 / ENEURO.0219-16. 2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). En robust Og høy gjennomstrømning Cre rapportering og karakterisering system for hele musen hjernen. Nat. Neurosci. 13, 133–140. doi: 10.1038 / nn.2467
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Mahler, S. V. og Aston-Jones, G. (2018). Cno onde? Betraktninger for bruk av dreadds i behavioral neuroscience. Neuropsykofarmakologi 43, 934-936. doi: 10.1038 / npp.2017.299
PubMed Abstract | CrossRef Full Text | Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, M. S., Ritchie, J. C., Porter, J. H., et al. (2018). DREADD-agonisten klozapin n-oksid (CNO) metaboliseres omvendt til klozapin og produserer klozapinlignende interoceptive stimuluseffekter hos rotter og mus. Sci. Rep. 8, 3840. doi: 10.1038 / s41598-018-22116-z
Kryssref Fulltekst | Google Scholar
Misslin, R., Herzog, F., Koch, B., Og Ropartz, P. (1982). Effekter av isolasjon, håndtering og nyhet på hypofysen-adrenalrespons i musen. Psykoneuroendokrinologi 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed Abstrakt / Fulltekst / Google Scholar
Nakamura, A., Zhang, W., Yanagisawa, M., Fukuda, Y., Og Kuwaki, T. (2007). Årvåkenhet tilstand-avhengig demping av hyperkapnisk chemoreflex og overdrevet søvn apnea i orexin knockout mus. J. Appl. Physiol. 102, 241–248. doi: 10.1152 / japplfysiol.00679.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Obonai, T., Yasuhara, M., Nakamura, T., Og Takashima, S. (1998). Katekolamin nevroner endring i hjernestammen av krybbedød ofre. Pediatri 101, 285-288. doi: 10.1542 / peds.101.2.285
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Ozawa, Y., Takashima, S., Og Tada, H. (2003). Alfa2-adrenerge reseptorer subtype endringer i hjernestammen i krybbedød. Tidlig Hum. Dev. 75 (Suppl.), S129-S138. doi: 10.1016 / j. patofyser.2004.01.015
CrossRef Full Text | Google Scholar
Padovan-Hernandez, Y., Og Knackstedt, La (2018). Doseavhengig reduksjon i kokainindusert bevegelse av klozapin-n-oksid hos rotter med selvadministrering i anamnesen. Neurosci. Lett. 674, 132–135. doi: 10.1016 / j.neulet.2018.03.045
PubMed Abstract | CrossRef Full Text | Google Scholar
I Tillegg til dette har De også en rekke andre former for fysisk aktivitet. (2011). Puste UTEN CO (2) kjemosensitivitet i betingede Phox2b mutanter. J. Neurosci. 31, 12880–12888. doi: 10.1523 / JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Egr2-nevroner kontrollerer voksen respiratorisk respons på hyperkapni. Hjernereses 1511, 115-125. doi: 10.1016 / j.brainres.2012.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
R. S., Corcoran, A. E., Brust, R. D., Kim, J. C., Richerson, G. B., Nattie, E., et al. (2011). Nedsatt respirasjons – og kroppstemperaturkontroll ved akutt serotonerg nevronhemming. Vitenskap 333, 637-642. doi: 10.1126 / vitenskap.1205295
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Ryabinin, A. E., Wang, Y. M. Og Finn, D. A. (1999). Ulike nivåer Av fos immunoreaktivitet etter gjentatt håndtering og injeksjonsspenning i to innavlede stammer av mus. Pharmacol. Biochem. Oppfør deg. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
PubMed Abstrakt / Fulltekst / Google Scholar
Snyder, B., Shell, B., Cunningham, Jt, Og Cunningham, Rl (2017). Kronisk intermitterende hypoksi induserer oksidativt stress og betennelse i hjernegrupper assosiert med tidlig stadium neurodegenerasjon. Physiol. Rep. 5, 1-13. doi: 10.14814 / phy2.13258
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Sun, Jj, Huang, T.-W., Neul, Jl, Og Ray, Rs (2017). Embryonale bakhjernemønstre avgrenser distinkte hjerte-respiratoriske og metabolske homeostatiske populasjoner hos voksne. Sci. Rep. 7: 9117. doi: 10.1038 / s41598-017-08810-4
Full Text | Google Scholar
Sun, J. J. og Ray, R. S. (2017). Tg (Th-Cre)FI172Gsat (Th-Cre) definerer nevroner som kreves for full hyperkapniske og hypoksiske reflekser. Biol. Åpen 6, 1200-1208. doi: 10.1242 / bio.026823
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
J., Lu, Y., Wang, Y., Kreple, C. J., Ghobbeh, A., Fan, R., et al. (2014). Sengekjernen til stria terminalis er kritisk for angstrelatert oppførsel fremkalt AV CO2 og acidose. J. Neurosci. 34, 10247–10255. doi: 10.1523 / JNEUROSCI.1680-14. 2014
PubMed Abstract | CrossRef Full Text | Google Scholar
Valentino, R. J., Og Van Bockstaele, E. (2008). Konvergent regulering av locus coeruleus aktivitet som en adaptiv respons på stress. Eur. J. Pharmacol. 583, 194–203. doi: 10.1016 / j.ejphar.2007.11.062
CrossRef Full Text | Google Scholar
Verbraecken, J., Og McNicholas, Wt (2013). Respirasjonsmekanikk og ventilasjonskontroll i overlapp syndrom og fedme hypoventilering. Pusterom. 14:132. doi: 10.1186/1465-9921-14-132
PubMed Abstrakt / Fulltekst / Google Scholar
Viemari, J.-C. (2008). Noradrenerg modulering av det respiratoriske nevrale nettverket. Pusterom. Physiol. Neurobiol. 164, 123–130. doi: 10.1016 / j.resp.2008.06.016
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Vinter, A., Ahlbrand, R., Naik, D., Og Sah, R. (2017). Differensiell atferdsfølsomhet for innånding av karbondioksid (CO2) hos rotter. Nevrovitenskap 346, 423-433. doi: 10.1016 / j. nevrovitenskap.2017.01.003
PubMed Abstract | CrossRef Full Text | Google Scholar
J. E., Dahdaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, A. M., Et al. (2009). Amygdala er en kjemosensor som oppdager karbondioksid og acidose for å fremkalle fryktadferd. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar