- Innledning
- Materialer Og Metoder
- Høsting Av Oocytter Og cRNA Mikroinjeksjon
- Isolering Av Membranfraksjoner Og Immunoblotting
- Immunhistokjemi
- Fryse Frakturelektronmikroskopi
- Par-Oocyttanalyse Og Kvantifisering Av Kontaktområder
- Hydrostatisk Trykkimpulsanalyse
- Kapratinkubasjon
- Statistisk Analyse
- Resultater
- Uttrykk For Claudin-5 og Integrering I X. laevis Oocyte Plasmamembran
- Flekker Av Tight-Junction Tråder Er Synlige I Claudin-5 Uttrykke Oocytter
- Parret Oocytanalyse For Analyse Av Claudintransinteraksjon
- Hydrostatisk Trykkimpulsanalyse Avslører Claudin-Spesifikk Sammenkobling Av Oocytpar
- Inkubasjon Med Kaprat
- Diskusjon
- Claudins Bidra Til Sterkere Adhesjonsegenskaper
- Konklusjon
- Datatilgjengelighetserklæring
- Etikkerklæring
- Forfatterbidrag
- Finansiering
- Interessekonflikter
- Anerkjennelser
- Supplerende Materiale
Innledning
den tette kryssproteinfamilien er avgjørende for cellefysiologi, da mangel eller svekkelse er forbundet med sykdommer og dysfunksjon av mange organer Og vev, som vist f.eks. i det indre øret (Wilcox et al., 2001; Florian et al., 2003), renal (Konrad Et al., 2006; Gü et al., 2009), mage-tarmkanalen (Resnick et al., 2005; Amasheh et al., 2009), epidermis (Furuse et al., 2002; Tebbe et al., 2002), og hjernekapillærer (Nitta et al., 2003; Wolburg et al., 2003). Claudins representerer en transmembran protein familie bestående av minst 27 medlemmer (Mineta et al., 2011). I tillegg til de fire transmembrane helix-domenene inneholder de to ekstracellulære sløyfer (ECL1 OG ECL2), en kort N-terminus og En C-terminus (Suzuki et al., 2014). Spesifikke claudin uttrykksmønstre bestemme og reflektere selektiv permeabilitet av epitel, og evnen av claudin proteiner til å interagere i cis (innenfor samme membran) og i trans (mellom membraner av nabocellen) tillater dannelsen av barriereforming og pore danner tette veikryss tråder (Van Itallie Og Anderson, 2006).
Claudin-5 uttrykkes sterkt i kapillær endotel og dominerer det tette krysset (TJ) av blod-hjernebarrieren (BBB) da uttrykket er >100 ganger høyere sammenlignet med andre claudin (Ohtsuki et al., 2007). Videre uttrykkes det i en rekke epiteliale vev, inkludert lunge( Soini, 2011), eksokrine vev (Comper et al., 2009), tarm (Garcia-Hernandez et al., 2017), og urinveiene (Koda et al., 2011). Claudin-5 forårsaker imidlertid en sterkere barriere i hjernekapillærene enn i andre vev (Reinhold og Rittner, 2017), og funksjonen er svekket i nevrodegenerative og nevroinflammatoriske lidelser (Greene et al., 2019). Derfor er claudin-5 avgjørende for å opprettholde BBB. MEN BBB er ikke bare beskyttende, det begrenser også de terapeutiske alternativene da medisiner hindres for å gjennomsyre denne barrieren.
Nitta et al. (2003) rapporterte AT BBB er mer permeabel for molekyler på 800 Da i størrelse i claudin-5 mangelfulle mus sammenlignet med villtype mus (Nitta et al., 2003). Dette var i samsvar med transfeksjon eksperimenter demonstrere en tetting effekt av claudin-5 I Caco – 2 celle monolayers (Amasheh et al., 2005).
En annen stor barriereformende claudin er claudin-3, som har blitt rapportert å selektivt forsegle barrieren mot passering av ioner av enten ladning og uladede oppløsninger (Milatz et al., 2010). Det er også uttrykt i endotel tett krysset av hjernen kapillærer og dens funksjonstap er observert i faser av microvessel betennelse, glioblastom og årehinnen plexus av pasienter med multippel sklerose (Engelhardt et al ., 2001; Wolburg et al., 2003).
Barriereegenskaper kan endres dynamisk, som f. eks. inkubasjon med natriumkaprat ble vist å raskt og reversibelt redusere transepitelial elektrisk motstand i den humane tarmcellelinjen HT-29/B6 (Krug et al ., 2013). Natriumkaprat åpner forbigående claudin-5 som inneholder barrierer ved tette veikryss av epitel-og endotelceller (Del Vecchio et al., 2012).
dette indikerer at claudin-5 er et lovende mål for forbedring av legemiddellevering I BBB.
i denne studien hadde vi som mål å benytte heterologe uttrykk system Av Xenopus laevis oocytter (Vitzthum et al., 2019) for analyse av claudin-5 og claudin-3 interaksjon og pertubasjon. På grunn av mangelen på endogene celle-celle-kontakter, muliggjør dette enkeltcelleuttrykkssystemet analyse av spesifikke claudiner uten forstyrrelse av andre tette kryssproteiner.
Materialer Og Metoder
Høsting Av Oocytter Og cRNA Mikroinjeksjon
Oocytter ble samlet inn fra Voksne Kvinnelige Afrikanske klofrosker ved kirurgisk laparotomi. For anestesi, 0.2% MS222 (etyl-3-aminobenzoatmetanesulfonat, Sigma-Aldrich, Taufkirchen, Tyskland) ble brukt som en badeløsning i 5-10 minutter ved 20°C. når kirurgisk anestesi ble nådd, ble hud-og abdominale muskelinnsnitt gjort og ovarialmasse ble eksteriorisert og ovarialt vev fjernet. Isoleringen av oocytter ble utført ved enzymatisk fordøyelse ved romtemperatur i 90 minutter i 1,5 mg/ml kollagenase Fisher Bioreagenter BP2649-1 (Fisher Scientific, Schwerte, Tyskland) oppløst I Oocyte Ringer solution (ORi) som beskrevet Av Vitzthum et al. (2019). Follikulære celler ble fjernet ved inkubasjon I Ca2 + – fri ORi inneholdende (i mM): NaCl (90), KCl (1), EGTA (trietylenglykoldiamintetraeddiksyre) (1), 5 HEPES (5); pH 7,4 for 10 min på en mekanisk shaker med 50 rpm. Oocytter av trinn V Og VI (>1000 µ) ble injisert (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Usa) med 1 ng cRNA som koder for humant claudin-5, claudin-3 eller rnase-fritt vann som kontroller. Injeksjonsvolumet var 50,6 nl per oocytt. Etter injeksjon ble oocytter inkubert ved 16°C i ORi 3 dager for proteinuttrykk.
Isolering Av Membranfraksjoner Og Immunoblotting
Ti injiserte oocytter ble samlet for western blot-analyse og resuspendert i 500 µ homogeniseringsbuffer inneholdende (i mM) MgCl2 (5), NaH2PO4 (5), EDTA (etylendiamintetraeddiksyre) (1), sukrose (80) og Tris (tris(hydroksymetyl)aminometan) (20); pH 7,4. Oocyttekstrakter ble sentrifugert to ganger ved 200 o / min i 10 min ved 4°C for å kaste celleavfall. Supernatanten ble sentrifugert ved 13.000 rpm i 30 min ved 4°C for å pellet cellemembranen som beskrevet Av Leduc-Nadeau et al. (2007). Pellets ble resuspendert i 80 µ homogeniseringsbuffer. Proteinkvantifisering ble gjort kolorimetrisk ved Bruk Av Pierce 600 nm Proteinanalysesett (Thermo Fisher Scientific, Hennigsdorf, Tyskland) i henhold til produsentens instruksjon i en 96 brønnplate. Plateleseren (PerkinElmer Enspire Multimode Plate Reader, Waltham, MA, Usa) ble justert til 562 nm og Bovint Serumalbumin Standard (Thermo Fisher Scientific, Hennigsdorf, Tyskland) fra 125 til 2000 µ/ml ble brukt til evaluering. Før immunoblotting ble prøver blandet med 4× Laemmli buffer (Bio-Rad Laboratories, Munich, Tyskland), lastet på en 10% sds polyakrylamidgel og elektroforesert. FOR proteinoverføring BLE PVDF-membraner brukt og blokkert i 5% ikke-fett tørr melk I Trisbufret saltvann i 120 min. Proteiner ble påvist ved immunoblotting ved bruk av primære antistoffer hevet mot claudin-3 eller claudin-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Usa).
Peroxidase-konjugerte geit-anti-kanin-og anti-mus-antistoffer (#7074, #7076 Cell Signaling Technology, Danvers, MA, Usa) ble brukt til å binde seg til de primære antistoffene og ble derfor inkubert i minst 45 minutter ved romtemperatur. For deteksjon Ble Clarity Western ECL Blotting Substrate (#1705061, Bio-Rad Laboratories GmbH, Munich, Tyskland) brukt og signaler ble visualisert av Et ChemiDoc MP-system (Bio-Rad Laboratories).
Immunhistokjemi
Injiserte oocytter ble fiksert i 4% PFA (16% paraformaldehyd, E15700, Science Service, Munich, Tyskland) i 4 timer ved romtemperatur etterfulgt av dehydreringsgradient fra 70% etanol til xylol (Carl Roth, Karlsruhe, Tyskland) innen 48 timer. Prøver ble innebygd i paraffin og tverrsnitt (5 µ) ved Bruk Av En Leica RM 2245 mikrotom (Mikrotom).leica microsystems heidelberg, tyskland). Kort tid før immunhistokjemisk behandling ble parafin fjernet via xylol til etanolgradient. Uspesifikke bindingssteder ble blokkert ved bruk av 5% geiteserum i fosfatbufret saltvann og inkubert med de samme primære antistoffene som for immunoblotting. Prøver ble inkubert med sekundære antistoffer Alexa Fluor-488 geit anti-kanin Og Alexa Fluor-594 geit anti-mus (Life Technologies, Carlsbad, CA, Usa) og undersøkt ved konfokal laserskanning immunfluorescens mikroskopi (LSM 710, Zeiss, Oberkochen, Tyskland).
Fryse Frakturelektronmikroskopi
Fryse frakturelektronmikroskopi ble utført som rapportert nylig (Greene et al ., 2019). For fiksering ble injiserte oocytter inkubert i glutaraldehyd (2,5% i 0,1 M cacodylatbuffer) over natten ved 4°C. etter vask med cacodylatbuffer ble oocytter forberedt for frysefrakturering. Prøver ble kryobeskyttet i 30% glyserol og frosset i flytende nitrogen. Etter oppsprekking og skygging med platina og karbon (Baf400d; Balzers, Liechtenstein) ble gjenværende organisk materiale fjernet av en natriumhypoklorittvask. Oocytter ble analysert i et transmisjonselektronmikroskop (EM-10, Zeiss, Oberkochen, Tyskland) og fotografert med et digitalkamera (Trö GmbH). Morfometrisk analyse av de tette forbindelsesstrengene ble utført med en forstørrelse på 20.000×.
Par-Oocyttanalyse Og Kvantifisering Av Kontaktområder
Mannitol ble implementert for å krympe de injiserte oocytene og tillate mekanisk fjerning av vitellinmembranen ved bruk av tang uten å skade plasmamembranen. 5-10 oocytter ble plassert i en petriskål (35 mm diameter, Thermo Fisher, Henningsdorf, Tyskland, #153066) fylt Med ORi. Mannitol ble tilsatt og oppløst til hypertonisk krymping av cellene ble oppnådd (omtrent 400 mOsmol / l i 10 min). Etter manuell devitellinisering ble oocytter umiddelbart overført til en 24 brønnplate (1. 86 cm2 overflateareal, Tpp Techno Plastprodukter, Trasadingen, Sveits, # 92024) som inneholder 2 ml ORi. I hver brønn ble to celler forsiktig gruppert ved å skyve dem sammen med En Pasteur pipette (1 ml, Thermo Fisher, Henningsdorf, Tyskland, #PP88SB) og en pæresonde.
Oocyttpar claudin-5-expressing (cldn5 − cldn5), claudin-3-expressing (cldn3 − cldn3), claudin-3 og claudin-5 coexpressing (cldn3,5 − cldn3,5) og kontroll − oocytter (kontroll-kontroll) ble holdt sammen i Opptil 48 timer I ORi ved 16°C.
Lyst feltmikroskopi ble brukt for kvantifisering av kontaktområdet for grupperte Oocytter etter 1, 24 og 48 timer. bilder av naï oocyttparene i 24 brønnkulturretter ble tatt på disse tidspunktene ved hjelp av et leica dmi6000 b-mikroskop (leica microsystems, wetzlar, tyskland). Diameter av kontaktområdet ble målt ved hjelp av mikronskalaen (LAS-AF 3.2.0). Kontaktområder anses å være sirkulære, og dermed ble kontaktområdet beregnet ved å bruke sirkelligningen A=π ∙ r2.
Hydrostatisk Trykkimpulsanalyse
Vitellinmembraner ble mekanisk fjernet som beskrevet tidligere og oocytter gruppert analagous til den parede oocyttanalysen. I tillegg ble blandede oocytpar (kontroll–cldn5 og kontroll–cldn3) testet i den hydrostatiske trykkimpulsanalysen (hpi). Etter 24 timers stabilisering ble en definert hydrostatisk impuls opprettet ved hjelp av en enkeltkanals elektronisk pipette (EE-300r, Eppendorf Research Pro, programvareversjon 2.06.00, Hamburg, Tyskland).
Oocytter ble oppbevart i 24 brønnplater inneholdende 2 ml ORi, og sentral posisjonering ble kontrollert før pipetteringsvolumet ble påført 250 µ ORi. Dispenseringshastigheten ble jevnt satt til maksimal hastighet, tilsvarende en dispenseringshastighet på 0,9 s. videre ble vinkelen (45°) og applikasjonsavstanden (∼1,3 cm) jevnt påført. Omgivelsestrykk, viskositet Av ORi og diameter på pipettespissåpningen ble holdt under konstante forhold. Bright feltmikroskopi ble anvendt for kvantifisering av kontaktområder 30 min etter at hydrostatisk trykk ble påført og sammenlignet med kontaktområder før påføring. Det eksperimentelle oppsettet er beskrevet I Figur 1.
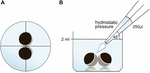
Figur 1. Eksperimentell oppsett av hydrostatisk trykkimpulsanalyse (a) skjematisk toppvisning av brønnen: sentral posisjonering av oocytparet ble kontrollert før påføring av det hydrostatiske trykket. (B) Skjematisk sidebilde av brønnen: 250 µ Ble tilsatt ved hjelp av en enkeltkanals elektronisk pipette. Dispenseringshastigheten ble jevnt satt til maksimal hastighet. Vinkelen (45 hryvnias) og avstanden til applikasjonen ble jevnt påført. Omgivelsestrykk, viskositet Av ORi og diameter på pipettespissåpningen ble holdt under konstante forhold.
Kapratinkubasjon
for kapratinkubasjon ble natriumkaprat (#C4151, Sigma Aldrich, Taufkirchen, Tyskland) i endelige konsentrasjoner på 50, 100 og 500 µ eller ori som referansegruppe tilsatt oocytene 24 timer etter paring. Oocytter ble oppbevart i 24 brønnplater inneholdende 2 ml ORi og kapratoppløsning ble oppløst i et definert tilleggsvolum på 250 µ ORi per brønn. Bredden på kontaktområdet ble kvantifisert ved 30, 60 og 120 min etter tillegg.
Statistisk Analyse
Statistisk analyse ble utført MED JMP Pro 14.0.0 (NC, Usa). Data presenteres som medianer og vises som prosentvis endring basert på klyngekombinasjonen ved de første undersøkelsespunktene. Figur 4, 5 presenteres Som Boksplott, som viser første kvartil (25 prosent), medianen (50 prosent) og andre kvartil (75 prosent). Whiskers er trukket ned til 10. persentil og opp til 90. persentil. Normalfordeling ble kontrollert Ved Hjelp Av Shapiro-Wilk-test.
Kruskal–Wallis test ble brukt for flere sammenligninger, etterfulgt av En Dunn-Bonferroni korreksjon. p-verdier er gitt som kontinuerlige tall.
Resultater
Uttrykk For Claudin-5 og Integrering I X. laevis Oocyte Plasmamembran
for å teste det vellykkede uttrykket Og integrasjonen av det tette forbindelsesproteinet claudin-5 i oocyttplasmamembranen, 3 dager etter injeksjon av claudin-5 cRNA, ble membranfraksjoner analysert ved immunoblotting. Alle prøver fra tre individuelle dyr (d1–d3) viste claudin-5 spesifikke signaler ved 23 kDa, mens Rnasefrie vanninjiserte oocytter ikke viste noe spesifikt signal for claudin-5-uttrykk (Figur 2a).
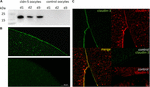
Figur 2. Påvisning av heterologt uttrykte claudiner I Xenopus laevis-oocytter. (A) Immunoblotanalyse av claudin-5 i X. laevis–oocytter fra tre dyr (d1-d3). Cellemembran lysater ble utsatt FOR SDS-PAGE etterfulgt av immunoblot på PVDF membraner. Membranene ble inkubert med primære antistoffer og sekundære peroksidase-konjugerte antistoffer (n = 3). (B) Immunfluorescerende farging avslørte spesifikke claudin – 5-signaler (grønn) i oocytmembraner av alle cRNA-injiserte oocytter, mens i vanninjiserte kontroller ble det ikke påvist claudin-spesifikke signaler i konfokal mikroskopi. Representative bilder av oocytter avledet fra tre dyr. Vektstenger: 50@m. (C) Immunfluorescent farging av claudin-5 og claudin-3 uttrykker oocytter avdekket spesifikke claudin – 3 signaler (grønn) og claudin – 5 signaler (rød) i oocytt membraner av cRNA-injisert oocytter, mens i vann-injisert kontroller, ingen claudin-spesifikke signaler ble detektert. Kolokalisering av uttrykte claudinproteiner i oocytplasmamembranen avsløres ved dobbelt immunfluorescerende farging (gul). Skala bar: 10 µ
for visualisering av de uttrykte proteiner i plasmamembranen ble immunhistokjemiske flekker utført og analysert ved konfokal laserskanningsmikroskopi (Figur 2b). Spesifikke signaler ble detektert og jevnt fordelt gjennom plasmamembranen av claudin-5 som uttrykker oocytter. I samsvar med immunobloter ble det ikke påvist spesifikke signaler i plasmamembraner for kontroll av oocytter.
således, etter injeksjon av cRNA, ble claudin-5 vellykket uttrykt Og integrert I plasmamembranen Av X. laevis-oocytter.
Koekspresjon av claudin-3 og claudin-5 i oocyttpar viste spesifikke signaler for claudin-5 (rød) og claudin-3 (grønn) i begge cellene (Figur 2c). Oocyte plasmamembraner viste en fusjon av nabocellene levert av direkte cldn3,5–cldn3, 5 interaksjon (gul).
Flekker Av Tight-Junction Tråder Er Synlige I Claudin-5 Uttrykke Oocytter
Oocyte plasmamembraner ble analysert og visualisering av tight-junction tråder var vellykket (Figur 3). Frys frakturelektronmikroskopi viste flekker av trådmorfologi i plasmamembranene av claudin-5 injiserte oocytter, og strandorganisering av claudin-5-uttrykkende oocytter var svært organisert og av vinkelform (Figur 3A). Stramme kryssstrenger ble primært detektert i membranets protoplasmatiske (P-) ansikt. Claudin – 3 injiserte oocytter viste avrundede høyt organiserte stramme kryssstrenger som rapportert tidligere (Vitzthum et al., 2019; Figur 3B). Frys frakturelektronmikroskopi av claudin-3 og claudin-5 coexpressing oocytter avslørte fibriller som begge bærer egenskaper av claudin – 3 og claudin-5. Fibril strand arkitektur av coexpressing oocytter dukket opp både avrundet og kompleks som claudin-3 uttrykke oocytter, men også diskontinuerlig og mer vinklet som vist for claudin-5 uttrykke celler (Figur 3c). Kontroll-oocytter hadde en typisk glatt overflate (Figur 3D).
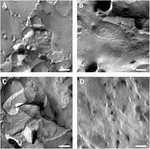
Figur 3. Frys frakturelektronmikroskopi. (A) Fryse frakturelektronmikroskopi avslører tett kryssprotein cldn-5 som et meshwork av vinkelformede diskontinuerlige fibriller i rader I Xenopus laevis-oocytter. (B) Fryse frakturelektronmikroskopi avslører tett kryssprotein cldn-3 som et meshwork av avrundede fibriller I X. laevis-oocytter. (C) Frys frakturelektronmikroskopi av claudin-3 og claudin-5 coexpressing oocytter avslører fibriller som begge bærer egenskapene til claudin-3 og claudin-5. (D) vann injisert kontroll oocytter har en glatt overflate. Representative bilder av oocytter avledet fra tre dyr. Skala bar: 250 nm.
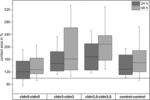
Figur 4. Median kontaktområder for grupperte oocytkombinasjoner cldn5-cldn5, cldn3-cldn3,cldn3, 5-cldn3, 5 og kontroll–kontroll 24 og 48 h etter gruppering i % av innledende kontaktområder kort tid etter gruppering (n = 8-38).

Figur 5. Kontaktområder av claudin-5, claudin-3 og coexpressing claudin-3 og claudin – 5 oocytter i hydrostatisk trykkimpuls (HPI) utfordring etter stabiliseringsperiode og 30 min ETTER HPI (n = 16-70, *p < 0,05, **p < 0.01, Kruskal-Wallis etterfulgt av En Dunn-Bonferroni korreksjon).
Parret Oocytanalyse For Analyse Av Claudintransinteraksjon
alle grupperte kombinasjoner viste en tidsavhengig økning i kontaktområdet over den målte tidsperioden (Figur 4 Og Tabell 1).
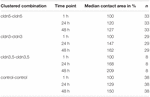
Tabell 1. Oocyttkontaktområder innen 48 h etter clustering.
kontaktområdet for vanninjiserte kontrollocytter økte til 129% etter 24 timer og 150% etter 48 timer. Klyngede par oocytter som uttrykte claudin-3 viste også en økning av kontaktområder til 147% (24 h) og 162% (48 h). Klyngede par oocytter som koekspresserte claudin – 3 og claudin-5 viste kontaktområder på 168% (24 timer) og 209% (48 timer). Klyngede par oocytter som uttrykte claudin-5 alene viste kontaktområder på 120% (24 h) og 127% (48 h). Derfor var kontaktområder i alle testede kombinasjoner sammenlignbare.
Hydrostatisk Trykkimpulsanalyse Avslører Claudin-Spesifikk Sammenkobling Av Oocytpar
i en separat tilnærming ble oocytter som uttrykte claudin-3 eller claudin-5 eller koekspresjon av begge claudiner gruppert etter mekanisk devitellinisering. Oocytter ble utfordret ved å bruke EN HPI og kontaktområder ble målt og beregnet 30 min etter utfordring og sammenlignet med innledende områder etter 24 h stabiliseringsperioden (Figur 5 Og Tabell 2). Etter hydrostatisk trykkutfordring ble kontaktområdet for vanninjiserte kontrollocytter redusert til 89%. Klyngede par oocytter som uttrykker claudin-5, claudin-3 eller koekspresserende claudin-3 og claudin-5 beholdt større kontaktområder (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Kontaktområdene til kontroll-oocytter med blandet vanninjeksjon og claudin-ekspresjon (kontroll-cldn5 og kontroll-cldn3) var ikke signifikant forskjellig fra kontroll-oocytter (93%, p = 0,2900; 83%, p = 0,4455).
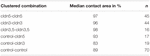
Tabell 2. Hydrostatisk trykkimpulsanalyse.
Inkubasjon Med Kaprat
i et pilotinkubasjonseksperiment ble oocytter injisert og paret i kombinasjoner som enten uttrykte claudin-5 (cldn5-cldn5) eller injisert med rnasefritt vann som kontroller (kontroll–kontroll). Parene ble inkubert med endelige natriumkapratkonsentrasjoner på 50, 100 eller 500 µ. Inkubasjonen av oocytpar med ORi tjente som en referansegruppe. Oocytter ble gruppert og etter 24 timer med stabilisering startet inkubasjon og kontaktbredder ble målt 30, 60 og 120 min etter tilsetning (Supplerende Figur S1).
tilsetningen Av ORi resulterte i en innledende reduksjon av kontaktområder både i claudin-ekspresjons-og vanninjiserte oocytpar som er dispergert 60 eller 120 min etter tilsetting. Dette er skissert av den parabolske formen på forbindelseslinjen mellom mediankontaktområdene over tid (røde kurver I Tilleggsfigur S1). Imidlertid, inkubasjon med 100 og 500 µM sodium caprate økt kontaktflate litt (100 µM) eller sterkt (500 µM) 30 min etter caprate tillegg fra 5.1 × 105 til 5,2 × 105 µm2 og 4,3 × 105 til 4,9 × 105 µm2.
Diskusjon
i denne studien brukte vi den klassiske modellen for transportører og menneskelig sykdomsmodellering (Tammaro et al., 2009; Nenni et al., 2019), X. laevis-oocytene, for en grundig analyse av claudin-5-interaksjon og funksjonelt bidrag til kryssforseglingen. Til dette formål ble det etablert en ny tilnærming, som introduserte EN HPI for utfordrende interaksjon innenfor kontaktområdet av Klyngede Xenopus-oocytter.
Claudins Bidra Til Sterkere Adhesjonsegenskaper
i samsvar med tidligere resultater Fra Vitzthum et al. (2019), enkelt claudiner uttrykt i oocytter førte ikke til økning av interaksjonskontaktområder sammenlignet med kontroll-oocytter. Imidlertid viste immunoblot og immunhistokjemisk visualisering det vellykkede uttrykket og integrasjonen I X. laevis oocyte plasmamembran. Videre tillot bruk av konfokal laserskanningsmikroskopi en presis lokalisering av de uttrykte claudinene i plasmamembranen da pinhole blokkerte fluorescens utenfor fokus. En kvantifisering av immunhistokjemiske signaler ble ikke fulgt, da affiniteten av antistoffer for binding av deres mål er forskjellig.
Vedula et al. (2009) brukte en mikropipett aspirasjonsteknikk for å undersøke aspekter av claudin-claudin-interaksjon ved Bruk Av l-fibroblaster transfisert MED GFP-merket occludin, cldn-1 og cldn-2. Separasjonskraften som trengs for å løsne to celler fra hverandre var større i cldn-1 og cldn-2 transfiserte celler (henholdsvis 2,8 og 2,3 nN). Selv om denne tilnærmingen også kan virke lovende for claudin-claudin-interaksjonsanalysen av ekspresjon av oocytter, viste foreløpige tester at en løsrivelse av grupperte oocytter ikke er mulig uten forstyrrelse av oocytplasma membranene.
derfor, Som en ny tilnærming, ble kraften av forbindelsene målt ved EN HPI. SELV OM HPI ikke gir en kvantifisering av separasjonskraften i absolutte verdier (f. eks. i newtons), tillater det en rask og kostnadseffektiv analyse av claudininteraksjonen uten forstyrrelse av andre tette kryssproteiner (f. eks., occludin, tricellulin, SYLTETØY-A). Claudiner bidrar til krysset mellom oocyttpar da de viser et større kontaktområde sammenlignet med vanninjiserte oocytter etter HPI. Dette indikerer sterk homofil transinteraksjon mellom claudin-uttrykkende celler.
Strand fibril arkitektur er spesifikk for enkelt claudins (Colegio et al., 2002). I fryse frakturelektronmikroskopi, claudin-3 ble rapportert å montere en mer avrundet tråd meshwork i loop figurer I Xenopus oocytter (Vitzthum et al., 2019; Figur 3B) mens claudin-5 i vår studie dannet et meshwork mer vinklet og bestilt i rader. Bildene avslørte at det tette kryssproteinet claudin-5 danner et meshwork av fibriller i diskontinuerlige, vinkelformede rader I X. laevis-oocytter. Dette er i samsvar med claudin – 5 tråder kjent for å forekomme som kjeder av partikler assosiert Med P-Fase (Piontek et al., 2011). I våre eksperimenter syntes geometrisk form av fibrillene ikke å ha noen effekt på eggets adhesjonsegenskaper. I samsvar med dette ble paracellulær resistens rapportert å være relatert til fibrillnummer og fibrildannende egenskaper (Colegio et al., 2002). Videre er claudin – 3 og claudin-5 vist å ha en lignende evne til homofil transinteraksjon i HEK293-celler (Piontek et al., 2011).
denne modellen Av X. laevis-oocytter, som uttrykker enkeltkryssende proteiner, tillater en observasjon av effekten av stoffer som natriumkaprat på dannelsen av kontaktområder mellom klyngede oocytter. Det kan derfor gi et nyttig verktøy for en tids – og kostnadseffektiv screening for stoffer som påvirker den tette kryssbarrieren.
natriumkapratkonsentrasjoner på 100 og 500 µ kan gi en beskyttende effekt på oocytter som uttrykker claudin-5, noe som resulterer i økende kontaktområder etter 30 min inkubasjonstid.
Krug et al. (2013) viste at inkubasjon med natriumkaprat førte til en rask og reversibel reduksjon av transepitelial resistens i human tarmcellelinje HT-29 / B6. Videre viste konfokal laserskanningsmikroskopi en markert reduksjon av claudin-5 I ht-29/B6-celler behandlet med mediumkjedefettsyrelaurat (Dittmann et al., 2014). Den første ekstracellulære sløyfen av claudiner (ECL1) er viktig for barriereegenskapene til det tette krysset, mens den andre ekstracellulære sløyfen (ECL2) er involvert i strengdannelse av transinteraksjon (Piontek et al., 2008; Rossa et al., 2014; Grete et al., 2019). Claudin-5-bindemidler rettet MOT ECL1 ELLER ECL2 av claudin-5 kan indusere intracellulært opptak av det tette kryssproteinet, og derved hindre claudin-5-transinteraksjonene i den tette kryssforseglingen mellom tilstøtende celler og løsne det paracellulære rommet (Hashimoto et al., 2017).
Således antydet vi at inkubasjon med natriumkaprat ville føre til en reduksjon i kontaktområdet av klyngede claudin-5-uttrykk X. laevis-oocytter. Uventet førte økende konsentrasjoner av natriumkaprat (100 og 500 µ) til økende kontaktområder av klyngede oocytter som uttrykte claudin-5, noe som indikerer en beskyttende effekt av natriumkaprat på den tette forbindelsesforseglingen. Videre er natriumkaprat beskrevet for å indusere sammentrekning av actomyosin perijunctional ring, utvide paracellular plass (Lindmark et al., 1998; Maher et al., 2009). Denne effekten er basert på fosforylering av den regulatoriske lette kjeden av myosin via en fosfolipase C-aktivering som fører til spaltning av fosfatidylinositol 4,5-bisfosfat (PIP2) i inositoltrifosfat (IP3) og diacylglycerol (Tomita et al., 1995). Det tette veikrysskomplekset som er forbundet MED stillasproteinet ZO-1 til actin-cytoskelettet, omfordeles deretter fra det tette krysset til cytoplasma (Lindmark et al.(1998; Turner, 2000). Cytoarkitekturen Til X. laevis-oocyten er avgjørende for cytoplasmatisk regionalisering under oogenese (Wylie et al., 1985). Selv om, før befruktning, tjp – 1 genuttrykk, genet koding FOR ZO-1 er bare uttrykt 1.9 TPM i oocyte stadier V-VI (Session et al ., 2016). En redusert interaksjon mellom claudinene og det cytoskeletale stillaset kan derfor forklare det uventede resultatet av kapratinkubasjonen. Er omfanget av fremtidige studier for å verifisere det mekanistiske grunnlaget for funnet.
en varianteffekt av natriumkaprat på paracellulær permeabilitet ble imidlertid beskrevet i litteraturen tidligere. I Peyers Patchvev tatt fra tarmen av voksne griser, ble det påvist en lignende forsterkende effekt. Claudin-5 ble signifikant økt etter inkubasjon med 5 mM kaprat. I denne studien caprate førte til en betydelig høyere transepitelial elektrisk motstand (TEER) i hårsekken assosiert epitel (Radloff et al., 2019).
Konklusjon
som konklusjon, heterolog ekspresjon av det tette kryssproteinet claudin – 5 I X. laevis oocytter gir ny innsikt i bidraget av enkelt claudins til celle-celle interaksjon og adhesjonsegenskaper av tilstøtende celler. Dermed kan Bruk Av X. laevis tight junction-modellen for claudin-5 analyse AV BBB-komponenter i en enkeltcellemodell.
Datatilgjengelighetserklæring
datasettene som genereres for denne studien, er tilgjengelige på forespørsel til den tilsvarende forfatteren.
Etikkerklæring
dyrebehandlingene var i samsvar med retningslinjene i tysk lovgivning, med godkjenning fra dyrevelferdsansvarlig For Freie Universitetit Berlin Og under Ledelse Av Berlin Veterinary Health Inspectorate (Landesamt fü Gesundheit und Soziales Berlin, tillatelse G0025/16).
Forfatterbidrag
alle forfattere har lest og godkjent manuskriptet. NB og SA designet, planla og overvåket eksperimentene og skrev manuskriptet. NB, LS, VC, RK og PF-B utførte eksperimentene og dataanalysen.
Finansiering
denne studien ble finansiert Av Deutsche Forschungsgemeinschaft, Stipend Nr. AM141/11-1 og H. Wilhelm Schaumann Stiftung.
Interessekonflikter
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Anerkjennelser
Vi takker Martin Grunau, Gisela Manz, Katharina Sö Og Susanne Trappe for utmerket teknisk assistanse. Vi anerkjenner støtte fra Open Access-Publiseringsinitiativet Til Freie Universitä Berlin.
Supplerende Materiale
Supplerende Materiale for denne artikkelen kan bli funnet online på: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
FIGUR S1 / Kontaktområder av claudin-5 som uttrykker oocytpar i µ 2 under inkubasjon med natriumkaprat i forskjellige konsentrasjoner (henholdsvis n = 6-8) og vanninjiserte oocytter som kontroller (henholdsvis n = 5-7).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., Og Kroesen, A. J. (2009). Inflammet poseslimhinne har endrede tette veikryss som indikerer tilbakefall av inflammatorisk tarmsykdom. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed Abstrakt / Fulltekst / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Bidrag av claudin-5 til barriereegenskaper i tette veikryss av epitelceller. Cellevev Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed Abstrakt / Fulltekst / Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C., Og Anderson, Jm (2002). Rollen av claudin ekstracellulære domener i tett veikryss fibril arkitektur og paracellulær ladning selektivitet. Mol Biol Celle. 13:286.
Google Scholar
S., Gobbo, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). Ekspresjonsmønster av claudiner 5 og 7 skiller solid-pseudopapillær fra pankreatoblastom, akinarcelle og endokrine svulster i bukspyttkjertelen. Er. J. Surg. Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
A., A., A., A., A., A., A., A., A., a., a., a., a., a., a., a., a., a., a., a., a., a., a., a., et al. (2012). Natriumkaprat åpner forbigående claudin-5-holdige barrierer ved tette veikryss av epitel-og endotelceller. Mol. Pharm. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., Og Amasheh, S. (2014). Laurat gjennomsyrer den paracellulære banen for små molekyler I tarmepitelcellemodellen HT-29/B6 via åpning av tette veikryss ved reversibel flytting av claudin-5. Pharm. Res. Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed Abstrakt / Fulltekst / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., Og Wolburg, H. (2001). Involvering av choroid plexus i sentralnervesystemet betennelse. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::hjelp-jemt13>3.0.co;2-5
Full Text | Google Scholar
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Claudins i de tette kryssene av stria vaskularer marginale celler. Biochem. Biophys. Res. Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
Full Text | Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Claudin-baserte stramme veikryss er avgjørende for pattedyrs epidermal barriere: en leksjon fra claudin-1-mangelfulle mus. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Garcia-Hernandez, V., Quiros, M., Og Nusrat, A. (2017). Intestinale epiteliale claudiner: uttrykk og regulering i homeostase og betennelse. Anne. N. Y. Acad. Sci. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Greene, C., Hanley, N., Og Campbell, M. (2019). Claudin-5: gatekeeper av nevrologisk funksjon. Væsker Barr. CNS 16: 4321.
Google Scholar
G Hryvnzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudin – 16 påvirker transcellulær Cl-sekresjon I MDCK-celler. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113 / jfysiol.2009.173401
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
H., K., K., K., K., K., K., K., K., M., Et al. (2017). Claudin-5-bindemidler øker permeasjonen av oppløsninger over blod-hjernebarrieren i en pattedyrsmodell. J. Pharmacol. Exp. Ther. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
N., N., N., N., N., N., N., N., N., N., N., n., n., n., n., n., n., n., n., n., n., n., n., n., n., n., n., n., n., n., n. (2011). Nytt uttrykk for claudin-5 i glomerulære podocytter. Cellevev Res. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). Mutasjoner i tight-junction-genet claudin 19 (CLDN19) er forbundet med renal magnesiumavfall, nyresvikt og alvorlig okulær involvering. Er. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Abstrakt / Fulltekst / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., Og Amasheh, S. (2013). Natriumkaprat som en forsterker av makromolekylpermeasjon over tricellulære tette veikryss av tarmceller. Biomaterialer 34, 275-282. doi: 10.1016 / j.biomaterialer.2012.09.051
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., Og Bichet, D. G. (2007). Utarbeidelse av en ny teknikk for rensing av plasmamembraner Fra Xenopus laevis oocytter. Er. J. Physiol. Celle. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y., Og Artursson, P. (1998). Absorpsjonsforbedring gjennom intracellulær regulering av tett kryss permeabilitet av mellomkjedede fettsyrer I Caco – 2-celler. J. Pharmacol. Exp. Ther. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., Og Brayden, D. J. (2009). Sikkerhet og effekt av natriumkaprat for å fremme oral absorpsjon av legemidler: fra in vitro til klinikken. Adv. Drug Deliver. Åp 61, 1427-1449. doi: 10.1016 / j.adr.2009.09.006
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Schulzke, J. D., Schulzke, J. D., Schulzke, J. D., Et al. (2010). Claudin-3 fungerer som en tetningskomponent i det tette krysset for ioner av enten ladning og uladede oppløsninger. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j.bbamem.2010.07.014
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
A., A., A., A., A., A., A., A., a., a., a., a., a., a., a., et al. (2011). Forutsatt utvidelse av claudin multigene-familien. FEBS Lett. 585, 606–612. doi: 10.1016 / j.febslet.2011.01.028
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: tilrettelegging For Bruk Av Xenopus for å modellere Menneskelig sykdom. Front. Physiol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Størrelse-selektiv løsning av blod-hjernebarrieren i claudin-5-mangelfulle mus. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T., Og Terasaki, T. (2007). Eksogent ekspresjon av claudin-5 induserer barriereegenskaper i kultiverte rottehjernekapillære endotelceller. J. Celle Physiol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Pion, J., Fritzsche, S., K., K., K., K., K., K., M., Et al. (2011). Belyser prinsippene for molekylær organisering av heteropolymere tette krysstrenger. Celle Mol. Livet Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Dannelse av tett veikryss: determinanter av homofil interaksjon mellom klassiske claudiner. FASEB j. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Radloff, J., Cornelius, V., Markov, A. G., Og Amasheh, S. (2019). Caprate modulerer intestinal barrierefunksjon i porcine Peyers patch follikkel-assosiert epitel. Int. J. Mol. Sci. 20:1418. doi: 10.3390 | ijms20061418
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
Reinhold, A. K., Og Rittner, H. L. (2017). Barrierefunksjon i det perifere og sentrale nervesystemet-en gjennomgang. Pflug. Arch. Eur. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Claudin – 3-og Claudin-5-proteinfolding og montering i det tette krysset styres av ikke-konserverte rester i transmembran 3 (TM3) og ekstracellulær sløyfe 2 (ECL2) – segmentene. J. Biol. Chem. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genom evolusjon i allotetraploid frosk Xenopus laevis. Natur 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins i lungesykdommer. Resp. 12.70.
Google Scholar
Jørgen, A., Jørgen, a., jørgen, a., jørgen, a., jørgen, a., jørgen, r., et al. (2014). Krystallstruktur av en claudin gir innsikt i arkitekturen av stramme veikryss. Vitenskap 344, 304-307. doi: 10.1126 / vitenskap.1248571
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Tammaro, P., Shimomura, K., Og Proks, P. (2009). «Xenopus Oocytter som et heterologt uttrykkssystem for å studere ionkanaler med patch-clamp-teknikken,» I Kaliumkanaler: Metoder Og Protokoller, ed. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Tight junction proteins: en ny klasse av integrale membranproteiner-uttrykk i menneskelig epidermis og I HaCaT keratinocytter. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Tomita, M., Hayashi, M. ,Og Awazu, S. (1995). Absorpsjonsforbedrende mekanisme av natriumkaprat og dekanoylkarnitin I Caco-2-celler. J. Pharmacol. Exp. Ther. 272, 739–743.
Google Scholar
Turner, J. R. (2000). ‘Putting the squeeze’ på det stramme krysset: forstå cytoskeletal regulering. Sæd. Cell Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Van Itallie, C. M. Og Anderson, J. M. (2006). Claudiner og epitelial paracellulær transport. Annu. Pastor Physiol. 68, 403–429. doi: 10.1146 / annurev.physiol.68.040104.131404
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Kvantifiseringskrefter mediert av integrerte tette kryssproteiner I Celle – celleadhesjon. Exper. Robot. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutasjoner i genet som koder for tett veikryss claudin-14 forårsaker autosomal recessiv døvhet DFNB29. Celle 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
Full Text | Google Scholar
I Tillegg til Å være en del av en rekke av de mest kjente, er Det Også en del av En rekke av Dem. (2003). Lokalisering av claudin-3 i tette veikryss av blod-hjernebarrieren går selektivt tapt under eksperimentell autoimmun encefalomyelitt og human Glioblastoma multiforme. Acta Neuropathol. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J. Og Heasman, J. (1985). Cytoskelettet Av Xenopus-oocytter og dets rolle i utviklingen. J. Embryol. Exp. Forvandle. 89, 1–15.
Google Scholar