- Introduksjon
- ChREBP Struktur Og Regulering Via LID / Grace Domener
- Aktivering Av ChREBP Med Glukosemetabolitter
- ChREBP Co-Faktorer Og Partnere
- Rolle ChREBP I Karbohydratmetabolismen Og Hepatokin Produksjon
- ChREBP Som Regulator Av Hepatisk Fettsyresyntese Og VLDL Sekresjon
- Regulering Av Fruktosemetabolisme Ved ChREBP i Lever Og Tarm
- Regulering AV BDK:PPM1K-Akse I Leveren
- ChREBP Er Nødvendig For Glukose-Mediert Regulering AV FGF21
- Rolle ChREBP I Inter-Organ Nettverk Som Styrer Energi Homeostase
- Rolle Lever ChREBP I Kontroll Av Insulinfølsomhet Balanse
- Adipose ChREBP Knytter Lipogenese Til Insulinfølsomhet
- Ny Interaksjon Mellom Hormonfølsom Lipase og ChREBP I Fettvev
- Konklusjon Og Fremtidige Retninger
- Forfatterbidrag
- Finansiering
- Interessekonflikt
Introduksjon
Økt forbruk av enkle sukkerarter som sukrose og høy fruktose mais sirup de siste årene har ført til økt risiko for metabolske sykdommer som fedme, dyslipidemi, type 2 diabetes og/eller ikke-alkoholisk fettleversykdom (NAFLD). Leveren er hovedorganet som er ansvarlig for omdannelse av overflødig diettkarbohydrater til fett. De resulterende triglyserider (TG) kan pakkes inn i lipoproteiner med svært lav tetthet (VLDL) og enten utskilles i sirkulasjonen, lagres som lipiddråper eller metaboliseres gjennom beta-oksidasjonsveien. Insulin utskilles som svar på forhøyet blodsukker, stimulerer ekspresjonen av gener av de novo fettsyresyntese (lipogenese) gjennom transkripsjonsfaktoren sterol regulatorisk elementbindende protein-1c (SREBP-1c) (Foretz et al., 1999). SREBP-1c virker i synergi med en annen transkripsjonsfaktor kalt karbohydratresponselementbindende protein (ChREBP), som formidler responsen på diettkarbohydrater. ChREBP-proteinstrukturen inneholder et lavt glukosehemmende domene (LID) og et glukose-responsaktiveringskonservert element (GRACE) som ligger I Sin n-terminus (Li et al., 2006). Aktivering AV GRACE-domenet ved glukosemetabolitter fremmer Transkripsjonsaktivitet Og binding til En høyt konservert sekvens kalt karbohydratresponselement (ChoRE). ChoRE er tilstede på promotorer Av ChREBP målgener, som koder for nøkkelenzymer av de novo lipogenese, inkludert L-pyruvatkinase (L-pk), et hastighetsbegrensende enzym i glykolyse, fettsyresyntase (Fas), acetyl-CoA karboksylase (Acc) og stearoyl-CoA desaturase (Scd1) (Kawaguchi et al., 2001). En nylig studie rapporterte gjensidig avhengighet mellom ChREBP (aktivert av glukose) og SREBP-1c (aktivert av insulin) for full induksjon av glykolytisk og lipogen genuttrykk i leveren (Linden et al., 2018). Viral reetablering av den nukleare aktive formen AV SREBP – 1c i leveren Av ChREBP-mangelfulle mus (ChREBPKO) normaliserte lipogene genuttrykk, mens det ikke har noen effekt på å redde glykolytisk genuttrykk. Speileksperimentet, der ChREBP-uttrykk ble indusert i leveren AV SREBP-1c knockout-mus, reddet glykolytisk genuttrykk, men overraskende ikke lipogent genuttrykk, til tross for Den kjente Rollen Som ChREBP i kontrollen av fettsyresyntesegener. Likevel antyder denne studien betydningen av Den doble virkningen Av ChREBP og SREBP-1c i kontrollgenene som er involvert i reguleringen av fettsyresyntese (Linden et al., 2018).
ChREBP er svært beriket i leveren og har blitt studert som en master regulator av lipid metabolisme (Iizuka et Al., 2004; Osorio et al., 2016). ChREBP er også signifikant uttrykt i bukspyttkjerteløyer, tynntarm, skjelettmuskulatur og i mindre grad i nyrene og hjernen (se Richards et al., 2017 for gjennomgang). Interessant nok ble en annen isoform Av ChREBP, ChREBPß, som stammer fra en alternativ første eksonpromotor, først identifisert i fettvev (Herman et al ., 2012) og senere beskrevet i andre celletyper (Se Abdul-Wahed et al., 2017 for gjennomgang). Som vi skal diskutere, Er ChREBPß beskrevet som en konstitutivt aktiv isoform. Det er håpet at fremtidig arbeid vil adressere De respektive rollene Til ChREBP og ChREBPß i reguleringen av glukose – og lipidmetabolisme, samt identifisere deres spesifikke og / eller overlappende mål.
ChREBP Struktur Og Regulering Via LID / Grace Domener
ChREBP tilhører Mondo familien av bHLH / Zip transkripsjonsfaktorer. N-terminusdomenet (1-251 rester) inneholder to nuclear export signal (NES) og et nuclear localization signal (NLS) som regulerer subcellulær lokalisering ved å interagere med kromosomregion maintenance 1 (CRM1) også referert til som exportin 1 og/eller 14-3-3 proteiner (Sakiyama et al., 2008). C-terminus-regionen inneholder et polyprolin-domene, et bHLH / LZ-domene (660-737 rester) og et leucin glidelås-lignende domene (Zip-lignende, 807-847 rester) som er forbundet med ko-faktorer OG DNA-binding (Yamashita et al., 2001; Mikkelsen et al., 2010; Ge et al., 2012). Lokalisering og transkripsjonell aktivering av ChREBP bestemmes av næringsstofftilgjengelighet. Glukosemediert regulering Av ChREBP forekommer hovedsakelig på nivået av glukose-sensormodulen (GSM) eller mondo konservert region( MCR), som består av LOKKET og GRACE-domenene ,som nevnt i introduksjonen (Figur 1A; Li et al.(2006; Singh Og Irwin, 2016). I 2012, Herman et al. (2012) beskrev en Annen ChREBP isoform, ChREBPß, som er transkribert fra en alternativ first exon promoter 1b til exon 2 (Figur 1b). Dette transkriptet er oversatt fra exon 4, og genererer et kortere protein av 687 aminosyrer (Full lengde ChREBP isoform, omdøpt, inneholder 864 aminosyrer, kalt ChREBP i manuskriptet) der DE TO NES, NLS og LID-domenet mangler. ChREBPß er svært aktiv i hvitt fettvev PÅ EN GLUT – 4-avhengig måte og anbefales å være direkte regulert av ChREBPa siden en Orksekvens ble identifisert i exon promoter 1β (Herman et al., 2012; Figur 1b). Reguleringen Av ChREBPß av ChREBPa antyder eksistensen av en foroversløyfe som potensielt forverrer responsen på glukose under hyperglykemiske forhold. Reguleringsmekanismen (e) Til ChREBPß isoformen, og enda viktigere dens spesifikke funksjon, må imidlertid klargjøres.
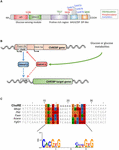
Figur 1. (A) struktur av karbohydratresponselementbindende protein α (ChREBPa). ChREBPa består av 864 aminosyrer og inneholder flere regulatoriske domener. Ved n-endepunktet inneholder proteinet en glukosesensormodul bestående av DET lavglukosehemmende domenet (LID) og det glukoseaktiverte konserverte elementet (GRACE). Proteinet inneholder også et polyprolinrikt, et bHLH / LZ og et leucin-glidelås-lignende (Zip-lignende) domene som ligger På C-terminus. Post-translasjonelle modifikasjoner er angitt i deres respektive rester, fosforylering (rød), acetylering (blå) og de nylig identifiserte O-Glcnacylasjonene (grønn). (B) genstrukturen til ChREBP-genet og genereringen av de to ChREBP-isoformene α og β ChREBPß transkriberes fra en alternativ første exon promoter 1b. dette transkriptet er oversatt fra exon 4 som genererer et kortere protein av 687 aminosyrer der de TO NES, NLS og LID-domenet mangler. ChREBPß Isoform har blitt foreslått å være direkte regulert av ChREBPa siden en Orksekvens ble identifisert i exon promoter 1b. Enten Både chrebp α og β isoformer begge binder seg til Orksekvensen, er det for øyeblikket ikke kjent. Figur tilpasset Fra Herman et al. (2012). (C) Multi-justering Av Ork konsensussekvenser presenterer i flere ChREBP-målgenpromotører. Nukleotider-basert justering er presentert på toppen av figuren sammen med konsensus sekvens Ork beskrevet I Poungvarin et al. (2015). Logoen som svarer til konsensussekvensen knyttet til denne spesielle justeringen er også representert.
Aktivering Av ChREBP Med Glukosemetabolitter
under fastende forhold, glukagonavhengig aktivering av proteinkinase A (PKA) (Kawaguchi et al., 2002) fosforylerer ChREBP på rester Ser196 Og Thr666, som fører Til ChREBP binding til proteinet 14-3-3 og dets oppbevaring i cytosol (Kawaguchi et al ., 2001, 2002; Davies et al., 2008). AMP aktivert proteinkinase (AMPK), en sentral cellulær energisensor, fosforylerer Også ChREBP På rest Ser568, som igjen reduserer bindingen Av ChREBP til promotorer av sine målgener (Kawaguchi et al ., 2002; Sato et al., 2016). Det ble vist at metabolitter generert under fasting, som AMP og ketonlegemer produsert fra fettsyreoksidasjon, spiller en allosterisk hemmende rolle ved å endre ChREBP og 14-3-3 proteinaffinitet, styrke kompleks stabilisering og favorisere cytosolisk retensjon (Sakiyama et al., 2008; Jørgen et al., 2013; Sato et al., 2016). Som svar på karbohydrater er ChREBP regulert på transkripsjonelle, translasjonelle og post-translasjonelle nivåer. Økte glukosekonsentrasjoner etter et måltid fremmer syntesen av intermediære metabolitter som xylulose-5-fosfat (X5P), opprinnelig foreslått som en aktivator av proteinfosfatase 2A (PP2A) (Kawaguchi et al., 2001; Hans Et al., 2003). PP2A ble tidligere beskrevet til defosforylat ChREBP Ved ser196-residuet som tillater translokasjon til kjernen der den blir videre defosforylert PÅ EN X5P – og PP2A-avhengig måte (På Thr666 Og Ser568). Imidlertid ble denne modellen utfordret gjennom årene, og andre metabolitter som glukose-6-fosfat (G6P) ble foreslått å være potensielle aktivatorer Av ChREBP translokasjon/aktivitet (Dentin et al., 2012). McFerrin et al. (2012) identifisert et antatt motiv FOR G6P-binding (253-SDTLFT-258) PÅ GRACE-domenet, som også er bevart I MondoA, En ChREBP / MondoB ortholog (se Richards et al., 2017 for gjennomgang). IFØLGE denne hypotesen KAN G6P fremme en allosterisk konformasjon endring som induserer en åpen konformasjon For ChREBP, tilrettelegge samspillet med co-faktorer og påfølgende translokasjon til kjernen (McFerrin et al., 2012).
Innenfor kjernen Kan ChREBP modifiseres Gjennom O-Glcnacylering, en post-translasjonell modifikasjon avhengig av glukosemetabolismen, og identifiseres for å være viktig for ChREBP transkripsjonell aktivitet (Guinez et al., 2010). O-Glcnacylering forekommer på serin-og treoninrester gjennom Aktiviteten Av o-GlcNAc transferase (OGT), et enzym som tilsetter n-acetylglukosamin (GlcNAc) rester til målproteiner og derved modifiserer deres aktivitet, stabilitet og/eller subcellulær plassering. Jan et al. (2017) avslørte nylig flere ChREBP-rester modifisert Ved O-Glcnacylering. Mutasjoner av disse rester på bHLH / ZIP og dimerization og cytoplasmatisk plassering domene (dcd) domener har tillatt for identifisering Av Thr517 Og Ser839 som viktige områder for glukose-avhengig aktivering Av ChREBP (Figur 1a). ChREBP kan også modifiseres ved acetylering via histonacetyltransferaseaktiviteten til p300 (Bricambert et al., 2010). Glukoseaktivert p300 acetylater ChREBP På Lys672 og øker sin transkripsjonelle aktivitet ved å øke rekrutteringen til Orksekvensen, som er optimal konsensusbindingssekvens Er CAYGYCnnnnnCRCRTG (Figur 1c). Poungvarin et al. (2015) analyserte ChREBP-bindingssteder ved ChIP-seq i lever og hvitt fettvev av mus som ble matet med et høyt karbohydrat, fettfritt kosthold. De rapporterte at ChREBP-binding er beriket i veier involvert i insulinsignalering, vedhengende veikryss og kreft, noe som tyder på en ny involvering av ChREBP i tumorigenese og kreftprogresjon. Videre rapporterte en nylig studie betydningen Av ChREBP i hepatocellulært karsinom (Hcc) (Ribback et al., 2017). Forfatterne fant at genetisk sletting Av ChREBP (I ChREBPKO-mus) svekket hepatokarsinogenese drevet av proteinkinase B / Akt overuttrykk hos mus. Videre resulterte siRNA-mediert hemming av ChREBP i mus og / eller humane hcc-celler i redusert proliferasjon og apoptose.
ChREBP Co-Faktorer Og Partnere
Flere co-faktorer og/eller partnere Av ChREBP ble identifisert de siste årene (se Richards et al., 2017 for gjennomgang). Max som protein x (Mlx), en bHLH/LZ transkripsjonsfaktor, var den første identifisert som en felles bindende partner Av Mondo-familien (Stoeckman et al., 2004). Dimerisering Av ChREBP Med Mlx er nødvendig for både nukleær translokasjon som respons på glukose og binding til Ork-elementer. Nukleære reseptorer som hepatocytt nukleær faktor 4α (HNF4a) og farnesoid X-reseptor (FXR) ble også beskrevet som ChREBP-partnere. HNF4a samhandler fysisk med ChREBP ved å binde seg til den direkte repeat – 1 (DR-1) regionen på promotor Av ChREBP målgener (Adamson et al., 2006; Meng et al., 2016). Videre ble p300 / CBP transkripsjonelle koaktivatorproteiner vist å stabilisere ChREBP / HNF4a-komplekset (Burke et al., 2009). P300 / CBP transcriptional co-activator proteiner spiller en sentral rolle i å koordinere og integrere flere signalavhengige hendelser med transkripsjonsapparatet. En annen viktig egenskap ved p300 / CBP er tilstedeværelsen av histonacetyltransferase (HAT) aktivitet, som gir p300 / CBP kapasitet til å påvirke kromatinaktivitet ved å modulere nukleosomale histoner. I humane hepatocytter utløser fxr-binding til ChREBP-HNF4a-komplekset frigjøring Av ChREBP fra CBP / p300, noe som fører til rekruttering av histondeacetylase SMRT på lpk-promotoren, og virker dermed som en co-repressor Av ChREBP transkripsjonell aktivitet (Caron et al., 2013). I tillegg endrer CBP/p300 HAT-aktivitet ChREBP På Lys 672, noe som fører til transkripsjonell aktivering som respons på glukose (Bricambert et al ., 2010).
Bricambert et al. (2018) nylig identifisert histon demetylase anlegget homeodomain finger 2 (Phf2), som tilhører histon lysin demetylase (KDM7) familien, som en ny co-faktor Av ChREBP. Interaksjon Mellom Phf2 og ChREBP forbedrer Transkripsjonsaktivering Av ChREBP ved å slette H3K9 metylmerker på promotoren av målgenene. Interessant, spesifikk co-rekruttering Av Phf2 Og ChREBP til arrangøren av nukleær faktor erytroid 2 som 2 (Nrf2) bidrar til den beskyttende effekten Av Phf2 mot økt reaktive oksygen arter (ROS)OG NAFLD progresjon i sammenheng med hyperglykemi (Bricambert et al., 2018).
Rolle ChREBP I Karbohydratmetabolismen Og Hepatokin Produksjon
ChREBP Som Regulator Av Hepatisk Fettsyresyntese Og VLDL Sekresjon
Alkoholfri fettleversykdom er et kjennetegn på metabolsk syndrom, og studier på mennesker viser at de novo lipogenese bidrar til ca 25% av totale leverlipider hos pasienter MED NAFLD (Donnelly et al., 2005). I insulinresistente tilstander øker hyperglykemi og hyperinsulinemi lipogenesen delvis ved aktivering Av ChREBP og SREBP-1C. ChREBP hemming i leveren av overvektige og insulinresistente ob / ob mus, gjennom RNAi eller genetisk ablasjon fører til reversering av hepatisk steatose (Dentin et al., 2006; Iizuka et al., 2006). Endret sekresjon AV VLDL i leveren bidrar også til patogenesen AV NAFLD. Mikrosomalt triglyseridoverføringsprotein (mttp) er proteinet som har ansvaret for montering og utskilling av apolipoprotein b-holdige lipoproteiner. Mangel PÅ MTTP hos mus og mennesker forårsaker hypolipidemi og fettlever. Regulering av dette proteinet har vært assosiert med noen svært konserverte cis-elementer i sin promotor, inkludert kritiske positive og negative regulatoriske domener (Cuchel et al., 2013; Hussain et al., 2011). Nylig Ble ChREBP påpekt som en potensiell regulator AV MTTP siden mangel på funksjonell ChREBP i leveren undertrykker Mttp-uttrykk og VLDL-montering og sekresjon (Niwa et al., 2018). Men siden Ingen Ork kunne klart identifiseres på Mttp-promotoren, vil det være behov for ytterligere analyse for å identifisere mekanismen Som ChREBP regulerer Mttp med.
Regulering Av Fruktosemetabolisme Ved ChREBP i Lever Og Tarm
koblingen Mellom ChREBP og fruktosemetabolisme ble først påvist ved fenotypisk analyse Av ChREBP knockout-mus (ChREBPKO-mus). ChREBPKO-mus ble rapportert å dø innen flere dager med høy fruktose diett (HFrD) mating (Iizuka et al., 2004). Denne store intoleransen mot fruktose ble tilskrevet reduksjonen i ekspresjonen av fructokinase og triose kinase, to enzymer som kreves for fruktosemetabolisme (Iizuka et al., 2004). Kim et al. (2016) senere rapporterte Betydningen Av ChREBP for effektiv konvertering av fruktose til glukose i lever og helkroppsfruktoseclearance, men også under inntak av fruktose kunne ChREBP bidra til hyperglykemi ved direkte transaktiverende g6pc-uttrykk, et nøkkelgen av glukoneogenese. Denne effekten kan føre til en ond syklus der fruktoseforbruk forverrer glukoseproduksjonen selv Om ChREBP-aktivitet (Kim Et al ., 2016). Året etter, studien Av Zhang et al. (2017) rapporterte at ChREBPKO-mus matet Med HFrD utvikler alvorlig leverskade på grunn av overaktivering av endoplasmatisk retikulumspenning og CCAAT-enhancer-bindende protein homologt protein (CHOP)-mediert hepatocyttapoptose. Apoptose i hepatocytter hos disse musene var mest sannsynlig knyttet til økt kolesterolbiosyntese siden hemming av DENNE veien via HMG-CoA reduktase (HMGCR) eller SREBP2-hemming reddet ChREBPKO-mus fra HFrD-indusert leverskade. En mangel På ChREBP ble også nylig assosiert med en dysregulering av sukrose og fruktose metabolisme som fører til sukkerintoleranse og malabsorpsjon hos mus (Kato et al., 2018). Disse effektene var forbundet med redusert ekspresjon av intestinal sukrose-isomaltase (SI), som fordøyer sukrose i glukose og fruktose, glukosetransportørene 5 (Glut5) og 2 (Glut2) og ketohexokinase (Khk) enzymet, som regulerer fruktolyse (Figur 2). Dysregulering av disse enzymene kan føre til akkumulering av ufordøyd sukrose og fruktose med potensielle konsekvenser for tarmmikrobiotasammensetningen. Sammenligningen Mellom ChREBPKO og leverspesifikke ChREBP knockout (ChREBPLiverKO) mus matet Med HFrD hadde tidligere avslørt at hepatisk ChREBP-mangel alene ikke fører til fruktoseintoleranse, men At ChREBP-mangel i tynntarmen er mest sannsynlig ansvarlig for nedskrivningen i fruktosetoleranse observert hos disse musene (Kim et al., 2017). Til sammen understreker disse studiene Viktigheten Av ChREBP i reguleringen av fruktosemetabolisme og understreker behovet for bedre forståelse av sin rolle og regulering i tynntarmen.
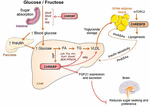
Figur 2. ChREBP regulerer multipler signalering / metabolske veier som respons på glukose og fruktose. ChREBP uttrykkes i flere vev, inkludert tarm, lever og hvitt fettvev. I disse celletypene aktiveres ChREBP som respons på glukose og/eller fruktose og induserer spesifikt genisk program som angitt på figuren. I tarmen ble stimulering AV SI, Glut5, Glut2 og Ketohexokinase (Khk) uttrykk ved ChREBP (enten direkte eller indirekte) beskrevet for å forbedre sukrosetoleranse og fruktoseabsorpsjon. I leveren Er ChREBP en nøkkelmodulator av glykolytisk, lipogen og mikrosomal triglyseridoverføringsprotein (Mttp) genuttrykk, og kontrollerer dermed både fettsyreakkumulering og VLDL-eksport fra leveren. ChREBP regulerer også produksjonen av hepatokiner som fibroblast vekstfaktor 21 (FGF21). Denne lever-til-hjerne-aksen utvider Leverkrebp-funksjonen fra en leverregulator til en systemisk modulator som ikke bare påvirker substrathåndtering i leveren, men også næringsinnstilling. ChREBP-aktivering i hvitt fettvev er knyttet til forbedret metabolsk homeostase ved å produsere beskyttende sirkulerende signaler. En ny klasse av pattedyrlipider karakterisert ved en forgrenet esterbinding mellom en fettsyre og en hydroksy-fettsyre (palmitinsyrehydroksylstearinsyre) ble rapportert å utøve gunstige effekter på glukosehomeostase gjennom direkte og inkretinmediert modulering av β cellefunksjon, forbedret adipose glukoseopptak og redusert betennelse. Interessant nok ble mTORC2 nylig identifisert som en ny regulator av ChREBPß isoform i fettceller.
Regulering AV BDK:PPM1K-Akse I Leveren
det første engasjerte trinnet av forgrenet aminosyre (Bcaa) katabolisme reguleres av det forgrenede ketoacid dehydrogenase (BCKDH) – komplekset som styres av to enzymer, den forgrenede alfa-keto-syre dehydrogenasekinasen (BDK) og proteinfosfatasen, mg2+/Mn22+ avhengig 1K (PPM1K). White et al. (2018) nylig assosiert ChREBP med oppregulering AV BDK og nedregulering AV PPM1K i leveren og identifisert et bevart Ork motiv i promotoren av begge disse genene. En positiv korrelasjon mellom ekspresjonen AV BDK og andre Typiske ChREBP-målgener (Fasn, Pklr, ChREBPß) ble observert hos lever av rotter som fikk et høyt glukose-eller fruktosediett. På fysiologisk nivå førte økning I bdk: PPM1K-forholdet til fosforylering og aktivering AV ATP-citratlyase (ACLY), og stimulerte dermed de novo lipogenese. Disse funnene viser at BDK og PPM1K kan være nye lipogeneseaktiverende gener regulert av ChREBPß. Gitt deres rolle i reguleringen av lipid -, glukose-og aminosyremetabolismen, KAN BDK og PPM1K betraktes som potensielle terapeutiske mål i leveren i nær fremtid (White Et al., 2018).
ChREBP Er Nødvendig For Glukose-Mediert Regulering AV FGF21
ChREBP ble nylig assosiert med produksjon og sekresjon av hepatokiner Som Fibroblast vekstfaktor 21 (FGF21) (Iizuka et al., 2009; Dushay et al., 2015, Iroz et al., 2017). FGF21 er et metabolsk hormon syntetisert av leveren med flere gunstige effekter i perifert vev (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). INNTIL nylig BLE FGF21 ansett som et fastende hormon som forbedrer fettsyreoksydasjon, ketogenese og lipolyse under transkripsjonskontroll av peroksisomproliferatoraktivert reseptor α (PPARa) (Inagaki et al ., 2007). Et Ork På fgf21 promoter har tidligere blitt identifisert i både mus (-74 til -52 bp) og mennesker (-380 til -366 bp) (Iizuka et Al., 2009) men funksjonelle studier har manglet til nylig. Forbruk av glukose og fruktose ble rapportert å føre til en rask økning AV FGF21 nivåer hos friske frivillige og pasienter med metabolsk syndrom (Dushay et al., 2015). Ytterligere studier rapporterte også en mekanistisk sammenheng mellom ChREBP-avledet FGF21 og makronæringsstoffpreferanse gjennom en lever-hjerneakse (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Denne lever-til-hjerne-aksen utvider ChREBP-funksjonen fra en hepatisk metabolsk regulator til en systemisk modulator, som ikke bare påvirker leversubstrathåndtering, men også global matingsadferd (Abdul-Wahed et al ., 2017).
Rolle ChREBP I Inter-Organ Nettverk Som Styrer Energi Homeostase
Rolle Lever ChREBP I Kontroll Av Insulinfølsomhet Balanse
vårt laboratorium tidligere rapportert At ChREBP fungerer som en viktig modulator av lever fatty acid sammensetning og insulinfølsomhet i sammenheng med alkoholfrie og alkoholholdige leversykdommer (se Abdul-Wahed et al., 2017 for gjennomgang). Mus overexpressing ChREBP utviklet større hepatisk steatose enn kontroller, men interessant holdt seg fri for metabolske komplikasjoner og utviklet ikke insulinresistens. Lipidomisk analyse har vist at ChREBP-mediert steatose er assosiert med en reduksjon i mettede fettsyrer og en økning i enumettede fettsyrer, sistnevnte som har vist seg å være assosiert med ChREBP-medierte gunstige effekter på insulinfølsomhet (Benhamed et al., 2012). Disse resultatene viser Rollen Som ChREBP i lipid partisjonering og tyder på at spesifikke lipid arter, når de er tilstede på riktig sted og tid, kan utløse signaler som modulerer tilpasning til metabolsk stress (Benhamed et al., 2012; Bricambert et al., 2018). Interessant, Jois et al. (2017) foreslo også en beskyttende rolle for hepatisk ChREBP angående hele kroppen glukose homeostase og insulinfølsomhet. ChREBPLiverKO-mus utviser forverret glukosetoleranse, mens de er beskyttet mot hepatisk steatose. Hepatisk ChREBP-sletting resulterte også i endringer i genuttrykk i hvite og brune fettvev, noe som tyder på inter-vevskommunikasjon. Bidraget Av ChREBP til hele kroppen energibalanse kan derfor stole på sin regulering av lipid arter og / eller hepatokin produksjon bidrar til inter vev koordinering av energi homeostase (Jois et al ., 2017).
Adipose ChREBP Knytter Lipogenese Til Insulinfølsomhet
Nedsatt insulinsignalering i fettvev er et kritisk trekk ved insulinresistens. Studier har rapportert at ChREBP-aktivering i hvitt fettvev kan forbedre metabolsk homeostase ved å produsere beskyttende sirkulerende signaler (Yore et al., 2014; Jørgen et al., 2016). En klasse av pattedyrlipider karakterisert ved en forgrenet esterbinding mellom en fettsyre og en hydroksyfettsyre, palmitinsyre hydroksylstearinsyre (PAHSA), ble rapportert å utøve gunstige effekter på glukosehomeostase gjennom direkte og inkretinmediert modulering av β cellefunksjon, glukoseopptak og reduksjon i betennelse (Yore et al., 2014). På samme måte er adipose-spesifikk ChREBP knockout (ChREBPadiposeKO), som viser lave lipogenesefrekvenser i fettvev, insulinresistente med nedsatt insulinvirkning i lever, muskel og hvitt fettvev under både chow og høyt fett diettforhold. ChREBPadiposeKO-mus har lavere serumnivåer Av Pahsa, MENS PAHSA-tilskudd, spesielt 9-PAHSA-isomeren, redder ChREBPadiposeKO global insulinresistens og fettvev betennelse, bekrefter at tap av adipose-ChREBP er tilstrekkelig til å forårsake insulinresistens (Vijayakumar et al., 2017). En nylig studie identifiserte det mekanistiske målet for rapamycin complex 2 (mTORC2) som en ny regulator av ChREBP (spesielt den β isoformen) i adipose celler. Spesifikk ablation av rapamycin-ufølsom følgesvenn av mTOR (Rictor)i modne adipocytter svekket insulinstimulert glukoseopptak i fettvev som førte til nedregulering Av ChREBPß og målgenuttrykk involvert i lipogenesekontroll (Tang et al ., 2016). I samsvar med en viktig crosstalk fra adipose–leveren mediert Av ChREBP, er disse effektene forbundet med leverinsulinresistens og forbedret glukoneogenese. Til sammen støtter disse studiene en viktig rolle for adipose ChREBP ved å utløse insulinfølsomme signaler (Tang et al., 2016).
Ny Interaksjon Mellom Hormonfølsom Lipase og ChREBP I Fettvev
ChREBP ble nylig identifisert som en partner av det lipolytiske enzymet hormonfølsom lipase (HSL)i fettvev (Morigny et al., 2019). Knockdown AV HSL i humane adipocytter og mus fettvev ble vist å øke insulinfølsomheten og indusere forlengelsen av svært langkjedet fettsyre enzym (Elovl6). Elov16 er et mikrosomalt enzym som regulerer forlengelsen Av C12 – 16 mettede og enumettede fettsyrer på En ChREBP-avhengig måte (Morigny et al., 2019). På mekanistisk nivå svekket fysisk interaksjon MELLOM HSL og ChREBP nukleær translokasjon Av ChREBPa og påfølgende induksjon Av ChREBPß og målgener, spesielt Elovl6 (Morigny et al ., 2019). Denne studien avslører en ny regulering for ChREBP i fettvev. Hemming av interaksjonen MELLOM Hsl og ChREBP kan føre til potensielle terapeutiske strategier for å forbedre insulinfølsomheten i fettceller.
Konklusjon Og Fremtidige Retninger
ChREBP er nå en veletablert karbohydratsensor. Selv om de fleste studier har vært dedikert til dens implikasjon i kontrollen av glykolytiske og lipogene veier, har nyere data også unraveled nye bidrag Av ChREBP i hepatocytter og i fettceller hvor det kan være medvirkende til å produsere hepatokiner og/eller lipokiner som utløser inter-organ crosstalk. Som diskutert kan nylig identifiserte ko-faktorer (epigenetiske modifikatorer) og/eller partnere (adipose HSL) i disse vevene også representere potensielle terapeutiske strategier for NAFLD og / eller for å forbedre systemisk insulinfølsomhet. Nylige studier har også støttet Betydningen Av ChREBP i reguleringen av fruktosemetabolisme og har understreket behovet for bedre forståelse av sin rolle og regulering i tynntarmen. Til slutt vil det være spesielt viktig å identifisere spesifikke og/eller overlappende mål For ChREBPa og ChREBPß i nøkkelcelletyper, samt å bestemme deres spesifikke innvirkning på insulinfølsomhet i de kommende årene.
Forfatterbidrag
alle forfattere oppført har gjort et betydelig, direkte og intellektuelt bidrag til arbeidet, og godkjent det for publisering.
Finansiering
postic ‘ s lab (U1016-Institut Cochin) støttes av tilskudd Fra ChroME-Nettverket (Marie Curie Skł Handling H2020-MSCA-ITN-2015-675610), Stiftelsen For Medisinsk Forskning (FRM) (DEQ20150331744) OG ANR-15-CE14-0026-hepatokind.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.