- Introduksjon
- Multipul Funksjoner Av Chymase
- Chymase I Mastceller
- Flere Enzymatiske Funksjoner Av Chymase
- Enzymatisk Funksjon Av Chymase I NASH
- Involvering Av Chymase I Nash Dyremodeller
- Effekt Av Chymasehemmer I Nash Dyremodeller
- Effekt Av Chymasehemmer I Nash Dyremodeller
- Mekanisme For Leverbetennelse Svekket Av Chymasehemmer
- Mekanisme For Hepatisk Steatose Svekket Av Kymasehemmer
- Mekanisme For Hepatisk Fibrose Svekket Av Kymasehemmer
- Konklusjon
- Forfatterbidrag
- Interessekonflikt
Introduksjon
IKKE-alkoholisk fettleversykdom (NAFLD) har blitt anerkjent som den vanligste formen for leversykdom (Angulo, 2002; Clark et al., 2002). Ikke-alkoholisk steatohepatitt (NASH) etterligner alkoholisk hepatitt til tross for fravær av en historie med drikking (Ludwig et al., 1980). NAFLD og NASH er assosiert med metabolsk syndrom som følge av fedme, insulinresistens, hyperlipidemi og hypertensjon. NAFLD anses å være den vanligste leversykdommen og presenterer vanligvis som enkel hepatisk steatose (Tiniakos et al., 2010). I motsetning er NASH preget av alvorlig steatose, lobulær betennelse og fibrose i leveren (Powell et al.( 1990; Bertot Og Adams, 2016). Selv om mekanismen som er ansvarlig for utviklingen AV NASH fortsatt er uklar, foreslås NASH å være forårsaket av en ‘multiple-hit’ prosess, med hepatisk steatose som ‘første hit’ og påfølgende treff som betennelse, oksidativt stress og endotoksiner (Tilg Og Moschen, 2010). NASH er nært knyttet til metabolsk syndrom, og flere kliniske studier har undersøkt terapeutisk behandling AV NASH ved å fokusere på symptomene på diabetes, hyperlipidemi og hypertensjon (Georgescu et al ., 2009; Park et al., 2010; Jørgen et al., 2011). Imidlertid er det ikke etablert noen allment aksepterte terapeutiske midler.
Chymase kan være involvert i patogenesen av hepatisk fibrose. Chymase aktivitet ble signifikant økt i lever av pasienter med fibrose eller cirrhose, og det var en signifikant korrelasjon mellom chymase nivå og grad av fibrose (Komeda et al., 2008). Selv om økt chymaseaktivitet ikke er rapportert hos pasienter MED NASH, er det observert i dyremodeller AV NASH (Tashiro et al., 2010; Masubuchi et al., 2013; Jørgen et al., 2017). I motsetning til dette resulterte hemming av chymase ved bruk av lavmolekylære hemmere i en signifikant reduksjon av betennelse, steatose og fibrose i rotte-OG hamster NASH-modeller (Tashiro et al., 2010; Masubuchi et al., 2013; Jørgen et al., 2017). Disse funnene indikerer at chymase kan være involvert i betennelse, steatose og fibrose under utvikling og progresjon AV NASH (Figur 1).
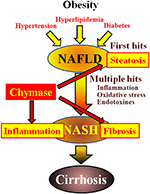
FIGUR 1. NAFLD og NASH er knyttet til metabolsk syndrom av fedme, insulinresistens, hyperlipidemi og hypertensjon. NASH antas å utvikle seg via en «multiple-hit» – prosess, med hepatisk steatose som» første hit » og påfølgende treff som betennelse, oksidativt stress og endotoksiner, og er preget av alvorlig steatose, betennelse og fibrose. Chymase kan være involvert i utviklingen av steatose, betennelse og fibrose i leveren.
Multipul Funksjoner Av Chymase
Chymase I Mastceller
Chymase (EC 3.4.21.39) uttrykkes i sekretoriske granuler av mastceller. Chymase produseres som en inaktiv prochymase i sekretoriske granulater, og krever dipeptidylpeptidase I (DPPI) for aktivering. DPPI er en tiol proteinase og dens optimale pH er 6,0. Den optimale pH-verdien er i samsvar med dppis foreslåtte funksjon for å aktivere prochymase, siden pH i sekretoriske granulater reguleres ved pH 5,5 (De Young et al . 1987) (Figur 2). Imidlertid har chymase ingen enzymatisk aktivitet i mastceller ved denne pH, fordi den optimale pH for chymase er mellom 7 og 9 (Takai et al., 1996, 1997). Etter aktivering av mastcellegranuler ved stimuli som betennelse og skade, frigjøres chymase og utviser enzymatisk funksjon ved optimal pH 7.4 (Figur 2).
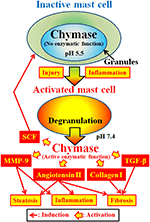
FIGUR 2. Chymase lagres i sekretoriske granuler av inaktive mastceller. PH i granulat opprettholdes ved pH 5,5, en tilstand der chymase ikke har noen enzymatisk aktivitet. Kymase har enzymatiske funksjoner, som dannelse av angiotensin II, mmp-9, TGF-β, kollagen i og SCF, ved frigjøring fra mastcellegranulat, etter aktivering ved betennelse og skade.
Flere Enzymatiske Funksjoner Av Chymase
Chymase er en serinprotease og spalter den C-terminale siden av proteiner etter aromatiske aminosyrer som Phe, Tyr og Trp generelt. Chymase kan spalte Phe8-His9 binding av den ikke-bioaktive peptid angiotensin i og danne sin bioaktive peptid angiotensin II i pattedyr vev inkludert human (Urata et al., 1990; Tore et al., 1996, 1997). I tillegg spalter chymase enzymatisk forløperne av matriksmetalloproteinase (MMP)-9, transformerende vekstfaktor (TGF)-β og kollagen I til deres aktive former (Kofford et al., 1997; Ingeborg et al., 2003; Furubayashi et al., 2008). Videre kan enzymatisk funksjon av chymase produsere stamcellefaktor (SCF) ved enzymatisk spaltning AV den inaktive membranbundne formen AV SCF, som induserer dannelsen av modne mastceller fra umodne mastceller via stimulering av c-kit-reseptor (Longley et al., 1997). Kymase har således flere enzymatiske funksjoner, inkludert aktivering av angiotensin II, mmp-9, TGF-β, kollagen I og SCF (Figur 2).
Enzymatisk Funksjon Av Chymase I NASH
Angiotensin II kan fremme hepatisk steatose og betennelse ved å øke reaktive oksygenarter (ROS) etter stimulering av angiotensin II-reseptorer i DYREMODELLER (Hirose et al., 2007; Jørgen et al., 2009). Angiotensin II induserte også hepatisk fibrose via induksjon av α-glatt muskelaktin (SMA) i hepatiske stellatceller (HSCs) (Yoshiji et al., 2001). MMP-9 er rapportert å indusere infiltrasjon av nøytrofiler og makrofager via nedbrytning av intercellulære matriser som vitronektin og fibronektin, noe som resulterer i økt betennelse (Medina et al., 2006). HOS nash-pasienter ble det observert en signifikant økning AV MMP-9 genuttrykk i leveren sammenlignet med normale kontroller (Ljumovic et al ., 2004). Hepatisk overuttrykk AV TGF – β hos transgene mus ga alvorlig hepatisk fibrose via økning av prokollagen I – genuttrykk (Casini et al., 1993). Både TGF-β dannelse og kollagen i akkumulering er kjent for å indusere hepatisk fibrose. Aktivering AV SCF induserer økning i mastcelletall, og dens enzymatiske funksjon kan resultere i en økning av chymase aktivitet i fibrotiske vev (Maruichi et al., 2004). Disse enzymatiske funksjonene til chymase kan være involvert i steatose, betennelse og fibrose, som alle observeres i lever AV nash-pasienter og dyremodeller (Figur 2).
Involvering Av Chymase I Nash Dyremodeller
metionin-og kolin-mangelfull (MCD) diett har blitt mye brukt til å indusere en typisk NASH-modell. I hamstere matet MCD-dietten ble det observert signifikante økninger i total bilirubin, triglyserid og hyaluronsyre i plasma (Tashiro et al., 2010). Videre ble akkumulering av inflammatoriske celler og økning av lipid innskudd område og fibrotisk område observert i leveren. I DENNE mcd-diettinduserte nash-modellen ble hepatisk kymaseaktivitet og relaterte faktorer, som angiotensin II, mmp-9 og kollagen I, signifikant økt (Tashiro et al ., 2010; Masubuchi et al., 2013). Nylig ble det utviklet en ny nash-modell hvor slag-utsatt spontant hypertensive 5/Dmcr (SHRSP5 / Dmcr) rotter ble matet et høyt fett og kolesterol (Hfc) diett (Kitamori et al., 2012). Denne modellen viste symptomer på metabolsk syndrom som antas å ligne klinisk PÅ NASH-pasienter (Kitamori et al., 2012). I den hfc-diettinduserte nash-modellen ble hypertensjon og hyperlipidemi observert, og alvorlig steatose, fibrose og inflammatorisk celleakkumulering ble påvist i leveren (Miyaoka et al., 2017). Videre ble det observert en signifikant økning av chymaseaktivitet sammen MED MMP-9, TGF-β og kollagen I i leveren (Miyaoka et al ., 2017). Dermed ser det ut til å være et nært forhold mellom chymase og nash patogenese i dyremodeller AV NASH.
Effekt Av Chymasehemmer I Nash Dyremodeller
Effekt Av Chymasehemmer I Nash Dyremodeller
en lavmolekylær chymasehemmer svekket signifikant chymaseaktivitet og reduserte angiotensin II, MMP-9 og kollagen i nivåer i leveren i EN MCD diett-matet nash hamster modell, når administrering av inhibitoren ble initiert samtidig MED MCD dietten (Tashiro et al ., 2010; Masubuchi et al., 2013). Chymasehemmeren forhindret signifikant hepatisk steatose, fibrose og inflammatorisk celleakkumulering i DENNE nash-modellen (Tashiro et al ., 2010; Masubuchi et al., 2013). Oksidativt stress antas å spille en rolle i ‘multiple-hit’ teorien OM nash utvikling, og styrking av oksidativt stress markør malondialdehyd ble betydelig svekket i leveren av chymase inhibitor (Masubuchi et al ., 2013). I en hamster MCD diett-indusert NASH modell, chymase inhibitor viste en bedøvende effekt når det gis i etablerte NASH (Masubuchi et al., 2013). Graden av både steatose og fibrose i leveren ble redusert sammenlignet med før administrering av chymasehemmeren (Masubuchi et al., 2013).
i leveren til en hypertensiv rotte HFC diettindusert NASH-modell, dempet en lavmolekylær chymasehemmer nivåene av chymase samt MMP-9, TGF-β og kollagen I, som alle er chymase-assosierte faktorer (Miyaoka et al., 2017). Chymasehemmeren svekket signifikant hepatisk steatose og fibrose, og reduserte myeloperoksidase som en markør for betennelse, spesielt for nøytrofilinfiltrasjon (Miyaoka et al., 2017). I denne HFK-diettinduserte modellen var overlevelsen til den placebobehandlede gruppen 0% ved 14 uker etter STARTEN AV hfk-dietten, og resulterte fra alvorlig leversvikt (Miyaoka et al ., 2017). Den kymasehemmerbehandlede gruppen, der rottene ble behandlet med kymasehemmeren umiddelbart etter starten AV hfc-dietten, viste imidlertid 100% overlevelse etter 14 uker. Videre ble en 50% overlevelse rapportert for rotter behandlet med chymasehemmeren som begynte 8 uker etter starten AV HFC diettmating, hvor NASH ble etablert (Miyaoka et al., 2017).
derfor kan chymasehemmere være nyttige midler for forebygging og forbedring AV NASH i dyremodeller. På den annen side fremmer angiotensin II også indirekte leverbetennelse, steatose og fibrose via økning AV MMP-9 og TGF-β genuttrykk. BÅDE MMP-9 og TGF – β er nært involvert i patogenesen AV NASH, men disse faktorene er ikke nødvendigvis bare indusert av angiotensin II (Takai et al., 2010). Andre faktorer enn angiotensin II-stimulering bidrar til økningen AV MMP-9 og TGF-β genuttrykk (Takai et al., 2010). I slike tilfeller er angiotensin II reseptorblokker (ARB) ikke i stand TIL å dempe VIRKNINGEN AV MMP-9 og tgf-β, men en kymasehemmer kan imidlertid ha dempende effekter via hemming AV AKTIVERING AV MMP-9 og tgf-β, noe som indikerer en potensiell behandlingsregime for forebygging AV nash-progresjon.
Mekanisme For Leverbetennelse Svekket Av Chymasehemmer
Chymasehemmer var i stand til å redusere betennelse i hamster MCD diett-og rotte hfc diett-induserte NASH modeller (Tashiro et al., 2010; Masubuchi et al., 2013; Jørgen et al., 2017). Behandling med kymasehemmer svekket signifikant chymaseaktivitet i leveren samt reduserte angiotensin II-og MMP-9-nivåer (Tashiro et al., 2010; Masubuchi et al., 2013; Jørgen et al., 2017). I HSC induserer angiotensin II ROS-generasjon som hydrogenperoksid og superoksid gjennom aktivering av nikotinamid-adenindinukleotidfosfat (NADPH) oksidase (De Minicis og Brenner, 2007). Chymasehemmer resulterte i reduksjoner i genuttrykk AV NADPH-oksidasekomponenten Rac-1 og oksidativt stressmarkør malondialdehyd i tillegg til en reduksjon av angiotensin II-nivåer i en HAMSTER MCD-indusert NASH-modell (Masubuchi et al ., 2013). Angiotensin II-indusert styrking AV ROS fremmet mmp-9 genuttrykk i nøytrofiler og makrofager (Yaghooti et al., 2011; Kurihara et al., 2012). Derfor hemmer chymasehemmer direkte aktiveringen av proMMP-9 TIL MMP-9 og indirekte reduserer MMP-9 genuttrykk via redusert angiotensin II. MMP-9 spalter ekstracellulære matriksbestanddeler, som vitronektin og fibronektin, fører til oppløsning av leverintegritet og induserer infiltrering av makrofager og nøytrofiler (Medina et al., 2006). I en HFC diettindusert nash-modell ble det observert en signifikant økning i myeloperoksidaseuttrykk i makrofager og nøytrofiler i leveren, og ble redusert av chymasehemmer (Miyaoka et al., 2017). Mekanismen for betennelse som dempes av chymasehemmer kan derfor være avhengig av reduksjon av angiotensin II-og mmp-9-nivåer i leveren.
Mekanisme For Hepatisk Steatose Svekket Av Kymasehemmer
Angiotensin II kan påvirke hepatisk steatose via ROS-produksjon. I murine HSC, en inhibitor AV NADPH oksidase betydelig redusert ROS produksjon og EN ARB bremset utviklingen av leversteatose via demping AV ROS produksjon (Hirose et al., 2007; Guimarã et al., 2010). I EN MCD-diettindusert nash-musemodell ble det observert en signifikant demping av steatose hos angiotensin II-reseptormangel (Nabeshima et al ., 2009). Både in vivo og in vitro eksperimenter viste at angiotensin II oppregulert sterol regulatory element-binding protein (SREBP)-1c og fettsyre syntase (FAS) genuttrykk, som begge er viktige faktorer i reguleringen av lipogenese, ETTER ROS augmentation (Kim et al., 2001; Hongo et al., 2009). I motsetning til dette svekket ARB hepatisk steatose sammen med nedregulering av genuttrykket AV SREBP-1c og FAS via ROS-demping i en MUS NASH-modell (Kato et al., 2012). I en hamster MCD diettindusert nash-modell ble signifikant demping av SREBP-1c og FAS genuttrykk observert etter behandling med en lavmolekylær chymasehemmer (Masubuchi et al., 2013). Derfor kan forbedringsmekanismen for hepatisk steatose av kymasehemmer være avhengig av reduksjon AV ROS-produksjon via redusert angiotensin II-generasjon i leveren.
Mekanisme For Hepatisk Fibrose Svekket Av Kymasehemmer
Kymase kan være nært forbundet Med utviklingen av vevsfibrose, siden Det bidrar TIL dannelsen AV TGF-β fra DEN ikke-bioaktive forløperen TGF-β, OG TGF-β er kjent for å sterkt indusere vekst av fibroblaster (Takai et al., 2003; Øystein et al., 2011). TGF-β er kjent for å spille en sentral rolle i utviklingen av fibrose hos nash-pasienter via aktivert HSC (Williams et al ., 2000). Hemming AV tgf-β funksjon via genuttrykk og signalering resulterte i forbedret hepatisk fibrose i eksperimentelle modeller (George et al., 1999; Arias et al., 2003). I en hfk-DIETTINDUSERT nash-modell hos rotter resulterte demping av kymaseaktivitet med kymasehemmer i reduksjoner I TGF-β-nivå og fibrotisk område i leveren (Miyaoka et al., 2017). Reduksjonen I tgf-β av kymasehemmer kan derfor bidra til forebygging av leverfibrose.
Angiotensin II kan også være involvert i induksjon av hepatisk fibrose. Angiotensin II induserer sammentrekning og proliferasjon AV HSC, og induserer også genuttrykk AV TGF-β i fibroblaster in vitro (Kagami et al ., 1994; Bataller et al., 2000). BÅDE tgf-β nivåer og graden av kollagenakkumulering og fibrotiske lesjoner ble observert ved gallekanalligering hos villtype mus, men disse ble dempet i angiotensin II-reseptormangel (Yang et al ., 2005). I en rotte NASH-modell svekket ARB også hepatisk fibrose via reduksjon AV TGF-β genuttrykk (Hirose et al., 2007). Det kan også være en sammenheng mellom angiotensin II og hepatisk fibrose annet enn angiotensin II-indusert tgf-β genuttrykk. HOS pasienter med kronisk hepatitt C reduserte ARB kollagengenuttrykk via rac-1 genuttrykk (Colmenero et al., 2009). HSC er anerkjent som de viktigste produserende cellene av kollagen i leveren, og forsterkning i uttrykket av α-glatt muskelaktin (SMA) i HSC induserer sterkt ekstracellulær matriksavsetning, inkludert kollagen I (De Minicis og Brenner, 2007). Angiotensin II kan indusere α-SMA genuttrykk i rotte HSC. I motsetning resulterer angiotensin II-blokkering i demping av hepatisk fibrose sammen med reduksjon av α-SMA (Yoshiji et al., 2001). Selv om det ikke ble evaluert hos pasienter MED NASH, ble både chymase OG angiotensin II-dannende aktiviteter signifikant forsterket i fibrotiske regioner av lever fra pasienter med cirrhose, og signifikante korrelasjoner mellom chymase, angiotensin II-dannende aktivitet og hepatisk fibrose ble observert (Komeda et al., 2008). I en hamstertetrakloridindusert levercirrhose-modell ble det observert signifikante økninger i kymase-OG angiotensin II-dannende aktivitet, som ble signifikant svekket sammen med levercirrhose etter behandling med en lavmolekylær kymasehemmer (Komeda et al., 2010).
mastcellestabilisatoren tranilast kunne hemme aktiveringen av mastceller, blokkere frigivelsen av chymase og dermed forhindre utvikling av leverfibrose i en rottediabetes og HFC diettinducert nash-modell (Uno et al., 2008). Chymase fremmer spredning av mastceller via scf-aktivering ved sin enzymatiske funksjon (Longley et al., 1997). I nash dyremodeller reduserte chymasehemmer økningen i mastcelletall i leveren, noe som resulterte i redusert chymaseaktivitet etter direkte hemming av chymasehemmer og en indirekte reduksjon av chymaseuttrykk i mastceller (Masubuchi et al ., 2013; Jørgen et al., 2017).
derfor kan kymasehemmer bidra til forebygging av leverfibrose via hemming AV TGF-β aktivering ved hemming av kymasehemming og / eller demping AV TGF-β nivå via reduksjon av angiotensin II og mastcelleproliferasjon.
Konklusjon
Metabolsk syndrom bestående av fedme, insulinresistens, hyperlipidemi og hypertensjon er nært knyttet til utviklingen AV NASH, og studier av antidiabetika, anti-hyperlipidemiske og antihypertensive midler har blitt utført for behandling AV NASH. Konseptet bak disse midlene er å dempe symptomene på metabolsk syndrom (Georgescu et al., 2009; Park et al., 2010; Jørgen et al., 2011). Tidligere rapporter har vist at chymaseinhibitor demper betennelse og fibrose uten å påvirke blodsukker og lipidnivåer og blodtrykk i dyremodeller av henholdsvis diabetes, hyperlipidemi og hypertensjon (Inoue et al., 2009; Ingeborg et al., 2014; Zhang et al., 2016). Derfor er konseptet bak chymasehemming å dempe leverbetennelse og fibrose av NASH direkte. Vi foreslår at chymaseinhibitor rettet mot metabolsk syndrom er en potensielt kraftig strategi for demping AV nash-progresjon.
Forfatterbidrag
ST og DJ: skrev manuskriptet. Begge forfatterne leste og godkjente det endelige manuskriptet.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.