Innledning
Helsetjenesteassosierte infeksjoner (Hai) som bakteriemi forårsaket av multiresistente Pseudomonas aeruginosa stammer resultere i en økt sykelighet og dødelighet, forlenge sykehusinnleggelse, og høyere kostnader sammenlignet med de infeksjoner forårsaket av følsomme stammer.1-3 Infeksjoner forårsaket av disse resistente mikroorganismer er ofte forbundet med alder, kreft, hjertesykdom, diabetes, intensiv bruk av antibiotika og invasive prosedyrer som hemodialyse, mekanisk ventilasjonskateter, trakeostomi og andre.4
den økende forekomsten av multiresistent P. aeruginosa som årsak til nosokomial infeksjon er et globalt problem, en konsekvens av denne mikroorganismens evne til å utvikle resistens mot nesten alle andre antimikrobielle midler under antimikrobiell kjemoterapi, enten ved valg av mutasjoner i kromosomale gener eller ved horisontal genoverføring.5,6 I Brasil er dette problemet enda mer signifikant, siden det er en svært høy tetthet av antibiotikabruk, spesielt β-laktamer, karbapenemer og fluorokinoloner.7,8 motstanden I P. aeruginosa til karbapenemer er opptil 60% hos Enkelte Brasilianske sykehus9, 10 og forekommer hovedsakelig ved produksjon av metallo-β-laktamaser (MBL).
Ti underklasser AV MBL-enzymer er kjent: IMP (Imipenemase), VIM (Verona Imipenemase), SPM-1 (Sã Paulo MBL), GIM (tysk Imipenemase), SIM-1 (Seul Imipenemase),11 AIM-1 (Australsk Imipenemase),12 KHM (Kyorin Universitetssykehus),13 NDM-1 (New Delhi MBL),14 DIM-1 (nederlandsk imipenemase),15 Og Tmb (tripoli mbl).16 I Brasil er DE mest utbredte underklassene IMP-1 OG SPM-1.11
Flere andre virulensgener samt biofilmdannelse kan bidra til patogeniteten av alvorlige infeksjoner, spesielt de som er forbundet med invasive prosedyrer.17 Blant de viktigste virulensfaktorene som er beskrevet i litteraturen, fremhever vi de som er relatert til overholdelse av mikroorganismer til vertsceller gjennom flagella, fimbriae og alginat18 og de som letter forstyrrelsen av epithelial integritet og forstyrrer immunsystemet, som elastase, fosfolipase C Og protease alkalisk, ytterligere eksotoksin A, pyocyanin og pyoverdin.19 biofilmproduksjonen er spesielt forbundet med vanskeligheten med antibiotika for å trenge inn i cellene, siden de utskiller en polymermatrise bestående av polysakkarider, proteiner og DNA.20,21
målet med denne studien var å identifisere risikofaktorer forbundet med bakteriemi forårsaket av karbapenemresistent p. aeruginosa samt produksjon AV MBL. I tillegg undersøkte vi frekvensen av virulensgener og deres evne til å danne biofilm.
Materialer og metoderpasienter og sykehus
P. aeruginosa-stammer ble gjenfunnet fra pasienter innlagt på Uberlandia Universitetssykehus (Brasil), Federal University Of Uberlâ (HC-UFU), og hentet fra Mikrobiologilaboratoriet TIL HC-UFU, i perioden Fra Mai 2009 til desember 2012, med tanke på bare den første infeksjonsepisoden.
Studiedesign
vi gjennomførte en casestudie (pasienter med bakteriemi på Grunn Av p. aeruginosa resistent mot karbapenemer) versus kontroll (pasienter med bakteriemi forårsaket Av p. aeruginosa mottakelig for karbapenemer) for å identifisere risikofaktorer blant pasienter infisert Med P. aeruginosa motstandsdyktig mot karbapenemer. I tillegg evaluerte vi sekundære utfall, inkludert perioder med sykehusinnleggelse, opptak til intensivavdelingen (ICU) og bruk av invasive prosedyrer. Demografiske, kliniske og epidemiologiske karakteristika for hver pasient som ble inkludert i studien, ble gjenfunnet fra de kliniske journalene.
Definisjoner
Helsetjenesteassosierte infeksjoner (Hai) er definert som enhver infeksjon ervervet etter pasientens innleggelse på sykehus. HAIs kan oppstå under sykehusinnleggelse eller etter utslipp, siden de er relatert til sykehusinnleggelse eller prosedyrer utført under sykehusinnleggelsen.22 Bakteriemi,ifølge Centers For Disease Control And Prevention, kan 23 defineres som tilstedeværelse av levedyktige bakterier i blodet dokumentert av et positivt blodkulturresultat. Bakteriemi ble klassifisert som primær når den ikke var relatert til et annet infeksjonsfokus eller når det var relatert til et intravenøst kateter, og sekundært når det var klinisk relatert til infeksjon på et annet anatomisk sted.9 Multidrugsresistens er definert som ervervet ikke-følsomhet for minst ett middel i tre eller flere antimikrobielle kategorier.24 den antimikrobielle behandlingen ble ansett som upassende når en isolert mikroorganisme presenterte in vitro resistens mot antimikrobielle midler brukt til behandling av pasienten og / eller mangel på behandling i 24 timer etter diagnose av mikrobielle infeksjoner.25
Klinisk mikrobiologisk og molekylær testing
Kulturer ble samlet inn i henhold til protokollen som Ble brukt av Mikrobiologilaboratoriet I HC-UFU og ble behandlet ved hjelp av det automatiserte systemet BACT / Alert® (Biomé, Durham, USA). Identifikasjons-og antimikrobielle følsomhetstester ble utført ved automatisering VED BRUK AV VITEK II-systemet, og stammene som viste mellomliggende følsomhet ble ansett som resistente. Kvalitetskontrollprotokoller ble brukt i henhold til standardene Fra Clinical And Laboratory Standard Institute.26-28 den karbapenem-resistente P. aeruginosa-isolater ble fenotypisk screenet FOR MBL-produksjon ved bruk av synergitester med dobbel disk, som tidligere beskrevet.29,30 i tillegg, for å vurdere tilstedeværelsen AV MBL-gener I p. aeruginosa-stammer, ble en MULTIPLEX PCR utført, som beskrevet tidligere.31 sykkelforholdene var: 94 hryvnias C i 5 minutter, etterfulgt av 30 denatureringssykluser ved 94 hryvnias C i 30 år, gløding ved 53 hryvnias C i 45 år og forlengelse ved 72 hryvnias C i 30 år, etterfulgt av endelig forlengelse ved 72 hryvnias C i 10 minutter, alt i En MasterCycler personlig (Eppendorf). Påvisning av virulensgener som kodifiserer alkalisk protease (aprA), elastase a (lasA), elastase (lasB),32 hemolytisk fosfolipase C (plcH), ikke-hemolytisk fosfolipase c (plcN), eksotoksin a (toxA) og alginat (algD)33 ble bestemt av uniplex PCR ved bruk av følgende protokoll: 94°C i 3 min, 30 sykluser ved 94°C i 30s, 55°C i 1 min og 72 i 1 min og 30s og 72°c for 5min.
initial adhesjonsanalyse34
for å evaluere initial adhesjon ble 200µ av en cellesuspensjon inneholdende 1×107celler / mL tilberedt I TSB tilsatt til polystyrenplater med 96 brønner. Innledende vedheft ble tillatt å forekomme i 2h ved 37°C med rotasjon ved 120rpm. Bakterier festet i 96-brønns polystyrenplater ble vasket to ganger med en 0,9% nacl-løsning og høstet ved å skrape brønnene i 90-tallet. den oppnådde cellesuspensjonen ble belagt PÅ tsa for kolonidannende enhet (CFU) oppregning. Alle eksperimenter ble gjort i tre eksemplarer i tre uavhengige eksperimenter. Stammen ATCC15692 (PAO1) ble brukt som en positiv kontroll og TSB uten bakterier ble brukt som en negativ kontroll.
biofilmformasjonsanalyse 35
200µ av cellesuspensjon inneholdende 1×107celler / mL tilberedt I TSB ble tilsatt til 96-brønns polystyrenplater. Biofilmdannelse ble tillatt i 24 timer ved 37°C med rotasjon ved 120rpm. Bakterier dyrket i 96-brønns polystyrenplater ble vasket to ganger med en 0,9% nacl-løsning og igjen tørket i omvendt stilling. Den totale biomassen ble målt ved metanol (Merck) fiksering, krystallfiolett (Merck) farging og syreeddik (Merck) eluering som tidligere beskrevet. Eluert fargestoff ble fjernet fra hver brønn og plassert i en ny 96-brønns mikrotiterplate, og absorbansen ble lest på EN ELISA plateleser (BioTek Instruments Inc. Vermont, usa) på 570nm. Forsøkene ble gjort med åtte replikater for hver stamme i tre uavhengige eksperimenter. TSB uten bakterier ble brukt som en negativ kontroll. Optical density cut – off value (ODc) ble etablert som tre STANDARDAVVIK (SD) over gjennomsnittet av den optiske tettheten( OD) av negativ kontroll: ODc=gjennomsnittlig od av negativ kontroll+3X SD av negativ kontroll. For enklere tolkning av resultatene ble stammer delt inn i følgende kategorier i henhold til optisk tetthet: (ODi): ODi≤ODc Eller ODc
ODi2x ODc=ikke-biofilmprodusent / svak biofilmprodusent; 2x ODcODi4x ODc=moderat biofilmprodusent; 4x ODcODi=sterk biofilmprodusent.Biofilmcellekonsentrasjon36
biofilmcellekonsentrasjonen ble bestemt VED CFU-opplisting. Etter biofilmdannelse ble biofilmene vasket to ganger med en 0,9% nacl-løsning og høstet etter skraping av brønnene i 90-tallet. den oppnådde cellesuspensjonen ble belagt på TSA-plater. Alle eksperimenter ble gjort i tre eksemplarer, ved tre uavhengige anledninger.
Statistisk analyse
Statistisk analyse ble utført Ved Hjelp Av GraphPad Prism v. 5 (GraphPad Software, San Diego, CA). Kvantitative analyser ble sammenlignet Ved Bruk Av Kruskal-Wallis, ved bruk Av dunns multiple sammenligningstest. Alle testene ble utført med et konfidensnivå på 95% og statistisk signifikans ble definert som p
0,05.Etisk godkjenning
forskningsetikkutvalget Ved Federal University Uberlandia evaluerte og godkjente vår studiedesign.
Resultater
fra 1.Mai 2009 til 31. desember 2012 ble en sykehusovervåkning av forekomsten Av p. aeruginosa bakteriemi utført i mikrobiologilaboratoriet På Universitetssykehuset. I denne perioden ble 157 ikke-repeterende pasienter med p. aeruginosa bakteriemi inkludert i studien. Detaljert informasjon om faktorer knyttet til utviklingen av bakteriemi og de kliniske og demografiske egenskapene, samt fordelingen av pasienter ved avdelinger, er vist i Tabell 1 og 2. Den primære bakteriemi forekom hos 75,8% og de med ukjent fokus utgjorde i 62.4% av tilfellene. Sekundær bakteriemi utgjorde 24,2% av pasientene, hvor luftveiene var hovedfokus for infeksjon (17,2%). Videre hadde 43,9% av pasientene bakteriemi Med karbapenemresistent p. aeruginosa, og de fleste av disse pasientene ble innlagt på INTENSIVAVDELINGEN. De fleste pasientene var menn (66.8%), med et gjennomsnittlig sykehusopphold på 63.2±80.17 dager og en gjennomsnittsalder på 52.01±20.24 år.
Fordeling Av Pasienter infisert Med Pseudomonas aeruginosa i ulike enheter I Klinisk Sykehus Ved Federal University Of Uberlâ Fra Mai/2009 til desember/2012.
| Klinikker | Totalt | Karbapenemresistente Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| Kirurgi | 35 (22.3) | 16 (23.2) |
| Medisinsk klinikk | 24 (15.3) | 10 (14.5) |
| Onkologi | 14 (8.9) | 2 (2.9) |
| Akuttmottaket | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| Neonatal ICU | 2 (1.3) | 0 |
| Pediatrisk INTENSIVAVDELING | 2 (1.3) | 1 (1.5) |
| Transplantasjon | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
Intensivavdeling.
Burneds, thorax smerte enhet.
Risikofaktorer forbundet med karbapenemresistens hos pasienter med bakteriemi forårsaket Av Pseudomonas aeruginosa.
| Risikofaktorer | Totalt | Karbapenemresistent | Multisensitivea | Univariate | Multivariate | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | OR (KI 95%) | p | |
| Alder-gjennomsnitt (år) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Mann / kvinne | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| tidspunkt for sykehusinnleggelse, gjennomsnittlig (dager) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| Intensivavdelingen | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Kirurgi | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| Invasive prosedyrer (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Venøst sentralt kateter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| Kirurgisk avløp | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Probes enteral / gastrisk ernæring | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hemodialyse | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| parenteral ernæring | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Komorbiditet | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| Hjertesvikt | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Kreft | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| Kronisk nyresvikt | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| Humant immunsviktvirus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| Primær bakteriemi | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| Central line kateter relatert | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Ukjent | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Sekundær bakteriemi | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| Luftveiene | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| Urinveis | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| Upassende terapi | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| Tidligere bruk av antibiotika | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| Dødelighet | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive stammer ble vurdert som de som presenterte følsomhet for alle testede antimikrobielle midler.
Odds ratio.
Konfidensintervall.
p-verdi.
gjennomsnittlig alvorlighetsgrad av sykdomsscore.
Statistisk signifikant(P≤0,05).
tidligere bruk av antibiotika (78,3%), invasive prosedyrer (88,5%), komorbiditeter (77,7%) og tidligere kirurgi (43,9%) var vanlig. Det ble funnet at 31,2% av pasientene fikk utilstrekkelig behandling, og dødeligheten var 58,6%. Flere indre og ytre faktorer for utvikling av bakteriemi ved stammer Av P. aeruginosa resistent mot karbapenemer ble påvist ved univariate analyser. Kun mekanisk ventilasjon, enteral / nasogastrisk tuber, primær bakteriemi med ukjent fokus og uhensiktsmessig behandling var risikofaktorer uavhengig forbundet med utvikling av karbapenemresistent p. aeruginosa bakteriemi.
MBL-produksjonen ble analysert for 56 karbapenemresistente p. aeruginosa-isolater. Ni (25,0%) isolater var fenotypisk positive og totalt 16,1% (n= 9/56) var i samsvar MED AMPLIKONENE MBL-gener, som var 10,71% blaSPM-1 og 5.3% blaVIM-gener generelt viste stammene en multiresistensprofil. For andre virulensgener evaluert (aprA, plcH, plcN, lasA, lasB, toxA og algD) viste alle stammer en høy frekvens (88%).
blant de 88 karbapenemfølsomme p. aeruginosa-stammene var 21 (23,9%) resistente mot andre β-laktamer. For 69 stammer resistente mot karbapenemer var resistensprofilen høy: β-laktam 50/69 (72,5%), fluorokinoloner 48/69 (69,6%) og aminoglykosider 50/69 (72,5%) (Tabell 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
I TILLEGG TIL MBL-forskning ble fem stammer valgt (to inneholdende SPM-1, en inneholdende VIM og to fenotypisk positive FOR MBL) til evalueringen av biofilmdannelsen ved hjelp av kvantitative analyser av total biomasse ved farging med krystallviolett. MED TANKE på TILSTEDEVÆRELSEN AV MBL-gener ble alle stammer identifisert som sterkt biofilmprodusenter med et gjennomsnitt på 0,90±0,61 biomasse. Forskjeller i innledende adhesjon av individuelle stammer ble ikke observert. Det var imidlertid en lavere OD for stammen som inneholdt blaVIM-genet (Fig. 1).
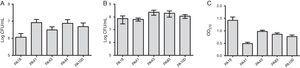
(A) antall celler festet til en polystyrenoverflate etter 2 timer, uttrykt som log CFU / mL for 5 prøver Av Pseudomonas aeruginosa isolert fra blod. (B) antall levedyktige celler i biofilmen (log CFU/mL). (C) Biomasse av biofilm uttrykt som optisk tetthet av krystallviolett (OD570nm).
Diskusjon
bakteriemi forårsaket av multiresistente mikroorganismer, Enten Gram-positive eller Gram-negative, har ofte blitt beskrevet som et betydelig helseproblem som øker sykehuskostnadene og gjør det vanskelig å etablere en passende antimikrobiell behandling, noe som resulterer i en dårligere prognose.37 den høye andelen sykehusbakteremi forårsaket Av p. aeruginosa resistent mot karbapenemer indikerer betydningen av denne organismen som en betydelig årsak til denne infeksjonen på sykehuset vårt. Den høye andelen sykehusbakterier forårsaket Av p. aeruginosa resistent mot karbapenemer indikerer betydningen av denne organismen som en betydelig årsak til denne infeksjonen på vårt sykehus. Resultatene fra ulike studier har antydet at iboende risikofaktorer som mekanisk ventilasjon, bruk av et nasogastrisk rør og tidligere bruk av antibiotika øker risikoen for bakteriemiutvikling forårsaket Av p. aeruginosa resistent mot karbapenemer, samt risikoen for sykelighet og dødelighet.38
i denne studien var mer enn 50% av risikofaktorene forbundet med infeksjon av denne mikroorganismen i henhold til univariate analyser. Kun mekanisk ventilasjon, enteral/gastrisk materør, primær bakteriemi av ukjent opprinnelse og uhensiktsmessig behandling ble vurdert som uavhengige risikofaktorer ved multivariat analyse.
et sentralt venekateter er en av de viktigste risikofaktorene for ervervet bakteriemi på sykehuset, da det var forbundet med mer enn 90% av disse infeksjonene.39 selv om det ikke var en signifikant risikofaktor i denne studien, hadde 85,5% av pasientene med bakteriemi Med karbapenemresistent p. aeruginosa denne invasive prosedyren.
ofte har bakteriemi forårsaket Av p. aeruginosa resistent mot antibiotika en høyere dødelighet på grunn av spesielt administrering av upassende antibiotikabehandling.40 i denne studien undersøkte vi en kohorte av 157 pasienter med bakteriemi forårsaket Av p. aeruginosa-stammer, med 69 av dem infisert av karbapenemresistente p. aeruginosa-isolater. Total mortalitet var høyere i karbapenem-resistente gruppen; tilstedeværelsen av resistente stammer var imidlertid signifikant assosiert med upassende antimikrobiell behandling, noe som viste at denne gruppen vanligvis har en dårligere prognose. I likhet med våre funn viste tidligere studier At P. aeruginosa isolert fra pasienter som fikk upassende behandling, hadde en verre prognose, med priser på 46,1% 41 og 53,8%.42
i Tillegg til å være forbundet med alvorlige infeksjoner, resulterer resistens mot karbapenem i P. aeruginosa ofte i PRODUKSJON AV MBL.43 våre resultater viste at karbapenem-resistente P. aeruginosa var utbredt i hele sykehuset med gener som koder for disse enzymene i 16,1% av stammene, som er 10,7% av genotype blaSPM-1 og 5,4% av genotype blaVIM. Siden frekvensen av multiresistente stammer var høy, tyder disse resultatene på at andre motstandsmekanismer sameksisterer i disse stammene, for eksempel efflukspumper og membranets ugjennomtrengelighet.44
forekomsten AV MBL som resistensmekanisme har økt, spesielt i Latin-Amerika.45 I Brasil, utbredelsen AV MBL-produserende P. aeruginosa varierer mellom ulike regioner og mellom sykehus, med priser fra 7,5% til 44%.11
SPM-1-enzym regnes som det vanligste I Brasil, etterfulgt AV IMP-1,11,46, men det har også vært en økning i frekvensen Av P. aeruginosa-isolater som inneholder VIM-enzym.45,47 i vår studie BLE SPM – 1-enzymet påvist i 16,7% av fenotypisk produserende PRØVER AV MBL, etterfulgt AV VIM-enzym, som ble påvist i 8,3% av tilfellene. Disse resultatene indikerer en betydelig spredning AV MBL-kodende gener i vår region.
Med tanke på TILSTEDEVÆRELSEN AV MBL og biofilmproduksjon ble 100% av stammene klassifisert som sterke produsenter. En Annen Studie i Brasil fant at 40% av p. aeruginosa klassifisert som sterk biofilmproduserende var OGSÅ MBL-produsenter.35 vi tror at disse resultatene er viktige når disse egenskapene (biofilmproduksjon og MBL) overlapper og infeksjoner forårsaket av disse bakteriene er vanskelige å behandle. Dette er delvis begrunnet, fordi veksten av bakterier i biofilmen er omtrent 64 ganger mer resistent mot antimikrobielle.48
S. aeruginosa har et stort antall ekstracellulære virulensfaktorer som også bidrar til patogeniteten og alvorlighetsgraden av disse infeksjonene, slik som kodet av aprA, plcH, plcN, lasA, lasB, toxA og algD-gener.32,33 våre data viste at tilstedeværelsen av en multiresistent profil, i de fleste stammene (88%) var positiv for aprA, plcH, plcN, lasA, lasB, toxA og algD virulensgener, bortsett fra i en stamme som ikke viste toxA og plcH gener, noe som ytterligere kan bidra til en verre prognose forbundet med alvorlige infeksjoner.
våre resultater bekrefter tidligere funn om risikofaktorer for utvikling Av P. aeruginosa carbapenem-resistente bakteriemi, samt spredning AV MBL-produserende stammer AV SPM-1 type. Denne studien bidrar imidlertid til ytterligere bevis på spredning AV MBL-produserende stammer, spesielt VIM-typen, i svært virulente stammer og sterkt biofilmprodusenter.
Interessekonflikter
forfatterne erklærer ingen interessekonflikter.