Introduction
Helicobacter pylori (H. pylori) est une bactérie microaérophile à Gram négatif, dont l’habitat naturel est l’estomac. Bien qu’il ait généralement une forme bacillaire avec plusieurs flagelles à une extrémité, il adopte un aspect coccoïde dans des conditions environnementales défavorables.1,2
H. pylori est un facteur étiologique majeur dans la gastrite chronique active, l’ulcère peptique, le lymphome du tissu lymphoïde associé à la muqueuse gastrique (MALT) et le cancer gastrique. Bien que l’on estime que la bactérie est présente dans la muqueuse gastrique de la moitié de la population mondiale, ces maladies ne se développent que chez environ 15 à 20% des individus colonisés.2,3
Les schémas thérapeutiques les plus courants ont abouti à un taux d’éradication d’environ 85% dans de nombreuses zones géographiques4-6, mais leur efficacité a été compromise, en particulier ces dernières années, par l’émergence rapide de souches résistantes aux antibiotiques et une mauvaise observance du traitement.5,7
Il est important de considérer que la guérison (ainsi que la prévention des complications) de la gastrite chronique active et de l’ulcère peptique et de certaines formes de lymphome gastrique de MALT de bas grade dépend du succès de l’éradication de H. pylori. En outre, assurer et maintenir l’éradication réussie de ce microorganisme sous toutes ses formes biologiques empêcherait la recrudescence de l’infection et, par conséquent, les rechutes de la maladie.
Le but de cette revue est de présenter un aperçu général de la forme coccoïde de H. pylori, en mettant en évidence son profil microbiologique, sa sensibilité aux antibiotiques et sa virulence. Son implication dans la maladie gastrique sera également analysée, et la mesure dans laquelle elle est associée à une recrudescence d’infection et à une rechute de la maladie sera examinée.
Survie et adaptation cellulaire de H. Considérations générales
Tous les organismes vivants sont équipés de mécanismes leur permettant de survivre dans des environnements défavorables. Pour certains, leur réponse implique (en plus des adaptations métaboliques) des modifications de la morphologie cellulaire.8,9 Plusieurs microorganismes ont la capacité de se différencier en un état viable mais non cultivable (VBNC) en réponse à des conditions environnementales défavorables à la survie et à la croissance. Cette stratégie est largement utilisée par des microorganismes tels que Salmonella, Campylobacter et Escherichia.10,11
À l’état VBNC, les bactéries diminuent généralement leur taille et changent de forme pour devenir de petits corps sphériques. Ils réduisent leur vitesse de respiration et leur transport de nutriments et modifient l’expression des gènes et la synthèse moléculaire. Dans cet état, ils ne peuvent pas être détectés à l’aide de techniques de culture conventionnelles. Cependant, des changements dans les conditions environnementales peuvent conduire ces microorganismes à « revivre » (et à se reconvertir à leur état actif) ou à dégénérer.10-13
De même, H. pylori, lorsqu’il subit des conditions environnementales néfastes (dans ou en dehors de son habitat naturel), change sa forme bacillaire classique et entre dans un état VBNC qui entraîne des changements morphologiques et métaboliques ainsi que des modifications du comportement de croissance.14,15
État viable mais non cultivable de H. pylori
Bien que certains auteurs aient initialement essayé de démontrer que la conversion de la forme bacillaire en forme coccoïde était un processus passif qui entraînait la mort cellulaire et, par conséquent, que les formes coccoïdes étaient les restes dégénérés de bactéries mortes,16, 17 trois formes de H. on considère actuellement que des pylores existent, à savoir (dans l’ordre du plus ou du moins virulent), la forme bacillaire viable et culturable, la forme coccoïde VBNC et la forme dégénérative non viable.18-20
Morphologiquement, la conversion de la forme bacillaire à la forme coccoïde se fait par des formes intermédiaires en V et en u13,14 (Fig. 1 et 2), dans lesquelles les structures cellulaires telles que le cytoplasme et la membrane cellulaire restent intactes, 15, 21 tandis que les flagelles ont tendance à s’enrouler autour de la structure cellulaire coccoïde, devenant ainsi presque invisibles. D’autres modifications ultrastructurales de la forme coccoïde entraînent deux sous-types. Le type A a des bords irréguliers avec une surface rugueuse et est considéré comme une cellule morte, tandis que le type B a une surface plus lisse, est plus petit et est considéré comme une cellule vivante.21,22
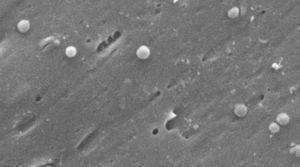
Images de la forme coccoïde d’Helicobacter pylori. Microscope électronique à balayage image reproduite avec l’aimable autorisation du Dr Nuno F. Azevedo. LEPABE – Département de Génie Chimique de la Faculté d’Ingénierie de l’Université de Porto (Portugal).
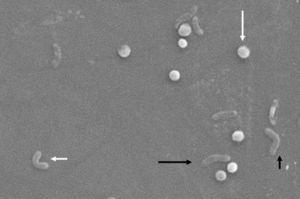
Changements morphologiques chez Helicobacter pylori. Forme en spirale (longue flèche noire), forme en V (courte flèche noire), forme en U (courte flèche blanche) et forme coccoïde (longue flèche blanche). Microscope électronique à balayage image reproduite avec l’aimable autorisation du Dr Nuno F. Azevedo. LEPABE – Département de Génie Chimique de la Faculté d’Ingénierie de l’Université de Porto (Portugal).
Dans les analyses au microscope électronique à balayage (MEB) de la couche de gel muqueux de surface de patients atteints d’un cancer gastrique infectés par H. pylori, Ogata et al.23 a observé la coexistence de formes bacillaires et coccoïdes. D’autres auteurs ont confirmé la présence de la forme coccoïde à la fois dans l’estomac humain et dans le duodénum24-26, bien qu’il semble que le pourcentage de formes coccoïdes soit plus élevé dans le duodénum que dans l’estomac, au point où seule la forme coccoïde est observée dans certaines biopsies duodénales.26,27 Ce fait suggère soit que H. pylori est obligé de s’adapter aux conditions biologiques du duodénum ou que ces conditions sont idéales pour que H. pylori s’y réfugie dans l’état VBNC.
Des expériences in vitro et in vivo ont montré que, dans des conditions défavorables telles que l’aérobiose, 28, 29 un pH alcalin, 29, 30 une température élevée, 31 de longues périodes d’incubation, 29, 32 une incubation prolongée dans l’eau33 ou un traitement avec des inhibiteurs de la pompe à protons32 ou des antibiotiques,34 le phénotype coccoïde peut maintenir un certain niveau d’activité métabolique, car il exprime une grande variété de gènes présents sous forme bacillaire,35 maintient des niveaux détectables d’activité uréasique,36 continue la synthèse protéines, mais en plus petites quantités (moins de 1% de la quantité de protéines synthétisées par le forme bacillaire) 37 et produit de petites quantités d’ADN, maintenu même après 3 mois de stockage en solution saline physiologique à 4°C. 29,38 Toutes ces données soulignent le fait que les changements biologiques chez H. pylori en réponse à des stimuli nocifs reflètent sa puissante capacité, au cours de sa vie utile, à préserver l’espèce.
Formation de biofilm
Comme pour d’autres bactéries, la capacité de H. pylori à persister en tant qu’entité infectieuse et à résister à l’arsenal d’agents antimicrobiens visant à l’éradiquer est due à la variabilité génétique qui lui permet de développer une résistance bactérienne. Sa stratégie de survie est encore améliorée lorsque les cellules bactériennes forment ce qu’on appelle des biofilms.20 Les biofilms sont une sorte de « communauté » microbienne dans laquelle les bactéries adhèrent fermement aux surfaces biotiques ou abiotiques au moyen d’une matrice auto-produite. Cette matrice, composée de substances polymères extracellulaires, 39,40 crée un environnement très tolérant aux agents antimicrobiens et fortement résistant à la phagocytose. Divers mécanismes de défense de l’hôte sont donc éludés, ce qui rend l’éradication difficile. Les biofilms sont considérés comme des systèmes dynamiques vraiment complexes qui facilitent le transfert horizontal de gènes entre les bactéries. Ils confèrent ainsi à des populations bactériennes de nouveaux génomes modifiés qui contribuent de manière significative à la résistance bactérienne, à la variabilité des souches et à l’adaptabilité.41-43
Dans une étude portant sur 21 biopsies de patients chez lesquels la bactérie avait déjà été éradiquée, H. pylori a été isolé par culture dans 7 des biopsies, tandis que les techniques d’expression génique ont détecté des cellules H. pylori viables dans la plupart des biopsies. Le MEB, quant à lui, a montré des bactéries coccoïdes groupées disposées dans un biofilm microbien, suggérant que les formes coccoïdes pourraient faciliter la persistance bactérienne et la résistance aux antibiotiques.44
Sensibilité aux antibiotiques de la forme coccoïde
De nombreuses études ont montré que H. pylori peut passer de la forme bacillaire à la forme coccoïde lors d’une exposition (in vitro) à divers agents antimicrobiens. Différentes concentrations d’amoxicilline, de clarithromycine, de métronidazole et d’érythromycine (pour ne citer que quelques-uns des antibiotiques disponibles) peuvent induire cette transformation morphologique.34,35,45 L’effet d’induction le plus important a été observé avec l’amoxicilline, 27, 34, 46 connue pour être très efficace in vitro contre H. pylori ; cependant, les observations morphologiques des cultures montrent que les formes bacillaires diminuent en nombre au profit des formes coccoïdes.34,46 Faghri et coll., 47 a obtenu des effets bactéricides pour les formes coccoïdes, à plus de 60% avec le métronidazole à deux fois la concentration inhibitrice minimale (CMI), et à 80-90% avec la clarithromycine au CMI; cependant, le traitement à l’amoxicilline par CMI et CMI × 2 n’a pas inhibé les formes coccoïdes viables. De même, Berry et al.34 a observé que si l’amoxicilline à la CMI× 10 éliminait les formes bacillaires de H. pylori, elle induisait également la formation de formes coccoïdes. Perkins et coll.48 a observé, dans une étude sur des chats infectés naturellement par H. pylori, que 6 semaines après le traitement d’éradication, les sucs gastriques étaient positifs pour H. pylori chez un seul chat, mais l’analyse par réaction en chaîne par polymérase (PCR) a identifié le matériel génétique de H. pylori chez tous les chats de l’étude. Même si H. pylori a été détecté chez un seul chat, les lésions histologiques étaient compatibles avec une gastrite chronique et étaient marquées par la présence de follicules lymphoïdes.
Compte tenu de ces données microbiologiques et de recherche fondamentale, dans une étude précédente menée chez des patients infectés par H. pylori — où la sensibilité des souches isolées à l’amoxicilline a été préalablement déterminée — la bithérapie (inhibiteurs de la pompe à protons et amoxicilline) a obtenu un taux de guérison des souches sensibles à l’amoxicilline de seulement 66%. Ce résultat démontre la présence d’importants facteurs de résistance bactérienne indépendants supplémentaires liés à l’utilisation réussie de cet antibiotique.49 Ceci est particulièrement vrai si l’on considère qu’il semble impossible que les formes coccoïdes puissent être sensibles aux antibiotiques β-lactames, car les formes coccoïdes ont des profils protéiques de liaison à la pénicilline différents des formes bacillaires.50 Il est donc probable que tous les organismes de H. pylori ne soient pas complètement éliminés après un traitement d’éradication; il est plutôt probable que certains soient convertis en formes coccoïdes et deviennent ainsi résistants aux médicaments antibactériens. Cela expliquerait l’échec du traitement et la recrudescence.13,34,45
Il convient de souligner que certaines études très récentes ont démontré que les acides gras libres, tels que l’acide linolénique et l’acide linolénique liposomal, ont un effet bactéricide sur les deux formes de H. pylori, quelle que soit leur résistance aux antibiotiques.51,52 Ces molécules pourraient donc avoir un effet antimicrobien potentiellement efficace dans le traitement de l’infection par H. pylori, notamment sous sa forme coccoïde.
Virulence et pathogénicité de la forme coccoïde
Les facteurs de virulence de la forme bacillaire de H. les pylores et les mécanismes par lesquels cette bactérie est impliquée dans le développement de maladies gastro-intestinales ont été largement étudiés.1,3,4 Cependant, on sait peu de choses sur la virulence et la pathogénicité de la forme coccoïde. Ci-dessous, nous passons en revue les conclusions les plus pertinentes sur ce sujet.
Comme la forme bacillaire, la forme coccoïde exprime des gènes de virulence majeurs, tels que l’uréE, l’ureB, hpaA, vacA et cagA, cagE et BabA.35,53,54 Cette expression, qui se produit sur une longue période, joue probablement un rôle important dans les troubles chroniques sévères de l’estomac.
Adhérence de H. les pylores de l’épithélium gastroduodénal sont connus pour être une étape importante dans l’induction d’une inflammation chronique active de la couche muqueuse. Des études SEM ont montré que la forme coccoïde de H. pylori peut se présenter à la surface de la membrane plasmique des cellules épithéliales gastriques et, comme la forme bacillaire, a la capacité d’envahir ces cellules.15,55 En cas d’invasion cellulaire, les formes coccoïdes sont enfermées dans des vésicules membranaires à double couche et les cellules épithéliales gastriques apparaissent gonflées et lytiques, montrant une érosion de la couche muqueuse.56 Étant donné que la forme coccoïde est moins sensible aux antibiotiques, on pense que ces formes de membrane plasmique latente peuvent se propager et infecter d’autres cellules épithéliales voisines en l’absence d’une concentration efficace d’antibiotiques.57
L’infection à H. pylori est également connue pour induire une réponse immunitaire locale qui ne parvient pas à éradiquer la bactérie, permettant ainsi à la maladie gastrique de devenir chronique. La réponse immunitaire peut être déterminée par détection d’anticorps à l’aide de méthodes sérologiques développées à l’aide de la forme bacillaire de H. pylori.58 En effet, la présence de ces anticorps spécifiques peut être utilisée comme indicateur épidémiologique de l’infection et pour confirmer le succès du traitement. Il n’existe cependant aucune méthode sérologique permettant de détecter les formes coccoïdes. Afin de déterminer si les formes coccoïdes ont eu un effet quelconque sur la réponse immunitaire chez les individus colonisés, Figueroa et al.59 a mis au point une technique de dosage immuno-enzymatique spécifique (ELISA) pour évaluer et comparer la réponse immunitaire aux formes coccoïdes et bacillaires à un panel de sérums provenant d’individus infectés symptomatiques et asymptomatiques. Les formes coccoïdes de H. il a été démontré que les pylores induisent une réponse immunitaire humorale similaire à celle induite par les formes bacillaires chez les individus infectés. Dans une autre étude menée chez des enfants souffrant de douleurs épigastriques, le rôle possible de la forme coccoïde dans l’infection à H. pylori a été examiné à l’aide d’une technique ELISA et d’antigènes préparés à partir de formes de cellules bacillaires et coccoïdes. Il a été constaté que 13,3% et 55,8% des cellules étaient séropositives pour les antigènes de la forme bacillaire et de la forme coccoïde, respectivement, alors que les valeurs de séropositivité pour les enfants asthmatiques n’étaient que de 7,0% et 26,5%, respectivement. Cette différence à peu près quadruple de séropositivité entre les antigènes coccoïdes et bacillaires chez les patients symptomatiques et asymptomatiques pourrait suggérer un rôle infectieux possible de la forme coccoïde de H. pylori.60
Cellini et coll.61 suspensions concentrées inoculées par voie intragastrique de H. pylori sous forme coccoïde dans un modèle de souris BALB/c. H. pylori a été isolé 2 semaines plus tard, des modifications histopathologiques sont survenues 1 mois plus tard et toutes les souris colonisées ont montré une réponse anticorps systémique à H. pylori. Dans d’autres expériences avec des souris BALB / c, des animaux inoculés avec des formes coccoïdes ont développé des changements pathologiques importants dans l’estomac, y compris des lésions érosives et une infiltration cellulaire inflammatoire de la muqueuse gastrique.36 She et coll., 53 afin de comparer virulence et infectiosité, des souris BALB/c inoculées par voie intragastrique avec H. pylori, un groupe avec la forme bacillaire et un deuxième groupe avec la forme coccoïde. Lors de l’examen SEM d’échantillons des 2 groupes, ils ont observé l’adhérence des formes bacillaires et coccoïdes aux cellules épithéliales de la paroi gastrique et la présence de flagelles dans les formes coccoïdes. L’examen histologique a montré différents degrés de lésions dans la muqueuse gastrique, de l’infiltration cellulaire inflammatoire légère aux érosions et aux ulcères. La lésion de la muqueuse était plus légère chez les souris infectées par la forme coccoïde, tandis qu’un résultat positif n’a pas été obtenu dans le groupe témoin ayant reçu de l’eau stérile.53 Rabelo-Gonçalves et coll.62 a montré que les formes coccoïdes de H. pylori a induit une réponse inflammatoire aiguë dans l’estomac des souris dès les premiers stades de l’infection. Les résultats ci-dessus mettent en évidence la capacité des formes coccoïdes à coloniser et à infecter la muqueuse gastrique in vivo.
Plusieurs études ont révélé la présence de la forme coccoïde dans l’eau.33,63 Une de ces études — réalisée par notre groupe — a comparé 2 groupes de souris Wistar sevrées, l’une ayant administré de l’eau de puits et de l’eau du robinet pendant une période prolongée et l’autre de l’eau distillée stérile, constatant que les souris du groupe d’étude ont développé un processus inflammatoire chronique avec formation de plaques lymphocytaires et présence de bacilles compatibles avec H. pylori.64
Comme mentionné précédemment, il serait logique de supposer que, dans des conditions défavorables, H. pylori entre dans un état « quiescent », modifiant sa forme bacillaire classique en forme coccoïde sans produire de modifications dégénératives de son génome et conservant la capacité de revenir à la forme bacillaire une fois que les conditions de l’environnement ou de l’habitat naturel se sont améliorées.
La participation de la forme coccoïde à la récurrence
de H. pylori après une éradication réussie est rare dans les pays développés par rapport aux pays en développement, avec des taux de récurrence annuels de 2,67% et 13%, respectivement.65,66
Il existe deux types de récurrence de l’infection à H. pylori: la recrudescence, lorsque la souche bactérienne responsable de la récidive est génétiquement identique à celle isolée avant l’éradication; et la réinfection, lorsque la récidive est causée par une souche différente.67 La différenciation entre la recrudescence et la réinfection nécessite une analyse par PCR ou par polymorphisme génétique pour identifier les souches bactériennes.67,68 Étant donné que ces méthodes ne sont pas couramment appliquées, il est souvent impossible de faire la différence entre la recrudescence et la réinfection dans la pratique clinique de routine.
H. la récidive de pylori est cliniquement pertinente, car une rechute d’ulcère peptique peut être observée chez une proportion considérable de patients infectés, alors que la réapparition de microorganismes pourrait expliquer certaines récidives de lymphome de MALT après le traitement.69 Des facteurs tels que la consommation d’eau du robinet, les maladies dentaires et gingivales, l’amygdalite récurrente, l’hospitalisation, l’équipement dentaire et médical et le contact avec les membres de la famille sont censés affecter la récurrence de H. pylori.70-72 Les autres facteurs associés à la récurrence de l’infection sont l’âge plus jeune, le diabète chez les jeunes patients, le faible revenu annuel et l’inhibition à long terme de l’acide gastrique après l’éradication.73-76
La recrudescence est considérée comme la raison la plus probable de récidive au cours de la première année suivant l’éradication, tandis que la réinfection peut survenir après une période plus longue.68,77 De nombreux cas de récidive dans les pays développés sont en réalité dus à la recrudescence. La réinfection est plus fréquente dans les pays en développement, car les gens sont apparemment constamment exposés à H. pylori.65,78
Utilisant des techniques d’électrophorèse des protéines en gel de polyacrylamide, Costas et al.79 ont constaté que les patients présentant une récidive 4 semaines après le traitement d’éradication n’étaient en fait pas infectés par une autre souche de H. pylori; au contraire, la souche à l’origine de l’infection initiale n’avait pas été complètement éradiquée par le traitement, ce qui a entraîné une recrudescence de l’infection. Par conséquent, il est important de prendre en compte l’efficacité du schéma thérapeutique: H. la récidive de pylori est fréquente chez les patients traités par des thérapies à faible efficacité, mais est rare lorsque des thérapies à haute efficacité sont utilisées. Ceci a été démontré par une étude sur l’incidence de la récurrence de H. pylori en Espagne par Gisbert et al., 80 l’oms a constaté que la récidive de H. pylori 6 mois après l’éradication était de 8,2% chez les patients traités par des traitements à faible efficacité, mais seulement de 1,7% chez les patients traités par des traitements à haute efficacité.
Dans une étude menée en Corée de 2007 à 2010, H. les taux de récidive de pylori ont été analysés après 6 mois de traitements d’éradication réussis de première et de deuxième intention, avec un suivi annuel – jusqu’à la fin de la période d’étude – basé sur des tests respiratoires, une biopsie de l’estomac et des tests rapides d’uréase.81 Il a été constaté que les taux de récidive annuels au cours et après le suivi de 2 ans étaient de 9,3% et 2,0%, respectivement, après le traitement de première intention, et de 4,5% et 2,9%, respectivement, après le traitement de deuxième intention. Les auteurs ont conclu que H annuel. les taux de récidive de pylori chez les patients ayant reçu un traitement d’éradication ont fortement diminué après la période de suivi de 2 ans. Cela a été considéré comme suffisamment de temps après le traitement pour confirmer l’éradication, et également suffisamment de temps pour permettre une distinction entre récidive et recrudescence des souches de H. pylori.81
Considérations finales et conclusions
Compte tenu de la capacité de H. pylori pour entrer dans un état VBNC lorsqu’il est soumis à des conditions défavorables à l’intérieur ou à l’extérieur de son habitat, il est raisonnable de supposer que les schémas de traitement antibiotique utilisés pour éradiquer la forme bacillaire de H. pylori peuvent induire des formes coccoïdes VBNC capables de survivre pendant de longues périodes dans l’environnement gastroduodénal. De là, ils peuvent avoir un potentiel pathogène direct et indirect qui entraîne une recrudescence de l’infection et, par conséquent, des échecs de traitement, des rechutes d’infection et une récurrence de la maladie gastroduodénale. Une éradication réussie peut donc nécessiter non seulement l’éradication des formes bacillaires mais également des formes coccoïdes, ou s’assurer que les formes coccoïdes ne sont pas induites.
Étant donné que les méthodes de routine actuellement mises en œuvre dans la pratique clinique pour confirmer l’éradication de H. pylori ne permettent pas de détecter les formes coccoïdes, les hôtes peuvent être diagnostiqués à tort comme exempts d’infection; en outre, ces méthodes peuvent ne pas être en mesure de fournir une preuve complète du potentiel clinique des médicaments utilisés pour éradiquer H. pylori. Ainsi, pour que l’éradication soit considérée comme réussie, un suivi annuel est recommandé – en utilisant des techniques non invasives ou, le cas échéant, des méthodes moléculaires — pour déterminer si les bactéries ont été complètement éliminées, en particulier dans les zones à forte prévalence et chez les patients à risque de récidive.
Enfin, d’autres études sont nécessaires sur la forme coccoïde VBNC de H. pylori, son potentiel pathogène, son implication dans l’infection et la recrudescence et son rôle dans la formation de biofilms dans l’estomac et d’autres endroits au sein de l’hôte. De telles études permettraient de développer à la fois des protocoles diagnostiques plus efficaces qui évitent de sous-estimer la colonisation par H. pylori et de nouvelles stratégies thérapeutiques visant à éliminer les formes coccoïdes et à « désarmer » les biofilms.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.