Introduction
Les infections associées aux soins de santé (IAS) comme la bactériémie causée par des souches multirésistantes de Pseudomonas aeruginosa entraînent une morbidité et une mortalité accrues, prolongeant l’hospitalisation et des coûts plus élevés par rapport aux infections causées par des souches sensibles.1-3 Les infections causées par ces microorganismes résistants sont souvent associées à l’âge, au cancer, aux maladies cardiaques, au diabète, à l’utilisation intensive d’antibiotiques et à des procédures invasives telles que l’hémodialyse, le cathéter de ventilation mécanique, la trachéotomie et autres.4
L’incidence croissante du P multirésistant. l’aeruginosa en tant que cause d’infection nosocomiale est un problème mondial, une conséquence de la capacité de ce microorganisme à développer une résistance à presque tous les autres agents antimicrobiens pendant la chimiothérapie antimicrobienne, soit par sélection de mutations dans les gènes chromosomiques, soit par transfert horizontal de gènes.5,6 Au Brésil, ce problème est encore plus important, car il existe une très forte densité d’utilisation d’antibiotiques, en particulier les β-lactames, les carbapénèmes et les fluoroquinolones.7,8 La résistance en P. l’aeruginosa aux carbapénèmes est jusqu’à 60% dans certains hôpitaux brésiliens9,10 et se produit principalement par la production de métallo-β-lactamases (MBL).
Dix sous-classes des enzymes MBL sont connues : IMP (Imipénémase), VIM (Imipénémase de Vérone), SPM-1 (MBL de São Paulo), GIM (Imipénémase Allemande), SIM-1 (Seul Imipénémase), 11 AIM-1 (Imipénémase australienne), 12 KHM (Hôpital universitaire de Kyorin), 13 NDM-1 (MBL de New Delhi), 14 DIM-1 (Néerlandais Imipénémase), 15 et TMB (MBL de Tripoli).16 Au Brésil, les sous-classes les plus répandues sont IMP-1 et SPM-1.11
Plusieurs autres gènes de virulence ainsi que la formation de biofilms peuvent contribuer à la pathogénicité des infections graves, en particulier celles associées aux procédures invasives.17 Parmi les principaux facteurs de virulence décrits dans la littérature, nous soulignons ceux liés à l’adhérence des microorganismes aux cellules hôtes par les flagelles, les fimbriae et l’alginate18 et ceux qui facilitent la perturbation de l’intégrité épithéliale et interfèrent avec le système immunitaire, tels que l’élastase, la phospholipase C et la protéase alcaline, en outre l’exotoxine A, la pyocyanine et la pyoverdine.19 La production de biofilm est particulièrement associée à la difficulté des antibiotiques à pénétrer dans les cellules, car ceux-ci sécrètent une matrice polymère composée de polysaccharides, de protéines et d’ADN.20,21
L’objectif de cette étude était d’identifier les facteurs de risque associés à la bactériémie causée par P. aeruginosa résistant aux carbapénèmes ainsi qu’à la production de MBL. De plus, nous avons étudié la fréquence des gènes de virulence et leur capacité à former un biofilm.
Matériaux et méthodespatients et hôpitaux
Le P. les souches d’aeruginosa ont été récupérées chez des patients admis à l’Hôpital universitaire d’Uberlandia (Brésil), Université fédérale d’Uberlândia (HC-UFU), et obtenues auprès du Laboratoire de microbiologie de l’HC-UFU, au cours de la période de mai 2009 à décembre 2012, en ne considérant que le premier épisode d’infection.
Plan de l’étude
Nous avons mené une étude de cas (patients présentant une bactériémie due à P. aeruginosa résistant aux carbapénèmes) par rapport au contrôle (patients présentant une bactériémie causée par P. aeruginosa sensible aux carbapénèmes) pour identifier les facteurs de risque chez les patients infectés par P. aeruginosa. aeruginosa résistant aux carbapénèmes. De plus, nous avons évalué les résultats secondaires, y compris les périodes d’hospitalisation, l’admission à l’unité de soins intensifs (USI) et l’utilisation de procédures invasives. Les caractéristiques démographiques, cliniques et épidémiologiques de chaque patient inclus dans l’étude ont été récupérées à partir des dossiers cliniques.
Définitions
Les infections associées aux soins de santé (IAS) sont définies comme toute infection contractée après l’admission d’un patient à l’hôpital. Les IAS peuvent se manifester pendant l’hospitalisation ou après la sortie, car elles sont liées à une hospitalisation ou à des procédures effectuées pendant l’hospitalisation.22 La bactériémie, selon les Centers for Disease Control and Prevention, 23 peut être définie comme la présence de bactéries viables dans le sang documentée par un résultat d’hémoculture positif. La bactériémie a été classée comme primaire lorsqu’elle n’était pas liée à un autre foyer d’infection ou lorsqu’elle était liée à un cathéter intraveineux, et secondaire lorsqu’elle était cliniquement liée à une infection dans un autre site anatomique.9 La multirésistance est définie comme une non-sensibilité acquise à au moins un agent dans trois catégories ou plus d’antimicrobiens.24 Le traitement antimicrobien a été jugé inapproprié lorsqu’un microorganisme isolé présentait une résistance in vitro aux antimicrobiens utilisés pour traiter le patient et/ou un manque de traitement pendant 24h après le diagnostic d’infections microbiennes.25
Tests microbiologiques et moléculaires cliniques
Cultures ont été collectées selon le protocole utilisé par le Laboratoire de Microbiologie de l’UFU-HC et ont été traitées à l’aide du système automatisé BACT/Alert® (bioMérieux, Durham, USA). Les tests d’identification et de sensibilité aux antimicrobiens ont été effectués par automatisation à l’aide du système VITEK II et les souches présentant une sensibilité intermédiaire ont été considérées comme résistantes. Les protocoles de contrôle de la qualité ont été utilisés selon les normes du Clinical and Laboratory Standard Institute.26-28 Le P résistant aux carbapénèmes. les isolats d’aeruginosa ont été criblés phénotypiquement pour la production de MBL à l’aide de tests de synergie à double disque, comme décrit précédemment.29,30 De plus, pour évaluer la présence de gènes MBL dans les souches de P. aeruginosa, une PCR multiplex a été réalisée, comme décrit précédemment.31 Les conditions de cycle étaient les suivantes : 94°C pendant 5min, suivi de 30 cycles de dénaturation à 94°C pendant 30s, recuit à 53°C pendant 45s et extension à 72°C pendant 30s, suivi de l’extension finale à 72°C pendant 10min, le tout dans un MasterCycler personnel (Eppendorf). La détection des gènes de virulence codifiant la protéase alcaline (aprA), l’élastase A (lasA), l’élastase (lasB), la phospholipase C hémolytique 32 (plcH), la phospholipase C non hémolytique (plcN), l’exotoxine A (toxA) et l’alginate (algD) 33 a été déterminée par PCR uniplex, en utilisant le protocole suivant: 94 ° C pendant 3min, 30 cycles à 94° C pendant 30s, 55°C pendant 1min et 72 pour 1min et 30s et 72°C pendant 5min.
Test d’adhérence initiale34
Afin d’évaluer l’adhérence initiale, 200µL d’une suspension cellulaire contenant 1×107cellules/mL préparée en BST ont été ajoutés à des plaques de polystyrène à 96 puits. L’adhérence initiale a été autorisée pendant 2h à 37 °C avec une rotation à 120 tr/ min. Les bactéries adhérentes dans des plaques de polystyrène à 96 puits ont été lavées deux fois avec une solution de NaCl à 0,9% et récoltées par raclage des puits pendant 90s.La suspension cellulaire obtenue a été plaquée sur TSA pour le dénombrement des unités formant colonie (UFC). Toutes les expériences ont été réalisées en trois exemplaires dans trois expériences indépendantes. La souche ATCC15692 (PAO1) a été utilisée comme témoin positif et le BST sans bactérie a été utilisé comme témoin négatif.
Essai de formation de biofilm35
200µL d’une suspension cellulaire contenant 1×107cells/mL préparée dans du BST a été ajouté à des plaques de polystyrène à 96 puits. La formation de biofilm a été autorisée pendant 24h à 37 °C avec une rotation à 120 tr/min. Les bactéries cultivées dans des plaques de polystyrène à 96 puits ont été lavées deux fois avec une solution de NaCl à 0,9% et laissées sécher en position inversée. La biomasse totale a été mesurée par fixation au méthanol (Merck), coloration au violet cristallin (Merck) et élution acide acétique (Merck) comme décrit précédemment. Le colorant élué a été retiré de chaque puits et placé dans une nouvelle plaque de microtitre à 96 puits, et son absorbance a été lue sur un lecteur de plaque ELISA (BioTek Instruments Inc., Vermont, États-Unis) à 570 nm. Les expériences ont été réalisées avec huit répliques pour chaque souche dans trois expériences indépendantes. Le BST sans bactéries a été utilisé comme témoin négatif. La valeur de coupure de la densité optique (ODc) a été établie comme trois écarts types (SD) au-dessus de la moyenne de la densité optique (DO) du témoin négatif: ODc = DO moyen du témoin négatif + 3x SD du témoin négatif. Pour une interprétation plus facile des résultats, les souches ont été divisées en catégories suivantes en fonction de la densité optique: (ODi): ODi≤ODc ou ODc
ODi2x ODc = producteur de non-biofilm / producteur de biofilm faible; 2x ODcODi4x ODc = producteur de biofilm modéré; 4x ODcODi = producteur de biofilm fort.Concentration de cellules de biofilm36
La concentration de cellules de biofilm a été déterminée par dénombrement de l’UFC. Après formation de biofilms, les biofilms ont été lavés deux fois avec une solution de NaCl à 0,9% et récoltés après raclage des puits pendant 90s.La suspension cellulaire obtenue a été plaquée sur des plaques TSA. Toutes les expériences ont été faites en trois exemplaires, à trois occasions indépendantes.
Analyse statistique
L’analyse statistique a été réalisée à l’aide de GraphPad Prism v.5 (GraphPad Software, San Diego, CA). Les dosages quantitatifs ont été comparés à l’aide du test de Kruskal–Wallis, en appliquant le test de comparaison multiple de Dunn. Tous les tests ont été effectués avec un niveau de confiance de 95% et la signification statistique a été définie comme p
0,05.Approbation éthique
Le Comité d’éthique de la recherche de l’Université fédérale Uberlandia a évalué et approuvé notre conception d’étude.
Résultats
Du 1er mai 2009 au 31 décembre 2012, une surveillance hospitalière de l’incidence de la bactériémie de P. aeruginosa a été réalisée dans le laboratoire de microbiologie de l’Hôpital Universitaire. Au cours de cette période, 157 patients non répétitifs atteints de bactériémie à P. aeruginosa ont été inclus dans l’étude. Les tableaux 1 et 2 présentent des informations détaillées sur les facteurs associés au développement de la bactériémie et les caractéristiques cliniques et démographiques, ainsi que la répartition des patients par service. La bactériémie primaire s’est produite dans 75,8 % des cas et chez ceux dont le foyer était inconnu, dans 62.4% des cas. La bactériémie secondaire représentait 24,2% des patients, où les voies respiratoires étaient le principal foyer d’infection (17,2%). De plus, 43,9% des patients présentaient une bactériémie avec P. aeruginosa résistant aux carbapénèmes, et la plupart de ces patients ont été admis aux soins intensifs. La plupart des patients étaient des hommes (66,8%), avec un séjour moyen à l’hôpital de 63,2 ± 80,17 jours et un âge moyen de 52,01 ±20,24 ans.
Distribution des patients infectés par Pseudomonas aeruginosa dans différentes unités de l’Hôpital clinique de l’Université fédérale d’Uberlândia de mai / 2009 à décembre / 2012.
| Cliniques | Total | Pseudomonas aeruginosa résistant aux carbapénèmes |
|---|---|---|
| L=157 (%) | L=69 (%) | |
| Chirurgie | 35 (22.3) | 16 (23.2) |
| Clinique médicale | 24 (15.3) | 10 (14.5) |
| Oncologie | 14 (8.9) | 2 (2.9) |
| Salle d’urgence | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| Soins INTENSIFS néonatals | 2 (1.3) | 0 |
| Soins INTENSIFS pédiatriques | 2 (1.3) | 1 (1.5) |
| Greffe | 2 (1.3) | 0 |
| Autresb | 3 (1.9) | 0 |
.
Brûlures, unité de douleur thoracique.
Facteurs de risque associés à la résistance au carbapénème chez les patients atteints de bactériémie causée par Pseudomonas aeruginosa.
| Facteurs de risque | Total | Résistant aux carbapénèmes | Multisensivea | Univarié | Multivarié | ||
|---|---|---|---|---|---|---|---|
| L=157 (%) | L=69 (%) | L=65 (%) | ORBE (CIc 95%) | pd | OU (IC 95%) | p | |
| Âge – moyenne (années) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| Homme / femme | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| Temps d’hospitalisation, moyenne (jours) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| Unité de soins intensifs | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| Chirurgie | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| Procédures invasives (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Cathéter central veineux | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| Drain chirurgical | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| Sondes nutrition entérale / gastrique | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| Hémodialyse | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Nutrition parentérale | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Conditions de comorbidité | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| Insuffisance cardiaque | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| Cancer | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabète sucré | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| Insuffisance rénale chronique | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| Virus de l’immunodéficience humaine | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| Voir les résultats≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| Bactériémie primaire | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| Cathéter de ligne centrale lié | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Inconnu | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| Bactériémie secondaire | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| Voies respiratoires | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| Voies urinaires | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| Traitement inapproprié | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| Utilisation antérieure d’antibiotiques | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| Mortalité | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Les souches multisensibles ont été considérées comme celles qui présentaient une sensibilité à tous les antimicrobiens testés.
Rapport de cotes.
Intervalle de confiance.
valeur p.
Score moyen de gravité de la maladie.
Statistiquement significatif (P≤0,05).
L’utilisation antérieure d’antibiotiques (78,3%), les procédures invasives (88,5%), les comorbidités (77,7%) et les interventions chirurgicales antérieures (43,9%) étaient courantes. Il a été constaté que 31,2% des patients recevaient un traitement inadéquat et que le taux de mortalité était de 58,6%. Plusieurs facteurs intrinsèques et extrinsèques pour le développement de la bactériémie par des souches de P. des aeruginosa résistants aux carbapénèmes ont été détectés par analyse univariée. Cependant, seules la ventilation mécanique, les trompes entérales/nasogastriques, la bactériémie primaire à foyer inconnu et un traitement inapproprié étaient des facteurs de risque associés indépendamment au développement d’une bactériémie à P. aeruginosa résistante aux carbapénèmes.
La production de MBL a été analysée pour 56 isolats de P. aeruginosa résistants aux carbapénèmes. Neuf isolats (25,0%) étaient phénotypiquement positifs et un total de 16,1% (n = 9/56) étaient compatibles avec les gènes MBL des amplicons, soit 10,71% de blaSPM-1 et 5.3% de gènes blaVIM En général, les souches présentaient un profil de multirésistance aux médicaments. Pour les autres gènes de virulence évalués (aprA, plcH, plcN, lasA, lasB, toxA et algD), toutes les souches ont montré une fréquence élevée (88%).
Parmi les 88 souches de P. aeruginosa sensibles aux carbapénèmes, 21 (23,9 %) étaient résistantes aux autres β-lactames. Pour 69 souches résistantes aux carbapénèmes, le profil de résistance était élevé : β-lactame 50/69 (72,5%), fluoroquinolones 48/69 (69,6%) et aminoglycosides 50/69 (72,5%) (Tableau 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
En plus de la recherche sur le MBL, cinq souches ont été sélectionnées (deux contenant du SPM-1, une contenant du VIM et deux phénotypiquement positives pour le MBL) pour l’évaluation de la formation du biofilm à l’aide de tests quantitatifs de la biomasse totale par coloration au violet cristallin. Compte tenu de la présence de gènes MBL, toutes les souches ont été identifiées comme fortement productrices de biofilms avec une moyenne de 0,90 ±0,61 de biomasse. Aucune différence dans l’adhérence initiale des souches individuelles n’a été observée. Cependant, il y avait une DO inférieure pour la souche contenant le gène blaVIM (Fig. 1).
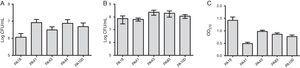
(A) Nombre de cellules adhérant à une surface de polystyrène après 2h, exprimé en log UFC / mL pour 5 échantillons de Pseudomonas aeruginosa isolés du sang. (B) Nombre de cellules viables dans le biofilm (log UFC/mL). (C) Biomasse de biofilm exprimée en densité optique de violet cristallin (OD570nm).
Discussion
La bactériémie hospitalière causée par des microorganismes multirésistants, qu’ils soient à Gram positif ou à Gram négatif, a souvent été décrite comme un problème de santé important qui augmente les coûts hospitaliers et rend difficile l’établissement d’un traitement antimicrobien approprié, ce qui entraîne un pronostic plus mauvais.37 La forte proportion de bactériémies hospitalières causées par P. aeruginosa résistant aux carbapénèmes indique l’importance de cet organisme comme cause significative de cette infection dans notre hôpital. La forte proportion de bactériémies hospitalières causées par P. aeruginosa résistant aux carbapénèmes indique l’importance de cet organisme comme cause importante de cette infection dans notre hôpital. Les résultats de différentes études ont suggéré que des facteurs de risque intrinsèques tels que la ventilation mécanique, l’utilisation d’une sonde nasogastrique et l’utilisation préalable d’antibiotiques augmentent le risque de développement de bactériémies causées par P. aeruginosa résistant aux carbapénèmes, ainsi que le risque de morbidité et de mortalité.38
Dans cette étude, plus de 50% des facteurs de risque étaient associés à une infection par ce microorganisme selon une analyse univariée. Cependant, seules la ventilation mécanique, les sondes d’alimentation entérale / gastrique, la bactériémie primaire d’origine inconnue et un traitement inapproprié ont été considérés comme des facteurs de risque indépendants par analyse multivariée.
Un cathéter veineux central est l’un des facteurs de risque les plus importants de bactériémie acquise à l’hôpital, car il était associé à plus de 90% de ces infections.39 Bien qu’il ne s’agisse pas d’un facteur de risque significatif dans cette étude, 85,5% des patients atteints de bactériémie avec P. aeruginosa résistant aux carbapénèmes ont subi cette procédure invasive.
Souvent, la bactériémie causée par P. aeruginosa résistant aux antibiotiques a un taux de mortalité plus élevé en raison, notamment, de l’administration d’une antibiothérapie inappropriée.40 Dans cette étude, nous avons étudié une cohorte de 157 patients atteints de bactériémie causée par des souches de P. aeruginosa, dont 69 infectés par des isolats de P. aeruginosa résistants aux carbapénèmes. La mortalité totale était plus élevée dans le groupe résistant aux carbapénèmes; cependant, la présence de souches résistantes a été significativement associée à un traitement antimicrobien inapproprié, prouvant que ce groupe a généralement un pronostic plus défavorable. À l’instar de nos résultats, des études antérieures ont montré que P. aeruginosa isolé chez des patients ayant reçu un traitement inapproprié avait un pronostic plus mauvais, avec des taux de 46,1% 41 et 53,8%.42
En plus d’être associée à des infections graves, la résistance aux carbapénèmes chez P. aeruginosa entraîne souvent la production de MBL.43 Nos résultats ont montré que le P résistant aux carbapénèmes. les aeruginosa étaient répandus dans tout l’hôpital avec des gènes codant ces enzymes dans 16,1% des souches, soit 10,7% du génotype blaSPM-1 et 5,4% du génotype blaVIM. La fréquence des souches multirésistantes étant élevée, ces résultats suggèrent que d’autres mécanismes de résistance coexistent dans ces souches, tels que les pompes d’efflux et l’imperméabilité de la membrane.44
La prévalence du MBL en tant que mécanisme de résistance a augmenté, en particulier en Amérique latine.45 Au Brésil, la prévalence de P produisant du MBL. aeruginosa varie d’une région à l’autre et d’un hôpital à l’autre, avec des taux allant de 7,5 % à 44 %.11
L’enzyme SPM-1 est considérée comme la plus courante au Brésil, suivie de l’enzyme IMP-1,11,46 cependant, il y a également eu une augmentation de la fréquence des isolats de P. aeruginosa contenant l’enzyme VIM.45,47 Dans notre étude, l’enzyme SPM-1 a été détectée dans 16,7% des échantillons de MBL produisant phénotypiquement, suivie de l’enzyme VIM, qui a été détectée dans 8,3% des cas. Ces résultats indiquent une propagation significative des gènes codant pour le MBL dans notre région.
Compte tenu de la présence de MBL et de la production de biofilms, 100% des souches ont été classées comme producteurs forts. Une autre étude menée au Brésil a révélé que 40% des P. aeruginosa classés comme produisant un biofilm puissant étaient également des producteurs de MBL.35 Nous pensons que ces résultats sont importants une fois que ces caractéristiques (production de biofilm et MBL) se chevauchent et que les infections causées par ces bactéries sont difficiles à traiter. Cela est justifié, en partie, parce que la croissance des bactéries dans le biofilm est environ 64 fois plus résistante aux antimicrobiens.48
P. aeruginosa possède un grand nombre de facteurs de virulence extracellulaires qui contribuent également à la pathogénicité et à la gravité de ces infections, tels que ceux codés par les gènes aprA, plcH, plcN, lasA, lasB, toxA et algD.32,33 Nos données ont montré que la présence d’un profil multirésistant, dans la plupart des souches (88%), était positive pour les gènes de virulence aprA, plcH, plcN, lasA, lasB, toxA et algD, sauf dans une souche qui ne présentait pas les gènes toxA et plcH, ce qui peut contribuer davantage à un pronostic pire associé à des infections graves.
Nos résultats confirment les découvertes antérieures concernant les facteurs de risque de développement d’une bactériémie résistante aux carbapénèmes de P. aeruginosa, ainsi que la dissémination de souches productrices de MBL de type SPM-1. Cependant, cette étude apporte des preuves supplémentaires de la propagation des souches productrices de MBL, en particulier du type VIM, dans des souches très virulentes et fortement productrices de biofilms.
Conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.