L’embolie pulmonaire (EP) est une cause fréquente de décès cardiovasculaire, avec une incidence croissante.1-4 L’insulte d’une augmentation aiguë de la postcharge du ventricule droit (RV) secondaire à une obstruction du thrombus dans les artères pulmonaires, à une vasoconstriction hypoxémique et à la libération de vasoconstricteurs de l’artère pulmonaire peut entraîner un dysfonctionnement et une dilatation de la RV et une diminution de la précharge du ventricule gauche (VG), entraînant un effondrement cardiovasculaire dans les cas les plus graves.5 L’anticoagulation est le pilier du traitement de tous les SPe avec d’excellents résultats chez les patients à faible risque.6,7
Il existe cependant un sous-ensemble de patients atteints d’EP à risque intermédiaire-élevé et élevé qui peuvent bénéficier d’un traitement plus avancé, y compris la fibrinolyse systémique, la thérapie dirigée par cathéter (TDC) avec ou sans perfusion de fibrinolytiques ou d’embolectomie pulmonaire, car ces options réduisent activement la charge thrombus pour diminuer la postcharge de VR. Chez les patients qui survivent à la présentation initiale, des séquelles à long terme peuvent se développer, notamment un dysfonctionnement persistant du RV, une hypertension pulmonaire thromboembolique chronique et une diminution de la qualité de vie et de la tolérance à l’exercice.8,9
Il a été prouvé que la fibrinolyse systémique diminue rapidement la charge thrombus et la pression artérielle pulmonaire. Cependant, ceci est au risque d’un taux de saignement majeur qui dépasse 20% et de la complication redoutée de l’hémorragie intracrânienne (ICH) dans 3%.10,11 Le souci de complications hémorragiques a conduit à la sous-utilisation de la fibrinolyse systémique, avec une forte proportion de patients présentant une contre-indication absolue ou relative.12 Compte tenu du taux d’événements indésirables, la fibrinolyse systémique a généralement été limitée aux personnes les plus à risque avec des signes de compromis hémodynamique ou de choc cardiogénique. CDT a été de plus en plus utilisé pour offrir une amélioration active de la postcharge de VR au-delà de l’anticoagulation seule, mais avec une dose réduite ou sans traitement fibrinolytique.
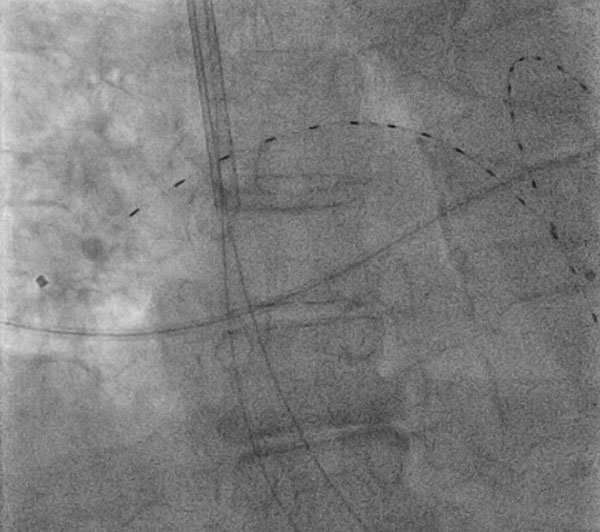 Figure 1: Fibrinolyse à faible dose dirigée par cathéter et facilitée par ultrasons
Figure 1: Fibrinolyse à faible dose dirigée par cathéter et facilitée par ultrasons Une femme de 74 ans a présenté une embolie pulmonaire proximale bilatérale avec tachycardie persistante et a reçu une fibrinolyse à faible dose dirigée par cathéter et facilitée par ultrasons sous guidage fluoroscopique via un accès à la veine jugulaire interne droite. Le dispositif représenté est le système endovasculaire EKOSONIQUE (EKOS, Bothell, WA) dans les artères pulmonaires bilatérales. Les CDT
comprennent ceux qui délivrent des agents fibrinolytiques (p. ex., activateur tissulaire du plasminogène) avec ou sans assistance par ultrasons, ainsi que des dispositifs qui réduisent la charge de caillots par diverses méthodes mécaniques sans agents fibrinolytiques. Le dispositif dirigé par cathéter le mieux étudié et le seul approuvé par la Food and Drug Administration des États-Unis pour la gestion de l’EP est le système endovasculaire EkoSonic (EKOS, Bothell, WA) (Figure 1). Le 5.4 Les cathéters de perfusion français sont placés directement dans les artères pulmonaires, généralement via un accès interne à la veine jugulaire ou fémorale, et contiennent un noyau ultrasonore qui libère des ondes ultrasonores en plus d’une série de pores qui délivrent du t-PA.
Des études in vitro ont démontré une pénétration et une liaison améliorées du t-PA à la fibrine en présence d’ultrasons.13 Dans un petit essai de 59 patients atteints de PE à risque intermédiaire randomisés en fibrinolyse à faible dose facilitée par échographie plus anticoagulation vs. l’anticoagulation seule, le groupe d’intervention avait une diminution plus importante du rapport de diamètre RV / LV et des pressions systoliques artérielles pulmonaires, et une amélioration plus significative de la fonction RV à 24 heures.14 Au suivi de 90 jours, il y avait une tendance à une plus grande réduction de la taille du VR dans le groupe d’intervention (p = 0,07); cependant, il n’y avait aucune différence dans la pression artérielle systolique.
« CDT a été de plus en plus utilisé pour offrir une amélioration active de la postcharge de VR au-delà de l’anticoagulation seule, mais avec une dose réduite ou sans traitement fibrinolytique. »
Un essai multicentrique à bras unique plus vaste a évalué la fibrinolyse à faible dose facilitée par ultrasons chez 150 patients atteints de PE massive ou submassive. Il y a eu une réduction significative du rapport de diamètre RV / LV, de la pression systolique de l’artère pulmonaire et de la charge thrombus à 48 heures.15 Il y a eu un saignement sévère et 15 un saignement modéré, sans hémorragie intracrânienne. Les cathéters de perfusion sans ultrasons (par exemple, Cragg-McNamara, cathéter à queue de cochon) offrent également une administration de fibrinolytique dans les artères pulmonaires avec un coût nettement inférieur à celui de la fibrinolyse facilitée par ultrasons. Bien que limitée à de petites études rétrospectives, la fibrinolyse dirigée par cathéter avec et sans échographie a été évaluée et montre des résultats similaires.16,17 Ces résultats n’ont pas été validés dans un essai contrôlé randomisé, bien qu’un essai soit en cours (NCT02758574).18
Une méta-analyse a évalué 16 études de thrombolyse dirigée par cathéter et a révélé un taux de complication majeure de 4,7% et un taux d’hémorragie intracrânienne de 0,35%.19 Une récente analyse comparative de la propension des résultats à l’hôpital a utilisé la base de données nationale sur la réadmission pour comparer les résultats systémiques et les résultats cliniques. fibrinolyse dirigée par cathéter et a démontré une mortalité hospitalière et des saignements plus faibles chez les patients ayant reçu une fibrinolyse dirigée par cathéter.20 Il n’y a pas eu d’essais prospectifs randomisés comparant la fibrinolyse systémique à la fibrinolyse dirigée par cathéter.
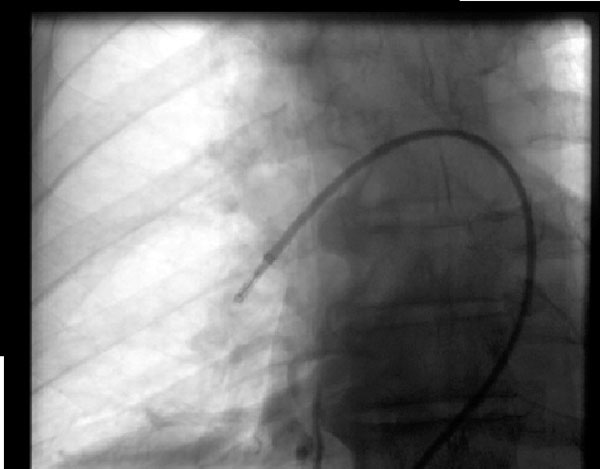 Figure 2: Thrombectomie par aspiration
Figure 2: Thrombectomie par aspiration Un homme de 68 ans a développé une embolie pulmonaire massive un jour après une chirurgie de la colonne vertébrale et n’était pas candidat à la fibrinolyse, il a donc subi une thrombectomie par aspiration sous guidage fluoroscopique avec une amélioration de son hémodynamique. Le dispositif représenté est le système d’embolectomie indigo (Pénombre, Alameda, CA) dans l’artère pulmonaire droite.
Fréquemment, les patients justifieront un traitement avancé, mais présentent des contre-indications même à de faibles doses de t-PA. Chez ces patients, l’embolectomie pulmonaire est une option possible. Cependant, il nécessite une sternotomie et un pontage cardiopulmonaire avec des doses élevées d’héparine. Le CDT mécanique offre une option percutanée qui n’utilise pas la fibrinolyse. Il existe divers CDT mécaniques, y compris une thrombectomie mécanique par aspiration ou par aspiration (figure 2), une macération avec un cathéter à queue de cochon et une thrombectomie rhéolytique.
Il existe diverses limitations à chaque système disponible, telles qu’une manipulation adéquate dans les artères pulmonaires en raison de la taille du cathéter, de la perte de sang pendant l’aspiration et de la capacité limitée d’éliminer le thrombus, en particulier s’il est plus âgé et plus fibrotique. Il peut y avoir un rôle pour la thérapie mécanique et fibrinolytique combinée pour améliorer la clairance du thrombus.21 Les données relatives au CDT mécanique sont limitées aux petites séries de boîtiers à un seul centre, bien qu’elles démontrent un succès technique raisonnable.22-25 CDT offre également une option de traitement de renflouement pour les patients présentant un choc persistant malgré la fibrinolyse systémique ou les patients qui ont été placés sous oxygénation de la membrane extracorporelle.26
« Il n’existe pas d’études de haute qualité comparant les différents CDT entre eux ou contre une thrombolyse systémique. »
Il n’existe pas d’études de haute qualité comparant les différents CDT entre eux ou contre une thrombolyse systémique. Compte tenu du taux actuel d’utilisation de CDT dans l’EP à risque intermédiaire et des risques et coûts potentiels de ces interventions, une évaluation des résultats à long terme, y compris l’hypertension pulmonaire et la tolérance à l’exercice, en plus de données sur les résultats cliniques à court terme de meilleure qualité est nécessaire.
En conclusion, la TDC est une option de prise en charge prometteuse pour les patients atteints d’EP aiguë et offre une thérapie avancée alternative pour les patients qui sont de mauvais candidats à la thrombolyse systémique ou à l’embolectomie pulmonaire. Il reste un domaine passionnant avec le développement rapide de nouvelles thérapies, mais nécessite des recherches supplémentaires avant son utilisation généralisée dans l’EP à risque intermédiaire.
Brett Carroll, MD, a récemment terminé sa bourse de médecine vasculaire au Brigham and Women’s Hospital et est maintenant directeur de la médecine vasculaire au Beth Israel Deaconess Medical Center, tous deux à Boston, MA.
- Jimenez D, de Miguel-Diez J, Guijarro R, et al. Je suis Coll Cardiol 2016; 67:162-70.
- Huang W, Goldberg RJ, Anderson FA, et al. Am J Med 2014; 127:829-39 e5.
- Cohen AT, Agnelli G, Anderson FA, et al. Thrombb Haemost 2007; 98: 756-764.
- Mozaffarian D, Benjamin EJ, Go AS, et al. Tirage 2016; 133: e38-360.
- Place G, Goldhaber SZ. Circulation 2010; 122:1124-9.
- Aujesky D, Obrosky S, Stone RA, et al. Am J Resp Crit Care Med 2005; 172:1041-6.
- Kearon C, Akl EA, Ornelas J, et al. Poitrine 2016; 149:315-52.
- Place G, Goldhaber SZ. N Eng J Med 2011; 364:351-60.
- Sista AK, Miller LE, Kahn SR, Kline JA. Vasc Med 2017; 22:37-43.
- Goldhaber SZ, Haire WD, Feldstein ML, et al. Lancette 1993;341:507-11.
- Goldhaber SZ, Visani L, De Rosa M. Lancet 1999; 353:1386-9.
- Stein PD, Mat F. Am J Med 2012; 125:465-70.
- Siddiqi F, Odrljin TM, Fay PJ, et al. Sang 1998; 91:2019-25.
- Kucher N, Boekstegers P, Muller OJ, et al. Circulation 2014; 129:479-86.
- Piazza G, Hohlfelder B, Jaff MR, et al. JACC Cardiovasc Interv 2015; 8:1382-92.
- Liang NL, Avgerinos ED, Marone LK, et al. Surg endovasculaire Vasc 2016; 50:405-10.
- Graif A, Grilli CJ, Kimbiris G, et al. J Vasc Interv Radiol 2017; 28:1339-47.
- Avgerinos ED, Mohapatra A, Rivera-Lebron B, et al. J Vasc Surg Trouble lymphatique veineux 2018; 6: 126-32.
- Bloomer TL, El-Hayek GE, McDaniel MC, et al. Cathéter Cardiovasc Interv 2017; 89:754-60.
- Arora S, Panaich S, Ainani N, et al. Am J Cardiol 2017; 120:1653-61.
- Liu B, Liu M, Yan L, et al. J Int Med Res 2017; Jan 1;.
- Ciampi-Dopazo JJ, Romeu-Prieto JM, Sanchez-Casado M, et al. J Vasc Interv Radiol 2018; 29:101-6.
- Tukaye DN, McDaniel M, Liberman H, et al. JACC Cardiovasc Interv 2017; 10:94-5.
- Hubbard J, Saad WE, Sabri SS, et al. Thrombose 2011; 2011: 246410.
- Donaldson CW, Baker JN, Narayan RL, et al. Cathéter Cardiovasc Interv 2015; 86: e81-7.
- George B, Parazino M, Omar HR, et al. Réanimation 2018; 122:1-5.
Sujets Cliniques: Gestion de l’Anticoagulation, Arythmies et EP Clinique, Chirurgie Cardiaque, Dyslipidémie, Insuffisance Cardiaque et Cardiomyopathies, Angiographie et Intervention Cardiovasculaires Invasives, Hypertension Pulmonaire et Thromboembolie Veineuse, Médecine Vasculaire, SCD / Arythmies Ventriculaires, Fibrillation Auriculaire / Arythmies Supraventriculaires, Chirurgie Cardiaque et Arythmies, Chirurgie Cardiaque et Insuffisance Cardiaque, Métabolisme Lipidique, Statines, Insuffisance Cardiaque Aiguë, Hypertension Pulmonaire, Interventions et Médecine Vasculaire
Mots Clés: Publications de l’ACC, Interventions en Cardiologie, Food and Drug Administration des États-Unis, Pression Artérielle, Pontage Cardiopulmonaire, Dilatation, Embolectomie, Tolérance à l’Exercice, Oxygénation de la Membrane Extracorporelle, Veine Fémorale, Fibrine, Fibrinolyse, Agents Fibrinolytiques, Études de Suivi, Héparine, Mortalité Hospitalière, Hypertension, Pulmonaire, Carmin Indigo, Hémorragies Intracrâniennes, Veines Jugulaires, Réadmission du Patient, Artère Pulmonaire, Embolie Pulmonaire, Qualité de Vie, Études Rétrospectives, Choc, Cardiogénique, Sternotomie, Aspiration, Tachycardie , Thrombectomie, Thérapie thrombolytique, Thrombose, Activateur tissulaire du Plasminogène, Ondes de Choc à Haute Énergie, Vasoconstriction, Agents Vasoconstricteurs
< Retour à la liste