Toutes les cellules tissulaires dépendent du métabolisme aérobie pour la génération de l’énergie (sous forme d’adénosine triphosphate, ATP) nécessaire à la survie et au fonctionnement. Ce processus mitochondrial fondamentalement vital se caractérise par une consommation d’oxygène et une production de dioxyde de carbone, qui peut varier d’environ 200 mL / minute à l’état de repos à plus de cinq fois ce taux pendant l’exercice.
Le destin ultime de ce dioxyde de carbone est l’élimination du corps dans l’air expiré, et une fonction importante du sang est le transport du dioxyde de carbone des cellules tissulaires aux poumons.
La compréhension de ce processus de transport dépend d’une appréciation de ce que l’on entend par pression partielle d’un gaz ainsi que de certaines lois physiques de base qui régissent la solubilité et le mouvement (diffusion) des gaz.
- QUELLE EST LA PRESSION PARTIELLE D’UN GAZ ?
- SOLUBILITÉ ET DIFFUSION DES GAZ
- TRANSPORT DU DIOXYDE DE CARBONE DES CELLULES TISSULAIRES AUX POUMONS
- DIOXYDE DE CARBONE ET PH SANGUIN
- EN LABORATOIRE – DÉFINITION DES PARAMÈTRES DE CO2
- PRESSION PARTIELLE DE DIOXYDE DE CARBONE pCO2
- CONCENTRATION EN BICARBONATE (HCO3-)
- CONCENTRATION TOTALE DE DIOXYDE DE CARBONE DANS LE PLASMA (ctCO2)
- MÉTHODES CHIMIQUES DE MESURE DU ctCO2
- DISCORDANCE ENTRE LE ctCO2 MESURÉ ET LE BICARBONATE CALCULÉ
- RÉSUMÉ
QUELLE EST LA PRESSION PARTIELLE D’UN GAZ ?
La quantité de gaz dans un système, y compris les systèmes biologiques, est définie par la pression qu’il exerce, traditionnellement mesurée comme la hauteur d’une colonne de mercure (mmHg). Ainsi, en disant que la pression atmosphérique est de 760 mmHg, nous voulons dire que les gaz (oxygène, azote et dioxyde de carbone) dans l’air que nous respirons ont une pression combinée suffisante pour supporter une colonne standard de mercure de 760 mm de haut.
Cette pression totale est simplement la somme des pressions partielles de chaque gaz constitutif. Ainsi puisque l’air comprend environ 20% d’oxygène, 79% d’azote et 0.03% de dioxyde de carbone, la pression partielle d’oxygène (pO2) dans l’air inspiré est d’environ (20 x 760) / 100 = 152 mmHg et la pression partielle de dioxyde de carbone (pCO2) est de (0,03 x 760) / 100 = 0,2 mmHg.
L’unité de pression du système international (SI), utilisée dans les laboratoires cliniques en dehors de l’Amérique du Nord, est le kilopascal (kPa). Le facteur de conversion 0,133 peut être utilisé pour convertir mmHg en kPa.
SOLUBILITÉ ET DIFFUSION DES GAZ
La loi de Henry stipule qu’à l’équilibre, la quantité de gaz dissous dans un liquide est proportionnelle à la pression partielle de ce gaz, tant que la température est constante:
Gaz dissous = pression partielle (p) x coefficient de solubilité (S)
Où S est une constante dépendante de la température pour le gaz particulier. Le ou les coefficients de solubilité du dioxyde de carbone à la température corporelle sont de 0,23 mmol/L/ kPa (ou 0,03 mmol/mmHg). Ainsi, puisque pCO2 artériel est d’environ 5.3 kPa (40 mmHg), la quantité de CO2 dissous dans le sang artériel (dCO2) est (5,3 x 0,23) ou 40 x 0,03) = 1,2 mmol / L.
Le mouvement (diffusion) des gaz est déterminé en grande partie par des gradients de concentration. Le gaz diffuse de haute pression partielle à basse pression partielle.
TRANSPORT DU DIOXYDE DE CARBONE DES CELLULES TISSULAIRES AUX POUMONS
Le voyage du dioxyde de carbone (FIGURE 1a) commence dans la mitochondrie des cellules tissulaires où il est produit. En raison du gradient de concentration dominant, le dioxyde de carbone diffuse des mitochondries (où pCO2 est le plus élevé) à travers le cytoplasme, hors de la cellule et dans le réseau capillaire.
FIGURE 1a: CO2 dans les tissus
Cliquez pour agrandir
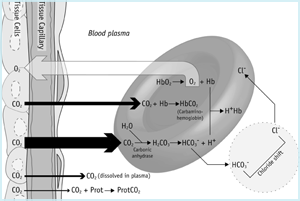
Une petite partie du CO2 arrivant dans le sang des cellules tissulaires reste physiquement dissoute dans le plasma sanguin (voir ci-dessus) et une proportion encore plus faible se lie aux groupes terminaux NH2 (amino) des protéines plasmatiques, formant ce qu’on appelle des composés carbamino. La plupart cependant, diffuse un gradient de concentration dans les globules rouges.
Une petite partie reste dissoute dans le cytoplasme de l’érythrocyte et une partie est liée de manière lâche aux groupes terminaux aminés de l’hémoglobine réduite formant le carbamino-Hb. Cependant, la majeure partie du dioxyde de carbone arrivant dans les globules rouges est rapidement hydratée en acide carbonique par l’isoforme des globules rouges de l’enzyme anhydrase carbonique. Au pH physiologique, la quasi-totalité (≈96%) de cet acide carbonique se dissocie en ions bicarbonate et hydrogène :
Équation 1:
![]()
Les ions hydrogène sont tamponnés par une hémoglobine réduite et la plupart des ions bicarbonate passent des globules rouges au plasma en échange d’ions chlorure (ce que l’on appelle le « déplacement du chlorure » maintient la neutralité électrochimique). Il ressort clairement de ce qui précède que la plupart du dioxyde de carbone est transporté sous forme de bicarbonate (principalement dans le plasma sanguin), mais il existe au total quatre modes de transport du CO2 :
- 90 % est transporté sous forme de bicarbonate dans le plasma (65%) et les globules rouges (25 %)
- 5 % est transporté physiquement dissous dans le plasma et le cytoplasme des globules rouges
- 5% est transporté librement lié à l’hémoglobine dans les globules rouges et
La teneur totale en dioxyde de carbone dans le sang est la somme de ces quatre composants.
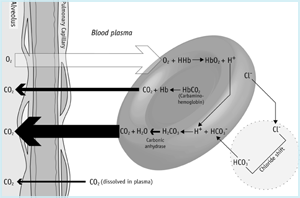
Dans la microvasculature des poumons (FIGURE 1b), le gradient de pression partielle à travers la membrane alvéolaire détermine que le CO2 dissous passe du sang aux alvéoles. Cette perte de dioxyde de carbone du sang favorise l’inversion des réactions des globules rouges décrites ci-dessus.
Ainsi, le bicarbonate passe du plasma aux globules rouges, tamponnant les ions hydrogène libérés de l’hémoglobine, au fur et à mesure de son oxygénation. L’inversion de la réaction d’anhydrase carbonique se traduit par la production de CO2 qui se diffuse des globules rouges vers le plasma et ensuite vers les alvéoles.
Le sang veineux mixte arrivant aux poumons a une teneur totale en CO2 d’environ 23,5 mmol / L (ou 52 mL / DL) tandis que le sang artériel sortant des poumons a une teneur totale en CO2 de 21,5 mmol / L (48 mL / dL).
Cette différence artério-veineuse (2 mmol / L ou 4 mL / dL) représente la quantité de CO2 ajoutée au sang par les cellules tissulaires et perdue par le sang lors de son passage dans la microvasculature pulmonaire, pour être éventuellement excrétée du corps dans de l’air expiré.
FIGURE 1b: CO2 dans les poumons
Cliquez pour agrandir
DIOXYDE DE CARBONE ET PH SANGUIN
Le potentiel acide du CO2, dû à sa réaction d’hydratation à l’acide carbonique (voir équation 1 ci-dessus), garantit que sa concentration dans le sang est un déterminant majeur du pH sanguin. À mesure que la concentration en CO2 augmente, la concentration en ions hydrogène (H +) augmente également. La régulation du CO2 sanguin, c’est-à-dire l’adaptation du taux d’élimination du CO2 dans l’air expiré au taux de production dans la mitochondrie des cellules tissulaires, essentiel au maintien d’un pH sanguin normal, est l’affaire du système respiratoire.
La fréquence respiratoire (contrôlée par des chimiorécepteurs sensibles au pCO2 situés dans le tronc cérébral et l’artère carotide) est augmentée si le pCO2 augmente et diminuée si le pCO2 diminue. L’augmentation de la fréquence respiratoire (respirations / min) entraîne une augmentation du taux d’élimination du CO2 et une diminution de la fréquence respiratoire favorise la rétention du CO2.
La relation entre le pH et le dioxyde de carbone est décrite par une forme de l’équation de Henderson-Hasselbach (équation 2). Ceci est dérivé de l’application de la loi de l’action de masse aux réactions d’hydratation et de dissociation décrites dans l’équation 1.
Équation 2:
![]()
où
| L/1 | = | ‘ constante apparente de dissociation de l’acide carbonique = 6.1 |
| = | concentration de bicarbonate plasmatique (mmol/L) | |
| L | = | coefficient de solubilité pour le CO2 à 37 oC (0,23 si le pCO2 est mesuré en kPa ou 0,03 si le pCO2 est mesuré en mmHg) |
| pCO2 | = | pression partielle de pCO2 (kPa ou mmHg) |
Comme expliqué précédemment, le dénominateur de cette équation (S x pCO2) est la quantité de dioxyde de carbone dissous (dCO2) mmol/L.
En supprimant toutes les constantes, l’équation 2 peut être simplifiée en:
Équation 3:
pH ∞ / pCO2
Ainsi, le pH du sang dépend du rapport entre la concentration plasmatique en bicarbonate (la composante métabolique) et le pCO2 (la composante respiratoire). Ainsi, si le pCO2 augmente sans augmentation équivalente du bicarbonate, le pH diminue. Inversement, si le pCO2 chute sans baisse équivalente du bicarbonate, le pH augmente.
La relation inverse est valable pour la concentration en bicarbonate, à savoir une augmentation du HCO3– = augmentation du pH; une diminution du bicarbonate = diminution du pH.
Le bicarbonate est le principal tampon sanguin et sa concentration à un moment donné reflète l’équilibre entre celui produit à partir du CO2 et celui consommé dans le tampon des ions hydrogène (H +) (voir équation 1).
EN LABORATOIRE – DÉFINITION DES PARAMÈTRES DE CO2
Les paramètres de CO2 générés par l’analyseur de gaz sanguins sont:
- Pression partielle de dioxyde de carbone (pCO2) (kPa / mmHg)
- Concentration plasmatique de bicarbonate (HCO3-) (mmol / L)
- Concentration plasmatique totale de dioxyde de carbone (ctCO2) (mmol/ L)
Le dernier d’entre eux, ctCO2, peut également être mesuré dans le plasma ou le sérum par des méthodes chimiques indépendantes de l’analyseur de gaz du sang.
PRESSION PARTIELLE DE DIOXYDE DE CARBONE pCO2
Ce paramètre est une mesure de la pression exercée par la petite partie (≈5%) du dioxyde de carbone total dans le sang qui reste à l’état gazeux, « dissous dans » la phase aqueuse du plasma et du cytoplasme des cellules sanguines. La mesure est effectuée à l’aide d’une électrode de pH spécifique au CO2 incorporée dans les analyseurs de gaz sanguins.
En santé, le pCO2 du sang artériel est maintenu dans la plage de 4,7 à 6,0 kPa (35-45 mmHg); le pCO2 du sang veineux est un peu plus élevé de 5,6 à 6,8 kPa (41-51 mmHg).
CONCENTRATION EN BICARBONATE (HCO3-)
C’est la quantité de bicarbonate en unité de volume plasmatique. Comme indiqué précédemment, il s’agit de la forme sous laquelle la plupart du dioxyde de carbone (90%) est transporté dans le sang. Ce paramètre ne peut pas être mesuré mais est généré par calcul lors de l’analyse des gaz sanguins. Le calcul utilisé est un réarrangement de l’équation 2 : Équation
4:
log = pH + log (S x pCO2) – pK/1
et dépend d’avoir des valeurs pour le pH et le pCO2, qui sont toutes deux mesurées lors de l’analyse des gaz sanguins.
Théoriquement, le bicarbonate de plasma est la différence entre le CO2 total (ctCO2) et la somme de toutes les autres formes de CO2 dans le plasma, c’est-à-dire le CO2 dissous (dCO2), le CO2 lié aux protéines plasmatiques (carbamino CO2) et l’acide carbonique (H2CO3).
Ainsi:
Bicarbonate de plasma (mmol/L) =
ctCO2 – (dCO2 + carbamino-CO2 + H2CO3)
En pratique, parce que le carbamino-CO2 et le H2CO3 sont quantitativement insignifiants, on suppose que le CO2 total est la somme du bicarbonate et du CO2 dissous. Ainsi, le bicarbonate de plasma est effectivement la différence entre le CO2 total plasmatique (ctCO2) et le CO2 dissous plasmatique (dCO2).
En santé le bicarbonate de plasma artériel (tel que calculé lors de l’analyse des gaz sanguins) est maintenu dans la plage de référence approximative: 22-28 mmol / L. Le bicarbonate veineux est un peu plus élevé: 24-30 mmol / L.
Dans certains laboratoires, une distinction est faite entre le bicarbonate « réel » (le paramètre décrit ci-dessus) et le bicarbonate « standard ». Le bicarbonate standard est un deuxième paramètre calculé et correspond à la concentration plasmatique en bicarbonate du sang qui a été équilibrée avec un gaz de tension normale pCO2 (40 mmHg, 5,3 kPa).
En santé, la concentration réelle de bicarbonate est la même que la concentration standard de bicarbonate car dans les deux cas, le pCO2 est normal. En normalisant le pCO2, la composante respiratoire de l’équilibre acido-basique, le bicarbonate standard est une mesure uniquement de la composante métabolique et est donc considéré comme utile pour élucider la cause des perturbations complexes de l’équilibre acido-basique.
CONCENTRATION TOTALE DE DIOXYDE DE CARBONE DANS LE PLASMA (ctCO2)
C’est théoriquement la somme de toutes les formes de dioxyde de carbone dans le plasma. Il n’est pas mesuré lors de l’analyse des gaz sanguins, mais – comme le bicarbonate – calculé, en supposant comme ci-dessus que le dioxyde de carbone total est la somme du bicarbonate et du CO2 dissous:
Puisque le plasma dCO2 mmol / L = (S x pCO2), ctCO2 est calculé ainsi :
plasma ctCO2 (mmol/L) =
bicarbonate de plasma (mmol/L) + (S x pCO2) (mmol/L)
Le CO2 dissous (S x pCO2) contribue environ 1.2 mmol / L au CO2 total dans le plasma du sang artériel (voir ci-dessus), de sorte que ctCO2 est environ 1,2 mmol plus élevé que le bicarbonate de plasma. La plage de référence ctCO2 est donc d’environ 23-29 mmol/L pour le sang artériel.
On notera que de même que la valeur calculée de bicarbonate générée lors de l’analyse des gaz sanguins dépend de la relation décrite dans l’équation 2, il en va de même de la valeur calculée de ctCO2 générée lors de l’analyse des gaz sanguins.
Bien que le ctCO2 et le bicarbonate fournissent des informations cliniques équivalentes, dans la pratique clinique, c’est invariablement le bicarbonate plutôt que le ctCO2 qui est utilisé en conjonction avec le pH et le pCO2 pour évaluer l’état acido-basique. La valeur clinique du ctCO2 calculé généré lors de l’analyse des gaz sanguins est donc limitée.
MÉTHODES CHIMIQUES DE MESURE DU ctCO2
Contrairement au bicarbonate, qui ne peut pas être mesuré, le ctCO2 peut et le dosage est généralement un composant du profil urée et électrolyte (U & E) du plasma / sérum veineux. Comme U & E est commandé beaucoup plus fréquemment que les gaz du sang artériel, le ctCO2 mesuré peut être la première indication de perturbation de l’homéostasie du dioxyde de carbone (et donc de l’acide-base).
Il est courant pour certains laboratoires cliniques de désigner ce composant mesuré du profil U &E comme » bicarbonate de plasma « . Ceci est erroné car les méthodes chimiques mesurent tout le CO2 libéré du plasma (ou du sérum) par addition d’acide fort ou alternativement tout le bicarbonate produit à la suite de l’ajout d’un alcali fort au plasma.
Il comprend donc non seulement du bicarbonate, mais également du CO2 dissous et de l’acide carbonique. Si le plasma ou le sérum utilisé dans ces dosages étaient dérivés du sang artériel, le ctCO2 mesuré se rapprocherait théoriquement de la valeur ctCO2 calculée générée lors de l’analyse des gaz sanguins artériels.
En effet, les profils U &E sont exclusivement réalisés sur du plasma ou du sérum récupéré à partir de sang veineux de sorte qu’il existe une faible différence théorique inévitable de 1-2 mmol /L (ctCO2 mesuré > ctCO2 calculé) due à la différence artério-veineuse.
La différence théorique entre le ctCO2 mesuré et le bicarbonate plasmatique calculé est un peu plus élevée (ctCO2 mesuré > bicarbonate plasmatique calculé) car en plus de la différence artério-veineuse de 1-2 mmol / L, il existe une différence supplémentaire de 1,5 mmol / L due à l’inclusion de CO2 dissous et d’acide carbonique dans le ctCO2 mesuré.
Cependant, cette différence suppose qu’aucun dioxyde de carbone dissous n’est perdu dans l’atmosphère avant l’analyse. Cela pourrait ne pas être le cas car les échantillons U & E ne sont pas manipulés de manière anaérobie.
Certains ont soutenu que le terme « bicarbonate de sérum / plasma » pour le ctCO2 mesuré est justifié par le fait que la pratique normale en laboratoire est associée à une perte inévitable de CO2 dissous de l’échantillon U & E avant l’analyse, auquel cas le ctCO2 mesuré se rapprocherait, théoriquement au moins, du bicarbonate calculé.
DISCORDANCE ENTRE LE ctCO2 MESURÉ ET LE BICARBONATE CALCULÉ
Malgré les légères différences théoriques entre les valeurs mesurées et calculées décrites ci-dessus, il est généralement admis que le ctCO2 mesuré généré dans le cadre d’un profil U & E est, à toutes fins cliniques pratiques, identique à la concentration plasmatique de bicarbonate calculée lors de l’analyse des gaz sanguins.
Cela se reflète dans l’utilisation du terme « bicarbonate de plasma » pour décrire le ctCO2 mesuré.
La meilleure preuve à ce jour que les résultats de bicarbonate mesurés et calculés peuvent en pratique être cliniquement interchangeables provient d’un rapport très récent de la Mayo Clinic. Les auteurs de ce rapport ont récupéré 17 621 enregistrements de concentrations mesurées et calculées de bicarbonate pour des échantillons prélevés simultanément chez les mêmes patients en 2006/7. La concentration en bicarbonate de cette énorme base de données variait de 5 à 49 mmol / L.
La différence moyenne (ET) entre les valeurs mesurées et calculées était de -0,36 (1,23 mmol / L), et pour 98.5% des résultats des échantillons appariés étaient à moins de 3 mmol/L l’un de l’autre. Bien que, comme le suggère le rapport Mayo, il existe généralement un accord acceptable entre les deux paramètres, il n’est pas rare que les résultats soient totalement discordants, le ctCO2 mesuré différant du bicarbonate calculé jusqu’à 15 mmol /L.
Au cours des quarante dernières années, de nombreuses études ont cherché à établir la fréquence, l’ampleur et la cause de l’écart entre le bicarbonate calculé et le ctCO2 mesuré.
Un premier axe de ce travail a remis en question la fiabilité du calcul du bicarbonate, qui dépend de manière cruciale de la constance de pK/1 (voir équation 4). En fait, il ne s’agit pas d’une véritable constante thermodynamique mais d’une constante de dissociation « apparente » déterminée expérimentalement à partir de la mesure du pH, du pCO2 et du CO2 dissous en utilisant la relation suivante dérivée de l’équation de Henderson-Hasselbach:
pK / 1 = pH + log dCO2-log
Plusieurs études ont révélé une variabilité suffisante de la pK / 1, en particulier chez les malades critiques, pour une erreur cliniquement significative dans le bicarbonate calculé. Par exemple, dans une étude, pK / 1 s’est avéré aller de 5,84 à 6,29.
Les auteurs calculent que des écarts de pK / 1 6,1 de cette magnitude entraîneraient des erreurs dans le bicarbonate calculé de l’ordre de ± 60%. Une autre décrit le cas d’un enfant diabétique en acidocétose dont le pK / 1 variait de 5,49 à 6,02 sur une période de sept heures.
Dans une étude portant sur 79 nourrissons pris en charge dans une unité de soins intensifs pédiatriques, 25% ont présenté un pK / 1 en dehors de la plage « normale » de 6,055 à 6,195 définie par l’étude, et dans trois cas, le pK / 1 était > 6,3, avec une valeur « étonnante » de 7,11. Ces rapports et d’autres rapports de variabilité cliniquement significative de la pK / 1 ont été contestés et la fiabilité ou non du bicarbonate calculé reste une question non résolue et litigieuse.
La base théorique de l’opinion selon laquelle le bicarbonate calculé n’est pas fiable en cas de maladie grave a été énoncée par Flear. Une approche tout aussi théorique accompagnée d’une multitude de preuves expérimentales a été déployée par Mass et al pour faire valoir les arguments opposés en défense du bicarbonate calculé.
Les auteurs d’études qui n’ont pas démontré de variabilité cliniquement significative de la pK / 1 suggèrent que la discordance majeure entre le bicarbonate calculé et le ctCO2 mesuré, parfois observée en pratique clinique, est probablement le résultat d’une combinaison de variables pré-analytiques, de différences analytiques et d’erreurs analytiques aléatoires.
La mesure de ctCO2 est particulièrement sujette à la variabilité pré-analytique car le sang pour le profilage U & E est universellement collecté et traité de manière aérobie. Les échantillons peuvent être laissés sans capuchon pendant des heures avant l’analyse. Étant donné que l’air ambiant contient moins de CO2 que le sang, il y a une tendance à la perte de CO2 dissous dans l’échantillon. Cela a été estimé pour réduire le CO2 mesuré au taux de 6 mmol / h.
En revanche, le bicarbonate calculé n’est pas associé au même risque de variation préanalytique parce que le sang pour les analyses de gaz sanguins est régulièrement échantillonné de manière anaérobie et qu’il y a un retard minimal (presque invariablement
Une autre cause contributive de discordance entre les valeurs mesurées et calculées pourrait être la différence d’échantillon, puisque le sang artériel est utilisé pour calculer une valeur et les échantillons de sérum ou de plasma sont utilisés pour mesurer une valeur.
Quelle que soit la cause, les études continuent de démontrer une discordance modérée mais cliniquement significative entre les deux paramètres chez les malades critiques. Cependant, comme pour confirmer le caractère litigieux du débat, la plus récente étude sur des patients gravement malades fournit la preuve d’un accord acceptable entre le bicarbonate calculé et le ctCO2 mesuré.
Malgré cette dernière étude, il existe un ensemble d’opinions selon lesquelles, pour les patients gravement malades au moins, il pourrait être prudent d’abandonner le bicarbonate calculé au profit du ctCO2 mesuré, bien qu’il faille souligner que ce point de vue est controversé et qu’il se pourrait que l’impact clinique des différences soit limité.
La preuve d’un accord acceptable fournie par la très grande étude de la clinique Mayo ne peut malheureusement pas être utilisée dans le débat particulier centré sur les malades critiques, car la population de patients n’a pas été définie.
Des deux paramètres, le bicarbonate calculé présente le net avantage de commodité par rapport au ctCO2 mesuré car il permet aux trois paramètres (pH pCO2 et bicarbonate) utilisés dans l’évaluation de l’acide-base d’être disponibles en même temps à partir d’un seul échantillon.
Il n’y a toujours pas de consensus dans la littérature sur bon nombre des questions abordées ci-dessus. Ainsi, il reste même difficile de savoir s’il y a ou non une discordance entre le CO2 mesuré et calculé, bien que l’équilibre des preuves ait récemment évolué en faveur de l’absence de discordance par la grande étude de la clinique Mayo.
Pour ceux qui croient que la balance des preuves suggère qu’il y a discordance, il y a deux autres questions non résolues.
Ce sont: la signification clinique de cette discordance et la cause de cette discordance. Le débat sur la cause de la discordance s’est principalement concentré sur la question de savoir si la pKl1 varie de manière significative entre les patients et dans quelle mesure les différences préanalytiques, les différences analytiques et les erreurs aléatoires contribuent à la discordance.
Enfin, au moins un commentateur a mis en doute le besoin clinique de bicarbonate calculé ou de ctCO2 mesuré, suggérant que le pH et le pCO2 seuls permettent une évaluation complète des perturbations acido-basiques.
RÉSUMÉ
Le dioxyde de carbone est un produit du métabolisme cellulaire aérobie qui est transporté dans le sang vers les poumons pour être excrété dans l’air expiré. Un peu est transporté inchangé dissous dans le sang, mais la plupart est transportée sous forme de bicarbonate.
La régulation de la quantité de dioxyde de carbone dans le sang, ou plus précisément la régulation du rapport bicarbonate / concentration de dioxyde de carbone dissous, est essentielle au maintien du pH sanguin (équilibre acido-basique normal).
L’investigation clinique de la perturbation acido-basique comprend l’analyse des gaz du sang artériel, un test qui génère trois paramètres de l’état du dioxyde de carbone. Parmi ceux-ci, un seul, le pCO2, est effectivement mesuré; les deux autres – le bicarbonate de plasma et la concentration totale de dioxyde de carbone – sont déduits par des calculs à partir du pH mesuré et du pCO2.
La validité de ces calculs a été remise en question et il existe des preuves contradictoires selon lesquelles, dans certains groupes de patients, il pourrait être plus fiable sur le plan clinique de mesurer le dioxyde de carbone total par des méthodes chimiques que de s’appuyer sur des valeurs calculées.
Ce dernier reste une question très controversée qui ne peut être finalement résolue que par une étude plus approfondie.