Le carcinome épidermoïde de la tête et du cou (SCCHN) est le sixième néoplasme le plus fréquent au monde avec environ 600 000 cas diagnostiqués chaque année. Au cours des 20 dernières années, de nombreuses données d’essais cliniques ont été recueillies, ce qui a transformé les normes de soins pour le traitement du NSCC. Historiquement, le mauvais contrôle local de la maladie et la survie globale ont donné une impulsion à une multitude d’essais cliniques évaluant la thérapie de multimodalité chez les patients atteints de NSCC. L’anatomie complexe et les rôles fonctionnels et sociaux critiques de la région de la tête et du cou ont sans doute également motivé des efforts importants pour identifier des alternatives à la résection oncologique des tumeurs malignes dans cette région. Dans cette revue, nous résumons le développement historique de la thérapie combinée de chimioradiation dans le traitement du NSCCHN, fournissons une mise à jour de la littérature récente dans ce domaine et discutons des questions cliniques contemporaines que des études futures pourraient résoudre.
Chimioradiation simultanée – Du traitement expérimental au Traitement préféré
Les études cliniques sur le rôle du traitement combiné de chimioradiation pour le SCCHN remontent au moins à la fin des années 1960, les premières études explorant l’utilisation séquentielle et concomitante d’agents uniques, notamment le fluorouracile (5FU), la bléomycine, le cisplatine, le méthotrexate et la mitomycine.1 De tels essais ont démontré une mauvaise réponse à la chimiothérapie en un seul agent tout en indiquant que le cisplatine est l’agent unique le plus efficace avec un taux de réponse de 25 à 30%.2-4 Des études ultérieures ont exploré le rôle de la chimiothérapie multi-agents et ont démontré une amélioration marquée de la réponse à la maladie à 70% avec le cisplatine et la bléomycine combinés 5 et des taux de réponse > 90% avec le cisplatine et la perfusion continue 5FU.6,7 Fait important, ces premières études ont mis en évidence un avantage potentiel pour la survie de l’ajout de la chimiothérapie aux traitements définitifs traditionnels de radiothérapie et / ou de chirurgie pour le NSCCHN et ont incité des études plus approfondies dans des essais randomisés de phase III plus importants.
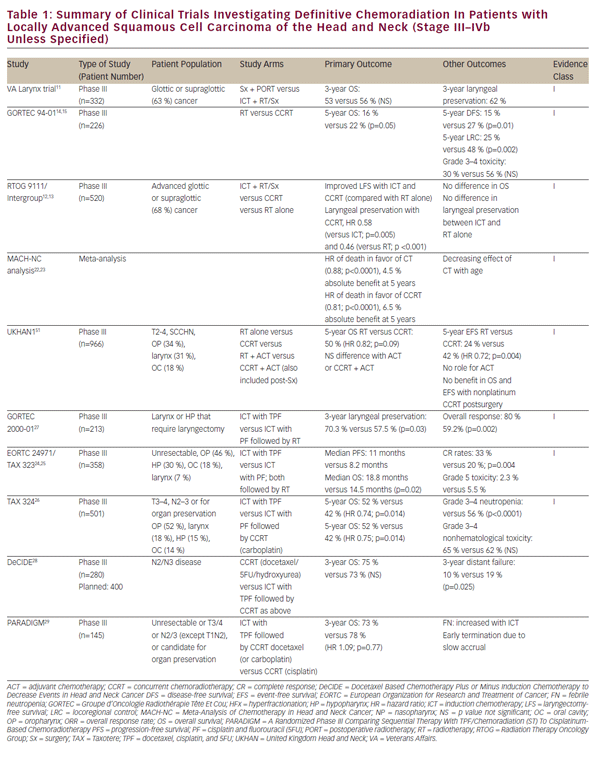
Avec le raffinement des schémas chimiothérapeutiques, la réflexion s’est tournée vers le potentiel d’approches de chimioradiation définitives et économes en organes chez les patients atteints d’un SCCHN localement avancé. Ce travail a d’abord été avancé par une série d’études à établissement unique démontrant la viabilité de la chimioradiation définitive comme alternative à la chirurgie pour les tumeurs laryngées glottiques et supraglottiques.8-10 L’étude sur le cancer du larynx de Veteran Affairs, historiquement importante, a finalement démontré que la chimiothérapie d’induction (ICT) suivie d’une radiothérapie pouvait assurer la préservation des organes chez les patients atteints de NSCCHN sans compromettre la survie globale.11 Cet essai a établi une justification de l’étude historique du Groupe d’oncologie de radiothérapie (RTOG) 9111, qui portait sur le séquençage approprié de la chimiothérapie et de la radiothérapie chez des patients atteints d’un cancer du larynx supraglottique ou glottique localement avancé. Les patients ont été randomisés en : TIC suivi d’une radiothérapie; chimioradiation simultanée (TCRC); ou le rayonnement seul.12,13 Les résultats du RTOG 9111 ont démontré la supériorité de la TRCC en termes de contrôle de la maladie locorégionale et de préservation du larynx, alors qu’aucune différence n’a été observée dans la survie globale entre les trois bras. Par la suite, l’essai du Groupe d’Oncologie Radiothérapie Tête Et Cou (GORTEC) 94-01 a randomisé des patients présentant des tumeurs primitives oropharyngées localement avancées en radiothérapie ou CCRT avec carboplatine / 5FU et a démontré une amélioration du contrôle local de la maladie ainsi que de la survie globale.14,15 Des améliorations similaires de la survie et du contrôle locorégional ont été rapportées chez les patients nasopharyngés traités par une TCRC.16-21 Un rapport de la Méta-Analyse de la chimiothérapie dans le cancer de la Tête et du cou (MACHNC) a suggéré un bénéfice global de survie de 6,5% à 5 ans avec le CCRT, mais pas avec les TIC ou la chimiothérapie adjuvante.22,23 L’effet de la chimiothérapie sur la survie dans cette méta-analyse a diminué avec l’âge chez les personnes de plus de 50 ans, aucun bénéfice démontrable n’ayant été démontré chez les personnes de 71 ans ou plus. Collectivement, bien que ces études diffèrent en termes de critères d’inclusion et d’exclusion, de paramètres cliniques et de méthodologies de traitement (voir tableau 1), elles confirment l’avantage de la TCRC par rapport à la radiothérapie seule en tant que traitement définitif du NSCCHN localement avancé.
Chimiothérapie d’Induction Précédant la Radiothérapie (Chimio) – Une stratégie viable?
Bien qu’une comparaison en tête-à-tête avec le TCRC ait indiqué une infériorité des TIC en termes de contrôle local de la maladie dans l’essai clinique RTOG 911112, cette approche thérapeutique demeure intéressante. Les données du RTOG 9111 indiquent une équivalence de ces approches en termes de toxicités de haut grade, ce qui rend difficile la justification du choix des TIC pour des raisons de tolérance du patient. Néanmoins, des études de suivi du RTOG 9111 ont cherché à se développer sur la plate-forme des TIC afin d’en faire une option de traitement plus viable. L’essai EORTC 24971/ TA X 32324,25 a démontré une amélioration de la survie globale avec l’ajout de docétaxel (TPF) au schéma ICT cisplatine et 5FU (PF) utilisé dans l’étude RTOG 9111 chez des patients atteints de NSCCHN non résécable. L’essai TA X 324 a évalué de manière similaire la TPF par rapport à la PF dans la mise en place du CCRT et la substitution hebdomadaire du carboplatine par le cisplatine dans ces schémas. Cette étude a démontré une amélioration du contrôle locorégional et distant de la maladie ainsi qu’une amélioration de la survie globale avec la TPF par rapport à la PF.26 Une étude de suivi supplémentaire (GORTEC 2000-01) dans le cancer du larynx et de l’hypopharynx localement avancé a confirmé une amélioration de la réponse à la maladie et de la préservation du larynx avec la TPF d’induction par rapport à la PF, mais n’a démontré aucun effet sur la survie.27 Bien que ces études diffèrent en termes de critères d’inclusion et d’exclusion, de paramètres cliniques et de méthodologies de traitement (voir tableau 1), elles soutiennent collectivement la supériorité de la FP sur les TIC basées sur la FP. Néanmoins, la comparaison directe des TIC avec le TCRC à base de cisplatine standard fait défaut.
La méta-analyse MACH-NC, comme indiqué précédemment, suggérait une infériorité des TIC par rapport à la TRCCC en termes de survie globale et de contrôle des maladies locorégionales.22 Il convient toutefois de noter que les avantages des TIC étaient plus prononcés que ceux de la TRCC en termes de taux de métastases à distance.22 Cela peut refléter un rôle distinct de la chimiothérapie dans ces approches thérapeutiques. La chimiothérapie concomitante peut jouer un rôle prédominant de radiosensibilisation, entraînant un effet dominant sur le contrôle local de la maladie, tandis que les TIC multi-agents peuvent fournir un traitement systémique efficace de la maladie micro-métastatique. Cette observation génératrice d’hypothèses suggère un caractère potentiellement complémentaire de ces traitements et a suscité un intérêt pour leur combinaison. Jusqu’à présent, les efforts déployés pour examiner la combinaison des TIC et du CCRT ont abouti à une mauvaise comptabilité d’exercice et à des résultats peu concluants (études DeCIDE et PARADIGM).28,29 Une étude de phase III randomisée en cours compare les TIC à la PF ou à la TPF suivie d’un TCRC à base de cisplatine par rapport au TCRC seul comme traitement de première intention du NSCCHN localement avancé (NCT00261703). Les résultats des études ci-dessus sur le CCRT et les TIC sont également résumés dans le tableau 1.
Chimioradiation adjuvante
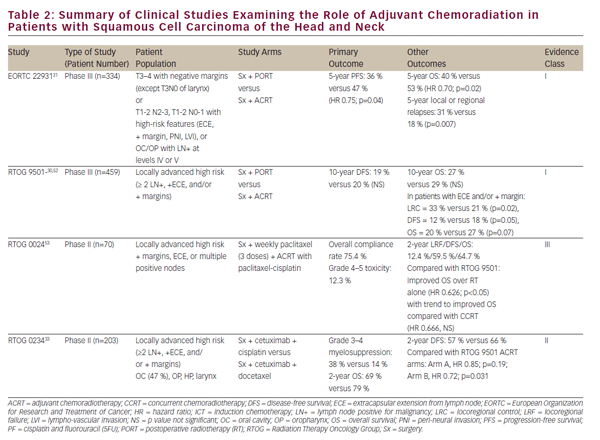
Les essais cliniques susmentionnés ont établi le CCRT comme traitement définitif viable pour la préservation des organes dans le SCCHN localement avancé. Néanmoins, la résection oncologique définitive reste une option de traitement importante pour les maladies localisées et une partie vitale de la thérapie multimodale pour les tumeurs avancées de la cavité buccale, du larynx et de l’hypopharynx. Le rôle de la chimioradiation en milieu adjuvant après résection oncologique a été largement défini par deux essais randomisés de phase III — EORTC 22931 et RTOG 950130,31 (voir Tableau 2). Ces études ont examiné l’utilisation de la radiothérapie postopératoire par rapport à la chimioradiation adjuvante avec le cisplatine administré toutes les 3 semaines pendant trois cycles chez des patients atteints de NSCCHN postopératoires. Les deux études ont montré une amélioration du contrôle des maladies locorégionales et une survie sans progression, tandis que l’étude EORTC a également montré une amélioration de la survie globale. Une analyse post-hoc de ces deux études a suggéré que le bénéfice de la TCRC adjuvante était le plus important chez les patients dont les marges chirurgicales et/ou l’extension extracapsulaire (ECE) étaient positives à partir de ganglions lymphatiques réséqués.32 Le rôle de l’adjuvant CCRT chez les patients dont les marges chirurgicales sont proches est moins clair et a été soutenu par EORTC 22931, qui comprenait des patients dont les marges chirurgicales sont ≤5 mm. D’autre part, RTOG 9501 incluait des patients sur la base de marges positives mais non proches. L’analyse post-hoc n’a suggéré aucun bénéfice apparent du TCRC chez les patients répondant aux critères d’entrée d’une seule de ces études.32 Dans le même ordre d’idées, le TCRC adjuvant n’a pas été suffisamment étudié chez les patients âgés car les patients de plus de 70 ans ont été exclus de l’EORTC 22931 et ne représentent qu’une petite minorité (5 %) des patients du RTOG 9501.30,31
Pursuant to EORTC 22931 and RTOG 9501, adjuvant CCRT has now become standard-of-care treatment in high-risk postoperative SCCHN patients. The phase II RTOG 0234 study has explored alternative adjuvant chemoradiation treatment regimens, randomizing patients with multiple involved lymph nodes, ECE, or positive margins to the epidermal growth factor receptor (EGFR) antibody, cetuximab, plus docetaxel or cetuximab plus cisplatin. This study demonstrated an apparent survival benefit from concurrent adjuvant cetuximab and docetaxel.33 Les résultats de cette étude intrigante de phase II doivent être validés dans une étude de phase III avant d’être incorporés dans la pratique clinique.
Impact du fractionnement par radiothérapie sur la chimioradiation
Dans le but d’accroître l’efficacité, des études cliniques antérieures ont étudié d’autres schémas de fractionnement pour l’administration de radiothérapie avec ou sans chimiothérapie concomitante chez des patients atteints de NSCCHN. Les essais RTOG 9003 et DAHANCA (Danish Head and Neck Cancer Group) ont démontré une amélioration de la lutte contre les maladies locorégionales avec des schémas de radiothérapie accélérés ou hyperfractionnés lorsque la radiothérapie est utilisée seule.34,35 Une méta-analyse ultérieure a même suggéré un bénéfice de survie modeste de l’hyper-fractionnement du rayonnement lorsqu’il est utilisé comme seule modalité de traitement.36 Dans le cadre d’une chimiothérapie concomitante, cependant, les études RTOG 0129 et GORTEC 99-02 n’ont démontré aucune amélioration des résultats cliniques avec l’utilisation de la radiothérapie accélérée par rapport à la radiothérapie conventionnelle.37,38 La TRCC hyper-fractionnée, comparée à la radiothérapie hyper-fractionnée seule, a permis d’améliorer le contrôle de la maladie locorégionale dans une étude en établissement unique de l’Université Duke et une étude de phase III de Yougoslavie, cette dernière montrant également une survie globale améliorée et une survie sans métastases à distance.39,40 Ces études indiquent que le bénéfice de la TCRC persiste avec la radiothérapie hyper-fractionnée. Aucune comparaison directe entre la TRCC fractionnée classiquement et la TRCC hyper fractionnée n’a été entreprise à ce jour. Il est à noter, cependant, que la méta-analyse MACH-NC n’a pas détecté de différence de résultat parmi les patients traités par CCRT en utilisant des techniques de fractionnement conventionnelles ou modifiées.22
Toxicité – Le coût de la chimioradiation
En accord avec de nombreuses études menées dans un seul établissement qui l’ont précédée, le RTOG 9111 a indiqué que les avantages de la chimiothérapie, qu’elle soit administrée séquentiellement ou en même temps que la radiothérapie, se font au détriment d’une toxicité supplémentaire.12 De même, dans le contexte des adjuvants, les essais cliniques EORTC 2291 et RTOG 9501 ont démontré un doublement approximatif des toxicités de grade 3 avec chimioradiation par rapport au rayonnement seul.30,31 Une telle tendance persiste même dans le cadre de la radiothérapie hyper-fractionnée.39 Bien que le taux attendu de toxicité spécifique déterminé à partir d’études historiques soit probablement surestimé à l’ère actuelle des techniques de radiothérapie hautement conformes, telles que la radiothérapie à modulation d’intensité (TMI). Deux petits essais randomisés ont rapporté une réduction significative de l’incidence et de la gravité de la xérostomie avec l’utilisation de l’IMRT par rapport à la radiothérapie conforme tridimensionnelle conventionnelle pour les cancers de la tête et du cou (intensité d’épargne parotide modulée par rapport à la radiothérapie conventionnelle dans les essais sur le cancer de la tête et du cou et à l’hôpital Tata Memorial).41,42 Les essais les plus récents portant sur la TRCCC permettent l’administration d’un traitement basé sur la TRM comme approche standard dans la prise en charge du NSCCHN. Il reste à voir quel impact l’IMRT aura sur les taux de toxicité lorsqu’elle est combinée à la chimiothérapie dans ces études randomisées plus vastes.
L’amélioration des techniques de radiothérapie, associée à l’importance et à la disponibilité croissantes des soins de soutien et des services auxiliaires tels que la pathologie de la parole et les soins dentaires, limite encore davantage l’incidence de toxicités graves non hématologiques. Cependant, la toxicité prévue du CCRT devrait toujours être supérieure à celle de la radiothérapie seule. Cette toxicité persistante reflète le « coût » clinique de la combinaison de la chimiothérapie et de la radiothérapie. Dans ce contexte, il demeure primordial que les médecins évaluent de manière exhaustive les patients afin de déterminer si les avantages potentiels de la TRCCC justifient ce coût. L’utilisation de traitements à base de radiothérapie à modalité unique chez des patients présentant des comorbidités marquées / une performance de base faible ou présentant une maladie à faible risque et à un stade précoce peut être une approche raisonnable pour maximiser le ratio thérapeutique. Cette analyse risque-bénéfice devient encore plus importante avec l’avènement d’agents moléculaires ciblés qui offrent une option alternative viable pour le traitement simultané.
Le rôle émergent des Agents à visée moléculaire
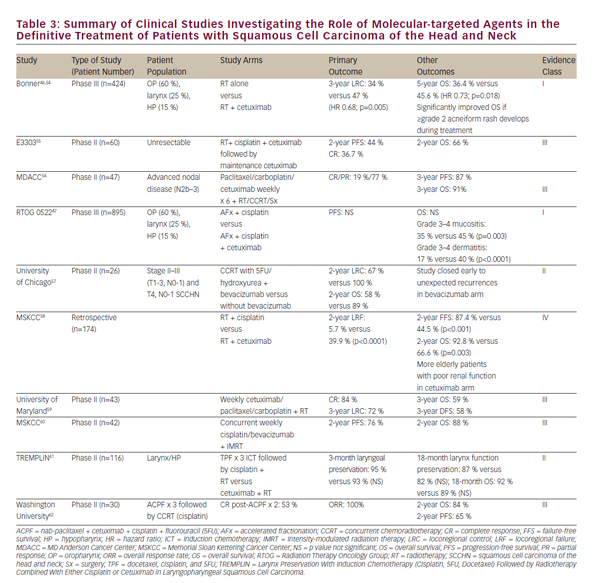
La toxicité du traitement par chimioradiation, ainsi que le désir d’améliorer encore les résultats cliniques, ont favorisé un intérêt croissant pour le rôle des agents à visée moléculaire dans le traitement du SCCHN. L’EGFR est surexprimé ou muté dans 80 à 90% des tumeurs SCCHN, ce qui est associé à une diminution de la réponse à la radiothérapie et à des résultats cliniques plus médiocres.43-45 En 2006, Bonner et coll. rapport d’un essai historique chez des patients atteints de NSCCHN localement avancé traités par rayonnement seul ou par rayonnement concomitant à l’anticorps EGFR, le cetuximab. Cette étude a démontré que le cetuximab et le rayonnement simultanés augmentaient le contrôle de la maladie locorégionale et la survie globale sans exacerber les toxicités courantes du rayonnement.46 Cette étude a défini un rôle pour le cetuximab et la radiothérapie simultanés chez les patients qui ne sont pas candidats au cisplatine.
Des études ultérieures ont cherché à comparer le CCRT avec le cetuximab concomitant à celui avec le cisplatine. Les études rétrospectives et les études de phase précoce diffèrent dans cette évaluation et une comparaison randomisée de phase III est en cours dans RTOG 1016. Notamment, l’essai RTOG 0522 a évalué le bénéfice supplémentaire potentiel du cetuximab à un schéma thérapeutique à base de cisplatine du CCRT47. Cette étude a montré que, lorsqu’il était ajouté au CCRT standard à base de platine, le cetuximab n’améliorait pas davantage la survie sans progression ni la survie globale. Dans le cadre postopératoire, le RTOG 0920 évaluera la radiothérapie adjuvante avec ou sans cetuximab dans le SCCHN réséqué localement avancé tandis que l’essai de phase II / III RTOG 1216 évaluera le CCRT adjuvant avec le cisplatine concomitant versus le docétaxel versus le docétaxel et le cetuximab pour le SCCHN à haut risque.
De nombreux essais cliniques de phase précoce portant sur d’autres agents à visée moléculaire ainsi que sur la radiothérapie pour le traitement du SCCHN ont été menés ou sont en cours. Une sélection de ceux-ci est résumée dans le tableau i > 3. À l’exception des études sur le cetuximab, aucun autre agent moléculairement ciblé n’a atteint le point d’influencer la pratique actuelle en dehors d’un essai clinique. Bien que la perspective d’agents ciblés sur des molécules soit prometteuse, la chimiothérapie concomitante au cisplatine à haute dose reste la recommandation de niveau 1 préférée des lignes directrices actuelles du National Comprehensive Care (NCCN) pour l’ECTRC.
La chimioradiation dans le cancer de la tête et du Cou — Un paradigme en évolution
Les 20 dernières années ont vu l’émergence de la chimioradiation comme norme de soins dans le traitement définitif du NSCCH. Chez des patients correctement sélectionnés, le bénéfice démontrable pour la survie de ce traitement l’emporte sur les risques de toxicités supplémentaires. Cependant, des questions importantes demeurent concernant l’utilisation optimale de la chimioradiation. Un certain nombre d’essais cliniques ont exploré plus en détail l’utilité clinique potentielle des TIC chez des patients atteints localement de NSCCHN avancés et, bien que ces études aient démontré une amélioration des schémas thérapeutiques des TIC au détriment de la toxicité, aucune n’a démontré de manière concluante une amélioration clinique significative par rapport au CCRT à base de cisplatine.
Les études futures continueront sans aucun doute d’explorer des schémas thérapeutiques et des schémas posologiques alternatifs ainsi que des méthodes de fractionnement, de dosage et d’administration par radiothérapie dans le but de faire progresser les techniques existantes. De plus, avec le développement continu de nouvelles chimiothérapies à visée moléculaire, les études futures définiront presque certainement un rôle en plein essor pour ces agents dans le traitement du SCCHN. L’utilisation de ces agents dans un cadre d’induction avant la TRCCC peut être particulièrement intéressante, où ils peuvent cibler les micro-métastases et réduire les rechutes à distance sans imposer de limites liées à la toxicité sur les taux d’achèvement de la TRCCC. Bien que l’utilisation de la TCRC évolue, une enquête continue sur le rôle approprié de la chirurgie dans le RCS est également justifiée. Les progrès de la chirurgie robotique et des approches de traitement de la chimioradiation fournissent un équilibre pour une telle investigation. Les directives de pratique actuelles recommandent une chimioradiation adjuvante pour les patients postopératoires présentant des marges positives ou une ECE, tandis que la radiothérapie adjuvante seule ou la prise en compte de la chimioradiation est recommandée pour les patients postopératoires présentant une maladie nodale primaire pT3 ou pT4, pN2 ou pN3, une atteinte des ganglions lymphatiques de niveau IV ou V, ou une invasion péri-neurale ou lympho-vasculaire. Des études supplémentaires identifiant les prédicteurs radiographiques et cliniques préopératoires de l’état à haut risque chez les patients atteints de NSCCHN à un stade précoce s’avéreront utiles pour guider le traitement de ces patients qui pourraient être épargnés d’une intervention chirurgicale avec une approche de traitement de chimioradiation définitive initiale.
La reconnaissance récente de l’infection par le virus du papillome humain (VPH) comme cause et facteur pronostique favorable du NSCCH provenant de l’oropharynx48 et potentiellement d’autres sites transforme la conception du NSCCH en tant qu’entité pathologique. Dans une analyse rétrospective du RTOG 0129, la survie globale à 3 ans chez les patients atteints de tumeurs positives au VPH était de 82,4% contre 57% pour la maladie négative au VPH (p49,50 À la lumière de cela, les études futures seront nécessairement stratifiées en fonction du statut du VPH ou adaptées à un sous-ensemble de patients positifs ou négatifs au VPH, ce qui provoquera un schisme croissant dans les approches de traitement. La perspective d’étudier des approches de traitement moins toxiques pour les tumeurs positives au VPH et des traitements définitifs plus agressifs pour les tumeurs négatives au VPH est déjà évoquée afin de tenir compte des différences marquées dans leurs réponses respectives aux modalités de traitement actuelles. RTOG 1016 est l’une de ces études évaluant spécifiquement les patients positifs au VPH pour une désintensification du traitement par l’utilisation simultanée de cetuximab avec rayonnement par rapport au TCRC standard à base de cisplatine. L’interaction de schémas thérapeutiques spécifiques et d’agents cibles moléculaires particuliers avec le statut HPV tumoral s’avérera sans aucun doute un terrain fertile pour de futures recherches. Il reste à voir quel impact l’épidémie de VPH en plein essor et les programmes de vaccination actuels auront sur les résultats cliniques et les approches de traitement chez les patients atteints de NSCC.