Résumé
La cardiomyopathie cirrhotique est une affection récemment reconnue consistant en un dysfonctionnement myocardique qui se manifeste chez les patients cirrhotiques en l’absence de maladie cardiaque antérieure. Les mécanismes pathogéniques sous-jacents comprennent un environnement « miocardiotoxique » qui conduit à une réponse cardiaque émoussée au stress, qu’il soit physique ou pharmacologique. Cette condition est maintenant mieux comprise et peut être diagnostiquée à l’appui clinique, par des critères d’électrocardiographie et d’échocardiographie de laboratoire. Cliniquement, l’incompétence systolique est plus évidente lorsque les patients cirrhotiques sont soumis à un stress physique ou pharmacologique. Bien qu’il soit bien compris, il y a un manque de connaissances pour une application pratique appropriée. Des rapports de cas récents ont suggéré que le CCM doit être traité tôt car il peut être un facteur déclenchant des complications de la cirrhose. Des études sont nécessaires pour identifier les traitements potentiels qui modifient l’histoire naturelle des maladies cardiaques chez les patients cirrhotiques, en particulier dans les phases où les patients sont asymptomatiques.
Mots clés
cirrhose du foie, insuffisance cardiaque, cardiomyopathie
Introduction
La cardiomyopathie cirrhotique (CCM) est un dysfonctionnement cardiaque caractérisé par une réponse contractile sous-optimale au stress et une altération de la fonction diastolique en l’absence de maladie cardiaque antérieure. De nos jours, la recherche a proposé que les patients cirrhotiques présentent un dysfonctionnement cardiaque intrinsèque qui peut influencer le développement de l’insuffisance rénale dans une maladie hépatique avancée.
Depuis 2002, les résultats sur la dysfonction circulatoire dans les maladies du foie ont évolué grâce à des méthodes de diagnostic, soulignant l’importance de l’identification du CCM dans la pratique clinique. Cependant, il y a encore un manque de connaissances concernant la gestion de cette condition. La présence d’un dysfonctionnement myocardique dans la cirrhose augmente le risque de syndrome hépatorrénal (HRS) et d’événements cardiaques indésirables et elle est liée à une mortalité plus élevée.
Nous avons examiné la littérature disponible dans PubMed concernant les marqueurs des complications de la cirrhose et les interactions du cœur et du foie. Le but de cette revue est de discuter de la nécessité de suivre et de traiter précocement la MCC, car elle peut être un facteur déclenchant des complications de la cirrhose, apportant ainsi de nouvelles perspectives à la pratique clinique.
Définition et prévalence
CCM décrit un dysfonctionnement cardiaque chronique chez les patients cirrhotiques malgré l’absence de maladie cardiaque structurelle antérieure. Elle est définie par un ou plusieurs des éléments suivants: anomalies structurelles des chambres cardiaques; dysfonctionnement diastolique; fonction systolique normale ou augmentée au repos mais mauvaise réponse contractile au stress; et modifications électrophysiologiques. Ces anomalies peuvent être observées chez jusqu’à 50% des patients cirrhotiques.
Physiopathologie
La physiopathologie de la cirrhose est connue par une surproduction d’oxyde nitrique (NO) dans les vaisseaux splanchniques et une vasodilatation systémique qui en résulte. Ce mécanisme déclenche l’activation du système rénine-angiotensine-aldostérone (RAAS) et du système nerveux sympathique et augmente le taux de vasopressine sérique, conduisant à un état hyperdinamique qui peut se répercuter des paramètres cellulaires aux paramètres cliniques.
Ces patients présentent une augmentation du monoxyde de carbone sérique (CO) secondaire à une hyperactivité sympathique et à des cytokines inflammatoires. Il y a une augmentation du CO, associée à des taux élevés de NO, à une accumulation d’endocannabinoïdes et d’autres vasodilatateurs. Ces substances augmentent les leves de guanosine monophosphate cyclique (cGMP), qui inhibe l’adénosine monophosphate cyclique (AMPc) dans les cardiomyocites, responsables de l’afflux de calcium et d’une plus grande force contractile (Figure 1,2). L’analyse des cellules myocardiques montre une réduction de la fluidité de la membrane plasmatique due au dépôt de cholestérol, ce qui complique l’interaction de substances telles que les récepteurs bêta-adrénergiques et les protéines G. La myosite ventriculaire peut également avoir une diminution de la fonction des canaux potassiques, ce qui entraîne une relaxation cardiaque sous-optimale et un dysfonctionnement diastolique qui en résulte.
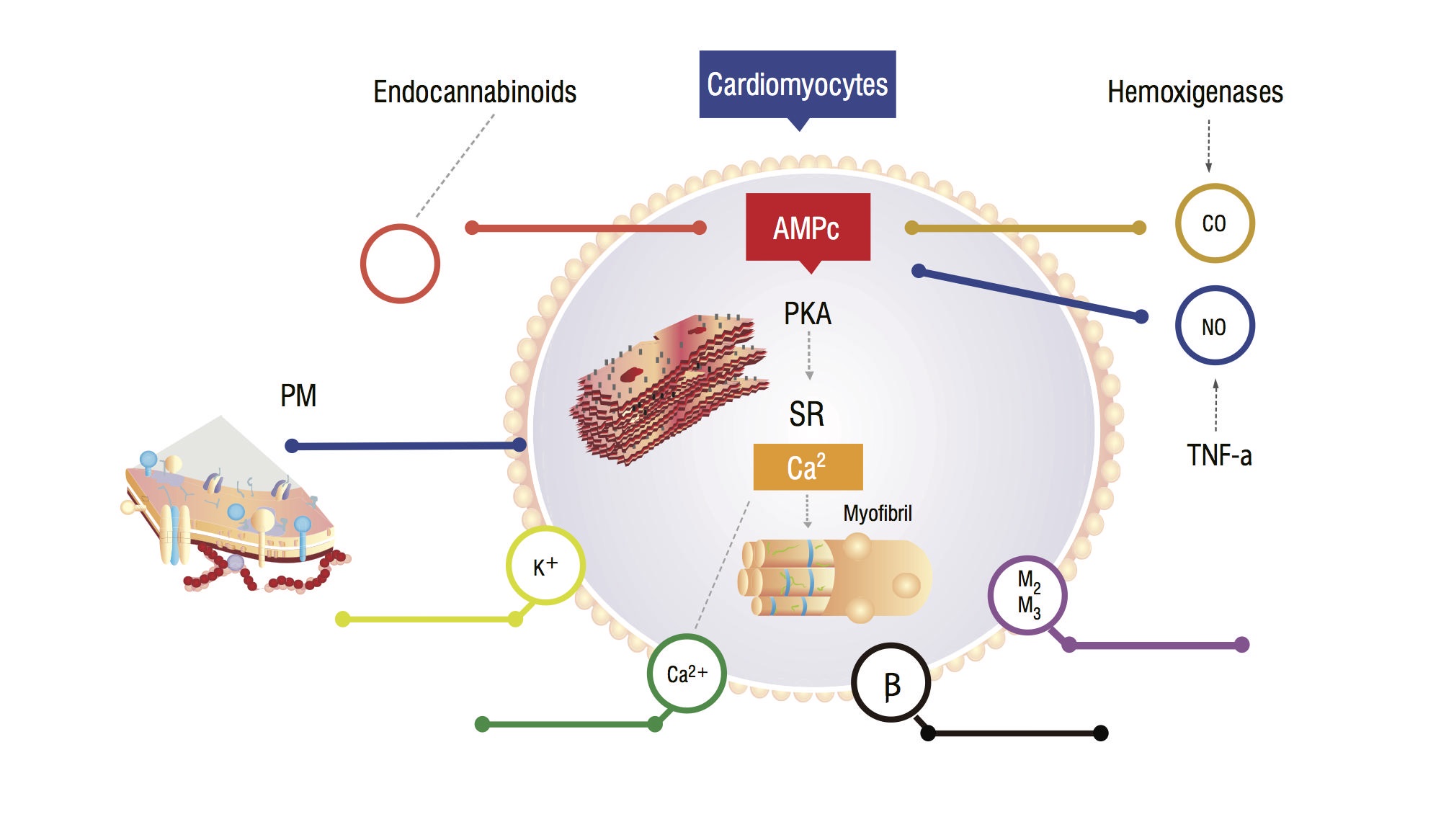
Figure 1. Modèle physiopathologique de cardiomyocyte montrant les principales voies de signalisation conduisant à une réponse myocardique floue au stress. PM: Membrane plasmatique; CO: Oxyde de carbone; NO: Oxyde nitrique; TNF-a: Facteur de nécrose tumorale alfa; SR: réticull sarcoplasmique; AMPc: adénosine monophosphate cyclique; PKA: Protéine kinase A.
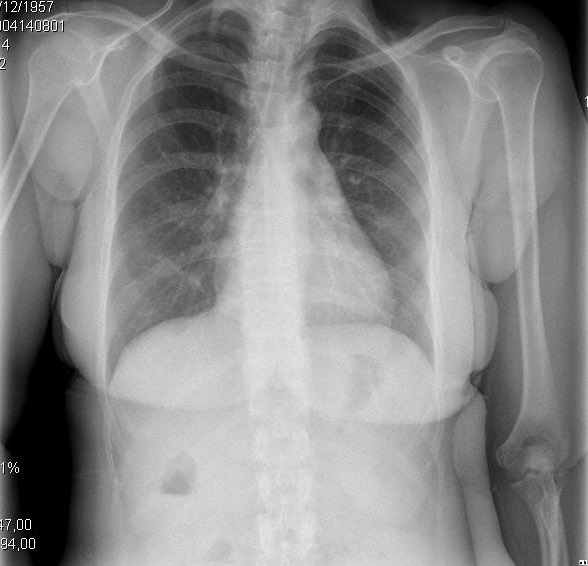
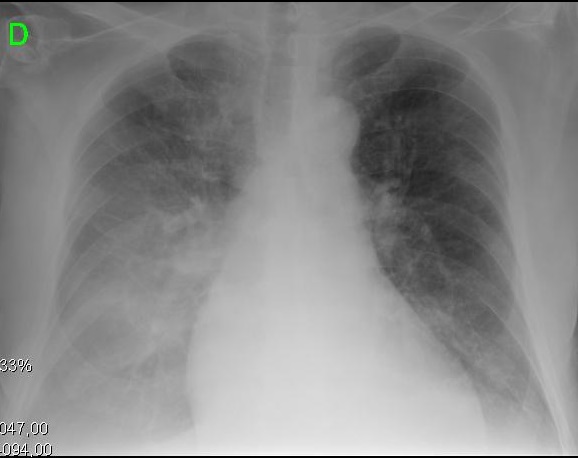
Figure 2. Présentations cliniques et radiologiques des différents stades évolutifs de la cardiomyopathie cirrhotique. A. L’image de gauche montre un petit épanchement pleural et une ICT de 0,50. B. L’image de droite représente une congestion pulmonaire sévère et une ICT de 0,67.
Tableau 1. Critères cliniques et complémentaires pour le diagnostic de CCM. Adapté de la référence 29 avec autorisation.
Les stimuli bêta-adrénergiques persistants induisent une régulation négative et réduisent la densité des récepteurs cardiaques, modifiant les cascades de signalisation responsables de l’activation des canaux calciques; le résultat est une altération de la fonction contractile. La répercussion clinique de cette voie est une fonction myocardique émoussée et une augmentation des biomarqueurs cardiaques.
L’identification de la MCC repose sur des caractéristiques cliniques subtiles qui peuvent être démasquées à mesure que la maladie progresse, ou peuvent devenir clairement évidentes dans des scénarios cliniques spécifiques de souche, et devient un défi quant à savoir si et quand traiter.
Histoire naturelle et diagnostic
Les critères diagnostiques sont résumés dans le tableau 1 et reposent sur des critères cliniques, d’imagerie et de biomarqueurs.
Caractéristiques cliniques
Les caractéristiques cliniques de la MCC peuvent survenir chez des patients présentant une fonction cardiaque apparemment normale, car l’adaptation chronique du cardiomyocyte à l’environnement cirrhotique entraîne toutes ces modifications cellulaires.
Les patients cirrhotiques évoluent avec une rétention de sodium et de liquide, une vasodilatation périphérique, une hyperactivité sympathique et une accumulation de substances « miocardiotoxiques », exigeant un processus adaptatif de cardiomyocyte. Cet équilibre du continuum peut être rompu et démasquer une insuffisance cardiaque latente dans des situations de stress, telles qu’une greffe de foie, un shunt portosystémique intrahépatique transjugulaire ou des infections.
Bien que la cardiomyopathie cirrhotique ait tendance à être une maladie chronique, des études révèlent que les signes cliniques de dysfonctionnement myocardique peuvent s’inverser jusqu’à 15 mois après une greffe hépatique réussie, ainsi que l’allongement de l’intervalle QT.
Résultats de laboratoire
Étant donné que le dysfonctionnement cardiaque peut être reflété par des biomarqueurs inflammatoires, de nouveaux marqueurs cardiaques et pro-inflammatoires sont récemment étudiés et corrélés au développement de complications conduisant à une mortalité accrue.
Des études récentes décrivent une corrélation entre les niveaux de pro-hormone d’ANP (proANP) et de peptide natriurétique de type B (BNP), de copeptine et de troponine T à haute sensibilité (hs-TnT), ainsi que de récepteur activateur du plasminogène de type urokinase soluble (suPAR) et de protéine C réactive hautement sensible (hs-CRP) et de complications cardiovasculaires dans la cirrhose. Cependant, son utilisation clinique est toujours en cours d’évaluation.
Les peptides natriurétiques sont sécrétés par les cardiomyocytes en réponse à une surcharge volumique ou de pression, ou à une ischémie myocardique, pour compenser l’effet RAAS sur l’équilibre du sodium et de l’eau. Le BNP peut être l’un des biomarqueurs les plus disponibles qui permet une reconnaissance précoce de l’atteinte cardiaque. Sa concentration sérique est d’autant plus élevée que les maladies du foie et du cœur sont graves.
Des études prometteuses indiquent que des taux élevés d’adrénomédulline sont également observés dans la cirrhose avec ou sans atteinte cardiaque clinique; cette substance est libérée dans le flux sanguin pour agir comme vasodilatateur et vise à réduire la postcharge. La galectine-3, le biomarqueur le plus récent étudié élevé chez les patients cirrhotiques, a été associée à une fibrose myocardique et peut être en corrélation avec la gravité de la cirrhose. Ce marqueur s’avère plus sensible que le BNP dans l’évaluation de la dysfonction diastolique, bien qu’il soit moins spécifique.
Électrocardiogramme
Des anomalies électrocardiographiques (ECG) peuvent être remarquées tôt chez un patient asymptomatique CCM et peuvent être corrélées avec des arythmies ventriculaires et une mort subite. La découverte ECG la plus courante est l’allongement de l’intervalle QT, qui peut être observé chez environ 30 à 40% des patients cirrhotiques, principalement Child-Pugh B ou C, quelle que soit l’étiologie de la cirrhose.
Ce schéma ECG peut être secondaire à des anomalies de repolarisation des cardiomyocytes dans les canaux potassiques et à une réduction de la concentration de ces canaux dans la membrane plasmique, en réponse à des modifications mineures de la pression portale. Les dysfonctionnements des canaux ioniques provoquent ainsi un allongement du potentiel d’action des cellules myocardiques, entraînant une systole ventriculaire et un QT plus longs. Un temps de contraction plus long implique une relaxation altérée, provoquant un dysfonctionnement diastolique.
Le découplage électromécanique est décrit comme une dyssynchronie entre le stimulus électrique et la réponse mécanique systolique du cœur, entraînant une perte progressive de la fonction myocardique et une insuffisance cardiaque congestive chez ces patients1. L’incompétence chronotrope est caractérisée par l’incapacité du nœud sinusal à répondre à des stimuli physiologiques ou pharmacologiques, un fait déterminant en physiopathologie CCM. Ces changements sont également secondaires à l’hypertension portale, au dysfonctionnement autonome, à la circulation hyperdynamique et à la présence des facteurs pro-inflammatoires affectant le myocarde du patient.
Échocardiogramme
L’échocardiogramme fournit des données pertinentes sur la fonction cardiaque et est utilisé comme critère de diagnostic de la cardiomyopathie cirrhotique.
Les principaux résultats chez ces patients sont l’élargissement du ventricule gauche (VG) en fin de diastole, la réduction de la vitesse de pointe et le taux de déformation systolique; augmentation de la pression ventriculaire gauche end-diastolique, sans expansion appropriée de la FEVG. Une hypertrophie de l’oreillette gauche (LA) de plus de 34 mL / m2 peut suggérer une dysfonction diastolique chronique et, lorsqu’elle est associée à une réduction de la masse du VG, peut suggérer un pronostic plus défavorable. L’évaluation de LA peut être effectuée par échocardiographie en deux dimensions et suivi des taches.
Les résultats courants observés dans l’échocardiographie doppler cardiaque indiquent une relaxation myocardique altérée chez les patients cirrhotiques: diminution du rapport E / A (< 1), et temps de décélération prolongé de l’onde E (DT) et temps de relaxation isovolumétrique (IVRT) > 80ms.Le plus grave est le dysfonctionnement diastolique, plus court est le IVRT et le DT mitral, et plus élevé est le rapport de vitesse E / A, caractérisant un dysfonctionnement diastolique avancé, une pression accrue de LA et une classe fonctionnelle pire.
Des études récentes avec évaluation de la souche longitudinale globale (GLS) montrent que cela peut être une méthode utile pour la détection précoce du dysfonctionnement cardiaque chez le patient cirrhotique, principalement le dysfonctionnement systolique au repos.
Le rapport E / A peut être un paramètre fiable dans le diagnostic de la dysfonction diastolique chez les patients cirrhotiques, même avec des valeurs influencées par le degré d’hydratation du patient, bien qu’il puisse varier en raison d’une ascite et d’une surcharge volumique. Pendant ce temps, le temps de relaxation isovolumétrique, bien que très sensible, ne représente pas le remplissage du VG et varie à mesure que la fréquence cardiaque change.
Un dysfonctionnement systolique léger et un dysfonctionnement diastolique peuvent être présentés indépendamment du degré de cirrhose. Cependant, la dysfonction diastolique se retrouve le plus souvent chez les patients cirrhotiques et précède généralement la première.
Discussion
Cette revue aborde une identification et une compréhension croissantes de la physiopathologie sur la CCM, sa corrélation avec un mauvais pronostic chez les patients cirrhotiques et pose la préoccupation de l’approche thérapeutique.
Cet article résume les critères diagnostiques (tableau 1) déjà établis dans la littérature médicale, en mettant l’accent sur les nouveaux biomarqueurs étudiés pour la complémentation diagnostique. Des études ont montré qu’un dysfonctionnement myocardique existe à différents stades de la cirrhose du foie. Il a été décrit que si le patient présente un BNP élevé et un dysfonctionnement ventriculaire à l’échocardiogramme, le traitement de l’insuffisance rénale est très difficile; D’autre part, une intervention précoce chez les patients qui n’ont pas encore de maladie cardiaque établie est un domaine qui n’a pas encore été exploré.
Tableau 1. Critères cliniques et complémentaires pour le diagnostic de CCM. Adapté de la référence 29 avec autorisation.
Caractéristiques cliniques
Pas de symptômes cardiopulmonaires au repos
Faible réserve cardiaque fonctionnelle
État hiperadrénergique avec rétention de sodium et de liquide
Biomarqueurs (troponine I, pro- BNP et BNP, autres)
Eletrocardiography
Anomalies électrophysiologiques (allongement de l’intervalle QT et autres)
Critères échocardiographiques
Évaluation diastolique
Rapport E/A < 1.0 (âge corrigé)
Temps de relaxation isovolumique prolongé (> 80msec)
Temps de décélération prolongé (> 200msec)
Hypertrophie ventriculaire gauche
Évaluation systolique
Fraction d’éjection au repos < 55%
Déficit contractile du stress
Les signes et symptômes de l’insuffisance hépatique ont tendance à être tardifs, avec des manifestations cliniques et de laboratoire subtiles, parfois difficiles à interpréter. Le spécialiste, voire le médecin généraliste, peut faire face à un patient présentant une plainte de dyspnée, sans gonflement jugulaire pathologique, examens cardiologiques initiaux normaux, mais avec une BNP élevée, ce qui peut représenter un cas de MCC.
Contrairement à d’autres études, notre groupe propose une avancée dans ce domaine, car la compréhension des maladies cardiaques concomitantes à la cirrhose peut permettre une intervention thérapeutique précoce des complications attribuables à une insuffisance myocardique non diagnostiquée. La transplantation hépatique et les conseils sont des paramètres cliniques spéciaux qui peuvent déflagrer l’insuffisance cardiaque chez ces patients. Comme les patients survivent plus longtemps après ces procédures, les cliniciens seraient confrontés à une détérioration des paramètres cardiaques.
Nous pensons qu’une intervention thérapeutique précoce dans la MCC est prometteuse, lorsqu’elle se manifeste par des complications telles que les HRS réfractaires, avant de présenter une congestion pulmonaire claire imputable à une insuffisance myocardique. La littérature soutient que les situations de stress physique ou pharmacologique, ou d’infections, associées à une cardiomyopathie cirrhotique latente peuvent entraîner des HRS, qui peuvent être réfractaires aux traitements conventionnels et associées à un pronostic pire en cas de dysfonctionnement systolique.
Notre expérience suggère que la présentation des HRS est un indice pour initier le traitement du composant myocardique. Cette progression vers la HRS est comprise puisque l’existence de la CCM est un facteur déclencheur et perpétuateur de la HRS, donc si la CCM est abordée tôt dans ce contexte, la HRS peut avoir un meilleur pronostic.
Notre groupe a été le pionnier du traitement des patients avec un diagnostic clinique de CCM en progression vers SHR réfractaire aux traitements conventionnels, dans lesquels l’utilisation de la dobutamine comme thérapie de secours pour la fonction rénale a été couronnée de succès. L’objectif est d’appliquer ces connaissances théoriques en anticipant cette complication chez les patients atteints d’une maladie hépatique en phase terminale.
Bien qu’il soit bien compris, il y a un manque de connaissances pour une application pratique appropriée. Un degré élevé de suspicion clinique est nécessaire pour reconnaître la CCM chez le patient asymptomatique sans limitations fonctionnelles apparentes, mais présentant une cardiopathie cellulaire et structurelle subclinique.
Des études sont nécessaires pour identifier des traitements potentiels qui modifient l’histoire naturelle des maladies cardiaques chez les patients cirrhotiques, en particulier dans les phases où les patients sont asymptomatiques. Cela représente un domaine de connaissances qui n’a pas encore été exploré, en particulier en ce qui concerne les options thérapeutiques futures.
Conflits d’intérêts
Les auteurs ont déclaré qu’il n’y avait pas de conflits d’intérêts concernant la publication de cet article.
Soutien financier
Néant.
- Sampaio F, Pimenta J (2016) Évaluation de la fonction ventriculaire gauche dans la cirrhose: Méthodes actuelles et orientations futures. Monde J Gastroenterol 22:112-125.
- Shin WJ, Song JG, Jun IG, Moon YJ, Kwon HM, et al. (2016) Effet du couplage ventriculo-artériel sur les résultats de la transplantation chez les cirrhotiques: Analyse des relations de courbe pression-volume. J Hépatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) Dysfonctionnement diastolique dans la cirrhose du Foie: Prédicteur pronostique dans la transplantation hépatique? Proc 48:128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) La survie à 2 ans chez les patients cirrhotiques du foie est influencée par le volume auriculaire gauche et la masse ventriculaire gauche. Foie Int.
- Møller S, Henriksen JH (2002) Cardiomyopathie cirrhotique: examen physiopathologique du dysfonctionnement circulatoire dans les maladies du foie. Cœur 87:9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Cardiomyopathie cirrhotique: Un autre Cas d’approche réussie du traitement du syndrome hépatorénal. Cas Rep Gastroenterol 10:531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) Une perspective sur la cardiomyopathie cirrhotique. Greffe Proc 43: 1649-1653.
- Ma Z, Lee SS (1996) Cardiomyopathie cirrhotique: aller au cœur du problème. Hépatologie 24:451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, et al. (2010) Cardiomyopathie cirrhotique. Je suis Coll Cardiol 56:539-549.
- Myers RP, Lee SS (2000) Cardiomyopathie cirrhotique et transplantation hépatique. Transpl du foie 6: S44-52.
- Wiese S, Mortensen C, Gøtze JP, Christensen E, Andersen O, et al. (2014) Les marqueurs cardiaques et pro-inflammatoires prédisent le pronostic de la cirrhose. Foie Int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) Évaluation des fonctions cardiaques d’enfants cirrhotiques à l’aide d’un peptide natriurétique sérique du cerveau et d’une imagerie Doppler tissulaire. Ann Pediatr Cardiol 9:22-8.
- Rahman S, Mallett S V (2015) Cardiomyopathie cirrhotique?: Implications pour la prise en charge périopératoire des patients greffés du foie 7:507-20.
- Farr M, Schulze PC (2015) Progrès récents dans le Diagnostic et la Prise en charge de la Cardiomyopathie Associée à la Cirrhose chez les Candidats à la Transplantation Hépatique: Imagerie par Écho Avancée, Biomarqueurs Cardiaques et Thérapie Avancée de l’Insuffisance Cardiaque. Clin Med Insights Cardiol 8:67-74.
- Licata A, Corrao S, Petta S, Genco C, Cardillo M, et al. (2013) Le niveau plasmatique et le volume auriculaire de NT pro BNP sont liés à la gravité de la cirrhose du foie. PLoS Un 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactine-3 et peptide natriurétique cérébral par rapport à l’échocardiographie conventionnelle dans la détection précoce de la cardiomyopathie cirrhotique. Turk J Gastroenterol 27:367-74.
- Wong F, Siu S, Liu P, Blendis LM (2001) Peptide natriurétique du cerveau: est-ce un prédicteur de la cardiomyopathie dans la cirrhose? Clin Sci (Lond) 101:621-628.
- Wong F (2009) cardiomyopathie cirrhotique. Hépatol Int 3:294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, et al. (2003) Allongement de l’intervalle QTc chez les patients atteints de cirrhose. Ann Gastroenterol 16:155-8.
- Mozos I (2015) Risque d’arythmie dans la cirrhose du foie. Monde J Hépatol 7:662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Cardiomyopathie cirrhotique: Un autre Cas d’approche réussie du traitement du syndrome hépatorénal. Cas Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) Dispersion QT: Mesure et interprétation.
- Páll A, Czifra A, Vitális Z, Papp M, Paragh G, et al. (2014) Approche physiopathologique et clinique de la cardiomyopathie cirrhotique. J Gastrointestin Liver Dis 23:301-310.
- Castro Hevia J, Antzelevitch C, Tornés Bárzaga F, Dorantes Sánchez M, Dorticós Balea F, et al. (2006) Tpeak-Tend et dispersion Tpeak-Tend en tant que facteurs de risque de tachycardie ventriculaire / fibrillation ventriculaire chez les patients atteints du syndrome de Brugada. J Am Coll Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) Évaluation de l’intervalle Tp-e et du rapport Tp-e / QT chez les patients atteints d’hépatite B chronique. Prague Med Rep 114: 239-245.
- Jewell DP (2006) Nouveaux patients, nouvelles leçons, nouvelle réflexion sur les maladies inflammatoires de l’intestin: Symposium du Congrès mondial de gastroentérologie, Montréal, Canada. Dis colorectal 8 Suppl 1 (s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) Cardiomyopathie cirrhotique: perspective d’un cardiologue. Monde J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) Cardiomyopathie cirrhotique: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.