- Introduction
- Matériaux et méthodes
- Récolte d’ovocytes et microinjection d’aRNC
- Isolement des fractions membranaires et Immunoblot
- Immunohistochimie
- Microscopie électronique à fracture par congélation
- Dosage des ovocytes appariés et quantification des Zones de contact
- Essai d’impulsion de pression hydrostatique
- Incubation du caprate
- Analyse statistique
- Résultats
- Expression de Claudin-5 et Intégration dans X. membrane plasmique de l’ovocyte de laevis
- Des taches de brins à Jonction Serrée Sont Visibles dans les ovocytes exprimant la Claudine-5
- Test d’ovocytes appariés pour l’analyse de l’interaction Trans-Claudine
- Le test d’impulsion de Pression hydrostatique Révèle une jonction spécifique à la Claudine de paires d’ovocytes
- Incubation Avec du Caprate
- Discussion
- Les claudines Contribuent à des Propriétés d’adhérence plus fortes
- Conclusion
- Déclaration de disponibilité des données
- Déclaration d’éthique
- Contributions des auteurs
- Financement
- Conflit d’intérêts
- Remerciements
- Matériel supplémentaire
Introduction
La famille de protéines à jonction étroite est cruciale pour la physiologie cellulaire car l’absence ou l’altération est associée à des maladies et à un dysfonctionnement de nombreux organes et tissus, comme le montre par exemple l’oreille interne (Wilcox et al., 2001; Florian et coll., 2003), rein (Konrad et al., 2006; Günzel et coll., 2009), du tractus gastro-intestinal (Resnick et al., 2005; Amasheh et coll., 2009), l’épiderme (Furuse et al., 2002; Tebbe et coll., 2002), et les capillaires cérébraux (Nitta et al., 2003; Wolburg et coll., 2003). Les claudines représentent une famille protéique transmembranaire comprenant au moins 27 membres (Mineta et al., 2011). En plus de leurs quatre domaines d’hélice transmembranaires, ils contiennent deux boucles extracellulaires (ECL1 et ECL2), une courte extrémité N et une extrémité C (Suzuki et al., 2014). Les modèles d’expression spécifiques de la claudine déterminent et reflètent la perméabilité sélective des épithéliums, et la capacité des protéines de la claudine à interagir en cis (dans la même membrane) et en trans (entre les membranes de la cellule voisine) permet la formation de brins de jonction serrés formant des barrières et formant des pores (Van Itallie et Anderson, 2006).
La claudine-5 est fortement exprimée dans l’endothélie capillaire et domine la jonction étroite (TJ) de la barrière hémato-encéphalique (BBB) car l’expression est > 100 fois plus élevée que toute autre claudine (Ohtsuki et al., 2007). De plus, il est exprimé dans une variété de tissus épithéliaux, y compris les poumons (Soini, 2011), les tissus exocrines (Comper et al., 2009), intestinaux (Garcia-Hernandez et al., 2017) et des voies urinaires (Koda et al., 2011). Cependant, la claudine-5 provoque une barrière plus forte dans les capillaires cérébraux que dans les autres tissus (Reinhold et Rittner, 2017) et sa fonction est altérée dans les troubles neurodégénératifs et neuroinflammatoires (Greene et al., 2019). Par conséquent, claudin-5 est crucial pour maintenir le BBB. Mais le BBB n’est pas seulement protecteur, il limite également les options thérapeutiques car les médicaments sont empêchés de pénétrer cette barrière.
Nitta et al. (2003) ont rapporté que le BBB est plus perméable aux molécules de 800 Da chez les souris déficientes en claudine-5 que chez les souris de type sauvage (Nitta et al., 2003). Ceci était conforme aux expériences de transfection démontrant un effet d’étanchéité de la claudine-5 dans les monocouches de cellules Caco-2 (Amasheh et al., 2005).
Une autre claudine formant barrière majeure est la claudine-3, qui a été signalée pour sceller sélectivement la barrière contre le passage des ions de l’une ou l’autre charge et des solutés non chargés (Milatz et al., 2010). Il est également exprimé dans la jonction endothéliale serrée des capillaires cérébraux et sa perte fonctionnelle est observée dans les phases d’inflammation des microvaisseaux, de glioblastome et de plexus choroïde des patients atteints de sclérose en plaques (Engelhardt et al., 2001; Wolburg et coll., 2003).
Les propriétés de barrière peuvent être modifiées dynamiquement, par ex., l’incubation avec du caprate de sodium a démontré une diminution rapide et réversible de la résistance électrique transépithéliale dans la lignée cellulaire intestinale humaine HT-29/B6 (Krug et al., 2013). Le caprate de sodium ouvre transitoirement des barrières contenant de la claudine-5 aux jonctions serrées des cellules épithéliales et endothéliales (Del Vecchio et al., 2012).
Ceci indique que la claudine-5 est une cible prometteuse pour l’amélioration de l’administration de médicaments dans le BBB.
Dans cette étude, nous avons cherché à utiliser le système d’expression hétérologue des ovocytes de Xenopus laevis (Vitzthum et al., 2019) pour l’analyse de l’interaction et de la pertubation de claudine-5 et de claudine-3. En raison de l’absence de contacts cellule-cellule endogènes, ce système d’expression unicellulaire permet l’analyse de claudines spécifiques sans interférence d’autres protéines à jonction serrée.
Matériaux et méthodes
Récolte d’ovocytes et microinjection d’aRNC
Des ovocytes ont été prélevés sur des grenouilles à griffes africaines femelles adultes par laparotomie chirurgicale. Pour l’anesthésie, 0.2% MS222 (méthanesulfonate de 3-aminobenzoate d’éthyle, Sigma-Aldrich, Taufkirchen, Allemagne) a été utilisé comme solution de bain pendant 5-10 min à 20 ° C. Une fois l’anesthésie chirurgicale atteinte, des incisions de la peau et des muscles abdominaux ont été pratiquées et la masse ovarienne a été extériorisée et le tissu ovarien retiré. L’isolement des ovocytes a été réalisé par digestion enzymatique à température ambiante pendant 90 min dans 1,5 mg/ml de collagénase des BioRéagents Fisher BP2649-1 (Fisher Scientific, Schwerte, Allemagne) dissous dans une solution de sonnerie d’ovocytes (ORi) comme décrit par Vitzthum et al. (2019). Les cellules folliculaires ont été enlevées par incubation dans des ORi sans Ca2+ contenant (en mM) : NaCl (90), KCl(1), EGTA (acide triéthylène glycol diamine tétraacétique) (1), 5 HEPES (5); pH 7,4 pendant 10 min sur un agitateur mécanique à 50 tr/min. Des ovocytes des stades V et VI (> 1000 µm) ont été injectés (Nanoliter 2010, World Precision Instruments, Sarasota, FL, États-Unis) avec 1 ng d’aRNC codant pour de l’eau claudine-5, claudine-3 ou sans RNase humaine comme témoins. Le volume d’injection était de 50,6 nl par ovocyte. Après injection, les ovocytes ont été incubés à 16°C en 3 jours ORi pour l’expression des protéines.
Isolement des fractions membranaires et Immunoblot
Dix ovocytes injectés ont été mis en commun pour l’analyse par western blot et remis en suspension dans un tampon d’homogénéisation de 500 µl contenant (en mm) MgCl2 (5), NaH2PO4 (5), EDTA (acide éthylènediaminetétraacétique) (1), saccharose (80) et Tris (Tris (hydroxyméthyl)aminométhane) (20); pH 7.4. Des extraits d’ovocytes ont été centrifugés deux fois à 200 tr/min pendant 10 min à 4°C pour éliminer les débris cellulaires. Le surnageant a été centrifugé à 13 000 tr/min pendant 30 min à 4°C pour granuler la membrane cellulaire comme décrit par Leduc-Nadeau et al. (2007). Les pastilles ont été remises en suspension dans un tampon d’homogénéisation de 80 µl. La quantification des protéines a été effectuée en colorimétrie à l’aide du kit de dosage des protéines Pierce 600 nm (Thermo Fisher Scientific, Hennigsdorf, Allemagne) selon les instructions du fabricant dans une plaque à 96 puits. Le lecteur de plaques (PerkinElmer EnSpire Multimode Plate Reader, Waltham, MA, États-Unis) a été ajusté à 562 nm et le standard de Sérum Albumine bovine (Thermo Fisher Scientific, Hennigsdorf, Allemagne) allant de 125 à 2000 µg / ml a été utilisé pour l’évaluation. Avant l’immunoblot, les échantillons ont été mélangés avec du tampon 4× Laemmli (Laboratoires Bio-Rad, Munich, Allemagne), chargés sur un gel de polyacrylamide SDS à 10% et électrophorés. Pour le transfert de protéines, des membranes PVDF ont été utilisées et bloquées dans du lait sec non gras à 5% dans une solution saline tamponnée Tris pendant 120 min. Les protéines ont été détectées par immunoblot à l’aide d’anticorps primaires élevés contre la claudine-3 ou la claudine-5 (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, États-Unis).
Des anticorps anti-lapin et anti-souris de chèvre conjugués à la peroxydase (technologie de signalisation cellulaire #7074, #7076, Danvers, MA, États-Unis) ont été utilisés pour se lier aux anticorps primaires et ont donc été incubés pendant un minimum de 45 min à température ambiante. Pour la détection, le substrat de transfert Clarity Western ECL (#1705061, Bio-Rad Laboratories GmbH, Munich, Allemagne) a été utilisé et les signaux ont été visualisés par un système ChemiDoc MP (Bio-Rad Laboratories).
Immunohistochimie
Les ovocytes injectés ont été fixés dans du PFA à 4% (16% de paraformaldéhyde, E15700, Science Service, Munich, Allemagne) pendant 4 h à température ambiante, suivi d’un gradient de déshydratation de 70% d’éthanol en xylol (Carl Roth, Karlsruhe, Allemagne) en 48 h. Les échantillons ont été noyés dans de la paraffine et sectionnés (5 µm) à l’aide d’un microtome Leica RM 2245 ( Leica Microsystems Heidelberg, Allemagne). Peu de temps avant le traitement immunohistochimique, la paraffine a été éliminée par gradient de xylol en éthanol. Les sites de liaison non spécifiques ont été bloqués à l’aide de sérum de chèvre à 5% dans une solution saline tamponnée au phosphate et incubés avec les mêmes anticorps primaires que pour l’immunoblot. Des échantillons ont été incubés avec les anticorps secondaires Alexa Fluor-488 goat anti-rabbit et Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, États-Unis) et examinés par microscopie à immunofluorescence confocale à balayage laser (LSM 710, Zeiss, Oberkochen, Allemagne).
Microscopie électronique à fracture par congélation
La microscopie électronique à fracture par congélation a été réalisée comme indiqué récemment (Greene et al., 2019). Pour la fixation, les ovocytes injectés ont été incubés dans du glutaraldéhyde (2,5% dans du tampon cacodylate 0,1 M) pendant une nuit à 4°C. Après lavage avec du tampon cacodylate, les ovocytes ont été préparés pour la fracturation par congélation. Les échantillons ont été cryoprotégés dans du glycérol à 30% et congelés dans de l’azote liquide. Après fracturation et ombrage avec du platine et du carbone (BAF400D; Balzers, Liechtenstein), la matière organique restante a été éliminée par un lavage à l’hypochlorite de sodium. Les ovocytes ont été analysés au microscope électronique à transmission (EM-10, Zeiss, Oberkochen, Allemagne) et photographiés avec un appareil photo numérique (Tröndle GmbH). L’analyse morphométrique des brins de jonction serrés a été réalisée à un grossissement de 20 000×.
Dosage des ovocytes appariés et quantification des Zones de contact
Le mannitol a été mis en œuvre pour rétrécir les ovocytes injectés et permettre une élimination mécanique de la membrane vitelline à l’aide de pinces sans endommager la membrane plasmique. 5 à 10 ovocytes ont été placés dans une boîte de pétri (diamètre 35 mm, Thermo Fisher, Henningsdorf, Allemagne, #153066) remplie d’ORi. Le mannitol a été ajouté et dissous jusqu’à ce que le rétrécissement hypertonique des cellules soit atteint (environ 400 mOsmol/l pendant 10 min). Après dévitellinisation manuelle, les ovocytes ont été immédiatement transférés dans une plaque à 24 puits (1. 86 cm2 de surface, TPP Techno Plastic Products, Trasadingen, Suisse, #92024) contenant 2 ml d’ORi. Dans chaque puits, deux cellules ont été groupées doucement en les poussant ensemble avec une pipette Pasteur (1 ml, Thermo Fisher, Henningsdorf, Allemagne, #PP88SB) et une sonde bulbeuse.
Des paires d’ovocytes exprimant la claudine-5 (cldn5-cldn5), exprimant la claudine−3 (cldn3-cldn3), la claudine-3 et la claudine−5 coexprimant (cldn3, 5-cldn3,5) et des ovocytes témoins (témoin-témoin) ont été conservées ensemble jusqu’à 48 h dans ORi à 16 °C.
La microscopie en champ lumineux a été utilisée pour la quantification de zone de contact des ovocytes groupés après 1, 24 et 48 h. Des images des paires d’ovocytes naïfs dans 24 boîtes de culture de puits ont été prises à ces moments à l’aide d’un microscope Leica DMI6000 B (Leica Microsystems, Wetzlar, Allemagne). Le diamètre de la zone de contact a été mesuré à l’échelle du micron (LAS-AF 3.2.0). Les zones de contact sont considérées comme circulaires et la zone de contact a donc été calculée en utilisant l’équation circulaire A = π∙r2.
Essai d’impulsion de pression hydrostatique
Les membranes vitellines ont été enlevées mécaniquement comme décrit précédemment et les ovocytes groupés de manière analogue à l’essai d’ovocytes appariés. De plus, des paires d’ovocytes mixtes (témoin-cldn5 et témoin-cldn3) ont été testées dans le test d’impulsion de pression hydrostatique (HPI). Après 24 h de stabilisation, une impulsion hydrostatique définie a été créée à l’aide d’une pipette électronique monocanal (EE-300R, Eppendorf Research Pro, version du logiciel 2.06.00, Hambourg, Allemagne).
Les ovocytes ont été conservés dans 24 plaques de puits contenant 2 ml d’ORi et le positionnement central a été contrôlé avant application du volume de pipetage de 250 µl d’ORi. La vitesse de distribution a été réglée uniformément sur la vitesse maximale, ce qui équivaut à une vitesse de distribution de 0,9 s. De plus, l’angle (45 °) et la distance d’application (∼1,3 cm) ont été appliqués uniformément. La pression ambiante, la viscosité de l’ORi et le diamètre de l’ouverture de la pointe de la pipette ont été maintenus dans des conditions constantes. La microscopie à champ lumineux a été utilisée pour la quantification des zones de contact 30 min après l’application de la pression hydrostatique et comparée aux zones de contact avant l’application. La configuration expérimentale est décrite à la figure 1.
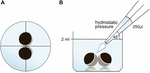
Figure 1. Configuration expérimentale du test d’impulsion de pression hydrostatique (A) vue de dessus schématique du puits: le positionnement central de la paire d’ovocytes a été vérifié avant l’application de la pression hydrostatique. (B) Vue schématique de côté du puits : 250 µl ORi ont été ajoutés à l’aide d’une pipette électronique à canal unique. La vitesse de distribution a été réglée uniformément sur la vitesse maximale. L’angle (45°) et la distance d’application ont été appliqués uniformément. La pression ambiante, la viscosité de l’ORi et le diamètre de l’ouverture de la pointe de la pipette ont été maintenus dans des conditions constantes.
Incubation du caprate
Pour l’incubation du caprate, du caprate de sodium (#C4151, Sigma Aldrich, Taufkirchen, Allemagne) à des concentrations finales de 50, 100 et 500 µM, ou ORi comme groupe de référence, a été ajouté aux ovocytes 24 h après l’appariement. Les ovocytes sont conservés dans 24 plaques de puits contenant 2 ml d’ORi et une solution de caprate est dissoute dans un volume d’addition défini de 250 µl d’ORi par puits. La largeur de la zone de contact a été quantifiée à 30, 60 et 120 minutes après l’addition.
Analyse statistique
L’analyse statistique a été réalisée avec JMP Pro 14.0.0 (NC, États-Unis). Les données sont présentées sous forme de médianes et affichées sous forme de variation en pourcentage en fonction de la combinaison groupée aux premiers points d’examen. Les figures 4 et 5 sont présentées sous forme de placettes représentant le premier quartile (25 %), la médiane (50 %) et le deuxième quartile (75 %). Les moustaches sont tirées jusqu’au 10e centile et jusqu’au 90e centile. La distribution normale a été vérifiée en utilisant le test de Shapiro-Wilk.
Le test de Kruskal–Wallis a été utilisé pour une comparaison multiple, suivie d’une correction de Dunn-Bonferroni. les valeurs p sont données sous forme de nombres continus.
Résultats
Expression de Claudin-5 et Intégration dans X. membrane plasmique de l’ovocyte de laevis
Pour tester l’expression et l’intégration réussies de la protéine de jonction serrée claudine-5 dans la membrane plasmique de l’ovocyte, 3 jours après l’injection du cRNA de claudine-5, les fractions membranaires ont été analysées par immunoblot. Tous les échantillons de trois animaux individuels (j1–j3) ont révélé des signaux spécifiques de claudine-5 à 23 kDa, alors que les ovocytes injectés dans l’eau sans RNase n’ont montré aucun signal spécifique pour l’expression de claudine-5 (Figure 2A).
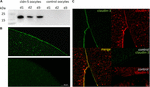
Figure 2. Détection de claudines exprimées hétérologiquement dans les ovocytes de Xenopus laevis. (A) Analyse immunoblot de la protéine de jonction serrée claudine-5 dans les ovocytes de X. laevis de trois animaux (j1-j3). Les lysats de membranes cellulaires ont été soumis à une page SDS suivie d’un immunoblot sur des membranes PVDF. Les membranes ont été incubées avec des anticorps primaires et des anticorps conjugués à la peroxydase secondaire (n= 3). (B) La coloration immunofluorescente a révélé des signaux spécifiques de claudine-5 (en vert) dans les membranes ovocytaires de tous les ovocytes injectés dans l’aRNC, alors que dans les témoins injectés dans l’eau, aucun signal spécifique de claudine n’a été détecté en microscopie confocale. Images représentatives d’ovocytes dérivés de trois animaux. Barres d’échelle: 50 µm. (C) La coloration immunofluorescente des ovocytes exprimant la claudine-5 et la claudine-3 a révélé des signaux spécifiques de claudine-3 (en vert) et de claudine-5 (en rouge) dans les membranes ovocytaires des ovocytes injectés dans l’aRNC, alors que dans les témoins injectés dans l’eau, aucun signal spécifique de la claudine n’a été détecté. La colocalisation des protéines de claudine exprimées dans la membrane plasmique de l’ovocyte est révélée par une double coloration immunofluorescente (jaune). Barre d’échelle: 10 µm.
Pour la visualisation des protéines exprimées dans la membrane plasmique, des colorations immunohistochimiques ont été effectuées et analysées par microscopie confocale à balayage laser (figure 2B). Des signaux spécifiques ont été détectés et répartis uniformément dans la membrane plasmique des ovocytes exprimant la claudine-5. Conformément aux immunoblots, aucun signal spécifique n’a été détecté dans les membranes plasmiques des ovocytes témoins.
Ainsi, après injection de cRNA, la claudine-5 a été exprimée avec succès et intégrée dans la membrane plasmique des ovocytes de X. laevis.
La co-expression de la claudine-3 et de la claudine-5 dans des paires d’ovocytes a révélé des signaux spécifiques pour la claudine-5 (rouge) et la claudine-3 (verte) dans les deux cellules (figure 2C). Les membranes plasmiques des ovocytes ont montré une fusion des cellules voisines fournie par l’interaction directe cldn3,5–cldn3,5 (jaune).
Des taches de brins à Jonction Serrée Sont Visibles dans les ovocytes exprimant la Claudine-5
Les membranes plasmiques des ovocytes ont été analysées et la visualisation des brins à jonction serrée a été réussie (Figure 3). La microscopie électronique à fracture par congélation a montré des taches de morphologie des brins dans les membranes plasmiques des ovocytes injectés de claudine-5, et l’organisation des brins des ovocytes exprimant la claudine-5 était très organisée et de forme angulaire (Figure 3A). Des brins de jonction serrés ont été principalement détectés dans la face protoplasmique (P-) de la membrane. Les ovocytes injectés de Claudine-3 présentaient des brins de jonction serrés très organisés arrondis comme indiqué précédemment (Vitzthum et al., 2019; Figure 3B). La microscopie électronique à fracture par congélation des ovocytes coexprimant la claudine-3 et la claudine-5 a révélé des fibrilles qui portent toutes deux les propriétés de la claudine-3 et de la claudine-5. L’architecture des brins fibriliques des ovocytes coexprimant est apparue à la fois arrondie et complexe comme les ovocytes exprimant la claudine-3, mais aussi discontinue et plus inclinée comme le montre la figure 3C pour les cellules exprimant la claudine-5. Les ovocytes témoins avaient une surface lisse typique (Figure 3D).
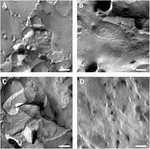
Figure 3. Microscopie électronique à fracture par congélation. (A) La microscopie électronique à fracture par congélation révèle la protéine de jonction serrée cldn-5 sous forme de maillage de fibrilles discontinues angulaires en rangées dans les ovocytes de Xenopus laevis. (B) La microscopie électronique à fracture par congélation révèle une protéine à jonction serrée cldn-3 sous forme de maillage de fibrilles arrondies dans les ovocytes de X. laevis. (C) La microscopie électronique à fracture par congélation des ovocytes coexprimant la claudine-3 et la claudine-5 révèle des fibrilles qui portent toutes deux les propriétés de la claudine-3 et de la claudine-5. (D) Les ovocytes témoins injectés dans l’eau ont une surface lisse. Images représentatives d’ovocytes dérivés de trois animaux. Barre d’échelle: 250 nm.
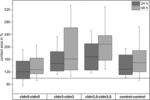
Figure 4. Zones de contact médianes des combinaisons d’ovocytes groupés cldn5-cldn5, cldn3-cldn3, cldn3, 5-cldn3, 5 et contrôle-contrôle 24 et 48 h après le regroupement dans % des zones de contact initial peu de temps après le regroupement (n = 8-38).

Figure 5. Les zones de contact des ovocytes de claudine-5, de claudine-3 et de claudine-5 coexprimant lors d’un défi d’impulsion de pression hydrostatique (HPI) après la période de stabilisation et 30 min après HPI (n = 16-70, *p < 0,05, ** p < 0.01, Kruskal-Wallis suivi d’une correction de Dunn-Bonferroni).
Test d’ovocytes appariés pour l’analyse de l’interaction Trans-Claudine
Toutes les combinaisons groupées ont montré une augmentation de la surface de contact dépendante du temps au cours de la période de temps mesurée (Figure 4 et tableau 1).
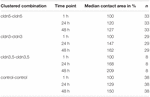
Tableau 1. Zones de contact des ovocytes dans les 48 h suivant le regroupement.
La surface de contact des ovocytes témoins injectés à l’eau a augmenté à 129 % après 24 h et à 150 % après 48 h. Des paires groupées d’ovocytes exprimant la claudine-3 ont également montré une augmentation des zones de contact à 147% (24 h) et 162% (48 h). Des paires groupées d’ovocytes coexprimant la claudine-3 et la claudine-5 ont montré des zones de contact de 168% (24 h) et de 209% (48 h). Des paires groupées d’ovocytes exprimant la claudine-5 seule ont montré des zones de contact de 120% (24 h) et de 127% (48 h). Par conséquent, les zones de contact dans toutes les combinaisons testées étaient comparables.
Le test d’impulsion de Pression hydrostatique Révèle une jonction spécifique à la Claudine de paires d’ovocytes
Dans une approche séparée, les ovocytes exprimant la claudine-3 ou la claudine-5 ou coexprimant les deux claudines ont été regroupés après dévitellinisation mécanique. Les ovocytes ont été mis au défi en utilisant un HPI et les zones de contact ont été mesurées et calculées 30 min après le défi et comparées aux zones initiales après la période de stabilisation de 24 h (figure 5 et tableau 2). Après un défi de pression hydrostatique, la surface de contact des ovocytes témoins injectés dans l’eau a diminué à 89%. Des paires groupées d’ovocytes exprimant la claudine-5, la claudine-3 ou coexprimant la claudine-3 et la claudine-5 ont conservé des zones de contact plus grandes (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Les zones de contact des ovocytes témoins injectés à l’eau et des ovocytes exprimant la claudine (cldn5 témoin et cldn3 témoin) ne différaient pas significativement des ovocytes témoins (93%, p = 0,2900; 83 %, p = 0,4455).
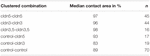
Tableau 2. Test d’impulsion de pression hydrostatique.
Incubation Avec du Caprate
Dans une expérience d’incubation pilote, des ovocytes ont été injectés et appariés dans des combinaisons exprimant soit la claudine-5 (cldn5–cldn5), soit injectés avec de l’eau sans RNase comme témoins (contrôle–contrôle). Des couples ont été incubés avec des concentrations finales de caprate de sodium de 50, 100 ou 500 µM. L’incubation de paires d’ovocytes avec ORi a servi de groupe de référence. Les ovocytes ont été groupés et après 24 h de stabilisation, l’incubation a commencé et les largeurs de contact ont été mesurées 30, 60 et 120 min après l’addition (Figure supplémentaire S1).
L’ajout d’ORi a entraîné une diminution initiale des zones de contact à la fois dans les paires d’ovocytes exprimant la claudine et injectées dans l’eau qui est dispersée 60 ou 120 min après l’addition. Ceci est souligné par la forme parabolique de la ligne de connexion entre les zones de contact médianes au fil du temps (courbes rouges sur la figure supplémentaire S1). Cependant, l’incubation avec du caprate de sodium de 100 et 500 µM a augmenté les zones de contact légèrement (100 µM) ou fortement (500 µM) 30 min après addition de caprate de 5,1 × 105 à 5,2 × 105 µm2 et de 4,3 × 105 à 4,9 × 105 µm2.
Discussion
Dans la présente étude, nous avons utilisé le modèle classique pour les transporteurs et la modélisation des maladies humaines (Tammaro et al., 2009; Nenni et coll., 2019), les ovocytes de X. laevis, pour une analyse approfondie de l’interaction claudine-5 et de la contribution fonctionnelle au joint de jonction. À cette fin, une nouvelle approche, introduisant un HPI pour une interaction difficile dans la zone de contact des ovocytes de xénope groupés, a été établie.
Les claudines Contribuent à des Propriétés d’adhérence plus fortes
Conformément aux résultats précédents de Vitzthum et al. (2019), les claudines uniques exprimées dans les ovocytes n’ont pas entraîné d’augmentation des zones de contact d’interaction par rapport aux ovocytes témoins. Cependant, la visualisation immunoblot et immunohistochimique a prouvé l’expression et l’intégration réussies dans la membrane plasmique des ovocytes de X. laevis. De plus, l’utilisation de la microscopie confocale à balayage laser a permis une localisation précise des claudines exprimées dans la membrane plasmique car le trou d’épingle bloquait la fluorescence hors foyer. Une quantification des signaux immunohistochimiques n’a pas été poursuivie, car l’affinité des anticorps pour lier leurs cibles diffère.
Vedula et al. (2009) ont utilisé une technique d’aspiration par micropipette pour étudier les aspects de l’interaction claudine-claudine à l’aide de fibroblastes L transfectés avec une occludine marquée par GFP, cldn-1 et cldn-2. La force de séparation nécessaire pour détacher deux cellules l’une de l’autre était plus importante dans les cellules transfectées cldn-1 et cldn-2 (∼2,8 et 2,3 nN, respectivement). Bien que cette approche puisse également sembler prometteuse pour l’analyse de l’interaction claudine-claudine des ovocytes exprimant, des tests préliminaires ont révélé qu’un détachement des ovocytes groupés n’est pas possible sans perturbation des membranes plasmiques des ovocytes.
Par conséquent, en tant que nouvelle approche, la force des connexions a été mesurée par un HPI. Bien que l’IPH ne fournisse pas de quantification de la force de séparation en valeurs absolues (par exemple, dans celle de Newton), elle permet une analyse rapide et rentable de l’interaction de la claudine sans perturbation d’autres protéines de jonction serrée (par exemple., occludine, tricelluline, CONFITURE – A). Les claudines contribuent à la jonction des paires d’ovocytes car elles présentent une plus grande surface de contact par rapport aux ovocytes injectés dans l’eau après HPI. Cela indique une forte interaction trans homophile entre les cellules exprimant la claudine.
L’architecture de fibrille de brin est spécifique pour les claudines simples (Colegio et al., 2002). En microscopie électronique à fracture par congélation, on a signalé que la claudine-3 assemblait un maillage de brins plus arrondi en forme de boucle dans les ovocytes de Xénope (Vitzthum et al., 2019; Figure 3B) alors que dans notre étude, claudin-5 formait un maillage plus angulaire et ordonné en rangées. Les images ont révélé que la protéine de jonction serrée claudine-5 forme un maillage de fibrilles en rangées discontinues et angulaires dans les ovocytes de X. laevis. Ceci est conforme aux brins de claudin-5 connus pour se produire sous forme de chaînes de particules associées à la phase P (Piontek et al., 2011). Dans nos expériences, la forme géométrique des fibrilles semblait n’avoir aucun effet sur les propriétés d’adhésion des ovocytes. Conformément à cela, il a été rapporté que la résistance paracellulaire n’était pas liée au nombre de fibrilles et aux propriétés de formation de fibrilles (Colegio et al., 2002). De plus, la claudine-3 et la claudine-5 ont une capacité similaire d’interaction transhumante homophile dans les cellules HEK293 (Piontek et al., 2011).
Ce modèle d’ovocytes de X. laevis, exprimant des protéines à jonction serrée unique, permet d’observer l’effet de substances comme le caprate de sodium sur la formation de zones de contact entre ovocytes groupés. Il peut donc constituer un outil utile pour un dépistage rapide et économique des substances affectant la barrière de jonction étanche.
Des concentrations de caprate de sodium de 100 et 500 µM peuvent avoir un effet protecteur sur les ovocytes exprimant la claudine-5, entraînant une augmentation des zones de contact après 30 min d’incubation.
Krug et coll. (2013) ont démontré que l’incubation avec du caprate de sodium entraînait une diminution rapide et réversible de la résistance transépithéliale dans la lignée cellulaire intestinale humaine HT-29/B6. De plus, la microscopie confocale à balayage laser a révélé une réduction marquée de la claudine-5 dans les cellules HT-29/B6 traitées avec le laurate d’acide gras à chaîne moyenne (Dittmann et al., 2014). La première boucle extracellulaire de claudines (ECL1) est importante pour les propriétés de barrière de la jonction serrée, tandis que la deuxième boucle extracellulaire (ECL2) est impliquée dans la formation de brins d’interaction trans (Piontek et al., 2008; Rossa et coll., 2014; Greene et coll., 2019). Les liants de claudine-5 ciblant l’ECL1 ou l’ECL2 de la claudine-5 peuvent induire l’absorption intracellulaire de la protéine de jonction serrée, contrecarrant ainsi les interactions trans de claudine-5 dans le joint de jonction étanche entre les cellules adjacentes et desserrant l’espace paracellulaire (Hashimoto et al., 2017).
Ainsi, nous avons émis l’hypothèse que l’incubation avec du caprate de sodium conduirait à une diminution de la surface de contact des ovocytes de claudine-5 exprimant X. laevis. De façon inattendue, l’augmentation des concentrations de caprate de sodium (100 et 500 µM) a conduit à une augmentation des zones de contact des ovocytes groupés exprimant la claudine-5 indiquant un effet protecteur du caprate de sodium sur le joint de jonction étanche. De plus, le caprate de sodium est décrit pour induire la contraction du cycle périjonctionnel de l’actomyosine, élargissant l’espace paracellulaire (Lindmark et al., 1998; Maher et coll., 2009). Cet effet est basé sur la phosphorylation de la chaîne légère régulatrice de la myosine via une activation de la phospholipase C qui conduit à un clivage du phosphatidylinositol 4,5-bisphosphate (PIP2) en inositol triphosphate (IP3) et diacylglycérol (Tomita et al., 1995). Le complexe de jonction serrée lié par la protéine d’échafaudage ZO-1 au cytosquelette d’actine est ensuite redistribué de la jonction serrée au cytoplasme (Lindmark et al., 1998; Turner, 2000). La cytoarchitecture de l’ovocyte de X. laevis est cruciale pour la régionalisation cytoplasmique pendant l’ovogenèse (Wylie et al., 1985). Bien que, avant la fécondation, l’expression du gène tjp-1, le gène codant pour ZO-1 n’est exprimé que de 1,9 TPM aux stades ovocytaires V–VI (Session et al., 2016). Une interaction réduite des claudines avec l’échafaudage cytosquelettique peut donc expliquer le résultat inattendu de l’incubation du caprate. Est la portée des études futures pour vérifier la base mécaniste de la découverte.
Cependant, un effet variant du caprate de sodium sur la perméabilité paracellulaire a déjà été décrit dans la littérature. Dans le tissu Patch de Peyer prélevé dans l’intestin de porcs adultes, un effet de renforcement similaire a été détecté. La Claudine-5 a été significativement augmentée après incubation avec du caprate de 5 mM. Dans cette étude, le caprate a conduit à une résistance électrique transépithéliale (TEER) significativement plus élevée dans l’épithélium associé au follicule (Radloff et al., 2019).
Conclusion
En conclusion, expression hétérologue de la protéine de jonction serrée claudine-5 dans X. les ovocytes de laevis permettent de mieux comprendre la contribution des claudines uniques à l’interaction cellule-cellule et aux propriétés d’adhérences des cellules adjacentes. Ainsi, l’utilisation du modèle de jonction serrée de X. laevis pour claudin-5 permet l’analyse des composantes de BBB dans un modèle unicellulaire.
Déclaration de disponibilité des données
Les ensembles de données générés pour cette étude sont disponibles sur demande auprès de l’auteur correspondant.
Déclaration d’éthique
Les traitements pour animaux étaient conformes aux directives de la législation allemande, avec l’approbation du responsable du bien-être animal de la Freie Universität Berlin et sous la gouvernance de l’Inspection sanitaire vétérinaire de Berlin (Landesamt für Gesundheit und Soziales Berlin, permis G0025/16).
Contributions des auteurs
Tous les auteurs ont lu et approuvé le manuscrit. NB et SA ont conçu, planifié et supervisé les expériences et ont écrit le manuscrit. NB, LS, VC, RK et PF-B ont effectué les expériences et l’analyse des données.
Financement
Cette étude a été financée par la Deutsche Forschungsgemeinschaft, Subvention No. AM141/11-1 et la Fondation H. Wilhelm Schaumann.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Martin Grunau, Gisela Manz, Katharina Söllig et Susanne Trappe pour leur excellente assistance technique. Nous reconnaissons le soutien de l’Initiative de Publication en Libre Accès de la Freie Universität Berlin.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à l’adresse suivante:: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
FIGURE S1 / Zones de contact de claudine-5 exprimant des paires d’ovocytes en µm2 pendant l’incubation avec du caprate de sodium à différentes concentrations (n = 6-8, respectivement) et des ovocytes injectés dans l’eau comme témoins (n = 5-7, respectivement).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J. et Kroesen, A. J. (2009). La muqueuse de la poche enflammée possède des jonctions serrées altérées indiquant une récurrence de la maladie inflammatoire de l’intestin. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007/s00384-009-0737-8
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Contribution de la claudine-5 aux propriétés de barrière dans les jonctions serrées des cellules épithéliales. Tissu cellulaire Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C. et Anderson, J. M. (2002). Le rôle des domaines extracellulaires de claudine dans l’architecture des fibrilles à jonction serrée et la sélectivité des charges paracellulaires. Cellule Mol Biol. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). Le schéma d’expression des claudines 5 et 7 distingue les tumeurs pseudopapillaires solides du pancréatoblastome, des cellules acineuses et des tumeurs endocrines du pancréas. Être. J. Surg. Pathol. 33, 768–774. doi: 10.1097/pas.0b013e3181957bc4
Résumé publié / Texte intégral croisé / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). Le caprate de sodium ouvre de manière transitoire des barrières contenant de la claudine-5 aux jonctions serrées des cellules épithéliales et endothéliales. Mol. PHARM. 9, 2523–2533. doi: 10.1021 / mp3001414
Résumé PubMed / Texte intégral Croisé / Google Scholar
Il s’agit de l’un des principaux facteurs de risque de la maladie de Parkinson. Le laurate imprègne la voie paracellulaire de petites molécules dans le modèle de cellules épithéliales intestinales HT-29 / B6 en ouvrant les jonctions serrées par relocalisation réversible de la claudine-5. PHARM. Rés. Dordr. 31, 2539–2548. doi: 10.1007/s11095-014-1350-2
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., et Wolburg, H. (2001). Implication du plexus choroïde dans l’inflammation du système nerveux central. Microsc. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112:: aide – jemt13>3.0.co;2-5
CrossRef Texte intégral / Google Scholar
Il s’agit de l’une des principales sources d’approvisionnement en eau potable de la région. (2003). Claudines dans les jonctions serrées des cellules marginales des stries vasculariennes. Biochem. Biophys. Res. Co. 304, 5–10. doi: 10.1016/s0006-291x(03)00498-4
CrossRef Texte intégral / Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Les jonctions serrées à base de claudine sont cruciales pour la barrière épidermique des mammifères: une leçon de souris déficientes en claudine-1. J. Biol Cellulaire. 156, 1099–1111. doi: 10.1083/jcb.200110122
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Garcia-Hernandez, V., Quiros, M., et Nusrat, A. (2017). Claudines épithéliales intestinales: expression et régulation de l’homéostasie et de l’inflammation. Ann. N.Y. Acad. Sci. 1397, 66–79. doi: 10.1111/ nyas.13360
Résumé PubMed / CrossRef Texte intégral / Google Scholar
Il s’agit d’une espèce de poissons de la famille des coléoptères (2019). Claudin-5: gardien de la fonction neurologique. Fluides Barr. CNS 16:4321.
Google Scholar
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). La claudine-16 affecte la sécrétion transcellulaire de Cl dans les cellules MDCK. J. Physiol. Lond. 587, 3777–3793. doi: 10.1113/jphysiol.2009.173401
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Les liants de Claudine-5 améliorent la perméation des solutés à travers la barrière hémato-encéphalique dans un modèle mammifère. J. Pharmacol. Exp. Là. 363, 275–283. doi: 10.1124/jpet.117.243014
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Nouvelle expression de la claudine-5 dans les podocytes glomérulaires. Tissu cellulaire Res. 343, 637-648. doi: 10.1007/s00441-010-1117- y
Résumé PubMed / Texte intégral Croisé / Google Scholar
Il s’agit de l’un des principaux organismes de recherche et de développement du Canada dans le domaine de la santé et de la santé. (2006). Des mutations dans le gène à jonction étroite claudine 19 (CLDN19) sont associées à une atrophie rénale du magnésium, à une insuffisance rénale et à une atteinte oculaire sévère. Être. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., et Amasheh, S. (2013). Le caprate de sodium comme activateur de la perméation des macromolécules à travers les jonctions serrées tricellulaires des cellules intestinales. Biomatériaux 34, 275-282. doi: 10.1016/j. biomatériaux.2012.09.051
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y. et Bichet, D. G. (2007). Elaboration d’une nouvelle technique de purification des membranes plasmiques à partir d’ovocytes de Xenopus laevis. Être. J. Physiol. Cellule. 292, C1132–C1136.
Google Scholar
Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » pooideae « , sous-famille des » pooideae « , originaire d’Asie du Sud-Est. Amélioration de l’absorption par la régulation intracellulaire de la perméabilité des jonctions serrées par les acides gras à chaîne moyenne dans les cellules Caco-2. J. Pharmacol. Exp. Là. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J. et Brayden, D. J. (2009). Innocuité et efficacité du caprate de sodium dans la promotion de l’absorption orale des médicaments: de in vitro à la clinique. Adv. Livraison de médicaments. Rév. 61, 1427-1449. doi: 10.1016/j.addr.2009.09.006
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin-3 agit comme un composant d’étanchéité de la jonction étanche pour les ions de la charge et des solutés non chargés. Biochimie. Biophys. Acta 1798, 2048-2057. doi: 10.1016/ j.bbamem.2010.07.014
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Expansion prévue de la famille claudin multigene. FEBS Lett. 585, 606–612. doi: 10.1016/ j. febslet.2011.01.028
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase : faciliter l’utilisation de Xenopus pour modéliser les maladies humaines. Devant. Physiol. 10:154. doi: 10.3389/fphys.2019.00154
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Relâchement sélectif de la barrière hémato-encéphalique chez les souris déficientes en claudine-5. J. Biol Cellulaire. 161, 653–660. doi: 10.1083/jcb.200302070
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » pooideae « , sous-famille des » Pooideae « , originaire d’Asie du Sud-Est. L’expression exogène de la claudine-5 induit des propriétés de barrière dans les cellules endothéliales capillaires du cerveau de rat en culture. J. Physiol Cellulaire. 210, 81–86. doi: 10.1002/jcp.20823
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M. et coll. (2011). Élucider les principes de l’organisation moléculaire des brins de jonction étanches hétéropolymères. Cellule Mol. Vie Sci. 68, 3903–3918. doi: 10.1007/s00018-011-0680- z
Résumé PubMed / Texte intégral Croisé / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Formation d’une jonction serrée: déterminants de l’interaction homophile entre les claudines classiques. FASEB J. 22, 146-158. doi: 10.1096 /fj.07 – 8319com
Résumé PubMed / Texte intégral Croisé / Google Scholar
Il s’agit de l’une des principales sources d’information sur la santé et la santé au travail. Le Caprate module la fonction de barrière intestinale dans l’épithélium folliculaire associé au patch de Peyer porcin. Int. J. Mol. Sci. 20:1418. doi: 10.3390/ijms20061418
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Reinhold, A. K., et Rittner, H. L. (2017). Fonction de barrière dans le système nerveux périphérique et central – un examen. Pflug. Arch. EUR. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Le repliement et l’assemblage des protéines de Claudine-3 et de Claudine-5 dans la jonction serrée sont contrôlés par des résidus non conservés dans les segments transmembranaires 3 (TM3) et de la boucle extracellulaire 2 (ECL2). J. Biol. Chem. 289, 7641–7653. doi: 10.1074/ jbc.m113.531012
Résumé PubMed / Texte intégral Croisé / Google Scholar
Les résultats de cette étude sont les suivants : A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Évolution du génome chez la grenouille allotétraploïde Xenopus laevis. Nature 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins dans les maladies pulmonaires. Resp. Rés. 12:70.
Google Scholar
Il s’agit d’une espèce de poissons de la famille des Nectaridés, de la sous-famille des Nectaridés et de la sous-famille des Nectaridés. (2014). La structure cristalline d’un claudin donne un aperçu de l’architecture des jonctions serrées. Science 344, 304-307. doi: 10.1126 / science.1248571
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Tammaro, P., Shimomura, K., et Proks, P. (2009). « Les ovocytes de xénope en tant que système d’expression hétérologue pour l’étude des canaux ioniques avec la technique du patch-clamp », in Potassium Channels: Methods and Protocols, ed. J. D. Lippiat (Totowa, NJ: Presse humaine), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Protéines à jonction serrée: une nouvelle classe de protéines membranaires intégrales – expression dans l’épiderme humain et dans les kératinocytes HaCaT. Arch Dermatol. Rés. 294, 14 à 18. doi: 10.1007 / s00403-001-0290- y
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Tomita, M., Hayashi, M. et Awazu, S. (1995). Mécanisme d’amélioration de l’absorption du caprate de sodium et de la décanoylcarnitine dans les cellules Caco-2. J. Pharmacol. Exp. Là. 272, 739–743.
Google Scholar
Turner, J.R. (2000). « Mettre la pression » sur la jonction étroite: comprendre la régulation cytosquelettique. Sperme. Dev cellulaire. Biol. 11, 301–308. doi: 10.1006/ scdb.2000.0180
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Van Itallie, C. M., et Anderson, J. M. (2006). Claudines et transport paracellulaire épithélial. Annu. Rév. Physiol. 68, 403–429. doi: 10.1146/annurev.physiol.68.040104.131404
Résumé PubMed / Texte intégral Croisé / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Quantification des forces médiées par les protéines de jonction serrée intégrales dans l’adhérence cellule-cellule. Exper. Méca. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Des mutations dans le gène codant pour la jonction serrée claudine-14 provoquent une surdité autosomique récessive DFNB29. Cellule 104, 165-172. doi: 10.1016/s0092-8674(01)00200-8
CrossRef Texte intégral / Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). La localisation de la claudine-3 dans les jonctions serrées de la barrière hémato-encéphalique est sélectivement perdue lors d’une encéphalomyélite auto-immune expérimentale et d’un glioblastome humain multiforme. Acta Neuropathol. 105, 586–592. doi: 10.1007 / s00401-003-0688- z
Résumé PubMed / Texte intégral Croisé / Google Scholar
Il s’agit de l’un des plus importants ouvrages de l’histoire de l’art et de l’histoire de l’Art. Le cytosquelette des ovocytes de Xénope et son rôle dans le développement. J. Embryol. Exp. Morphing. 89, 1–15.
Google Scholar