- Introduction
- Fonctions Multipul de la Chymase
- Chymase dans les mastocytes
- Fonctions enzymatiques multiples de la Chymase
- Fonction enzymatique de la Chymase dans la NASH
- Implication de la chymase dans des modèles animaux de NASH
- Effet de l’Inhibiteur de la Chymase dans les modèles animaux de la NASH
- Effet de l’inhibiteur de la Chymase dans les modèles animaux de la NASH
- Mécanisme de l’inflammation hépatique Atténué par l’inhibiteur de la Chymase
- Mécanisme de stéatose hépatique Atténué par l’inhibiteur de la chymase
- Mécanisme de la fibrose hépatique Atténuée par l’inhibiteur de la chymase
- Conclusion
- Contributions de l’auteur
- Déclaration de conflit d’intérêts
Introduction
La stéatose hépatique non alcoolique (NAFLD) a été reconnue comme la forme la plus courante de maladie du foie (Angulo, 2002; Clark et al., 2002). La stéatohépatite non alcoolique (NASH) imite l’hépatite alcoolique malgré l’absence d’antécédents de consommation d’alcool (Ludwig et al., 1980). La NAFLD et la NASH sont associées à un syndrome métabolique résultant de l’obésité, de la résistance à l’insuline, de l’hyperlipidémie et de l’hypertension. La NAFLD est considérée comme la maladie hépatique la plus fréquente et se présente généralement comme une simple stéatose hépatique (Tiniakos et al., 2010). En revanche, la NASH est caractérisée par une stéatose sévère, une inflammation lobulaire et une fibrose du foie (Powell et al., 1990; Bertot et Adams, 2016). Bien que le mécanisme responsable du développement de la NASH reste incertain, il est proposé que la NASH soit causée par un processus à « coups multiples », la stéatose hépatique étant le « premier coup » et les coups ultérieurs tels que l’inflammation, le stress oxydatif et les endotoxines (Tilg et Moschen, 2010). La NASH est étroitement liée au syndrome métabolique, et plusieurs études cliniques ont étudié le traitement thérapeutique de la NASH en se concentrant sur les symptômes du diabète, de l’hyperlipidémie et de l’hypertension (Georgescu et al., 2009; Park et coll., 2010; Mahady et coll., 2011). Cependant, aucun agent thérapeutique communément accepté n’a été établi.
La chymase peut être impliquée dans la pathogenèse de la fibrose hépatique. L’activité de la chymase était significativement augmentée dans le foie des patients atteints de fibrose ou de cirrhose et il existait une corrélation significative entre le niveau de chymase et le degré de fibrose (Komeda et al., 2008). Bien qu’aucune augmentation de l’activité de la chymase n’ait été rapportée chez les patients atteints de NASH, elle a été observée chez des modèles animaux de NASH (Tashiro et al., 2010; Masubuchi et coll., 2013; Miyaoka et coll., 2017). En revanche, l’inhibition de la chymase à l’aide d’inhibiteurs à faible molécule a entraîné une réduction significative de l’inflammation, de la stéatose et de la fibrose chez les modèles de NASH chez le rat et le hamster (Tashiro et al., 2010; Masubuchi et coll., 2013; Miyaoka et coll., 2017). Ces résultats indiquent que la chymase peut être impliquée dans l’inflammation, la stéatose et la fibrose au cours du développement et de la progression de la NASH (figure 1).
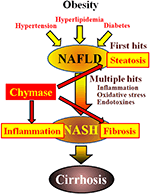
FIGURE 1. La NAFLD et la NASH sont liées au syndrome métabolique par l’obésité, la résistance à l’insuline, l’hyperlipidémie et l’hypertension. On pense que la NASH se développe via un processus à « coups multiples », avec une stéatose hépatique comme « premier coup » et des coups ultérieurs tels que l’inflammation, le stress oxydatif et les endotoxines, et se caractérise par une stéatose sévère, une inflammation et une fibrose. La chymase peut être impliquée dans la progression de la stéatose, de l’inflammation et de la fibrose du foie.
Fonctions Multipul de la Chymase
Chymase dans les mastocytes
La Chymase (EC 3.4.21.39) est exprimée dans les granules sécrétoires des mastocytes. La chymase est produite sous forme de prochymase inactive dans les granules sécréteurs et nécessite la dipeptidyl peptidase I (DPPI) pour son activation. Le DPPI est une protéinase thiol et son pH optimal est de 6,0. La valeur optimale du pH est compatible avec la fonction proposée du DPPI pour activer la prochymase, puisque le pH au sein des granules sécréteurs est régulé à un pH de 5,5 (De Young et al., 1987) (Figure 2). Cependant, la chymase n’a pas d’activité enzymatique au sein des mastocytes à ce pH, car le pH optimal pour la chymase est compris entre 7 et 9 (Takai et al., 1996, 1997). Après activation des granules de mastocytes par des stimuli tels que l’inflammation et les lésions, la chymase est libérée et présente une fonction enzymatique à son pH optimal de 7,4 (Figure 2).
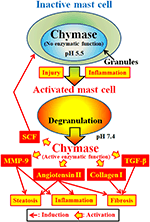
FIGURE 2. La chymase est stockée dans les granules sécrétoires des mastocytes inactifs. Le pH au sein des granules est maintenu à pH 5,5, condition dans laquelle la chymase n’a pas d’activité enzymatique. La chymase présente ses fonctions enzymatiques, telles que la formation d’angiotensine II, de MMP-9, de TGF-β, de collagène I et de SCF, lors de la libération de granules de mastocytes, après activation par inflammation et lésion.
Fonctions enzymatiques multiples de la Chymase
La chymase est une protéase à sérine et clive le côté C-terminal des protéines après les acides aminés aromatiques tels que Phe, Tyr et Trp en général. La chymase peut cliver la liaison Phe8–His9 du peptide non bioactif angiotensine I et former son peptide bioactif angiotensine II dans les tissus de mammifères, y compris humains (Urata et al., 1990; Takai et coll., 1996, 1997). De plus, la chymase clive enzymatiquement les précurseurs de la métalloprotéinase matricielle (MMP)-9, transformant le facteur de croissance (TGF)-β et le collagène I en leurs formes actives (Kofford et al., 1997; Takai et coll., 2003; Furubayashi et coll., 2008). De plus, la fonction enzymatique de la chymase peut produire un facteur de cellules souches (SCF) par clivage enzymatique de la forme inactive liée à la membrane de SCF, ce qui induit la formation de mastocytes matures à partir de mastocytes immatures via la stimulation du récepteur c-kit (Longley et al., 1997). Ainsi, la chymase a de multiples fonctions enzymatiques, notamment l’activation de l’angiotensine II, de la MMP-9, du TGF-β, du collagène I et de la SCF (Figure 2).
Fonction enzymatique de la Chymase dans la NASH
L’angiotensine II peut favoriser la stéatose hépatique et l’inflammation en augmentant les espèces réactives de l’oxygène (ROS) après stimulation des récepteurs de l’angiotensine II dans des modèles animaux de NASH (Hirose et al., 2007; Nabeshima et coll., 2009). L’angiotensine II a également induit une fibrose hépatique par induction de l’actine du muscle α-lisse (SMA) dans les cellules stellaires hépatiques (CSH) (Yoshiji et al., 2001). Il a été rapporté que la MMP-9 induisait l’infiltration de neutrophiles et de macrophages via la dégradation de matrices intercellulaires telles que la vitronectine et la fibronectine, entraînant une augmentation de l’inflammation (Medina et al., 2006). Chez les patients atteints de NASH, une augmentation significative de l’expression du gène MMP-9 a été observée dans le foie par rapport aux témoins normaux (Ljumovic et al., 2004). La surexpression hépatique du TGF-β chez des souris transgéniques a entraîné une fibrose hépatique sévère par l’augmentation de l’expression du gène procollagène I (Casini et al., 1993). La formation de TGF-β et l’accumulation de collagène I sont connues pour induire une fibrose hépatique. L’activation du SCF induit une augmentation du nombre de mastocytes et sa fonction enzymatique peut entraîner une augmentation de l’activité de la chymase dans les tissus fibrotiques (Maruichi et al., 2004). Ces fonctions enzymatiques de la chymase peuvent être impliquées dans la stéatose, l’inflammation et la fibrose, qui sont toutes observées dans le foie des patients atteints de NASH et des modèles animaux (Figure 2).
Implication de la chymase dans des modèles animaux de NASH
Le régime pauvre en méthionine et en choline (MCD) a été largement utilisé pour induire un modèle typique de NASH. Chez les hamsters nourris au régime MCD, des augmentations significatives de la bilirubine totale, des triglycérides et de l’acide hyaluronique ont été observées dans le plasma (Tashiro et al., 2010). De plus, une accumulation de cellules inflammatoires et une augmentation de la zone de dépôt lipidique et de la zone fibrotique ont été observées dans le foie. Dans ce modèle de NASH induit par l’alimentation MCD, l’activité de la chymase hépatique et les facteurs connexes, tels que l’angiotensine II, la MMP-9 et le collagène I, ont été significativement augmentés (Tashiro et al., 2010; Masubuchi et coll., 2013). Récemment, un nouveau modèle de NASH a été développé dans lequel des rats spontanément hypertendus 5 / Dmcr (SHRSP5 / Dmcr) sujets aux accidents vasculaires cérébraux ont été nourris avec un régime riche en graisses et en cholestérol (HFC) (Kitamori et al., 2012). Ce modèle a montré des symptômes du syndrome métabolique qui ressembleraient cliniquement à ceux des patients atteints de NASH (Kitamori et al., 2012). Dans le modèle de NASH induit par le régime alimentaire des HFC, une hypertension et une hyperlipidémie ont été observées, et une stéatose sévère, une fibrose et une accumulation de cellules inflammatoires ont été détectées dans le foie (Miyaoka et al., 2017). De plus, une augmentation significative de l’activité de la chymase a été observée avec la MMP-9, le TGF-β et le collagène I dans le foie (Miyaoka et al., 2017). Ainsi, il semble y avoir une relation étroite entre la pathogenèse de la chymase et de la NASH dans les modèles animaux de la NASH.
Effet de l’Inhibiteur de la Chymase dans les modèles animaux de la NASH
Effet de l’inhibiteur de la Chymase dans les modèles animaux de la NASH
Un inhibiteur de la chymase à faible molécule a considérablement atténué l’activité de la chymase et diminué les taux d’angiotensine II, de MMP-9 et de collagène I dans le foie dans un modèle de hamster NASH nourri au régime MCD, lorsque l’administration de l’inhibiteur a été initiée en même temps que le régime MCD (Tashiro et al., 2010; Masubuchi et coll., 2013). L’inhibiteur de la chymase a empêché de manière significative la stéatose hépatique, la fibrose et l’accumulation de cellules inflammatoires dans ce modèle de NASH (Tashiro et al., 2010; Masubuchi et coll., 2013). On pense que le stress oxydatif joue un rôle dans la théorie du développement de la NASH à coups multiples, et l’augmentation du marqueur du stress oxydatif, le malondialdéhyde, a été significativement atténuée dans le foie par l’inhibiteur de la chymase (Masubuchi et al., 2013). Dans un modèle de NASH induit par un régime alimentaire de MCD de hamster, l’inhibiteur de la chymase a montré un effet améliorant lorsqu’il est administré dans une NASH établie (Masubuchi et al., 2013). Les degrés de stéatose et de fibrose dans le foie ont été réduits par rapport à avant l’administration de l’inhibiteur de la chymase (Masubuchi et al., 2013).
Dans le foie d’un modèle de NASH induit par le régime HFC de rat hypertendu, un inhibiteur de la chymase à faible molécule a atténué les niveaux de chymase ainsi que de MMP-9, de TGF-β et de collagène I, qui sont tous des facteurs associés à la chymase (Miyaoka et al., 2017). L’inhibiteur de la chymase a considérablement atténué la stéatose hépatique et la fibrose, et a réduit la myéloperoxydase comme marqueur de l’inflammation, en particulier de l’infiltration de neutrophiles (Miyaoka et al., 2017). Dans ce modèle induit par l’alimentation en HFC, la survie du groupe traité par placebo était de 0 % 14 semaines après le début de l’alimentation en HFC, et résultait d’une insuffisance hépatique sévère (Miyaoka et al., 2017). Cependant, le groupe traité par un inhibiteur de la chymase, dans lequel les rats ont été traités avec l’inhibiteur de la chymase immédiatement après le début du régime alimentaire à base de HFC, a montré une survie à 100% à 14 semaines. De plus, un taux de survie de 50 % a été rapporté chez les rats traités par l’inhibiteur de la chymase à partir de 8 semaines après le début de l’alimentation par HFC, moment auquel la NASH a été établie (Miyaoka et al., 2017).
Par conséquent, les inhibiteurs de la chymase pourraient être des agents utiles pour la prévention et l’amélioration de la NASH chez les modèles animaux. D’autre part, l’angiotensine II favorise également indirectement l’inflammation hépatique, la stéatose et la fibrose via une augmentation de l’expression des gènes MMP-9 et TGF-β. La MMP-9 et le TGF-β sont tous deux étroitement impliqués dans la pathogenèse de la NASH, mais ces facteurs ne sont pas nécessairement induits uniquement par l’angiotensine II (Takai et al., 2010). Des facteurs autres que la stimulation de l’angiotensine II contribuent à l’augmentation de l’expression des gènes MMP-9 et TGF-β (Takai et al., 2010). Dans de tels cas, le bloqueur des récepteurs de l’angiotensine II (ARB) n’est pas capable d’atténuer les actions de la MMP-9 et du TGF-β; cependant, un inhibiteur de la chymase pourrait avoir des effets atténuants via l’inhibition de l’activation de la MMP-9 et du TGF-β, indiquant un traitement potentiel pour la prévention de la progression de la NASH.
Mécanisme de l’inflammation hépatique Atténué par l’inhibiteur de la Chymase
L’inhibiteur de la Chymase a pu réduire l’inflammation dans les modèles de NASH induits par le régime de MCD de hamster et le régime de HFC de rat (Tashiro et al., 2010; Masubuchi et coll., 2013; Miyaoka et coll., 2017). Le traitement par inhibiteur de la chymase a considérablement atténué l’activité de la chymase dans le foie ainsi que les taux réduits d’angiotensine II et de MMP-9 (Tashiro et al., 2010; Masubuchi et coll., 2013; Miyaoka et coll., 2017). Dans la CSH, l’angiotensine II induit la génération de ROS tels que le peroxyde d’hydrogène et le superoxyde par l’activation de la nicotinamide adénine dinucléotide phosphate (NADPH) oxydase (De Minicis et Brenner, 2007). L’inhibiteur de la chymase a entraîné une réduction de l’expression génique de la composante NADPH oxydase Rac-1 et du marqueur de stress oxydatif malondialdéhyde en plus d’une réduction des taux d’angiotensine II dans un modèle de NASH induit par la MCD du hamster (Masubuchi et al., 2013). L’augmentation du ROS induite par l’angiotensine II a favorisé l’expression du gène MMP-9 chez les neutrophiles et les macrophages (Yaghooti et al., 2011; Kurihara et coll., 2012). Par conséquent, l’inhibiteur de la chymase inhibe directement l’activation de PROMP-9 en MMP-9 et réduit indirectement l’expression du gène MMP-9 via une diminution de l’angiotensine II. La MMP-9 clive les constituants de la matrice extracellulaire, tels que la vitronectine et la fibronectine, entraîne la désintégration de l’intégrité hépatique et induit l’infiltration de macrophages et de neutrophiles (Medina et al., 2006). Dans un modèle de NASH induit par le régime alimentaire des HFC, une augmentation significative de l’expression de la myéloperoxydase dans les macrophages et les neutrophiles a été observée dans le foie et a été réduite par un inhibiteur de la chymase (Miyaoka et al., 2017). Par conséquent, le mécanisme d’inflammation atténué par l’inhibiteur de la chymase peut dépendre de la réduction des taux d’angiotensine II et de MMP-9 dans le foie.
Mécanisme de stéatose hépatique Atténué par l’inhibiteur de la chymase
L’angiotensine II peut influencer la stéatose hépatique via la production de ROS. Dans la CSH murine, un inhibiteur de la NADPH oxydase a significativement diminué la production de ROS et un ARB a ralenti le développement de la stéatose hépatique via l’atténuation de la production de ROS (Hirose et al., 2007; Guimarães et coll., 2010). Dans un modèle de souris NASH induite par l’alimentation MCD, une atténuation significative de la stéatose a été observée chez des souris déficientes en récepteurs de l’angiotensine II (Nabeshima et al., 2009). Des expériences in vivo et in vitro ont montré que l’angiotensine II régulait à la hausse l’expression des gènes de la protéine de liaison aux éléments régulateurs des stérols (SREBP)-1c et de la synthase des acides gras (FAS), deux facteurs importants dans la régulation de la lipogenèse, après l’augmentation de la ROS (Kim et al., 2001; Hongo et coll., 2009). En revanche, l’ARB a atténué la stéatose hépatique et a régulé à la baisse l’expression génique du SREBP-1c et du SAF via l’atténuation du ROS dans un modèle de NASH chez la souris (Kato et al., 2012). Dans un modèle de NASH induit par le régime alimentaire de MCD de hamster, une atténuation significative de l’expression des gènes SREBP-1c et FAS a été observée après un traitement avec un inhibiteur de la chymase à faible molécule (Masubuchi et al., 2013). Par conséquent, le mécanisme d’amélioration de la stéatose hépatique par un inhibiteur de la chymase peut dépendre de la réduction de la production de ROS via une génération réduite d’angiotensine II dans le foie.
Mécanisme de la fibrose hépatique Atténuée par l’inhibiteur de la chymase
La chymase peut être étroitement associée à la progression de la fibrose tissulaire, car elle contribue à la formation de TGF-β à partir du précurseur non bioactif TGF-β, et le TGF-β est connu pour induire fortement la croissance des fibroblastes (Takai et al., 2003; Oyamada et coll., 2011). Le TGF-β est connu pour jouer un rôle central dans la progression de la fibrose chez les patients atteints de NASH via un CSH activé (Williams et al., 2000). L’inhibition de la fonction TGF-β via l’expression et la signalisation des gènes a entraîné une amélioration de la fibrose hépatique dans des modèles expérimentaux (George et al., 1999; Arias et coll., 2003). Dans un modèle de NASH induit par le régime alimentaire des HFC chez le rat, l’atténuation de l’activité de la chymase par un inhibiteur de la chymase a entraîné une réduction du taux de TGF-β et de la zone fibrotique dans le foie (Miyaoka et al., 2017). Ainsi, la réduction du TGF-β par inhibiteur de la chymase peut contribuer à la prévention de la fibrose hépatique.
L’angiotensine II peut également être impliquée dans l’induction de la fibrose hépatique. L’angiotensine II induit la contraction et la prolifération de la CSH, et induit également l’expression génique du TGF-β dans les fibroblastes in vitro (Kagami et al., 1994; Bataller et coll., 2000). Les taux de TGF-β et le degré d’accumulation de collagène et de lésions fibrotiques ont été observés par ligature des voies biliaires chez des souris de type sauvage, mais ceux-ci ont été atténués chez des souris déficientes en récepteurs de l’angiotensine II (Yang et al., 2005). Dans un modèle de NASH chez le rat, l’ARB a également atténué la fibrose hépatique via la réduction de l’expression du gène TGF-β (Hirose et al., 2007). Il peut également exister une relation entre l’angiotensine II et la fibrose hépatique autre que l’expression du gène TGF-β induite par l’angiotensine II. Chez les patients atteints d’hépatite C chronique, l’ARB a réduit l’expression du gène du collagène via l’expression du gène Rac-1 (Colmenero et al., 2009). Les CSH sont reconnues comme les principales cellules productrices de collagène dans le foie, et l’augmentation de l’expression de l’actine du muscle α-lisse (SMA) dans les CSH induit fortement le dépôt de matrice extracellulaire, y compris le collagène I (De Minicis et Brenner, 2007). L’angiotensine II peut induire l’expression du gène α-SMA chez le rat HSC. En revanche, le blocage de l’angiotensine II entraîne l’atténuation de la fibrose hépatique ainsi que la réduction de l’α-SMA (Yoshiji et al., 2001). Bien qu’elles n’aient pas été évaluées chez les patients atteints de NASH, les activités de formation de la chymase et de l’angiotensine II ont été augmentées de manière significative dans les régions fibrotiques des foies de patients atteints de cirrhose, et des corrélations significatives entre la chymase, l’activité de formation de l’angiotensine II et la fibrose hépatique ont été observées (Komeda et al., 2008). Dans un modèle de cirrhose hépatique induite par le tétrachlorure de hamster, des augmentations significatives de l’activité de formation de la chymase et de l’angiotensine II ont été observées, qui ont été significativement atténuées avec la cirrhose hépatique après un traitement par un inhibiteur de la chymase à faible molécule (Komeda et al., 2010).
Le stabilisateur de mastocytes tranilast pourrait inhiber l’activation des mastocytes, bloquant la libération de la chymase et empêchant ainsi le développement d’une fibrose hépatique dans un modèle de diabète de rat et de NASH induit par le régime alimentaire des HFC (Uno et al., 2008). La chymase favorise la prolifération des mastocytes via l’activation du SCF par sa fonction enzymatique (Longley et al., 1997). Dans les modèles animaux de la NASH, l’inhibiteur de la chymase a réduit l’augmentation du nombre de mastocytes dans le foie, entraînant une diminution de l’activité de la chymase suite à une inhibition directe par l’inhibiteur de la chymase et une réduction indirecte de l’expression de la chymase dans les mastocytes (Masubuchi et al., 2013; Miyaoka et coll., 2017).
Par conséquent, l’inhibiteur de la chymase peut contribuer à la prévention de la fibrose hépatique via l’inhibition de l’activation du TGF-β par inhibition de la chymase et / ou l’atténuation du taux de TGF-β via la réduction de l’angiotensine II et la prolifération des mastocytes.
Conclusion
Le syndrome métabolique comprenant l’obésité, la résistance à l’insuline, l’hyperlipidémie et l’hypertension est étroitement lié au développement de la NASH, et des essais d’agents antidiabétiques, anti-hyperlipidémiques et anti-hypertenseurs ont été menés pour le traitement de la NASH. Le concept derrière ces agents est d’atténuer les symptômes du syndrome métabolique (Georgescu et al., 2009; Park et coll., 2010; Mahady et coll., 2011). Des rapports antérieurs ont démontré que l’inhibiteur de la chymase atténue l’inflammation et la fibrose sans influencer les taux de glucose et de lipides dans le sang et la pression artérielle dans des modèles animaux de diabète, d’hyperlipidémie et d’hypertension, respectivement (Inoue et al., 2009; Takai et coll., 2014; Zhang et coll., 2016). Par conséquent, le concept derrière l’inhibition de la chymase est d’atténuer directement l’inflammation hépatique et la fibrose de la NASH. Nous proposons que l’inhibiteur de la chymase ciblant le syndrome métabolique est une stratégie potentiellement puissante pour l’atténuation de la progression de la NASH.
Contributions de l’auteur
ST et DJ: a écrit le manuscrit. Les deux auteurs ont lu et approuvé le manuscrit final.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.