Malgré le déclin spectaculaire de la morbidité et de la mortalité liées au virus de l’immunodéficience humaine de type 1 (VIH-1) à la suite de la découverte des inhibiteurs de la protéase et de l’avènement d’un traitement combiné antirétroviral hautement actif (ARV) au milieu des années 1990, de nombreux patients continuaient d’échouer au traitement en raison d’une résistance et/ou d’une intolérabilité (1). Il était clair que davantage d’ARV agissant à différentes étapes du cycle de vie du virus, actifs contre les virus résistants et mieux tolérés étaient nécessaires. La démonstration du rôle clé des récepteurs de la chimiokine CCR5 et CXCR4 dans l’entrée du VIH-1 a suscité un intérêt pour ce processus en tant que nouvelle cible ARV (2, 3). CCR5 est le co-récepteur de la majorité des souches du VIH-1, et ces virus sont appelés tropiques CCR5 (R5). Les souches virales qui utilisent CXCR4 sont appelées CXCR4-tropiques (X4), tandis que les souches qui peuvent utiliser les deux récepteurs sont dual-tropiques (4). Le virus d’un patient peut souvent contenir des mélanges de souches R5, X4 et dual-tropiques, collectivement appelées utilisatrices de CXCR4.
Le rôle clé du CCR5 dans l’entrée du VIH-1, associé à la démonstration que les individus homozygotes pour une délétion de 32 paires de bases dans le gène CCR5 (CCR5Δ32), et n’exprimant par la suite pas le CCR5 fonctionnel, étaient hautement protégés contre l’infection par le VIH-1 R5, a focalisé l’attention sur le CCR5 en tant que cible attrayante (5). Bien que certaines études aient démontré des effets subtils de la mutation CCR5Δ32 sur la fonction immunitaire, tels que la diminution des scores inflammatoires chez les personnes infectées par l’hépatite C et le rétablissement de l’hépatite B chez les hétérozygotes; alors que les homozygotes sont plus sensibles à l’encéphalite à tiques et à la maladie grave à virus du Nil occidental, ces personnes souffrent de peu d’effets indésirables apparents sur leur santé (5, 6). Ceci, ajouté au fait que les membres de la superfamille des récepteurs couplés à la protéine G sont souvent susceptibles de développer des médicaments puissants, sélectifs et biodisponibles par voie orale (7), a conduit à l’initiation de programmes de découverte de ligands CCR5 par plusieurs groupes, y compris une équipe de Recherche et développement mondiale de Pfizer basée aux laboratoires Sandwich au Royaume-Uni.
Le Maraviroc (UK-427,857, MVC) a été découvert par criblage à haut débit de la banque de composés de Pfizer à l’aide d’un test de liaison aux radioligandes de chimiokines. Le composé le plus prometteur du processus de criblage a été optimisé pour sa puissance contre le récepteur, son activité antivirale, ses caractéristiques pharmacocinétiques et sa sélectivité contre les cibles cellulaires humaines grâce à un grand effort de chimie médicinale au cours duquel près de 1000 molécules ont été caractérisées (7). MVC se lie dans la poche transmembranaire de CCR5 et est un antagoniste fonctionnel à décalage lent qui empêche l’internalisation (7, 8). Il a une puissante activité antivirale contre un large éventail d’isolats du VIH-1 (7). Avec son excellent profil d’innocuité préclinique et sa pharmacocinétique acceptable, il a été nommé candidat clinique en décembre 2000 (7).
Il était toujours clair que le développement clinique des antagonistes du CCR5 serait difficile, car il s’agirait des premiers médicaments antirétroviraux ciblés par l’hôte et nous nous aventurions donc en territoire inconnu. Afin de préempter les problèmes clés, une équipe de développement clinique a été créée très peu de temps après le début du programme de découverte et j’ai été recruté pour diriger l’équipe de développement précoce, rejoignant Pfizer en février 1999. Nous avons identifié plusieurs défis clés à relever dans la conception du programme clinique, en plus de démontrer l’innocuité et l’efficacité. Le premier d’entre eux était qu’il n’existait aucun test disponible dans le commerce et validé cliniquement pour identifier les patients infectés par le VIH-1 R5. Cela était essentiel, car le MVC n’est actif que contre les souches de VIH-1 R5 (7). Deuxièmement, malgré le phénotype apparemment sain des individus atteints de CCR5Δ32 (5, 6), des préoccupations subsistaient quant à la sécurité d’une exposition à long terme aux antagonistes du CCR5, car le blocage du CCR5 peut être différent de l’absence congénitale du récepteur CCR5, où le système immunitaire a mûri en l’absence de CCR5 et des mécanismes compensatoires peuvent s’être développés. Enfin, chez les personnes infectées par le VIH-1, l’incidence des souches de VIH-1 utilisant le CXCR4 augmente avec la progression de la maladie et la diminution du nombre de cellules CD4 (9), bien qu’aucun lien de causalité entre le virus utilisant le CXCR4 et l’épuisement des cellules CD4 n’ait été démontré. Cela a conduit à craindre que la pression sélective d’un antagoniste du CCR5 puisse pousser la population virale à utiliser le CXCR4 et entraîner un déclin des cellules CD4.
Des études de phase 1 à dose unique et multiple chez des volontaires sains, menées en 2001 et au premier semestre de 2002, ont démontré que le MVC était sûr et bien toléré en doses multiples allant jusqu’à 300 mg deux fois par jour (BID), avait un profil pharmacocinétique compatible avec une administration orale une fois par jour (QD) ou BID, pouvait être combiné avec d’autres ARV et que des doses ≥100 mg BID entraînaient une exposition au-dessus de la moyenne géométrique de l’antiviral IC90 in vitro (7, 10). Pour démontrer une preuve de pharmacologie, la saturation des récepteurs CCR5 a été mesurée à l’aide d’un test d’internalisation ex vivo MIP-1β sur mesure. Une saturation dose-dépendante a été démontrée, avec des doses ≥ 25 mg QD entraînant des niveaux de saturation proches du maximum, ce qui soulève la possibilité intéressante que la MVC puisse être efficace à des doses aussi faibles que 25 mg QD. La saturation des récepteurs est restée élevée pendant plusieurs jours après l’arrêt de l’administration, reflétant un décalage lent par rapport au récepteur in vivo (11).
Nous avons été enthousiasmés et encouragés par les données de phase 1 et nous sommes rapidement passés à un programme de validation de concept de phase 2a. Les patients infectés par le VIH-1 ont été dépistés pour la présence du virus R5 uniquement, à l’aide d’un nouveau test de tropisme phénotypique (Trofile®, Monogram Biosciences, South San Francisco, Californie, États-Unis), et ont reçu MVC en monothérapie pendant 10 jours (12). La saturation des récepteurs CCR5 a été mesurée dans cette étude afin d’évaluer la possibilité de l’utiliser comme biomarqueur d’efficacité et de surveillance thérapeutique. Les données très attendues ont répondu à nos attentes et ont démontré que des doses ≥100 mg de BID entraînaient une réduction maximale moyenne de l’ARN du VIH-1 de > 1.5log10 (Figure 1A), avec tous les patients, à l’exclusion d’un patient atteint du virus X4 qui a été inclus par erreur, obtenant une réduction de l’ARN du VIH-1 d’au moins 1log10 (12). Cela nous a donné l’assurance que le test identifiait correctement les patients susceptibles de répondre à la MVC. Le nadir de l’ARN du VIH-1 est apparu 1 à 5 jours après la dernière dose de MVC, ce qui correspond à une saturation prolongée des récepteurs, comme l’ont démontré les études de phase 1 (12). Pour toutes les doses, à l’exception de 25 mg, une saturation des récepteurs QD > 80% a été observée tout au long de la période d’administration. Cependant, il n’y avait aucune corrélation entre la réduction de la charge virale et le degré de saturation des récepteurs. L’explication la plus probable est que des niveaux très élevés de saturation des récepteurs sont nécessaires pour l’efficacité antivirale et que la variabilité inhérente du test ne permet pas une différenciation à ce degré (11, 12).
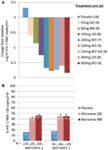
Figure 1. Preuve de concept de Maraviroc et résultats d’efficacité de phase 3. (A) Variation maximale moyenne de l’ARN VIH-1 par rapport à l’inclusion chez les patients recevant MVC en monothérapie. Sur la base des données de phase 1 et de la modélisation et de la simulation, des doses allant de 25 mg QD à 300 mg BID (y compris 150 mg BID nourris et à jeun) ont été sélectionnées. La pharmacocinétique de l’ARN du VIH-1, de l’innocuité et de la MVC a été évaluée (12). (B) MOTIVER 1 et 2 – proportion de patients atteignant l’ARN du VIH-1 < 50 copies / mL à la semaine 48. Les patients infectés par le VIH-1 avec R5 VIH-1 et une expérience et / ou une résistance de triple classe ont été randomisés pour recevoir MVC QD ou BID, ou un placebo, en combinaison avec un traitement antirétroviral de base optimisé (OBT). D < 0.001 (13, 14).
Les données de phase 2a ont suscité de l’enthousiasme dans toute l’entreprise et nous tenions à faire progresser le programme de développement clinique le plus rapidement possible car il y avait un besoin médical élevé de nouveaux ARV pour traiter les patients sans options de traitement ou limitées. Le vaste programme de phase 1 (y compris les études d’interactions médicamenteuses multiples) et la large gamme de doses évaluées dans les études de validation de principe de phase 2a, ainsi que la modélisation et la simulation, nous ont permis de très bien comprendre la dose probablement efficace de MVC en association avec d’autres ARV. Nous avons donc pu passer directement aux études d’efficacité de phase 3 évaluant la MVC à 300 mg (ou équivalent, selon les médicaments co-administrés) QD et BID, sans avoir besoin de faire des études autonomes de dosage de phase 2b, raccourcissant ainsi considérablement le calendrier de développement. Fin 2004, nous avons lancé quatre grandes études; MOTIVATE 1 et 2 chez des patients traités par le VIH-1 R5 (13, 14), MERIT (une étude de phase 3 avec un roll-in de phase 2b) chez des patients naïfs de traitement par le VIH-1 R5 (15), et l’étude A4001029, une étude d’innocuité de phase 2b chez des patients traités par le virus tropique non CCR5 (virus utilisant le CXCR4 ou non phénotypable) (16).
Ce fut une entreprise massive, avec 4794 patients dépistés dans plus de 200 sites aux États-Unis, au Canada, en Europe, en Australie, en Afrique du Sud, au Mexique et en Argentine. Deux autres antagonistes de la petite molécule CCR5 (l’aplaviroc et le vicriviroc) étaient également en cours d’évaluation dans les études de phase 2b à ce moment (17, 18). En plus des défis habituels liés à la gestion de grandes études cliniques, nous avons reçu deux balles courbées, la première d’entre elles étant l’arrêt de l’aplaviroc en raison d’une hépatotoxicité idiosyncratique. Il a été spéculé que cela pourrait être un effet de classe des antagonistes du CCR5, car les souris knockout du CCR5 sont plus sensibles à l’hépatotoxicité médiée par la concanavaline-A (17). De plus, un patient de l’étude MERIT a développé une hépatotoxicité sévère. Les données laissaient entendre qu’il était probablement lié à l’isoniazide ou au cotrimoxazole, mais un rôle contributif de la MVC ne pouvait être exclu (15). Un examen approfondi de toutes les données à la recherche de preuves d’hépatotoxicité pour la MVC et d’un niveau élevé de vigilance pour tout signal, n’a trouvé aucune preuve d’une augmentation systématique des enzymes hépatiques ou d’autres marqueurs de l’hépatotoxicité. Peu de temps après, des préoccupations ont été soulevées concernant un risque potentiel accru de certaines tumeurs malignes, à la suite de la survenue d’un lymphome chez quatre patients traités par vicriviroc dans l’étude ACTG5211 (18). Au départ, on craignait qu’il puisse s’agir d’un effet de classe basé sur le potentiel immunomodulateur des antagonistes du CCR5, mais l’examen des données d’autres études vicriviroc, ainsi que des études en cours sur le MVC, n’a pas soutenu cette théorie (18).
Les données de MOTIVATE 1 et 2 et A4001029 étaient disponibles avant celles de MERIT, car la durée de l’étude est généralement plus courte chez les patients traités. C’est avec beaucoup d’enthousiasme que nous avons attendu les analyses intermédiaires de la semaine 24 pour les études MOTIVATE en octobre 2006 et nous avons été ravis de voir que beaucoup plus de patients recevant MVC avaient un ARN du VIH-1 < 50 copies / mL (le marqueur clé d’efficacité) par rapport à ceux recevant le placebo OBT. Cela a été confirmé par les données de la semaine 48, démontrant la durabilité de la réponse (figure 1B) (13, 14). En revanche, les patients atteints de VIH-1 tropique non CCR5 recevant MVC dans A4001029 ne semblaient pas bénéficier d’un bénéfice virologique significatif par rapport au placebo (16). L’analyse des données de sécurité n’a soulevé aucune préoccupation importante. Plus précisément, il n’y avait aucune preuve d’effet indésirable sur la fonction immunitaire, sans augmentation des épisodes d’infection ou de tumeurs malignes chez les patients traités par MVC. L’évaluation du tropisme viral à l’échec a montré que > 50% des patients ayant échoué au traitement par MVC présentaient un virus utilisant le CXCR4 à l’échec, mais il n’y avait aucune preuve d’effet délétère sur le nombre de cellules CD4 (14). L’évaluation virologique a démontré que le virus utilisant le CXCR4 qui a émergé sous la pression sélective de la MVC provenait d’une population minoritaire préexistante et n’est pas apparu de novo (19). Dans l’ensemble, ces résultats ont clairement démontré les avantages de la MVC dans la prise en charge des patients traités avec le VIH-1 R5. Un effort suprême de l’équipe a abouti à la soumission de dossiers d’enregistrement aux États-Unis et en Europe seulement 2 mois après la disponibilité des données intermédiaires. MVC (300 mg BID) a reçu l’autorisation d’utilisation (en association avec d’autres ARV) aux États-Unis en août 2007, seulement 6.5 ans après sa nomination comme candidat au développement clinique. Un mois plus tard, il a également été approuvé pour une utilisation dans cette population dans l’UE.
L’analyse de la semaine 48 de l’étude MERIT a été décevante, car la MVC plus la zidovudine / lamivudine (ARN VIH-1 < 50 copies / mL, 65,3%) ne satisfaisait pas aux critères prédéfinis de non-infériorité (limite inférieure de l’intervalle de confiance 1 face de 97,5 inférieure à -10%) à l’éfavirenz plus la zidovudine / lamivudine (ARN VIH-1 < 50 copies / mL, 69,3%) (15). Cependant, les patients de cette étude ont été dépistés pour le virus R5 en utilisant le test Trofile original. Ce test a été amélioré entre-temps pour être plus sensible à la détection de populations minoritaires de virus utilisant le CXCR4. Tous les échantillons de dépistage pour les patients MÉRITÉS ont ensuite été testés à nouveau à l’aide du test amélioré et une analyse post hoc a été effectuée en incluant uniquement les patients atteints du virus R5 uniquement par le test plus sensible. Dans cette analyse, les taux de réponse pour le MVC et l’éfavirenz étaient respectivement de 68,3 et 68,5 %, la limite inférieure de l’intervalle de confiance de 97,5 % étant supérieure à -10 % (15). Sur la base de ces données, MVC a également été approuvé pour une utilisation chez des patients naïfs de traitement en novembre 2009 par la Food and Drug Administration des États-Unis.
Le MVC s’est non seulement avéré être un ajout précieux à l’arsenal de médicaments antirétroviraux en croissance constante, mais les données de ces études ont amélioré notre compréhension du tropisme du VIH et de la relation entre le tropisme et la progression de la maladie. Pour moi, personnellement, cela a représenté une période de grande excitation et de grande satisfaction, à la fois en tant que médecin et scientifique.
Contributions de l’auteur
ER a rédigé ce manuscrit sur la base de son expérience personnelle en tant que membre de l’équipe de développement de MVC. Toutes les données ont été publiées intégralement ailleurs. Toutes les études ont été menées en conformité avec les principes de la Déclaration d’Helsinki et avec toutes les Directives de Bonnes Pratiques Cliniques de la Conférence Internationale sur l’Harmonisation et les exigences réglementaires et juridiques locales. Toutes les études ont été approuvées par des comités d’éthique indépendants et tous les patients ont donné leur consentement éclairé écrit.
Déclaration de conflit d’intérêts
Elna Van Der Ryst était une employée de Pfizer Global Research and development au moment de la mise au point de MVC. Elle fournit actuellement des services-conseils à Pfizer.
Remerciements
J’aimerais remercier les collègues de Pfizer qui ont contribué au programme de découverte et de développement du MVC, ainsi que les chercheurs et les patients qui ont participé aux études cliniques.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF, et al. La prévalence de la résistance aux médicaments antirétroviraux aux États-Unis. AIDS (2004) 18:1393-401. doi: 10.1097/01.sida.0000131310.52526.c7
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. L’entrée du VIH-1 dans les cellules CD4+ est médiée par le récepteur de la chimiokine CC-CKR-5. Nature (1996) 381:667-73. doi: 10.1038/381667a0
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Cofacteur d’entrée du VIH-1: clonage fonctionnel d’ADNc d’un récepteur couplé à la protéine G à sept transmembranaires. Science (1996) 272:872-7. doi: 10.1126 / science.272.5263.872
CrossRef Texte intégral / Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Une nouvelle classification pour le VIH-1. Nature (1998) 391:240. doi:10.1038/34571
CrossRef Texte intégral / Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR5 chemokine receptor gene. Nature (1996) 382:722-5. doi: 10.1038/ 382722a0
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Utilisation clinique des inhibiteurs du CCR5 dans le VIH et au-delà. J Transl Med (2011) 9 (Complément 1): S9. doi: 10.1186 /1479-5876-9-S1-S9
Résumé Pubmed | Texte Intégral Pubmed | Texte intégral CrossRef / Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M, et al. Maraviroc (UK-427,857), un inhibiteur de petites molécules puissant, biodisponible par voie orale et sélectif du récepteur de la chimiokine CCR5 avec une activité anti-virus de l’immunodéficience humaine de type 1 à large spectre. Antimicrob Agents Chemother (2005) 49:4721-32. doi: 10.1128/AAC.49.11.4721- 4732.2005
CrossRef Texte intégral / Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, et al. Interactions moléculaires du CCR5 avec les principales classes d’antagonistes du CCR5 anti-VIH-1 à petites molécules. Mol Pharmacol (2008) 73:789-800. doi: 10.1124/mol.107.042101
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Récepteurs de la chimiokine en tant que co-récepteurs du VIH-1: rôles dans l’entrée virale, le tropisme et la maladie. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146/annurev.immunol.17.1.657
Résumé Pubmed / Texte Intégral Pubmed / Texte Intégral CrossRef / Google Scholar
10. Abel S, van der Ryst E, Rosario MC, James I, Ridgway C, Medhurst C, et al. Évaluation de la pharmacocinétique, de l’innocuité et de la tolérance du maraviroc, un nouvel antagoniste du CCR5, chez des volontaires sains. Br J Clin Pharmacol (2008) 65 (S1): 5-18. doi: 10.1111/j.1365-2125.2008.03130.x
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel S, et al. Analyse pharmacocinétique-pharmacodynamique de l’occupation des récepteurs CCR5 par le maraviroc chez des sujets sains et des patients séropositifs. Br J Clin Pharmacol (2008) 65 (S1): 86-94. doi: 10.1111/j.1365-2125.2008.03140.x
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef / Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM, et al. Efficacité de la monothérapie à court terme avec maraviroc, un nouvel antagoniste du CCR5 chez les patients infectés par le VIH-1. Nat Med (2005) 11:1170-2. doi: 10.1038 / nm1319
Résumé Pubmed / Texte Intégral Pubmed / Texte Intégral CrossRef / Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maraviroc pour les patients précédemment traités avec une infection par le VIH-1 R5. (2008) 359:1429-41. doi: 10.1056/NEJMoa0803152
CrossRef Texte intégral / Google Scholar
14. Fätkenheuer G, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Analyses de sous-groupes du maraviroc dans une infection à VIH-1 R5 précédemment traitée. (2008) 359:1442-55. doi: 10.1056 / NEJMoa0803154
Résumé Pubmed / Texte Intégral Pubmed | Texte Intégral CrossRef / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maraviroc versus éfavirenz, tous deux en association avec la zidovudine/lamivudine, pour le traitement des sujets naïfs d’antirétroviraux atteints du VIH-1 tropique CCR5. J Infect Dis (2010) 201:803-13. doi:10.1086/650697
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef / Google Scholar
16. Saag M, Goodrich J, Fätkenheuer G, Clotet B, Clumeck N, Sullivan J, et al. Un essai en double aveugle contrôlé contre placebo du maraviroc chez des patients traités infectés par le VIH-1 non-CCR5-tropique: résultats sur 24 semaines. J Infect Dis (2009) 11:1638-47. doi:10.1086/598965
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef / Google Scholar
17. Le groupe de travail Nichols, Steel HM, Bonny T, Adkison K, Curtis L, Millard J et coll. Hépatotoxicité observée dans les essais cliniques de l’aplaviroc (GW873140). Antimicrob Agents Chemother (2008) 52:858-65. doi: 10.1128/AAC.00821-07
Résumé Pubmed | Texte Intégral Pubmed / Texte Intégral CrossRef / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A, et al. Diagnostic de lymphome et charge plasmatique du virus d’Epstein-Barr pendant le traitement par vicriviroc: résultats des essais cliniques sur le SIDA groupe A5211. Clin Infect Dis (2009) 48:642-9. doi:10.1086/597007
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef / Google Scholar
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M, et al. Virus utilisant le CXCR4 détecté chez des patients recevant du maraviroc dans les études de phase III MOTIVATE 1 et 2 provient d’une minorité préexistante de virus utilisant le CXCR4. Antivir Ther (2007) 12:S65.
Google Scholar