- Introduction
- Structure et régulation de ChREBP Via les domaines LID/Grace
- Activation du ChREBP par les métabolites du glucose
- Co-facteurs et partenaires du ChREBP
- Rôle du ChREBP dans le Métabolisme des glucides et la Production d’hépatokines
- Le ChREBP en tant que régulateur de la Synthèse des Acides gras hépatiques et de la sécrétion de VLDL
- Régulation du métabolisme du fructose par le ChREBP dans le foie et l’intestin
- Réglementation du BDK:Axe PPM1K dans le foie
- Le ChREBP Est nécessaire à la Régulation par le glucose du FGF21
- Rôle du ChREBP dans le Réseau Inter-Organes Qui Contrôle l’Homéostasie énergétique
- Rôle du ChREBP hépatique dans le Contrôle de l’équilibre de la sensibilité à l’insuline
- Le ChREBP adipeux Relie la lipogenèse à la sensibilité à l’insuline
- Nouvelle interaction Entre la Lipase Hormono-sensible et le ChREBP dans le tissu adipeux
- Conclusion et Orientations futures
- Contributions des auteurs
- Financement
- Déclaration de conflit d’intérêts
Introduction
La consommation accrue de sucres simples tels que le saccharose et le sirop de maïs à haute teneur en fructose au cours des dernières années a entraîné un risque accru de maladies métaboliques telles que l’obésité, la dyslipidémie, le diabète de type 2 et / ou la stéatose hépatique non alcoolique (NAFLD). Le foie est le principal organe responsable de la conversion des glucides alimentaires en excès en graisses. Les triglycérides (TG) résultants peuvent être emballés dans des lipoprotéines de très basse densité (VLDL) et sécrétés dans la circulation, stockés sous forme de gouttelettes lipidiques ou métabolisés par la voie de la bêta-oxydation. L’insuline sécrétée en réponse à une glycémie élevée stimule l’expression des gènes de la synthèse des acides gras de novo (lipogenèse) par l’intermédiaire du facteur de transcription, l’élément régulateur du stérol, liant la protéine-1c (SREBP-1c) (Foretz et al., 1999). SREBP-1c agit en synergie avec un autre facteur de transcription appelé protéine de liaison à l’élément de réponse glucidique (ChREBP), qui médie la réponse aux glucides alimentaires. La structure de la protéine ChREBP contient un domaine inhibiteur de glucose faible (LID) et un élément conservé d’activation de la réponse au glucose (GRACE) situé à son extrémité N-terminale (Li et al., 2006). L’activation du domaine GRACE par les métabolites du glucose favorise l’activité transcriptionnelle du ChREBP et la liaison à une séquence hautement conservée appelée élément de réponse glucidique (ChoRE). ChoRE est présent sur les promoteurs des gènes cibles ChREBP, qui codent des enzymes clés de la lipogenèse de novo, notamment la L-pyruvate kinase (L-pk), une enzyme limitant le taux de glycolyse, la synthase des acides gras (Fas), l’acétyl-Coa carboxylase (Acc) et la stéaroyl-Coa désaturase (Scd1) (Kawaguchi et al., 2001). Une étude récente a rapporté l’interdépendance entre le ChREBP (activé par le glucose) et le SREBP-1c (activé par l’insuline) pour l’induction complète de l’expression des gènes glycolytiques et lipogéniques dans le foie (Linden et al., 2018). Le rétablissement viral de la forme active nucléaire de SREBP-1c dans le foie de souris déficientes en ChREBP (ChREBPKO) a normalisé l’expression des gènes lipogéniques, tout en n’ayant aucun effet sur le sauvetage de l’expression des gènes glycolytiques. L’expérience mirror, dans laquelle l’expression du ChREBP a été induite dans le foie de souris knockout SREBP-1c, a permis de sauver l’expression du gène glycolytique mais étonnamment pas l’expression du gène lipogène, malgré le rôle bien connu du ChREBP dans le contrôle des gènes de synthèse des acides gras. Néanmoins, cette étude suggère l’importance de la double action du ChREBP et du SREBP-1c dans les gènes témoins impliqués dans la régulation de la synthèse des acides gras (Linden et al., 2018).
Le ChREBP est hautement enrichi dans le foie et a été étudié comme régulateur maître du métabolisme des lipides (Iizuka et al., 2004; Osorio et coll., 2016). Le ChREBP est également exprimé de manière significative dans les îlots pancréatiques, l’intestin grêle, le muscle squelettique et, dans une moindre mesure, dans les reins et le cerveau (voir Richards et al., 2017 pour examen). Fait intéressant, une autre isoforme de ChREBP, ChREBPß, provenant d’un promoteur alternatif du premier exon, a été identifiée pour la première fois dans le tissu adipeux (Herman et al., 2012) et décrits plus tard dans d’autres types de cellules (voir Abdul-Wahed et al., 2017 pour examen). Comme nous en discuterons, ChREBPß est décrit comme une isoforme constitutivement active. Il est à espérer que les travaux futurs porteront sur les rôles respectifs du ChREBP et du ChREBPß dans la régulation du métabolisme du glucose et des lipides, ainsi que sur l’identification de leurs cibles spécifiques et/ou qui se chevauchent.
Structure et régulation de ChREBP Via les domaines LID/Grace
ChREBP appartient à la famille Mondo des facteurs de transcription bHLH/Zip. Le domaine N-terminus (résidus 1-251) contient deux signaux d’exportation nucléaire (NES) et un signal de localisation nucléaire (NLS) régulant la localisation subcellulaire en interagissant avec la région chromosomique de maintien 1 (CRM1) également appelée protéines exportine 1 et/ou 14-3-3 (Sakiyama et al., 2008). La région C-terminale contient un domaine polyproline, un domaine bHLH/LZ (660-737 résidus) et un domaine de type fermeture éclair à la leucine (résidus de type fermeture éclair, 807-847) qui sont associés à des co-facteurs et à la liaison à l’ADN (Yamashita et al., 2001; Fukasawa et coll., 2010; Ge et coll., 2012). La localisation et l’activation transcriptionnelle du ChREBP sont déterminées par la disponibilité des nutriments. La régulation du ChREBP par le glucose se produit principalement au niveau du module de détection du glucose (GSM) ou de la région conservée mondo (MCR), qui est composée du COUVERCLE et des domaines de GRÂCE, comme mentionné dans l’introduction (Figure 1A; Li et coll., 2006; Singh et Irwin, 2016). En 2012, Herman et coll. (2012) ont décrit une autre isoforme ChREBP, ChREBPß, transcrite d’un promoteur alternatif du premier exon 1b à l’exon 2 (Figure 1B). Cette transcription est traduite à partir de l’exon 4, générant une protéine plus courte de 687 acides aminés (l’isoforme ChREBP pleine longueur, rebaptisée α, contient 864 acides aminés, appelés ChREBP dans le manuscrit) dans laquelle les deux NES, NLS et le domaine LID sont manquants. ChREBPß est très actif dans le tissu adipeux blanc de manière dépendante de la GLUT-4 et il est suggéré d’être directement régulé par ChREBPa puisqu’une séquence de corvée a été identifiée dans le promoteur d’exon 1β (Herman et al., 2012; Figure 1B). La régulation de ChREBPß par ChREBPa suggère l’existence d’une boucle d’avance qui exacerbe potentiellement la réponse au glucose dans des conditions hyperglycémiques. Cependant, le ou les mécanismes de régulation de l’isoforme de ChREBPß, et plus important encore sa fonction spécifique, doivent être élucidés.
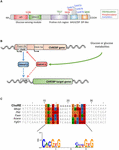
Figure 1. (A) Structure de la protéine de liaison à l’élément de réponse glucidique α (ChREBPa). Le ChREBPa est composé de 864 acides aminés et contient plusieurs domaines régulateurs. À l’extrémité N-terminale, la protéine contient un module de détection du glucose composé du domaine inhibiteur du glucose faible (LID) et de l’élément conservé activé par le glucose (GRACE). La protéine contient également un domaine riche en polyproline, un bHLH / LZ et un domaine ressemblant à une fermeture éclair (Zip-like) à la leucine situé à l’extrémité C. Les modifications post-traductionnelles sont indiquées dans leurs résidus respectifs, la phosphorylation (rouge), l’acétylation (bleu) et les O-GlcNAcylations récemment identifiées (vert). (B) Structure génique du gène ChREBP et génération des deux isoformes ChREBP α et β. ChREBPß est transcrit à partir d’un promoteur alternatif du premier exon 1b. Ce transcrit est traduit à partir de l’exon 4 générant une protéine plus courte de 687 acides aminés dans laquelle les deux NES, le NLS et le domaine LID sont manquants. Il a été suggéré que l’isoforme ChREBPß soit directement régulée par ChREBPa depuis qu’une séquence de corvée a été identifiée dans le promoteur de l’exon 1b. On ignore actuellement si les isoformes α et β de ChREBP se lient à la corvée. Figure adaptée de Herman et al. (2012). (C) Multi-alignement des séquences de consensus de corvée présentes dans plusieurs promoteurs de gènes cibles ChREBP. L’alignement basé sur les nucléotides est présenté en haut de la figure avec la corvée de séquence de consensus décrite dans Poungvarin et al. (2015). Le logo correspondant à la séquence de consensus associée à cet alignement particulier est également représenté.
Activation du ChREBP par les métabolites du glucose
Dans des conditions de jeûne, l’activation dépendante du glucagon de la protéine kinase A (PKA) (Kawaguchi et al., 2002) phosphorylent le ChREBP sur les résidus Ser196 et Thr666, conduisant à la liaison du ChREBP à la protéine 14-3-3 et à sa rétention dans le cytosol (Kawaguchi et al., 2001, 2002; Davies et coll., 2008). La protéine kinase activée par l’AMP (AMPK), un capteur d’énergie cellulaire central, phosphoryle également le ChREBP sur le résidu Ser568, ce qui diminue la liaison du ChREBP aux promoteurs de ses gènes cibles (Kawaguchi et al., 2002; Sato et coll., 2016). Il a été démontré que les métabolites générés pendant le jeûne, tels que les corps AMP et cétoniques produits à partir de l’oxydation des acides gras, jouent un rôle inhibiteur allostérique en modifiant l’affinité des protéines ChREBP et 14-3-3, en améliorant la stabilisation complexe et en favorisant la rétention cytosolique (Sakiyama et al., 2008; Nakagawa et coll., 2013; Sato et coll., 2016). En réponse aux glucides, le ChREBP est régulé aux niveaux transcriptionnel, translationnel et post-translationnel. L’augmentation des concentrations de glucose après un repas favorise la synthèse de métabolites intermédiaires tels que le xylulose-5-phosphate (X5P), initialement proposé comme activateur de la protéine phosphatase 2A (PP2A) (Kawaguchi et al., 2001; Kabashima et coll., 2003). Le PP2A a été décrit précédemment pour déphosphoryler le ChREBP au niveau du résidu Ser196 permettant sa translocation vers le noyau où il est déphosphorylé de manière dépendante du X5P et du PP2A (sur Thr666 et Ser568). Cependant, ce modèle a été remis en question au fil des ans et d’autres métabolites tels que le glucose-6-phosphate (G6P) ont été proposés comme des activateurs potentiels de la translocation/activité du ChREBP (Dentine et al., 2012). McFerrin et coll. (2012) ont identifié un motif putatif pour la liaison G6P (253-SDTLFT-258) sur le domaine de GRÂCE, qui est également conservé dans MondoA, un orthologue ChREBP/MondoB (voir Richards et al., 2017 pour examen). Selon cette hypothèse, le G6P pourrait favoriser un changement de conformation allostérique qui induit une conformation ouverte pour le ChREBP, facilitant l’interaction avec les co-facteurs et la translocation ultérieure vers le noyau (McFerrin et al., 2012).
Au sein du noyau, le ChREBP peut être modifié par O-GlcNAcylation, une modification post-traductionnelle dépendant du métabolisme du glucose, et identifié comme important pour l’activité transcriptionnelle du ChREBP (Guenez et al., 2010). L’O-GlcNAcylation se produit sur les résidus de sérine et de thréonine par l’activité de l’O-GlcNAc transférase (OGT), une enzyme qui ajoute des résidus de N-acétylglucosamine (GlcNAc) aux protéines cibles, modifiant ainsi leur activité, leur stabilité et / ou leur localisation sous-cellulaire. Yang et coll. (2017) ont récemment révélé plusieurs résidus de ChREBP modifiés par O-GlcNacylation. Des mutations de ces résidus au niveau des domaines bHLH/ZIP et de la dimérisation et du domaine de localisation cytoplasmique (DCD) ont permis d’identifier Thr517 et Ser839 comme sites essentiels pour l’activation dépendante du glucose du ChREBP (Figure 1A). Le ChREBP peut également être modifié par acétylation via l’activité histone acétyltransférase de p300 (Bricambert et al., 2010). La p300 activée par le glucose acétylechrebp sur Lys672 et augmente son activité transcriptionnelle en améliorant son recrutement dans la séquence de corvée, dont la séquence de liaison consensuelle optimale est Caygycnnnncrcrtg (Figure 1C). Poungvarin et coll. (2015) ont analysé les sites de liaison au ChREBP par CHIP-seq dans le foie et le tissu adipeux blanc de souris nourries avec un régime riche en glucides et sans graisses. Ils ont rapporté que la liaison au ChREBP est enrichie dans les voies impliquées dans la signalisation de l’insuline, les jonctions adhérentes et le cancer, suggérant une nouvelle implication du ChREBP dans la tumorigénèse et la progression du cancer. De plus, une étude récente a signalé l’importance du ChREBP dans le carcinome hépatocellulaire (CHC) (Ribback et al., 2017). Les auteurs ont constaté que la délétion génétique de ChREBP (chez les souris ChREBPKO) altérait l’hépatocarcinogenèse entraînée par la surexpression de la protéine kinase B / Akt chez les souris. De plus, l’inhibition du ChREBP par le siRNA dans les cellules HCC de souris et / ou humaines a entraîné une diminution de la prolifération et de l’apoptose.
Co-facteurs et partenaires du ChREBP
Plusieurs co-facteurs et/ou partenaires du ChREBP ont été identifiés au cours des dernières années (voir Richards et al., 2017 pour examen). Max like protein x (Mlx), un facteur de transcription bHLH/LZ, a été le premier identifié comme un partenaire de liaison commun de la famille Mondo (Stoeckman et al., 2004). La dimérisation de ChREBP avec Mlx est nécessaire à la fois pour la translocation nucléaire en réponse au glucose et pour la liaison aux éléments de corvée. Des récepteurs nucléaires tels que le facteur nucléaire hépatocytaire 4α (HNF4a) et le récepteur farnésoïde X (FXR) ont également été décrits comme des partenaires du ChREBP. HNF4a interagit physiquement avec le ChREBP en se liant à la région de répétition directe-1 (DR-1) sur le promoteur des gènes cibles du ChREBP (Adamson et al., 2006; Meng et coll., 2016). De plus, il a été démontré que les protéines co-activatrices transcriptionnelles p300/CBP stabilisent le complexe ChREBP/HNF4a (Burke et al., 2009). Les protéines co-activatrices transcriptionnelles p300/CBP jouent un rôle central dans la coordination et l’intégration de plusieurs événements dépendants du signal avec l’appareil de transcription. Une autre propriété clé de la p300/CBP est la présence d’une activité de l’histone acétyltransférase (HAT), qui confère à la p300/CBP la capacité d’influencer l’activité de la chromatine en modulant les histones nucléosomiques. Dans les hépatocytes humains, la liaison de FXR au complexe ChREBP-HNF4a déclenche la libération de ChREBP à partir de CBP/p300, conduisant au recrutement de l’histone désacétylase SMRT sur le promoteur Lpk, agissant ainsi comme co-répresseur de l’activité transcriptionnelle de ChREBP (Caron et al., 2013). De plus, l’activité HAT CBP/p300 modifie la ChREBP sur Lys 672, conduisant à son activation transcriptionnelle en réponse au glucose (Bricambert et al., 2010).
Bricambert et al. (2018) ont récemment identifié l’homéodomaine de la plante histone déméthylase doigt 2 (Phf2), qui appartient à la famille des histones lysine déméthylase (KDM7), comme un nouveau co-facteur de ChREBP. L’interaction entre Phf2 et ChREBP améliore l’activation transcriptionnelle de ChREBP en effaçant les marques de méthyle H3K9 sur le promoteur de ses gènes cibles. Fait intéressant, le co-recrutement spécifique de Phf2 et de ChREBP au promoteur du facteur érythroïde nucléaire 2 like 2 (Nrf2) contribue à l’effet protecteur de Phf2 contre l’augmentation des espèces réactives de l’oxygène (ROS) et la progression de la NAFLD dans le contexte de l’hyperglycémie (Bricambert et al., 2018).
Rôle du ChREBP dans le Métabolisme des glucides et la Production d’hépatokines
Le ChREBP en tant que régulateur de la Synthèse des Acides gras hépatiques et de la sécrétion de VLDL
La stéatose hépatique non alcoolique est une caractéristique du syndrome métabolique, et des études chez l’homme révèlent que la lipogenèse de novo contribue à environ 25% des lipides hépatiques totaux chez les patients atteints de NAFLD (Donnelly et al., 2005). Dans les états résistants à l’insuline, l’hyperglycémie et l’hyperinsulinémie améliorent la lipogenèse en partie par l’activation de ChREBP et de SREBP-1c. L’inhibition du ChREBP dans le foie de souris obèses et résistantes à l’insuline ob/ ob, par ARNi ou ablation génétique conduit à une inversion de la stéatose hépatique (Dentine et al., 2006; Iizuka et coll., 2006). Une sécrétion altérée de VLDL par le foie contribue également à la pathogenèse de la NAFLD. La protéine de transfert de triglycérides microsomaux (MTTP) est la protéine chargée de l’assemblage et de la sécrétion de lipoprotéines contenant de l’apolipoprotéine B. La carence en MTTP chez la souris et l’homme provoque une hypolipidémie et une stéatose hépatique. La régulation de cette protéine a été associée à quelques éléments cis hautement conservés dans son promoteur, y compris des domaines régulateurs critiques positifs et négatifs (Cuchel et al., 2013; Hussain et coll., 2011). Récemment, le ChREPP a été signalé comme un régulateur potentiel du MTTP, car l’absence de ChREPP fonctionnel dans le foie supprime l’expression du Mttp et l’assemblage et la sécrétion de VLDL (Niwa et al., 2018). Cependant, comme aucune corvée n’a pu être clairement identifiée sur le promoteur du Mttp, une analyse plus approfondie sera nécessaire pour identifier le mécanisme avec lequel le ChREBP réglemente le Mttp.
Régulation du métabolisme du fructose par le ChREBP dans le foie et l’intestin
Le lien entre le ChREBP et le métabolisme du fructose a d’abord été mis en évidence par l’analyse phénotypique de souris knockout ChREBP (souris ChREBPKO). Il a été rapporté que des souris ChREBPKO mourraient dans les quelques jours suivant une alimentation riche en fructose (HFrD) (Iizuka et al., 2004). Cette intolérance majeure au fructose a été attribuée à la réduction de l’expression de la fructokinase et de la triose kinase, deux enzymes nécessaires au métabolisme du fructose (Iizuka et al., 2004). Kim et coll. (2016) ont rapporté plus tard l’importance du ChREBP pour la conversion efficace du fructose en glucose dans la clairance du fructose du foie et du corps entier, mais aussi, sous ingestion de fructose, le ChREBP pourrait contribuer à l’hyperglycémie en activant directement l’expression du G6pc, un gène clé de la gluconéogenèse. Cet effet pourrait conduire à un cercle vicieux dans lequel la consommation de fructose exacerbe la production de glucose par l’activité du ChREBP (Kim et al., 2016). L’année suivante, l’étude de Zhang et al. (2017) ont rapporté que des souris ChREBPKO nourries avec du HFrD développaient une lésion hépatique grave en raison d’une suractivation du stress du réticulum endoplasmique et d’une apoptose des hépatocytes médiée par la protéine homologue de la protéine de liaison au renforceur CCAAT (CHOP). L’apoptose dans les hépatocytes de ces souris était très probablement liée à une augmentation de la biosynthèse du cholestérol, car l’inhibition de cette voie par l’intermédiaire de l’HMG-COA réductase (HMGCR) ou de l’inhibition de la SREBP2 a sauvé les souris ChREBPKO d’une lésion hépatique induite par le HFrD. Un manque de ChREBP a également été récemment associé à une dérégulation du métabolisme du saccharose et du fructose entraînant une intolérance au sucre et une malabsorption chez la souris (Kato et al., 2018). Ces effets ont été associés à une diminution de l’expression de la saccharose-isomaltase intestinale (SI), qui digère le saccharose en glucose et fructose, des transporteurs de glucose 5 (Glut5) et 2 (Glut2) et de l’enzyme cétohexokinase (Khk), qui régule la fructolyse (Figure 2). La dérégulation de ces enzymes peut entraîner l’accumulation de saccharose et de fructose non digérés, avec des répercussions potentielles sur la composition du microbiote intestinal. La comparaison entre des souris ChREBPKO et des souris ChREBPLiverKO (ChREBPLiverKO) spécifiques du foie nourries avec du HFrD avait précédemment révélé que la carence en ChREBP hépatique à elle seule n’entraîne pas d’intolérance au fructose, mais que la carence en ChREBP dans l’intestin grêle est très probablement responsable de l’altération de la tolérance au fructose observée chez ces souris (Kim et al., 2017). Au total, ces études soulignent l’importance du ChREBP dans la régulation du métabolisme du fructose et soulignent la nécessité d’une meilleure compréhension de son rôle et de sa régulation dans l’intestin grêle.
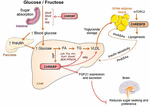
Figure 2. Le ChREPP régule de multiples voies de signalisation / métabolisme en réponse au glucose et au fructose. Le ChREBP est exprimé dans plusieurs tissus, notamment l’intestin, le foie et le tissu adipeux blanc. Dans ces types cellulaires, en réponse au glucose et/ou au fructose, le ChREBP est activé et induit un programme génique spécifique comme indiqué sur la figure. Dans l’intestin, la stimulation de l’expression de SI, Glut5, Glut2 et de la Cétohexokinase (Khk) par le ChREBP (directement ou indirectement) a été décrite pour améliorer la tolérance au saccharose et l’absorption du fructose. Dans le foie, le ChREBP est un modulateur clé de l’expression des gènes des protéines de transfert de triglycérides glycolytiques, lipogènes et microsomiques (Mttp), contrôlant ainsi à la fois l’accumulation d’acides gras et l’exportation de VLDL du foie. Le ChREBP régule également la production d’hépatokines telles que le facteur de croissance des fibroblastes 21 (FGF21). Cet axe foie-cerveau étend la fonction ChREBP du foie d’un régulateur hépatique à un modulateur systémique affectant non seulement la manipulation du substrat dans le foie, mais également la préférence nutritive. L’activation du ChREBP dans le tissu adipeux blanc est liée à une homéostasie métabolique améliorée en produisant des signaux circulants protecteurs. Une nouvelle classe de lipides de mammifères caractérisée par une liaison ester ramifiée entre un acide gras et un acide hydroxy-gras (acide palmitique hydroxylstéarique) aurait des effets bénéfiques sur l’homéostasie du glucose par modulation directe et par incrétine de la fonction des cellules β, augmentation de l’absorption du glucose adipeux et réduction de l’inflammation. Fait intéressant, mTORC2 a récemment été identifié comme un nouveau régulateur de l’isoforme ChREBPß dans les cellules adipeuses.
Réglementation du BDK:Axe PPM1K dans le foie
La première étape engagée du catabolisme des acides aminés à chaîne ramifiée (BCAA) est régulée par le complexe cétoacide déshydrogénase à chaîne ramifiée (BCKDH) qui est contrôlé par deux enzymes, l’alpha-cétoacide déshydrogénase kinase à chaîne ramifiée (BDK) et la protéine phosphatase, 1K dépendant de Mg2 + / Mn22 + (PPM1K). White et coll. (2018) ont récemment associé ChREBP à la régulation à la hausse du BDK et à la régulation à la baisse du PPM1K dans le foie et ont identifié un motif de corvée conservé dans le promoteur de ces deux gènes. Une corrélation positive entre l’expression de BDK et d’autres gènes cibles typiques de ChREBP (Fasn, Pklr, ChREBPß) a été observée dans les foies de rats nourris avec un régime riche en glucose ou en fructose. Au niveau physiologique, l’augmentation du rapport BDK: PPM1K a conduit à la phosphorylation et à l’activation de l’ATP-citrate lyase (ACLY), stimulant ainsi la lipogenèse de novo. Ces résultats révèlent que BDK et PPM1K peuvent être de nouveaux gènes activateurs de la lipogenèse régulés par ChREBPß. Compte tenu de leur rôle dans la régulation du métabolisme des lipides, du glucose et des acides aminés, le BDK et le PPM1K pourraient être considérés comme des cibles thérapeutiques potentielles dans le foie dans un avenir proche (White et al., 2018).
Le ChREBP Est nécessaire à la Régulation par le glucose du FGF21
Le ChREBP a récemment été associé à la production et à la sécrétion d’hépatokines telles que le facteur de croissance des fibroblastes 21 (FGF21) (Iizuka et al., 2009; Dushay et coll., 2015, Iroz et al., 2017). Le FGF21 est une hormone métabolique synthétisée par le foie avec de multiples effets bénéfiques dans les tissus périphériques (Kharitonenkov et al., 2005; Badman et coll., 2007; Markan et coll., 2014). Jusqu’à récemment, le FGF21 était considéré comme une hormone à jeun qui améliore l’oxydation des acides gras, la cétogenèse et la lipolyse sous le contrôle transcriptionnel du récepteur α activé par le proliférateur du peroxysome (PPARa) (Inagaki et al., 2007). Une corvée sur le promoteur Fgf21 a déjà été identifiée chez la souris (-74 à -52 pb) et chez l’homme (-380 à -366 pb) (Iizuka et al., 2009) mais les études fonctionnelles ont fait défaut jusqu’à récemment. Il a été rapporté que la consommation de glucose et de fructose entraînait une élévation rapide des taux de FGF21 chez des volontaires sains et des patients atteints du syndrome métabolique (Dushay et al., 2015). Des études supplémentaires ont également signalé un lien mécaniste entre le FGF21 dérivé du ChREBP et la préférence pour les macronutriments via un axe foie-cerveau (Talukdar et al., 2016; von Holstein-Rathlou et coll., 2016). Cet axe foie-cerveau étend la fonction ChREBP d’un régulateur métabolique hépatique à un modulateur systémique, affectant non seulement la manipulation du substrat hépatique, mais également le comportement alimentaire global (Abdul-Wahed et al., 2017).
Rôle du ChREBP dans le Réseau Inter-Organes Qui Contrôle l’Homéostasie énergétique
Rôle du ChREBP hépatique dans le Contrôle de l’équilibre de la sensibilité à l’insuline
Notre laboratoire a précédemment signalé que le ChREBP agit comme un modulateur clé de la composition en acides gras hépatiques et de la sensibilité à l’insuline dans le contexte des maladies hépatiques non alcooliques et alcooliques (voir Abdul-Wahed et al., 2017 pour examen). Les souris surexprimant le ChREBP ont développé une plus grande stéatose hépatique que les témoins, mais sont restées exemptes de complications métaboliques et n’ont pas développé de résistance à l’insuline. L’analyse lipidomique a révélé que la stéatose médiée par le ChREBP est associée à une diminution des acides gras saturés et à une augmentation des acides gras monoinsaturés, ces derniers étant associés à des effets bénéfiques médiés par le ChREBP sur la sensibilité à l’insuline (Benhamed et al., 2012). Ces résultats démontrent le rôle du ChREPP dans la répartition lipidique et suggèrent que des espèces lipidiques spécifiques, lorsqu’elles sont présentes au bon endroit et au bon moment, peuvent déclencher des signaux qui modulent l’adaptation au stress métabolique (Benhamed et al., 2012; Bricambert et coll., 2018). Fait intéressant, Jois et coll. (2017) ont également suggéré un rôle protecteur pour le ChREBP hépatique en ce qui concerne l’homéostasie du glucose dans l’ensemble du corps et la sensibilité à l’insuline. Les souris ChREBPLiverKO présentent une tolérance au glucose aggravée, alors qu’elles sont protégées de la stéatose hépatique. La délétion hépatique du ChREBP a également entraîné des modifications de l’expression des gènes dans les tissus adipeux blancs et bruns, suggérant une communication inter-tissus. La contribution du ChREPP au bilan énergétique de l’organisme entier peut donc reposer sur sa régulation des espèces lipidiques et/ou de la production d’hépatokines contribuant à la coordination inter-tissulaire de l’homéostasie énergétique (Jois et al., 2017).
Le ChREBP adipeux Relie la lipogenèse à la sensibilité à l’insuline
Une signalisation altérée de l’insuline dans le tissu adipeux est une caractéristique critique de la résistance à l’insuline. Des études ont rapporté que l’activation du ChREBP dans le tissu adipeux blanc peut améliorer l’homéostasie métabolique en produisant des signaux circulants protecteurs (Yore et al., 2014; Tang et coll., 2016). Il a été rapporté qu’une classe de lipides de mammifères caractérisée par une liaison ester ramifiée entre un acide gras et un acide hydroxy-gras, l’acide hydroxylstéarique de l’acide palmitique (PAHSA), exerce des effets bénéfiques sur l’homéostasie du glucose par modulation directe et par incrétine de la fonction des cellules β, de l’absorption du glucose et de la réduction de l’inflammation (Yore et al., 2014). De même, le ChREBP knockout spécifique à l’adipose (ChREBPadiposeKO), qui présente de faibles taux de lipogenèse dans le tissu adipeux, résiste à l’insuline avec une action altérée de l’insuline dans le foie, les muscles et le tissu adipeux blanc dans des conditions de régime alimentaire riche en graisses et en graisses. Les souris ChREBPadiposeKO ont des taux sériques d’AAPAA plus faibles, tandis que la supplémentation en AAPAA, en particulier l’isomère 9-PAHSA, sauve la résistance globale à l’insuline de ChREBPadiposeKO et l’inflammation du tissu adipeux, confirmant que la perte de ChREBP adipeux est suffisante pour provoquer une résistance à l’insuline (Vijayakumar et al., 2017). Une étude récente a identifié la cible mécaniste du complexe de rapamycine 2 (mTORC2) comme un nouveau régulateur du ChREBP (en particulier l’isoforme β) dans les cellules adipeuses. L’ablation spécifique du compagnon insensible à la rapamycine du mTOR (Rictor) dans les adipocytes matures a altéré l’absorption de glucose stimulée par l’insuline dans le tissu adipeux, entraînant une régulation négative du ChREBPß et de l’expression des gènes cibles impliqués dans le contrôle de la lipogenèse (Tang et al., 2016). En accord avec une diaphonie adipeuse–hépatique importante médiée par le ChREBP, ces effets sont associés à une résistance à l’insuline hépatique et à une gluconéogenèse accrue. Dans l’ensemble, ces études soutiennent un rôle important du ChREBP adipeux dans le déclenchement de signaux sensibles à l’insuline (Tang et al., 2016).
Nouvelle interaction Entre la Lipase Hormono-sensible et le ChREBP dans le tissu adipeux
Le ChREBP a récemment été identifié comme partenaire de l’enzyme lipolytique la lipase hormono-sensible (HSL) dans le tissu adipeux (Morigny et al., 2019). Il a été démontré que le knockdown de HSL dans les adipocytes humains et le tissu adipeux de souris augmentait la sensibilité à l’insuline et induisait l’allongement de l’enzyme d’acide gras à très longue chaîne (Elovl6). Elov16 est une enzyme microsomale qui régule l’allongement des acides gras saturés et monoinsaturés en C12-16 de manière dépendante du ChREBP (Morigny et al., 2019). Au niveau mécaniste, l’interaction physique entre HSL et ChREBP a altéré la translocation nucléaire de ChREBPa et l’induction subséquente de gènes ChREBPß et cibles, en particulier Elovl6 (Morigny et al., 2019). Cette étude révèle une nouvelle régulation du ChREBP dans le tissu adipeux. L’inhibition de l’interaction entre HSL et ChREBP peut conduire à des stratégies thérapeutiques potentielles pour améliorer la sensibilité à l’insuline dans les cellules adipeuses.
Conclusion et Orientations futures
Le ChREBP est maintenant un capteur de glucides bien établi. Bien que la plupart des études aient été consacrées à son implication dans le contrôle des voies glycolytiques et lipogéniques, des données récentes ont également révélé de nouvelles contributions du ChREBP dans les hépatocytes et les cellules adipeuses où il pourrait jouer un rôle déterminant dans la production d’hépatokines et / ou de lipokines déclenchant une diaphonie inter-organes. Comme discuté, les co-facteurs (modificateurs épigénétiques) et / ou partenaires (HSL adipeuse) nouvellement identifiés dans ces tissus peuvent également représenter des stratégies thérapeutiques potentielles pour la NAFLD et / ou pour améliorer la sensibilité systémique à l’insuline. Des études récentes ont également soutenu l’importance du ChREBP dans la régulation du métabolisme du fructose et ont souligné la nécessité d’une meilleure compréhension de son rôle et de sa régulation dans l’intestin grêle. Enfin, l’identification de cibles spécifiques et/ou de chevauchements de ChREBPa et de ChREBPß dans les types de cellules clés ainsi que la détermination de leur impact spécifique sur la sensibilité à l’insuline seront d’une importance particulière dans les années à venir.
Contributions des auteurs
Tous les auteurs énumérés ont apporté une contribution substantielle, directe et intellectuelle à l’œuvre et l’ont approuvée pour publication.
Financement
Le laboratoire du Postic (U1016 – Institut Cochin) est soutenu par des subventions du Réseau ChroME (Marie Curie Skłodowska Action H2020-MSCA-ITN-2015-675610), de la Fondation pour la Recherche Médicale (FRM) (DEQ20150331744) et de l’ANR-15-CE14-0026 – Hépatocind.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.