- Introduction
- Résultats
- Le pilote DBH-Cre Marque et se limite aux Régions Noradrénergiques exprimant le TH dans le Tronc cérébral Qui Sont Inhibées par l’administration de CNO
- Perturbation médiée par CNO-hM4D des Neurones noradrénergiques chez des Souris adultes
- La perturbation CNO-hM4D des neurones DBH-Cre Entraîne un Déficit hypercapnique
- Les Témoins Frères Habitués Injectés Avec 10 mg/kg De CNO Ont Montré un Déficit Ventilatoire Hypercapnique
- Les animaux sauvages habitués et non Habités injectés avec une solution Saline N’ont Montré Aucun Changement Présaline et Postsaline
- Les rapports de concentration Clozapine / CNO Sont plus élevés dans le Cerveau que dans le Sérum
- Discussion
- Matériaux et méthodes
- Approbation éthique
- Sélection, Antécédents génétiques et Maintien de souris
- Histologie
- Électrophysiologie
- Pléthysmographie
- Chromatographie en phase liquide – Spectrométrie de masse
- Collecte et analyse des données
- Pléthysmographie
- Statistiques
- Pléthysmographie
- Chromatographie liquide – Spectrométrie de masse
- Déclaration d’éthique
- Contributions des auteurs
- Financement
- Déclaration de conflit d’intérêts
- Remerciements
Introduction
Les réseaux de neurones qui sous-tendent le réflexe chimiosensoriel respiratoire sont une cible principale pour comprendre l’étiologie de plusieurs troubles comportementaux et physiologiques. On suppose que les réflexes chimiosensoriels perturbés jouent un rôle à la fois dans les troubles congénitaux et chez l’adulte, y compris le Syndrome de mort subite du nourrisson (SMSN), le Syndrome d’hypoventilation centrale congénitale (ESCC), les apnées centrales du sommeil, la respiration anormale dans le syndrome de Rett et le syndrome d’hypoventilation de l’obésité (Obonai et al., 1998; Ozawa et coll., 2003; Amiel et coll., 2009; Ramanantsoa et coll., 2011; Lavezzi et coll., 2013). Selon l’hypothèse d’une fausse alarme de suffocation, une activation chimiosensorielle ou une hypersensibilité inappropriée joueraient un rôle chez des sous-groupes de patients souffrant de trouble panique (Klein, 1993). Le dysfonctionnement chimiosensoriel peut également jouer un rôle dans les maladies neurodégénératives par le biais de troubles respiratoires du sommeil associés à une progression accélérée (Hakim et al., 2012; Verbraecken et McNicholas, 2013; Bahia et Pereira, 2015; Snyder et coll., 2017). Ainsi, une meilleure compréhension des réseaux chimiosensoriels du tronc cérébral fournira des indices importants sur un certain nombre de pathologies comportementales et physiologiques.
Récepteurs de synthèse pharmacogénétiques activés exclusivement par des médicaments de synthèse (DREADDs) (Armbruster et al., 2007) ont été utilisés dans un certain nombre d’études pour cartographier les populations neuronales du chimioréflexe respiratoire (réponse respiratoire à des niveaux élevés de CO2 dans le sang). La technologie DREADD en combinaison avec le déploiement génétique intersectionnel a été utilisée pour réduire au silence des populations neuronales hautement ciblées tout en observant la fonction respiratoire chez des souris conscientes et non contraintes par notre laboratoire et d’autres, évitant ainsi de nombreuses confusions des approches de cartographie de circuits antérieures (Ray et al., 2011, 2013; Brust et coll., 2014; Hennessy et coll., 2017; Sun et Ray, 2017; Sun et al., 2017). Ces études, ainsi que la plupart des autres, incluaient presque toujours des témoins de frères et sœurs non-DREADD n’exprimant aucun effet chimiosensoriel ou autre effet respiratoire, arguant que le CNO n’avait aucun effet hors cible sur la respiration chez des souris conscientes et non freinées malgré la dose élevée utilisée, 10 mg / kg. Néanmoins, il a été constaté dans plusieurs autres études que le CNO et ses produits du métabolisme du dos pouvaient avoir des effets hors cible sur le comportement et la locomotion dans une variété de tests, mais la production respiratoire n’a pas été abordée (Guettier et al., 2009; Joober, 2010; MacLaren et coll., 2016; Gomez et coll., 2017; Ilg et coll., 2018; Mahler et Aston-Jones, 2018; Manvich et coll., 2018; Padovan-Hernandez et Knackstedt, 2018). Il a également été démontré que le CNO et ses métabolites ne sont pas répartis de manière équivalente entre le système circulatoire et le cerveau (Gomez et al., 2017).
Une deuxième préoccupation, non traitée, provient du stress induit par le paradigme expérimental, y compris la détention d’animaux dans une chambre de pléthysmographie barométrique du corps entier, la manipulation, l’injection intra-péritonéale et les mesures de température rectale. Dans des études respiratoires antérieures de DREADD, des souris naïves ont été introduites dans une petite chambre (140-400 mls) et autorisées à s’acclimater 20-40 min avant l’acquisition des données (Ray et al., 2011, 2013; Brust et coll., 2014; Hennessy et coll., 2017; Sun et Ray, 2017; Sun et al., 2017). Cependant, il n’est pas clair si ce laps de temps est suffisant pour minimiser les modifications respiratoires induites par le stress qui peuvent agir comme un facteur d’interaction avec les effets de la clozapine.
Dans nos études visant à examiner le rôle du système noradrénergique (NA) dans le contrôle respiratoire, nous avons cherché à utiliser la RC bien établie::Allèle P_hM4D DREADD (Ray et al., 2011) pour tester le rôle des neurones NA dans la respiration de base et hypercapnique chez les animaux adultes non restreints en utilisant une pléthysmographie du corps entier. Parce que les neurones noradrénaline et NA sont également connus pour jouer un rôle central dans les réponses au stress (Valentino et Van Bockstaele, 2008; Chen et al., 2018), nous avons mené une série d’études pour comparer une accoutumance étendue (expositions multiples au paradigme expérimental selon lequel l’animal apprend que l’expérience n’est pas menaçante ou survivable) et une forte vs. faibles doses de CNO (1 mg/kg) avec des protocoles DREADD publiés antérieurement (Ray et al., 2011, 2013; Brust et coll., 2014; Hennessy et coll., 2017; Sun et Ray, 2017; Sun et al., 2017). Ici, nous montrons pour la première fois que des doses systémiques élevées de CNO sont capables de provoquer des effets hors cible sur une fonction respiratoire autonome chez des souris conscientes. Nous révélons également que l’effet hors cible de l’OCN sur la production respiratoire chimiosensorielle est effectivement démasqué par une accoutumance étendue et ne serait donc pas apparent dans les études de contrôle antérieures de l’OCN qui n’habituaient pas les animaux avant la mesure respiratoire, en utilisant seulement une courte période d’acclimatation avant la collecte des données. Ensemble, ces résultats suggèrent que les populations neuronales précédemment cartographiées peuvent affecter indirectement le contrôle respiratoire en jouant un rôle potentiel dans la régulation des réponses au stress. Notamment, ces données concordent avec des rapports récents suggérant que le CNO n’est pas biologiquement inerte à fortes doses par conversion métabolique en clozapine (MacLaren et al., 2016; Gomez et coll., 2017) et que des effets comportementaux hors cible peuvent se manifester non seulement par une perturbation des circuits comportementaux, mais également par des perturbations des circuits autonomes et de l’homéostasie sous-jacents.
Résultats
Le pilote DBH-Cre Marque et se limite aux Régions Noradrénergiques exprimant le TH dans le Tronc cérébral Qui Sont Inhibées par l’administration de CNO
Pour examiner l’expression et la spécificité de la lignée DBH-Cre, nous avons utilisé un schéma de sélection d’une seule recombinase (Figure 1A) dans lequel nous avons croisé le pilote à la lignée Ai9 (Madisen et al., 2010), qui exprime un tdTomato floqué. La coloration avec un anticorps de tyrosine hydroxylase (TH) a révélé que l’expression du tdTomato dans le tronc cérébral était limitée aux régions exprimant le TH, y compris les noyaux locus coeruleus, A5, A1, A2, A7, SubCV et SubCD comme prévu (Figure 1B). Pour confirmer que les neurones NA exprimant le récepteur hM4D répondaient au CNO, nous avons effectué des enregistrements sur les neurones du locus coeruleus (LC), où nous avons observé une inhibition du déclenchement des neurones lors de l’application du bain de CNO (n = 3, Figure 1C).
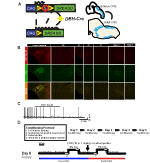
Figure 1. Schémas d’élevage et protocoles respiratoires. Le RC::L’allèle P_hM4D est associé à une lignée dopamine-bêta-hydroxylase (DBH)-Cre pour obtenir une expression spécifique du récepteur hM4D dans les neurones noradrénergiques (NA) (A). Expression fluorescente du tdTomato dans le DBH-Cre; Les sections cérébrales coronales Ai9 co-expriment avec la tyrosine-hydroxylase (TH) dans les noyaux NA du tronc cérébral (B). Dans l’enregistrement en tranches du locus coeruleus NA avant et après l’application de CNO, démontrant la fonctionnalité des récepteurs DREADD dans les neurones ciblés (C). Protocole respiratoire. Les souris habituées sont soumises à un protocole habitué de 5 jours comprenant la manipulation, la mesure de la température de la sonde rectale, l’injection de solution saline et l’exposition à la chambre de pléthysmographie. Le sixième jour, les souris habituées et non habitées subissent un test hypercapnique où l’animal est placé dans la chambre respiratoire et autorisé à s’acclimater dans des conditions d’air ambiant de base. L’animal est ensuite exposé à 20 min de CO2 à 5% suivi de 20 min d’air ambiant. L’animal est ensuite injecté par voie intrapéritonéale avec du CNO ou une solution saline, suivi de 20 minutes supplémentaires d’air ambiant post-injection, de 20 minutes de CO2 à 5% et de 20 minutes d’air ambiant. Les cases ouvertes délimitent les temps de collecte des données (D).
Perturbation médiée par CNO-hM4D des Neurones noradrénergiques chez des Souris adultes
Pour examiner le rôle des neurones NA sous la respiration de base et hypercapnique, nous avons utilisé le système DREADD inhibiteur RC: P_hM4D croisé avec le pilote DBH-Cre. En utilisant la pléthysmographie du corps entier (Ray et al., 2011), nous avons mesuré les réponses ventilatoires d’animaux adultes non retenus dans des conditions d’air ambiant (21% O2 / 79% N2) et hypercapniques (5% CO2 / 21% O2 / 74% N2) avant et après l’administration de CNO (Figure 1D). Pour répondre à la dose de CNO et au stress potentiel induit par notre conception expérimentale, les animaux ont été soumis à l’une des quatre conditions suivantes: (1) non habitée et injectée avec 10 mg / kg de CNO; (2) habituée et injectée avec 10 mg / kg de CNO; (3) non habitée et injectée avec 1 mg / kg de CNO; ou (4) habituée et injectée avec 1 mg / kg de CNO. L’habituation a consisté en un processus de 5 jours impliquant une manipulation, une sonde de température rectale, une injection de solution saline et une exposition à la chambre de pléthysmographie chaque jour pendant 30 min, tandis que les animaux naïfs n’ont été exposés qu’à une période d’acclimatation en chambre de 20 à 45 min immédiatement avant la collecte des données, comme cela a été fait dans des études antérieures (Ray et al., 2011, 2013; Brust et coll., 2014; Hennessy et coll., 2017; Sun et Ray, 2017; Sun et al., 2017). Les paramètres respiratoires mesurés comprenaient la fréquence respiratoire RR, le volume courant (VT), la ventilation minute (VE), la consommation d’oxygène (VO2), la ventilation minute normalisée à la consommation d’oxygène (VE / VO2), la fréquence d’apnée, la fréquence des soupirs et les coefficients de variation de l’intervalle et de l’amplitude intercalaires (instabilité périodique et volumique). Comme témoin supplémentaire, nous avons également comparé des animaux sauvages habitués et non habités injectés avec une solution saline.
La perturbation CNO-hM4D des neurones DBH-Cre Entraîne un Déficit hypercapnique
Dans trois des conditions, DBH-Cre; RC::Les animaux P_hM4D ont montré une réduction de VE et VE / VO2 après l’administration de CNO, tandis que les témoins frères n’ont montré aucune différence dans les valeurs pré et post-CNO. Les animaux non habités injectés avec 10 mg / kg de CNO ont montré une réduction significative de la RR (-12,17%, p = 0,034) et de la VT (-30,87%, p = 0,0016), entraînant une réduction de l’VE (-38,64%, p = 0,0031) et une légère réduction de la VO2 (-14,25%, p = 0,042) (Figure 2). La réduction de VE était supérieure à la diminution de VO2, entraînant une réduction globale de VE/VO2 (-26,89%, p = 0,0095). Les animaux non habités injectés avec 1 mg / kg de CNO ont montré une tendance à une réduction de la RR (-12,88 %, p = 0,066) et à une réduction significative de la VT (-16,52%, p = 0,00085) et de l’VE (-28,08%, p = 0,0070), conduisant à une réduction globale de la VE / VO2 (-22,23%, p = 0,016) (Figure 3). Enfin, les animaux habitués injectés avec 1 mg / kg de CNO ont montré une réduction du RR (-10,77%, p = 0,074), une tendance à une diminution de l’VE (-25,07%, p = 0,074) et une réduction globale de l’VE / VO2 (-23,70%, p = 0,024) (Figure 4). Aucun changement significatif de la fréquence de l’apnée, de la fréquence des soupirs, de l’instabilité périodique ou volumique ou de la température n’a été observé dans aucune cohorte.
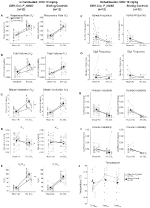
Figure 2. DBH-Cre non habitée; RC::P_hM4D les animaux administrés à 10 mg/kg de CNO présentent un déficit hypercapnique tandis que les témoins de la fratrie ne montrent aucun changement. Après administration du CNO, DBH-Cre; RC::P_hM4D les animaux ne montrent aucun changement dans la ventilation de l’air ambiant et des réductions de RR(A), VT(B), VE (C), VO2 (D) et VE /VO2 (E) dans des conditions hypercapniques sans changement de fréquence d’apnée (F), de fréquence de soupir (G), d’instabilité périodique (H) ou volumique (I) et de température (J). Les contrôles de frères et sœurs n’ont montré aucune différence dans toutes les valeurs pré- et post-CNO.
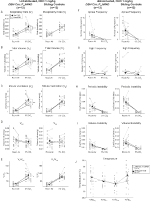
Figure 3. DBH-Cre non habitée; RC::P_hM4D les animaux administrés à 1 mg/kg de CNO présentent un déficit hypercapnique tandis que les témoins de la fratrie ne montrent aucun changement. Après administration du CNO, DBH-Cre; RC::Les animaux P_hM4D ne montrent aucun changement significatif dans la ventilation de l’air ambiant ou RR(A) et ont montré des réductions de VT(B), VE(C) et VE/VO2(E) dans des conditions hypercapniques sans changement de VO2 (D), de fréquence d’apnée (F), de fréquence de soupir (G), d’instabilité périodique (H) ou volumique (I) et de température (J). Les contrôles de frères et sœurs n’ont montré aucune différence dans toutes les valeurs pré- et post-CNO.
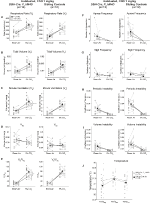
Figure 4. Les animaux DBH-Cre habitués; RC::P_hM4D administrés à 1 mg/kg de CNO présentent un déficit hypercapnique tandis que les témoins de la fratrie ne montrent aucun changement. Après administration du CNO, DBH-Cre; Les animaux RC::P_hM4D ne montrent aucun changement dans la ventilation de l’air ambiant et une réduction de RR(A) et VE/VO2(E) dans des conditions hypercapniques sans changements significatifs de VT (B), VE (C), VO2 (D), fréquence d’apnée (F), fréquence de soupir (G), instabilité périodique (H) ou volumique (I) et température (J). Les contrôles de frères et sœurs n’ont montré aucune différence dans toutes les valeurs pré- et post-CNO.
Les Témoins Frères Habitués Injectés Avec 10 mg/kg De CNO Ont Montré un Déficit Ventilatoire Hypercapnique
Dans les deux DBH-Cre; RC::P_hM4D et chez les animaux témoins habitués à recevoir 10 mg /kg de CNO, nous avons noté une réduction significative de VE /VO2 (p = 0,0235) médiée par des diminutions de RR (p = 0,00036) et de VE (p = 0,037) (Figure 5). Cependant, contrairement aux autres cohortes, il n’y avait pas de différence entre DBH-Cre; RC::P_hM4D et les animaux témoins frères dans ces paramètres: RR (-12,72 vs -10,22%, p = 0,6268), VE (-24,88 vs -23,94%, p = 0,4150), ou VE/VO2 (-15,4 vs -22,55%, p = 0,4643 ).
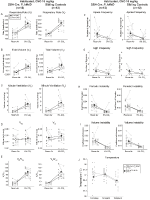
Figure 5. Les deux DBH-Cre habitués; RC::Les animaux P_hM4D et les témoins frères et sœurs administrés à 10 mg /kg de CNO présentent un déficit hypercapnique. Après administration de CNO, DBH-Cre; RC::P_hM4D les animaux et les témoins de la fratrie ne montrent aucun changement dans la ventilation de l’air ambiant et une réduction de RR(A), VE(C) et VE/VO2(E) dans des conditions hypercapniques sans changements significatifs de VT (B), VO2(D), fréquence d’apnée (F), fréquence de soupir (G), instabilité périodique (H) ou volumique (I) et température (J).
Les animaux sauvages habitués et non Habités injectés avec une solution Saline N’ont Montré Aucun Changement Présaline et Postsaline
Bien qu’aucun phénotype n’ait été observé chez les témoins injectés avec 1 mg / kg de CNO, nous avons abordé la possibilité que l’injection elle-même provoque le phénotype observé chez les témoins injectés avec 10 mg / kg de CNO en testant des animaux sauvages habitués et non habités injectés avec une solution saline (Figure 6). Dans les cohortes habituées et non habitées, les animaux n’ont montré aucune différence dans les paramètres respiratoires administration présaline et postsaline. Aucun changement significatif de la fréquence de l’apnée, de la fréquence des soupirs, de l’instabilité périodique ou volumique ou de la température n’a été observé.
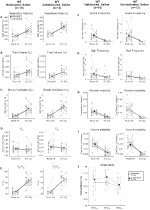
Figure 6. Tant les animaux sauvages non habités que les animaux de type sauvage habitués auxquels une solution saline a été administrée ne montrent aucune différence entre les valeurs avant et après l’injection. Après administration d’une solution saline, les animaux sauvages non habités et habitués n’ont montré aucun changement dans l’air ambiant ou les conditions hypercapniques en RR(A), VT(B), VE(C), VO2 (D), VE/VO2 (E), fréquence d’apnée (F), fréquence de soupir (G), instabilité périodique (H) ou volumique (I) et température (J).
Les rapports de concentration Clozapine / CNO Sont plus élevés dans le Cerveau que dans le Sérum
Pour déterminer la biodisponibilité du CNO et de la clozapine, nous avons mesuré leurs concentrations dans le sérum et le cerveau par spectrométrie de masse. Trente minutes après une injection intrapéritonéale de CNO chez des souris, l’abondance relative de CNO est plus faible que celle de son métabolite arrière clozapine dans le sérum et le cerveau pour toutes les doses testées, soit 0,1 mg/kg (sérum p = 0,0054, cerveau p = 0,0001) (Figure 7A), 1 mg/kg (sérum p > 0,05, cerveau p = 0,0197) (Figure 7B) et 10 mg/kg (sérum p = 0,0001). 0,0036, cerveau p = 0.0005) (figure 7C). Lorsque les rapports globaux clozapine / CNO ont été analysés, ils étaient toujours supérieurs à zéro et étaient plus élevés dans le cerveau que dans le sérum (véhicule p > 0,5, 0,1 mg / kg p > 0,5, 1 mg / kg p = 0,0018, 10 mg / kg p = 0,0160) (figure 7D).
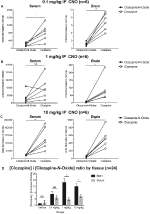
Figure 7. Les rapports de concentrations de Clozapine sur CNO sont plus élevés dans le cerveau que dans le sérum. Des échantillons de sérum et de cerveau ont été prélevés sur des souris de type sauvage 30 min après l’administration de CNO à 3 doses différentes 0,1 mg / kg (A), 1 mg / kg (B), 10 mg / kg (C). Les points de données individuels représentent l’abondance relative de clozapine-N-oxyde ou de clozapine obtenue par LC-MS. Le rapport Clozapine/CNO pour chaque dose et le MEB sont également indiqués (D).
Discussion
L’objectif initial de cette étude était d’examiner le rôle des neurones DBH-Cre dans la physiologie respiratoire après une perturbation aiguë chez des animaux adultes non restreints et conscients. Parce que les neurones noradrénaline et NA jouent un rôle bien documenté dans les comportements de stress (Valentino et Van Bockstaele, 2008; Chen et al., 2018), nous avons également cherché à examiner si l’accoutumance à un protocole physiologique probablement stressant aurait un effet sur les phénotypes respiratoires précédemment observés. Dans le protocole DREADD de pléthysmographie du corps entier utilisé dans notre laboratoire et dans d’autres, les animaux sont manipulés, sondés par voie rectale pour la température, exposés à un nouvel environnement (la chambre de pléthysmographie) et injectés par voie intrapéritonéale. Des études antérieures ont montré que la manipulation et l’accoutumance à l’injection et à d’autres procédures « de routine » peuvent modifier les paramètres comportementaux et physiologiques, y compris la respiration (Misslin et al., 1982; Andrews et File, 1993; Lapin, 1995; Ryabinin et coll., 1999). D’autres facteurs de stress appliqués modifient également la respiration dans des conditions ventilatoires de base et hypercapniques (Isom et Elshowihy, 1982; Kinkead et al., 2001).
Dans nos études utilisant des doses élevées de CNO, nous avons constaté que l’inhibition médiée par le hM4D des neurones NA définis par le DBH-Cre entraînait une réduction du réflexe hypercapnique dans VE / VO2 dans quatre cohortes expérimentales définies, avec une réduction de la RR, de la VT et de l’VE, soutenant des études antérieures (Biancardi et al., 2008; Viemari, 2008; Gargaglioni et coll., 2010). Cependant, des témoins frères habitués recevant une dose de 10 mg / kg de CNO utilisée dans des études respiratoires antérieures ont montré un déficit ventilatoire dans des conditions hypercapniques de la même ampleur que celui observé chez les animaux DBH-Cre; RC::P_hM4D. Aucun autre groupe témoin frère n’a montré ce phénotype, y compris la cohorte habituée qui n’a reçu que (1 mg / kg de CNO) ou une solution saline. Ces résultats suggèrent que des doses plus élevées de CNO (10 mg / kg) ont un effet sur la réponse hypercapnique qui est démasquée après une accoutumance étendue tout en réduisant vraisemblablement les niveaux de stress chez l’animal, et que des doses plus faibles de CNO n’ont pas d’effet sur le contrôle respiratoire chez les animaux habitués. Ces résultats sont également en accord avec les travaux de Korsak et coll. l’oms a démontré qu’une faible dose d’OCN (2 mg/kg) ne produit pas d’effets hors cible sur la capacité de travail lors d’un test d’exercice qui comprenait un entraînement préalable (Korsak et al., 2018) et Fleury Curado et coll. l’OMS n’a montré aucun effet spécifique de la CNO à faible dose (1 mg/ kg) sur le débit respiratoire (Fleury Curado et al., 2018).
Les rapports accrus des taux de clozapine et de CNO dans le sérum et dans le cerveau (figure 7) sont en accord avec des études récentes qui suggèrent que le CNO est facilement métabolisé en clozapine et montre une plus grande perméabilité cérébrale par rapport au CNO chez la souris et ailleurs (Jann et al., 1994; Chang et coll., 1998; Guettier et coll., 2009; Gomez et coll., 2017; Raper et coll., 2017). Cependant, il n’est pas clair si les effets hors cible observés sont dus au CNO ou à la clozapine. Comme nos mesures hypercapniques ont eu lieu < 30 min après l’application de CNO, il est probable que les effets respiratoires hors cible sont médiés par la clozapine. Nos résultats (figure 7) montrent des niveaux relatifs élevés de clozapine dans le cerveau, bien que le CNO ne soit pas complètement absent. Cependant, Huckstepp et ses collègues ont utilisé l’application directe de CNO sur la moelle ventrale chez des rats anesthésiés pour démontrer que l’application de CNO n’a qu’un faible effet, augmentant la fréquence et diminuant la durée expiratoire, mais laissant la TV inchangée, sans effet clair observé pendant l’hypercapnie (Huckstepp et al., 2015). Compte tenu de l’application directe chez les rats anesthésiés et du laps de temps des expériences, il est probable que les petits effets hors cible observés ont été médiés par CNO et non par la clozapine.
Le métabolite arrière clozapine est un médicament sédatif et antipsychotique couramment utilisé dans la schizophrénie avec de nombreuses cibles endogènes, y compris des actions antagonistes de faible affinité au niveau des récepteurs dopaminergiques D1, D2 et D4, des récepteurs sérotoninergiques 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 et 5-HT7, des récepteurs histaminiques H1 et des récepteurs adrénergiques α1 et α2, entre autres (Fitton et Heel, 1990; Ashby et Wang, 1996). Les effets hors cible observés ici peuvent résulter de mécanismes et de cibles distincts ou combinés. La clozapine peut affecter la respiration en tant que sédatif. Une étude antérieure a montré une réduction de la RR et de la VT sous 5 et 10% de CO2 pendant les états de sommeil à ondes lentes et de sommeil à mouvements oculaires rapides par rapport à l’état d’éveil silencieux chez la souris (Nakamura et al., 2007). Alternativement, l’inhibition des neurones exprimant les DREADD ciblés peut entraîner un effet antianxiogène ou anxiolytique similaire à notre protocole d’accoutumance pour révéler des effets chimiosensoriels hors cible médiés par la CNO / clozapine. Les deux explications sont étayées par plusieurs études ayant montré que le CO2 jouait un rôle dans les réponses de peur innées et apprises et les comportements liés à l’anxiété (Ziemann et al., 2009; Feinstein et coll., 2013; Taugher et coll., 2014; Dlouhy et coll., 2015; Winter et coll., 2017). Ainsi, les neurones ciblés dans certaines de ces études peuvent en effet jouer un rôle dans la conduite des réponses comportementales anxiogènes plutôt que des réflexes chimiosensoriels physiologiques, car les systèmes catécholaminergiques et sérotoninergiques sont impliqués dans les comportements de peur / anxiété et l’homéostasie chimiosensorielle (Brust et al., 2014; Hennessy et coll., 2017).
Inversement, les phénotypes chimiosensoriels observés avec des niveaux élevés de CNO peuvent être authentiques, car nous avons pu récapituler le déficit hypercapnique médié par le NA aux doses de CNO, une magnitude d’ordre plus faible chez les souris habituées, tandis que les groupes témoins n’ont montré aucun effet CNO. Cependant, les comparaisons complètes entre les études antérieures sont difficiles en raison de l’absence, dans certains cas, de données sur la VO2, la VT, la RR et la VE/VO2 rapportées. Par exemple, les changements de la température corporelle ou du taux métabolique peuvent également influer de plusieurs façons sur la production respiratoire et chimiosensorielle, et que les températures de la chambre de pléthysmographie étaient très différentes dans certains cas (34 contre 30 ° C dans nos études), affectant la plage dynamique de la composante barométrique de la forme d’onde et donc le volume courant. Notamment, nous n’avons constaté aucun changement appréciable des caractéristiques de la forme d’onde respiratoire dans aucune de nos affections ni d’arrêt cardio-respiratoire aigu observé lors de nos études antérieures sur les rhombomères entiers à forte dose (Sun et al., 2017).
Nos résultats montrent pour la première fois que le CNO a un effet inattendu sur le réflexe chimiosensoriel hypercapnique qui est démasqué par une accoutumance étendue. Fait important, malgré des niveaux élevés, un effet hors cible du CNO avait déjà été exclu en raison de l’absence de phénotype chez les témoins frères, mais que nous montrons devient clair lors de l’accoutumance. Nous proposons une caractérisation hors cible de CNO dans le système de modèle murin pour compléter les études chez le rat et les primates non humains. Les résultats ici soulèvent la possibilité que des effets supplémentaires médiés par des CNO, hors cible, sur les circuits étudiés ou sur les circuits autonomes ou homéostatiques puissent exister mais peuvent être masqués dans d’autres expériences contrôlées. Fait important, ces données révèlent que les chercheurs devraient s’efforcer d’utiliser les doses minimales du ligand activateur possibles en combinaison avec des niveaux élevés d’accoutumance, et que les contrôles appropriés doivent être inclus dans les manipulations génétiques chimiques pour apprécier et interpréter pleinement les données expérimentales.
Matériaux et méthodes
Approbation éthique
Les études ont été approuvées par le Baylor College of Medicine Institutional Animal Care and Use Committee en vertu du protocole AN-6171.
Sélection, Antécédents génétiques et Maintien de souris
Nous avons maintenu des colonies de toutes nos souches de souris hétérozygotes par rétrocroisement vers des souris C57BL/6J et des souches homozygotes par croisements frères. Pour les expériences d’histologie, le DBH-Cremice a été accouplé avec la souris homozygote Ai9 (Madisen et al., 2010) (JAX 007909). Pour les expériences de pléthysmographie, des souris DBH-Cre ont été accouplées avec RC::P_hM4D homozygote (Ray et al., 2011) pour dériver des animaux, chez lesquels toutes les souris portaient l’allèle RC::P_hM4D. Les animaux frères qui n’héritaient pas de l’allèle Cre ont été utilisés comme animaux témoins pour la progéniture positive Cre. Les amorces spécifiques Rosa26 pour les souris Ai9, RC::P_hM4D et RC::ePe étaient de 5′-GCACTTGCTCTCCCAAAGTC, 5′-GGGCGTACTTGGCATATGAT et 5′-CTTTAAGCCTGCCAGAAGA et donnent une bande de 495 pb (ciblée) et 330 pb (poids). Les amorces spécifiques au Cre pour tous les conducteurs de Cre rhombomères étaient de 5′-ATCGCCATCTTCCAGGCGCACCATTGCCC et de 5′-GCATTTCTGGGGATTGCTTA et donnaient une bande de 550 pb si elle était positive. Pour les expériences LC-MS, des souris C57BL / 6J ont été obtenues du Centre de médecine comparée (CCM) du Baylor College of Medicine.
Histologie
DBH-Cre de quatre à huit semaines; Des souris adultes Ai9 ont été perfusées par voie transcardiale avec une solution saline tamponnée au phosphate (PBS) de 0,1 M, puis avec du paraformaldéhyde (PFA) à 4% dans le PBS. Les cerveaux ont été disséqués et déposés pendant 2 h dans du PFA à 4% avant un rinçage au PBS et une équilibration dans du saccharose à 20% dans du PBS. Les cerveaux ont ensuite été sectionnés en sections de 30 µm, montés sur des lames et marqués avec des anticorps immunofluorescents. Nous avons coloré pendant une nuit avec un anticorps anti-tyrosine hydroxylase pour identifier les neurones catécholaminergiques (1: 1 000, Millipore AB152) suivi de 2 h avec un secondaire Cy3 anti-lapin d’âne (1: 500, Jackson 711-165-152) dans du Triton-X à 0,1% dans du PBS (PBST) avec du sérum d’âne à 5%. Les images ont été collectées sur un microscope épifluorescent vertical Zeiss.
Électrophysiologie
Des tranches de cerveau horizontales contenant le locus coeruleus (300 µm) ont été découpées avec un vibratome (Leica VT 1000S, Leica Microsystems, Buffalo Grove, IL) de souris adultes DBH-Cre; RR2P; RC::ePe (~ 1 mois) dans du liquide céphalo-rachidien artificiel (ACSF) à 4 °C. Les tranches ont été immergées dans une chambre perfusée avec de l’ACSF oxygéné (95% O2 et 5% CO2) contenant en mM : 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 et 10 glucose (2-3 ml/min). Des enregistrements de cellules entières ont été effectués à 30°C en utilisant des techniques conventionnelles de patch-clamp et un amplificateur MultiClamp 700B (Molecular Devices, Union City, CA). Les neurones positifs au GFP du locus coeruleus ont été identifiés visuellement et ensuite imagés par vidéo de contraste d’interférence différentielle infrarouge sur la scène d’un microscope vertical (Axioskope FS2, Carl Zeiss, Oberkochen, Allemagne). Les pipettes Patch (résistances 4-6 MU) ont été remplies de (en mM): 110 K-gluconate, 10 KCI, 10 HEPES, 10 Na2-phosphocréatine, 2 Mg3-ATP et 0,2 Na3-GTP; Le pH a été ajusté à 7,2 et l’osmolarité à 300 mOsm. Le potentiel de détention était de -70 mV. CNO a été appliqué au bain.
Pléthysmographie
La pléthysmographie sur des souris conscientes et non retenues a été réalisée comme décrit sur des animaux adultes âgés de 6 à 12 semaines (Ray et al., 2011). Les souris habituées ont été soumises à un protocole d’accoutumance de 5 jours comprenant chaque jour plusieurs minutes de manipulation, une prise de température par sonde rectale, une injection de solution saline intrapéritonéale et 30 minutes dans la chambre de pléthysmographie. Les souris ont ensuite été testées dans la semaine 1 suivant le dernier jour d’accoutumance. Les souris non habitées n’ont pas été exposées à la manipulation ou à la chambre de pléthysmographie. Toutes les souris étaient naïves envers CNO et utilisées une seule fois.
Le jour du test, des souris ont été prises dans leur cage d’origine, pesées et la température rectale a été prise. Les animaux ont ensuite été placés dans une chambre de pléthysmographie à température contrôlée (enveloppe d’eau à 30 ° C) et autorisés à s’acclimater pendant au moins 20 min dans des conditions d’air ambiant (21% O2 / 79% N2). Après acclimatation et mesure sous air ambiant, le gaz de chambre a été commuté sur un mélange hypercapnique de 5% CO2 / 21% O2 / 74% N2 pendant 20 min. Le gaz de chambre a ensuite été remis à l’air ambiant pendant 20 min. Les souris ont été brièvement enlevées pour la mesure de la température rectale et l’injection intra-péritonéale de CNO (National Institute of Mental Health Chemical Synthesis and Drug Supply Program) dissous dans une solution saline (1 ou 0,1 mg / ml) pour une concentration efficace de 10 ou 1 mg / kg, respectivement. L’animal a été renvoyé dans la chambre pendant encore 20 minutes d’air ambiant, 20 minutes d’hypercapnie et 20 minutes d’air ambiant. L’animal a ensuite été retiré de la chambre et la température rectale a été prise immédiatement après la fin de l’expérience.
Chromatographie en phase liquide – Spectrométrie de masse
Vingt-quatre souris de type sauvage, divisées uniformément par sexe, ont été pesées et traitées avec 10 mg / kg de CNO, 1 mg / kg de CNO, 0,1 mg / kg de CNO ou véhicule. Trente minutes après l’injection, des échantillons de sang ont été prélevés par ponction cardiaque et placés dans des microtainers BD. Les échantillons ont été centrifugés à 4°C à 13 500 tr/min dans une centrifugeuse de paillasse et des surnageants ont été collectés. Le sérum et le cerveau ont été maintenus à -20°C jusqu’à l’extraction.
Solvants de qualité HPLC l’eau, l’acétonitrile chloroforme, le méthanol et l’acide formique de qualité spectrométrie de masse ont été obtenus à partir de Sigma-Aldrich (St. Louis, MO). Une solution d’étalonnage contenant plusieurs calibres dans une solution d’acétonitrile, d’acide trifluoracétique et d’eau a été achetée à Agilent Technologies (Santa Cruz, CA). Les métabolites et les étalons internes, y compris l’acide N-acétyl-aspartique – d3, le tryptophane-15N2, l’acide glutamique-d5, la thymine-d4, l’acide gibbérellique, la trans-zéatine, l’acide jasmonique, l’acide 15N anthranilique et la testostérone-d3, ont été achetés auprès de Sigma-Aldrich (St. Louis, MO). Le Microtainer R SST TM a été obtenu auprès de Becton Dickinson (Franklin Lakes, New Jersey).
L’extraction consistait en 750 µl de méthanol: eau glacée (4: 1) contenant des étalons internes dopés de 20 µl qui ont été ajoutés à chaque échantillon de cerveau (50 mg) et aux contrôles de qualité, puis ont été homogénéisés pendant 1 min chacun. Ensuite, 750 µl d’acétonitrile à 100% contenant des étalons internes dopés à 20 µl ont été ajoutés à l’échantillon de lavage (100 µl) et aux contrôles de qualité, puis soniqués pendant 5 min. Tous les échantillons ont été centrifugés à 5000 tr/min pendant 10 min à 4°C. Le surnageant résultant a été collecté et 20 µl ont été injectés dans LC-MS.
Tous les échantillons ont été analysés à l’aide de 6 490 spectromètres de masse triples quadripolaires (Agilent Technologies, Santa Clara, CA) couplés au système HPLC (Agilent Technologies, Santa Clara, CA) par surveillance de réactions multiples (MRM). Environ 8 à 11 points de données ont été acquis par métabolite détecté. Les métabolites détectés étaient la clozapine, le CNO et la norclozapine (N-desméthyl clozapine). Le mode positif ESI a été utilisé dans la méthode. La colonne HPLC était la colonne ACQUITUPLC C18 (100 Å, 1,8 µm et 2,1 mm × 100 mm. Milford, MA, USA) avec un débit de 0,5 ml/min.
Collecte et analyse des données
Pléthysmographie
Les variations de pression de Pléthysmographie ont été mesurées à l’aide d’un transducteur de pression différentielle Validyne DP45 et d’une chambre de référence et d’un démodulateur de porteuse CD15 et enregistrées avec LabChartPro en temps réel. Les formes d’onde ont été analysées hors ligne à l’aide de LabChartPro et d’un code MATLAB écrit sur mesure pour déterminer la fréquence respiratoire (RR), le volume courant (VT) (Ray et al., 2011), ventilation minute (VE) et analyse des modèles. Les formes d’ondes respiratoires ont été collectées hors ligne pendant les périodes où l’animal était au repos, et les lectures étaient exemptes d’artefacts de mouvement. Un minimum de 1 min de données cumulatives compilées à partir de traces d’au moins 10 s de long à partir des 10 dernières minutes d’une condition expérimentale donnée ont été analysées. La consommation d’O2 a été déterminée en comparant la composition du gaz entre l’étalonnage dans une chambre vide et la respiration vivante à l’aide d’un capteur et d’un analyseur d’oxygène AEI. La température de la chambre a été constamment surveillée à l’aide d’un MicroThermo 2 et d’une sonde ThermoWorks et a été enregistrée avec LabChartPro en temps réel.
Les mesures de Poincaré et la fréquence des soupirs et des apnées ont été déterminées en utilisant 1 min de traces de mouvement de chaque condition respiratoire. Les soupirs étaient définis comme une respiration dont l’amplitude était au moins deux fois plus grande que la respiration moyenne. Les apnées ont été définies comme un intervalle entre les respirations (IBI) au moins deux fois plus grand que l’IBI moyen. Le coefficient de variation (CV) de l’IBI et de l’amplitude a également été calculé à partir de la même compilation de traces de 1 min de chaque condition respiratoire (erreur type IBI ou amplitude / IBI ou amplitude moyenne).
Statistiques
Pléthysmographie
Les résultats (RR, VT, VE, VO2, VE/VO2, nombre d’apnées et de soupirs, et CV d’IBI et d’amplitude) pour l’air ambiant et les données hypercapniques ont été comparés entre les cohortes DBH-Cre; RC::P_hM4D et les témoins frères en utilisant un modèle de régression linéaire à effets mixtes avec type d’animal (expérimental contre le contrôle) et l’administration de CNO (avant et après l’injection) en tant qu’effets fixes et l’identification de l’animal en tant qu’effet aléatoire. Les données de température ont été comparées à l’aide d’un modèle de régression linéaire à effets mixtes avec le type d’animal (expérimental vs témoin) comme effet fixe. Un p < 0,05 a été utilisé pour indiquer la signification statistique, et les points de données individuels, la moyenne et l’erreur type de la moyenne sont indiqués sur toutes les cartes.
Chromatographie liquide – Spectrométrie de masse
La surface obtenue sous le pic pour chaque échantillon a été normalisée par le contrôle interne puis au véhicule avant analyse statistique. Un test t non apparié a été utilisé pour comparer l’abondance relative de clozapine et de CNO dans chaque tissu par groupe de concentration.
Déclaration d’éthique
Toutes les expériences ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux du Baylor College of Medicine. Les expériences étaient conformes aux normes nationales pour le soin et l’utilisation des animaux de laboratoire établies par l’Association pour l’Évaluation et l’accréditation des Soins aux Animaux de laboratoire.
Contributions des auteurs
JS, FS-M, MC-M et RR ont conçu et conçu les expériences. JS, FS-M et PZ ont effectué les expériences et contribué à l’analyse des données. JS, FS-M, VM, MC-M et RR ont écrit le document.
Financement
Cette étude a été soutenue par les subventions R01HL130249 et R01HL130249-S1 du National Heart, Lung, and Blood Institute; March of Dimes Basil O’Connor Award; et le McNair Medical Institute.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions les Drs Shaila K. Mani et Benjamin Arenkiel pour leurs discussions utiles. Nous remercions également le centre central de protéomique du Baylor College of Medicine pour l’exécution de la chromatographie liquide – Spectrométrie de masse.
Amiel, J., Dubreuil, V., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B dans le contrôle respiratoire: leçons du syndrome d’hypoventilation centrale congénitale et de ses modèles murins. Respirez. Physiol. Neurobiol. 168, 125–132. doi: 10.1016/j. adm.2009.03.005
CrossRef Texte intégral / Google Scholar
Andrews, N., et File, S. E. (1993). La manipulation des antécédents de rats modifie les effets comportementaux des médicaments dans le test d’anxiété élevé plus-maze. EUR. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S. et Roth, B. L. (2007). Faire évoluer la serrure pour l’adapter à la clé afin de créer une famille de récepteurs couplés à la protéine G activés par un ligand inerte. Proc. Natl. Acad. Sci. États-Unis 104, 5163-5168. doi: 10.1073/pnas.0700293104
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Ashby, C. R., et Wang, R. Y. (1996). Actions pharmacologiques du médicament antipsychotique atypique clozapine: une revue. Synapse 24, 349-394. doi: 10.1002 / (SICI)1098-2396(199612)24:4<349:: AID-SYN5 >3.0.CO ; 2-D
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit de la première édition de la série. Apnée obstructive du sommeil et maladies neurodégénératives: une relation bidirectionnelle. Dement. Neuropsychol. 9, 9–15. doi: 10.1590/S1980-57642015DN91000003
Résumé PubMed / Texte intégral Croisé / Google Scholar
Biancardi, V., Bícego, K. C., Almeida, M. C. et Gargaglioni, L. H. (2008). Locus coeruleus les neurones noradrénergiques et le CO2 conduisent à la respiration. Arc de Pflugers. – EUR. J. Physiol. 455, 1119–1128. doi: 10.1007/s00424-007-0338-8
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit de l’un des principaux facteurs de risque de la maladie de Parkinson et de la maladie de Parkinson. Identification fonctionnelle et développementale d’un sous-type moléculaire de neurone sérotoninergique cérébral spécialisé dans la régulation de la dynamique respiratoire. Cellule Rep. 9, 2152-2165. doi: 10.1016/ j. celrep.2014.11.027
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Chang, W. H., Lin, S. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Métabolisme réversible de la clozapine et de la clozapine N-oxyde chez les patients schizophrènes. Prog. Neuro-Psychopharmacol. Biol. Psychiatrie 22, 723-739. doi: 10.1016 / L0278-5846(98)00035-9
Résumé PubMed / Texte intégral Croisé / Google Scholar
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Identification génétique d’une population de neurones noradrénergiques impliqués dans l’atténuation des réponses liées au stress. Mol. Psychiatrie 1-16. doi: 10.1038/s41380-018-0245-8
Résumé PubMed / Texte intégral Croisé / Google Scholar
Dlouhy, B. J., Gehlbach, B. K., Kreple, C. J., Kawasaki, H., Oya, H., Buzza, C., et al. (2015). La respiration est inhibée lorsque les crises se propagent à l’amygdale et lors de la stimulation de l’amygdale. J. Neurosci. 35, 10281–10289. doi: 10.1523/JNEUROSCI.0888-15.2015
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Feinstein, J. S., Buzza, C., Hurlemann, R., Follmer, R. L., Dahdaleh, N.s., Coryell, W. H., et al. (2013). Peur et panique chez les humains atteints de lésions amygdales bilatérales. NAT. Neurosci. 16, 270–272. doi: 10.1038/nn.3323
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Fitton, A., et Heel, R. C. (1990). Clozapine. Un examen de ses propriétés pharmacologiques et de son utilisation thérapeutique dans la schizophrénie. Médicaments 40, 722-747. doi: 10.2165/00003495-199040050-00007
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Les résultats de cette étude sont les suivants : (2018). Le silence des motoneurones hypoglossaux entraîne des troubles respiratoires du sommeil chez les souris maigres. Devant. Neurol. 9:962. doi: 10.3389 / fneur.2018.00962
CrossRef Texte intégral / Google Scholar
D., L. H., Hartzler, L. K., et Putnam, R.W. (2010). Le locus coeruleus et la chimiosensibilité centrale. Respirez. Physiol. Neurobiol. 173, 264–273. doi: 10.1016/j. adm.2010.04.024
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). La chimiogénétique a révélé: l’occupation et l’activation des DREADD via la clozapine convertie. Science 357, 503-507. doi: 10.1126 / science.aan2475
Résumé PubMed / Texte intégral Croisé / Google Scholar
Guettier, J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). A chemical-genetic approach to study G protein regulation of beta cell function in vivo. Proc. Natl. Acad. Sci. États-Unis 106, 19197-19202. doi: 10.1073/pnas.0906593106
CrossRef Texte intégral / Google Scholar
Hakim, F., Gozal, D., et Kheirandish-Gozal, L. (2012). Altérations sympathiques et catécholaminergiques de l’apnée du sommeil avec un accent particulier sur les enfants. Devant. Neurol. 3:7. doi: 10.3389 / fneur.2012.00007
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Les résultats de cette étude ont été publiés en 2017. L’activité des neurones du raphé Pet1 exprimant la Tachykinine1 module le chimioréflexe respiratoire. J. Neurosci. 37, 1807–1819. doi: 10.1523/JNEUROSCI.2316-16.2016
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit de l’un des plus grands ouvrages de l’histoire de l’art et de l’histoire de l’Art. Rôle des noyaux parafaciaux dans le contrôle de la respiration chez les rats adultes. J. Neurosci. 35, 1052–1067. doi: 10.1523/JNEUROSCI.2953-14.2015
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D. et Bähner, F. (2018). Behavioral effects of acute systemic low-dose clozapine in wild-type rats: implications for the use of DREADDs in behavioral neuroscience. Devant. Se comporter. Neurosci. 12:173. doi: 10.3389/fnbeh.2018.00173
CrossRef Texte intégral / Google Scholar
Il s’agit de la première édition de la série. Interaction du stress aigu et chronique avec la respiration: modification par la naloxone. Pharmacol. Biochem. Se comporter. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Jann, M. W., Lam, Y. W. et Chang, W. H. (1994). Formation rapide de clozapine chez les cobayes et l’homme après administration de clozapine-N-oxyde. Arch. Int. Pharmacodyne. Là. 328, 243–250.
Résumé PubMed / Google Scholar
Joober, R. (2010). Clozapine: une molécule distincte, mal comprise et sous-utilisée. J. Psychiatrie Neurosci. 35, 147–149. doi: 10.1503/jpn.100055
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit d’une espèce de poissons de l’ordre des cyprinidés (2001). Atténuation induite par le stress de la réponse ventilatoire hypercapnique chez les rats éveillés. J. Appl. Physiol. 90, 1729–1735. doi: 10.1152/ jappl.2001.90.5.1729
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Klein, D. F. (1993). Fausses alarmes de suffocation, panique spontanée et conditions connexes. Une hypothèse intégrative. Arch. Gen. Psychiatrie 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
Résumé PubMed / Texte intégral Croisé / Google Scholar
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. V. et Huckstepp, R. T. R. (2018). Le rôle des neurones parafaciaux dans le contrôle de la respiration pendant l’exercice. Sci. Rép. 8:400. doi: 10.1038/s41598-017-17412- z
CrossRef Texte intégral / Google Scholar
Lapin, I.P. (1995). Seuls contrôles: effet de la manipulation, de l’injection fictive et de l’injection intrapéritonéale de solution saline sur le comportement des souris dans un labyrinthe plus élevé. J. Pharmacol. Toxicol. Méthodes 34, 73-77. doi: 10.1016 / 1056-8719 (95) 00025-D
Résumé PubMed | Texte intégral Croisé / Google Scholar
Lavezzi, A. M., Alfonsi, G., et Matturri, L. (2013). Physiopathologie du complexe locus coeruleus humain dans la mort subite inexpliquée fœtale / néonatale. Neurol. Rés. 35, 44 à 53. doi: 10.1179/1743132812Y.0000000108
Résumé PubMed | CrossRef Texte intégral / Google Scholar
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., España, R. A., et al. (2016). L’administration de N-oxyde de Clozapine produit des effets comportementaux chez les rats long-evans: implications pour la conception d’expériences DREADD. eNeuro 3, 1-14. doi: 10.1523/ENEURO.0219-16.2016
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Un système de reporting et de caractérisation Cre robuste et à haut débit pour l’ensemble du cerveau de la souris. NAT. Neurosci. 13, 133–140. doi: 10.1038/nn.2467
Résumé PubMed / CrossRef Texte intégral / Google Scholar
Il s’agit de la première édition de la série. CNO mal? Considérations pour l’utilisation des dreadds en neurosciences comportementales. Neuropsychopharmacologie 43, 934-936. doi: 10.1038/ centrale nucléaire.2017.299
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, M. S., Ritchie, J. C., Porter, J. H., et coll. (2018). L’agoniste de DREADD, le N-oxyde de clozapine (CNO), est métabolisé par voie inverse en clozapine et produit des effets de stimulus interoceptifs de type clozapine chez le rat et la souris. Sci. Rép. 8, 3840. doi: 10.1038/s41598-018-22116- z
CrossRef Texte intégral / Google Scholar
Misslin, R., Herzog, F., Koch, B. et Ropartz, P. (1982). Effets de l’isolement, de la manipulation et de la nouveauté sur la réponse hypophysaireadrensurrénale chez la souris. Psychoneuroendocrinologie 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il a été découvert en 1997 par l’Université de Tokyo et a été découvert en 1998 par l’Université de Tokyo. Atténuation dépendante de l’état de vigilance du chimioréflexe hypercapnique et de l’apnée du sommeil exagérée chez les souris knockout orexin. J. Appl. Physiol. 102, 241–248. doi: 10.1152/ japplphysiol.00679.2006
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » pooideae « , sous-famille des » Pooideae « , originaire d’Asie du Sud-Est. Altération des neurones de catécholamine dans le tronc cérébral des victimes du syndrome de mort subite du nourrisson. Pédiatrie 101, 285-288. doi: 10.1542/ peds.101.2.285
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » pooideae « , sous-famille des » pooideae « , originaire d’Asie du Sud-Est. Altérations du sous-type du récepteur Alpha2-adrénergique dans le tronc cérébral dans le syndrome de mort subite du nourrisson. Bourdonnement précoce. Dev. 75 (Suppl.), S129–S138. doi: 10.1016/j. pathophys.2004.01.015
CrossRef Texte intégral / Google Scholar
Padovan-Hernandez, Y., et Knackstedt, L.A. (2018). Réduction dose-dépendante de la locomotion induite par la cocaïne par la clozapine-N-oxyde chez les rats ayant des antécédents d’auto-administration de cocaïne. Neurosci. Lett. 674, 132–135. doi: 10.1016 / j.neulet.2018.03.045
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Ramanantsoa, N., Hirsch, M.-R., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Respiration sans chimiosensibilité au CO(2) chez les mutants Phox2b conditionnels. J. Neurosci. 31, 12880–12888. doi: 10.1523/JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Les neurones Egr2 contrôlent la réponse respiratoire de l’adulte à l’hypercapnie. Cerveau Res. 1511, 115-125. doi: 10.1016 / j. brainres.2012.12.017
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Kim, J. C., Richerson, G. B., Nattie, E., et al. (2011). Altération du contrôle de la température respiratoire et corporelle lors d’une inhibition aiguë des neurones sérotoninergiques. Science 333, 637-642. doi: 10.1126 / science.1205295
Résumé PubMed / CrossRef Texte intégral / Google Scholar
Ryabinine, A. E., Wang, Y. M., et Finn, D.A. (1999). Différents niveaux d’immunoréactivité au Fos après une manipulation répétée et un stress par injection chez deux souches consanguines de souris. Pharmacol. Biochem. Se comporter. 63, 143–151. doi: 10.1016/S0091-3057(98)00239-1
Résumé PubMed / Texte intégral Croisé / Google Scholar
Snyder, B., Shell, B., Cunningham, J. T. et Cunningham, R. L. (2017). L’hypoxie intermittente chronique induit un stress oxydatif et une inflammation dans les régions du cerveau associées à une neurodégénérescence à un stade précoce. Physiol. Rép. 5, 1-13. doi: 10.14814/ phy2.13258
Résumé PubMed / CrossRef Texte intégral / Google Scholar
Sun, J. J., Huang, T.-W., Neul, J. L. et Ray, R.S. (2017). Les gènes de structuration du cerveau postérieur embryonnaire délimitent des populations homéostatiques cardio-respiratoires et métaboliques distinctes chez l’adulte. Sci. Rép. 7:9117. doi: 10.1038/s41598-017-08810-4
CrossRef Texte intégral / Google Scholar
Sun, J. J., et Ray, R.S. (2017). Tg (Th-Cre) FI172Gsat (Th-Cre) définit les neurones nécessaires aux réflexes hypercapniques et hypoxiques complets. Biol. Ouvert 6, 1200-1208. doi: 10.1242/ bio.026823
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Taugher, R. J., Lu, Y., Wang, Y., Kreple, C. J., Ghobbeh, A., Fan, R., et al. (2014). Le noyau du lit de la strie terminale est critique pour le comportement lié à l’anxiété évoqué par le CO2 et l’acidose. J. Neurosci. 34, 10247–10255. doi: 10.1523/JNEUROSCI.1680-14.2014
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Valentino, R. J., et Van Bockstaele, E. (2008). Régulation convergente de l’activité du locus coeruleus en tant que réponse adaptative au stress. EUR. J. Pharmacol. 583, 194–203. doi: 10.1016/j.ejphar.2007.11.062
CrossRef Texte intégral / Google Scholar
Il s’agit de la première édition de la série. Mécanique respiratoire et contrôle ventilatoire dans le syndrome de chevauchement et l’hypoventilation de l’obésité. Respirez. Rés. 14:132. doi: 10.1186/1465-9921-14-132
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Viemari, J.-C. (2008). Modulation noradrénergique du réseau neuronal respiratoire. Respirez. Physiol. Neurobiol. 164, 123–130. doi: 10.1016/j. adm.2008.06.016
Résumé PubMed / CrossRef Texte intégral / Google Scholar
Winter, A., Ahlbrand, R., Naik, D. et Sah, R. (2017). Sensibilité comportementale différentielle à l’inhalation de dioxyde de carbone (CO2) chez les rats. Neuroscience 346, 423-433. doi: 10.1016 / j. neuroscience.2017.01.003
Résumé PubMed / Texte intégral CrossRef / Google Scholar
L’étude a permis de déterminer si les résultats de l’étude étaient satisfaisants. (2009). L’amygdale est un chimiosenseur qui détecte le dioxyde de carbone et l’acidose pour susciter un comportement de peur. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar