Introduction
La thromboembolie veineuse (TEV), y compris la thrombose veineuse profonde (TVP), l’embolie pulmonaire (EP) et la thrombose veineuse splanchnique, est une complication fréquente du cancer.1 Le développement de la TEV associée au cancer est associé à une qualité de vie réduite et impose un fardeau économique important au patient et au système de soins de santé.2 La TEV est la deuxième cause de décès chez les patients cancéreux recevant une chimiothérapie en ambulatoire et il a été démontré qu’elle est un prédicteur indépendant de la mortalité dans la population de patients atteints de cancer.3,4 La prise en charge du traitement de la TEV associée au cancer peut être difficile car les risques de TEV récurrentes et de saignements liés aux anticoagulants sont élevés malgré une prise en charge appropriée.5 De plus, les interactions médicamenteuses et les comorbidités liées au cancer, telles qu’une dysfonction rénale et / ou hépatique, une diminution de la prise orale, des nausées et des vomissements induits par la chimiothérapie et une thrombocytopénie ajoutent également à la complexité du traitement en limitant le choix de l’agent anticoagulant.
Essais cliniques Évaluant l’héparine de Bas Poids moléculaire pour le traitement de l’ETV associée au cancer
L’utilisation à long terme de l’héparine de bas poids moléculaire (HPMT) pour le traitement de l’ETV chez les patients atteints d’un cancer actif est recommandée comme traitement de première intention sur la base des résultats de plusieurs essais contrôlés randomisés ouverts (ECR).6,7 Les deux études les plus importantes publiées à ce jour, les études CLOT (Comparaison de l’héparine de bas poids moléculaire par rapport au traitement anticoagulant oral pour la prévention de la thromboembolie veineuse récurrente chez les patients atteints de Cancer) et CATCH (Comparaison des Traitements Aigus dans l’Hémostase cancéreuse), ont comparé un traitement LMWH à un traitement antagoniste de la vitamine K chez les patients atteints de cancer actif et de TVP proximale symptomatique aiguë ou EP. Voir le tableau 1 pour les caractéristiques de base et le tableau 2 pour les résultats de l’étude.8,9 Les deux essais ont utilisé un plan d’étude en ouvert, le même ratio international normalisé cible (INR) dans le bras témoin antagoniste de la vitamine K, la même définition du cancer actif et la même durée de traitement et avaient des critères d’admissibilité comparables pour les patients.
Tableau 1: Conception de l’étude et Caractéristiques de base des essais de CAPTURE et de CAILLOTS
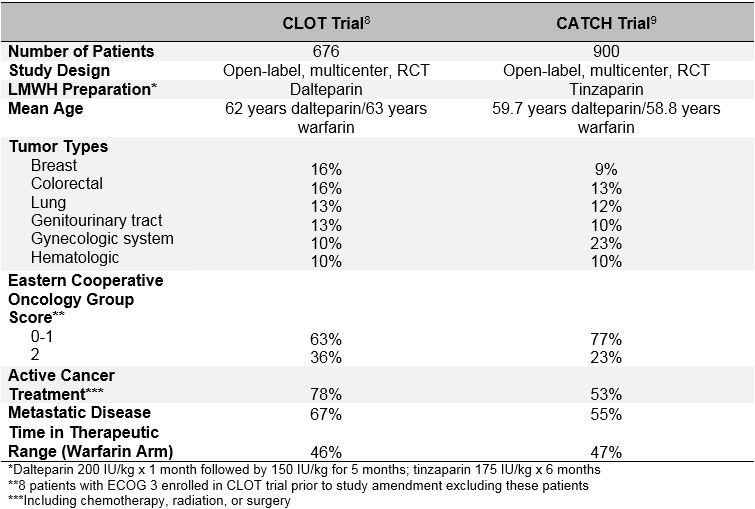
Tableau 2: Résultats des essais sur les CAILLOTS et LES CAPTURES

L’essai CLOT, publié en 2003, a randomisé 676 patients pour recevoir de la daltéparine (200 UI / kg par jour pendant 1 mois suivi de 150 UI / kg par jour pendant 5 mois) ou un antagoniste de la vitamine K (warfarine ou acénocoumarol avec une INR cible 2,5 pendant un total de 6 mois avec un chevauchement initial de 5 à 7 jours avec la daltéparine 200 UI / kg).8 Une TVP ou une EP récurrente symptomatique, y compris un décès lié à l’EP, a été observée chez 27 patients (7,0%) randomisés en daltéparine et chez 53 patients (15%) randomisés en antagoniste de la vitamine K (rapport de risque 0,48; intervalle de confiance à 95%, 0,30-0,77; p = 0,002). Aucune différence dans les taux de saignement majeur (6 vs 4%; p = 0,27), de saignement quelconque (15 vs 19%; p = 0,09) ou de décès (39 vs 41%; p = 0,53) n’a été observée entre les 2 groupes.
Dans l’essai CATCH, publié plus de 10 ans plus tard en 2015, 900 patients ont été randomisés en tinzaparine (175 UI / kg par jour sans réduction de dose) ou en warfarine (INR cible 2,0-3,0 avec chevauchement initial de 175 UI / kg de tinzaparine pendant 5 à 10 jours) pour un total de 6 mois.9 Le critère d’évaluation composite principal de l’ETV récurrente, y compris la TVP proximale incidente et l’EP, est survenu chez 31 patients (6,9%) dans le bras tinzaparine et 45 patients (10%) dans le bras warfarine (HR 0,65; IC à 95%, 0,41-1,03; p = 0,07). La TVP symptomatique est apparue chez un nombre significativement moins élevé de patients traités par la tinzaparine (2,7 contre 5,3 %; HR 0,48; IC à 95%, 0,24-0,96; p = 0,04). Bien que les taux de saignement majeurs soient similaires dans les deux bras, une réduction significative des saignements cliniquement pertinents et non majeurs a été observée avec la tinzaparine (10,9 contre 15,3%; HR 0,58; IC à 95%, 0,40-0,84; p = 0,004). La mortalité était similaire dans les deux groupes, environ un tiers des patients décédant au cours de la période d’étude (33,4 contre 30,6 %; p = 0,54). Bien que la tinzaparine n’ait pas réduit de manière significative le critère d’évaluation composite principal de la TEV récurrente, les résultats de l’étude CATCH soutiennent l’utilisation de l’HMT à long terme comme traitement privilégié de la TEV associée au cancer en raison d’un risque plus faible de saignement majeur cliniquement pertinent et d’une réduction significative de la TVP récurrente.
L’échec de l’essai de CAPTURE à atteindre la signification statistique pour le critère d’évaluation principal peut être dû au taux d’ETV récurrent plus faible que prévu observé dans le bras de la warfarine. Une explication possible de cette observation pourrait être une amélioration de la gestion de la warfarine dans l’essai de CAPTURE. Cependant, des niveaux similaires de contrôle de l’INR dans les deux études plaident contre cela (le temps dans la plage thérapeutique était de 46% dans le CAILLOT contre 47% dans les CAPTURES; le temps au-dessus de la plage thérapeutique était de 24% dans le CAILLOT contre 27% dans les CAPTURES). Une explication plus probable est un biais dans la sélection des patients « moins malades » pour l’inscription à l’essai CATCH. Bien que les études de CATCH et de CAILLOT aient utilisé des critères d’inclusion et d’exclusion similaires, il existe des différences clés dans les caractéristiques de base entre les deux populations de patients, en particulier en ce qui concerne les facteurs de risque thrombotiques et pronostiques. Une proportion plus élevée de patients dans l’essai CLOT recevaient un traitement actif contre le cancer (72 % CAILLOT contre 53 % CATCH), avaient des antécédents d’ETV (11 % CAILLOT contre 6 % CATCH), présentaient des signes de maladie métastatique (67 % CAILLOT contre 6 % CATCH). 55% DE CAPTURE), et avait un statut de performance plus médiocre (score du Groupe d’oncologie coopérative de l’Est de 2 pour 36% de CAILLOT contre 23% de CAPTURE). De plus, la mortalité au cours de la période de traitement de 6 mois était également plus élevée dans la population de CAILLOTS (39% de CAILLOTS contre 32 % de CAPTURES). Ainsi, la population de patients CATCH présentait probablement un risque inhérent de TEV récurrente inférieur à celui des patients de l’étude CAILLOT. Il est hautement probable que les enquêteurs n’aient pas inscrit de patients dans CATCH s’ils estimaient que l’HMTF serait plus bénéfique que la warfarine, ce qui entraînerait l’inscription sélective de patients moins susceptibles de développer une TEV récurrente.
Essais Évaluant les Anticoagulants oraux directs dans les TEV associés au cancer
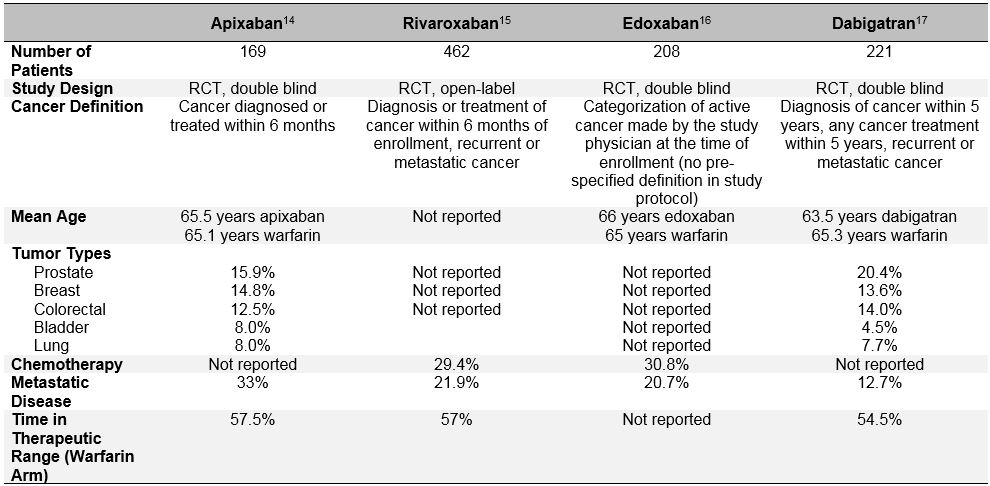
Le biais de sélection des patients est encore plus évident dans les récents essais randomisés évaluant l’efficacité et l’innocuité des anticoagulants oraux directs (DOAC) pour le traitement des TEV aigus.10 Ces anticoagulants oraux ont fait l’objet d’études approfondies au cours de la dernière décennie dans le domaine de la fibrillation auriculaire, du traitement de l’ETV et de la prévention de l’ETV. Dans les essais cliniques historiques de phase III pour le traitement de la TEV aiguë, il a été systématiquement démontré que les CDO ne sont pas inférieurs à la warfarine (risque relatif groupé de 0,90; IC à 95%, 0,77-1.06) dans la prévention de la TEV récurrente, et ils ont un risque similaire ou réduit de saignement majeur (RR groupé 0,40; IC à 95%, 0,45-0,83).11 Parmi les patients qui ont été classés comme ayant un « cancer » ou un « cancer actif » dans ces études, les DOAC semblent également fonctionner de manière similaire à la warfarine.12 Mais un examen plus approfondi de ces données post-hoc révèle un biais important de sélection des patients et remet en question la généralisation des résultats de l’essai DOAC aux patients « réels » atteints de cancer atteints d’ETV. En plus des définitions hétérogènes de « cancer actif » utilisées dans ces essais qui différaient des essais sur le CAILLOT et le CATCH, les déterminants importants de la TEV récurrente et des saignements étaient également très différents chez les patients atteints de cancer atteints de DOAC des essais spécifiques au cancer du LMWH (tableau 3). Ceux-ci incluent la présence d’une maladie métastatique et l’utilisation concomitante d’un traitement anticancéreux. Les grandes différences de mortalité au cours de la période d’étude soutiennent également que des groupes très différents de patients atteints de « cancer » ont été inclus dans les essais DOAC par rapport aux essais LMWH. De plus, contrairement à la LMWH, qui est associée à une réduction significative du risque de TEV récurrente par rapport aux antagonistes de la vitamine K (RR 0,52; IC à 95%, 0,36-0.74), les DOAC n’ont pas réduit de manière significative ce risque dans une méta-analyse de 1 132 patients atteints de cancer inscrits dans le programme d’essais cliniques EINSTEIN, HOKUSAI-VTE (Edoxaban Versus Warfarine pour le Traitement de la Thromboembolie Veineuse Symptomatique), RECOVER (Efficacité et Sécurité du Dabigatran par rapport à la Warfarine pour le Traitement de 6 Mois de la Thromboembolie Veineuse Symptomatique Aiguë) et AMPLIFY (Apixaban pour la Prise en Charge Initiale de l’Embolie Pulmonaire et de la Thrombose Veineuse Profonde en tant que Traitement de Première Intention) ECR (RR 0,66; IC À 95%, 0,39-1,11).10 Toutes ces considérations doivent mettre en garde contre l’utilisation non sélectionnée de DOACS chez les patients atteints d’un cancer actif et d’une TEV aiguë symptomatique.13
Tableau 3: Conception de l’étude et Caractéristiques de base des Sous-Groupes de Patients Atteints de Cancer Issus des essais DOAC de phase III
Conclusions
Toutes les principales lignes directrices consensuelles fondées sur des données probantes recommandent l’HPMT pour le traitement initial et à long terme des TEV associées au cancer.6,7,13 Cette recommandation est basée sur l’observation que la LMWH est non seulement plus efficace que la warfarine pour la prévention des TEV récurrentes, mais qu’elle offre également des avantages supplémentaires par rapport aux agents oraux, notamment une anticoagulation stable chez les patients présentant une mauvaise prise orale, un manque d’interactions médicamenteuses et une expérience clinique dans la gestion de l’anticoagulation entourant les procédures invasives et la thrombocytopénie. Bien que les DOAC ne soient pas actuellement recommandés pour le traitement de l’ETV chez les patients atteints de cancer, les ECR comparant le rivaroxaban et l’edoxaban à l’HBMT sont actuellement en cours et aideront à clarifier leur rôle dans l’ETV associée au cancer.6,13
- Khorana AA, Dalal M, Lin J, Connolly GC. Incidence and predictors of veinous thromboembolism (VTE) among ambulatory high-risk cancer patients undergoing chemotherapy in the United States. Cancer 2013; 119:648-55.
- Kourlaba G, Relakis J, Mylonas C, et al. Le fardeau humaniste et économique de la thromboembolie veineuse chez les patients cancéreux: une revue systématique. Fibrinolyse de la coagulation sanguine 2015; 26:13-31.
- Kuderer NM, Ortel TL, Francis CW. Impact de la thromboembolie veineuse et de l’anticoagulation sur le cancer et la survie au cancer. J Clin Oncol 2009; 27:4902-11.
- Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. La thromboembolie est l’une des principales causes de décès chez les patients cancéreux recevant une chimiothérapie ambulatoire. J Thrombb Haemost 2007; 5:632-4.
- Prandoni P, Lensing AW, Piccioli A, et al. Thromboembolie veineuse récurrente et complications hémorragiques pendant le traitement anticoagulant chez les patients atteints de cancer et de thrombose veineuse. Blood 2002; 100:3484-8.
- Lyman GH, Bohlke K, Khorana AA, et al. Prophylaxie et traitement de la thromboembolie veineuse chez les patients atteints de cancer: mise à jour des lignes directrices de pratique clinique de l’american society of clinical oncology 2014. J Clin Oncol 2015; 33:654-6.
- Streiff MB, Holmstrom B, Ashrani A, et al. Maladie Thromboembolique veineuse associée au cancer, Version 1.2015. J Natl Compr Canc Netw 2015; 13:1079-95.
- Lee AY, Levine MN, Baker RI, et al. Héparine de faible poids moléculaire contre coumarine pour la prévention de la thromboembolie veineuse récurrente chez les patients atteints de cancer. N Engl J Med 2003; 349:146-53.
- Lee AY, Kamphuisen PW, Meyer G, et al. Tinzaparine vs Warfarine pour le traitement de la Thromboembolie veineuse aiguë chez les Patients Atteints d’un Cancer Actif: Un essai clinique Randomisé. JAMA 2015; 314:677-86.
- Carrier M, Cameron C, Delluc A, Castellucci L, Khorana AA, Lee AY. Efficacité et innocuité du traitement anticoagulant pour le traitement de la thrombose aiguë associée au cancer: une revue systématique et une méta-analyse. Thrombb Res 2014; 134:1214-9.
- van Es N, Coppens M, Schulman S, Middeldorp S, Büller HR. anticoagulants oraux directs comparés aux antagonistes de la vitamine K pour la thromboembolie veineuse aiguë: preuves des essais de phase 3. Blood 2014; 124: 1968-75.
- Vedovati MC, Germini F, Agnelli G, Becattini C. anticoagulants oraux directs chez les patients atteints de TEV et de cancer: une revue systématique et une méta-analyse. Poitrine 2015; 147:475-83.
- Kearon C, Akl EA, Ornelas J, et al. Thérapie Antithrombotique pour la maladie TEV: Guide Thoracique et Rapport du Groupe d’experts. Poitrine 2016; 149:315-52.
- Agnelli G, Büller HR, Cohen A, et al. Apixaban oral pour le traitement de la thromboembolie veineuse chez les patients cancéreux: résultats de l’étude AMPLIFY. J Thrombb Haemost 2015; 13: 2187-91.
- Prins MH, Lensing AW, Brighton TA, et al. rivaroxaban oral contre énoxaparine avec antagoniste de la vitamine K pour le traitement de la thromboembolie veineuse symptomatique chez les patients atteints de cancer (EINSTEIN-TVP et EINSTEIN-PE): une analyse groupée de deux essais contrôlés randomisés. Lancet Haematol 2014; 1: e37-46.
- Raskob GE, van Es N, Segers A, et al. Edoxaban pour la thromboembolie veineuse chez les patients atteints de cancer: résultats d’une analyse de sous-groupe de non-infériorité de l’essai randomisé Hokusai-VTE, en double aveugle et à double mannequin. Lancet Haematol 2016; 3: e379-87.
- Schulman S, Goldhaber SZ, Kearon C, et al. Traitement par le dabigatran ou la warfarine chez les patients présentant une thromboembolie veineuse et un cancer. Thrombus Haemost 2015; 114:150-7.
Sujets Cliniques: Anticoagulation Management, Arrhythmias and Clinical EP, Cardio-Oncology, Pulmonary Hypertension and Venous Thromboembolism, Anticoagulation Management and Atrial Fibrillation, Anticoagulation Management and Venothromboembolism, Atrial Fibrillation/Supraventricular Arrhythmias
Keywords: Cardiotoxines, Cardiotoxicité, Héparine, Faible Poids Moléculaire, Warfarine, Anticoagulants, Rapport Normalisé International, Acénocoumarol, Daltéparine, Antithrombines, Thromboembolie Veineuse, Facteurs de Risque, Fibrillation Auriculaire, Patients Externes, Personnel de Recherche, Qualité de Vie, Pyridones, Pyrazoles, Pyridines, Thiazoles, Thrombose Veineuse, Embolie Pulmonaire, Thrombose, Thrombocytopénie, Comorbidité, Hémostase, Néoplasmes
< Retour aux annonces