Nom générique: phosphate de clindamycine
Forme posologique: crème vaginale
Revue médicale par Drugs.com . Dernière mise à jour le 1er mars 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
- POUR USAGE INTRAVAGINAL SEULEMENTPAS POUR USAGE OPHTALMIQUE, CUTANÉ OU ORAL
- Crème vaginale Cléocine – Pharmacologie clinique
- Mécanisme d’action
- Pharmacocinétique
- MICROBIOLOGIE
- Mécanisme d’action
- Résistance
- Activité antibactérienne
- Indications et utilisation de la Crème vaginale Cleocin
- Contre-indications
- Mises en garde
- Précautions
- Généralités
- Informations pour la patiente
- Interactions médicamenteuses
- Carcinogenèse, Mutagénèse, Altération de la fertilité
- Grossesse
- Les mères allaitantes
- Utilisation pédiatrique
- Utilisation gériatrique
- Effets indésirables
- Essais cliniques
- Surdosage
- Cleocin Dosage et administration de la Crème vaginale
- Comment la Crème vaginale Cleocin est-elle fournie
- Études cliniques
- MODE D’EMPLOI
- PANNEAU D’AFFICHAGE PRINCIPAL – Étiquette du Tube De 40 g
- PANNEAU D’AFFICHAGE PRINCIPAL – Carton Tubulaire De 40 g
- En savoir plus sur Cleocin Vaginal (clindamycine topique)
- Ressources pour les consommateurs
- Ressources professionnelles
- Autres formulations
- Guides de traitement connexes
POUR USAGE INTRAVAGINAL SEULEMENTPAS POUR USAGE OPHTALMIQUE, CUTANÉ OU ORAL
Le phosphate de Clindamycine est un ester soluble dans l’eau de l’antibiotique semi-synthétique produit par une substitution 7(S)-chloro du groupe 7(R)-hydroxyle de l’antibiotique parent lincomycine. Le nom chimique du phosphate de clindamycine est méthyle 7-chloro-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidinecarboxamido)-1-thio-L-threo-α–D-galacto- octopyranoside 2- (dihydrogénophosphate). Il a un poids moléculaire de 504,96 et sa formule moléculaire est C18H34ClN2O8PS. La formule structurelle est représentée ci-dessous:
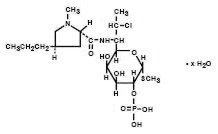
La crème vaginale Cleocin 2% est une crème blanche semi-solide contenant 2% de phosphate de clindamycine, USP, à une concentration équivalente à 20 mg de clindamycine par gramme. Le pH de la crème est compris entre 3,0 et 6,0. La crème contient également de l’alcool benzylique, de l’alcool cétostéarylique, des esters d’acides gras mélangés, de l’huile minérale, du polysorbate 60, du propylène glycol, de l’eau purifiée, du monostéarate de sorbitane et de l’acide stéarique.
Chaque applicateur de 5 grammes de crème vaginale contient environ 100 mg de phosphate de clindamycine.
Crème vaginale Cléocine – Pharmacologie clinique
Mécanisme d’action
La clindamycine est un médicament antibactérien (Voir MICROBIOLOGIE).
Pharmacocinétique
Après une dose intravaginale une fois par jour de 100 mg de crème vaginale au phosphate de clindamycine à 2%, administrée à 6 femmes volontaires en bonne santé pendant 7 jours, environ 5% (entre 0,6% et 11 %) de la dose administrée a été absorbée par voie systémique. La concentration sérique maximale de clindamycine observée le premier jour était en moyenne de 18 ng / mL (plage de 4 à 47 ng / mL) et au jour 7, elle était en moyenne de 25 ng / mL (plage de 6 à 61 ng / mL). Ces concentrations maximales ont été atteintes environ 10 heures après l’administration (plage de 4 à 24 heures).
Après une dose intravaginale une fois par jour de 100 mg de crème vaginale au phosphate de clindamycine à 2%, administrée pendant 7 jours consécutifs à 5 femmes atteintes de vaginose bactérienne, l’absorption était plus lente et moins variable que celle observée chez les femmes en bonne santé. Environ 5 % (entre 2 et 8 %) de la dose ont été absorbés par voie systémique. La concentration sérique maximale de clindamycine observée le premier jour était en moyenne de 13 ng / mL (plage de 6 à 34 ng / mL) et au jour 7, elle était en moyenne de 16 ng / mL (plage de 7 à 26 ng / mL). Ces concentrations maximales ont été atteintes environ 14 heures après l’administration (plage de 4 à 24 heures).
Il y avait peu ou pas d’accumulation systémique de clindamycine après administration vaginale répétée de crème vaginale au phosphate de clindamycine à 2%. La demi-vie systémique était de 1,5 à 2,6 heures.
MICROBIOLOGIE
Mécanisme d’action
La clindamycine inhibe la synthèse des protéines bactériennes en se liant à l’ARN 23S de la sous-unité 50S du ribosome. La clindamycine est principalement bactériostatique. Bien que le phosphate de clindamycine soit inactif in vitro, une hydrolyse rapide in vivo le convertit en clindamycine active.
Résistance
La résistance à la clindamycine est le plus souvent causée par une modification du site cible sur le ribosome, généralement par une modification chimique des bases de l’ARN par des mutations ponctuelles dans l’ARN ou occasionnellement dans les protéines. Une résistance croisée a été démontrée entre les lincosamides, les macrolides et les streptogramines B chez certains organismes. Une résistance croisée a été démontrée entre la clindamycine et la lincomycine.
Activité antibactérienne
Les tests de culture et de sensibilité des bactéries ne sont pas systématiquement effectués pour établir le diagnostic de vaginose bactérienne (voir INDICATIONS ET UTILISATION); méthodologie standard pour les tests de sensibilité des pathogènes bactériens potentiels, Gardnerella vaginalis, Mobiluncus spp., ou Mycoplasma hominis, n’a pas été défini.
Les données in vitro suivantes sont disponibles mais leur signification clinique est inconnue. La clindamycine est active in vitro contre la plupart des isolats des organismes suivants qui seraient associés à la vaginose bactérienne:
- Bacteroides spp.
- Gardnerella vaginalis
- Mobiluncus spp.
- Mycoplasma hominis
- Peptostreptococcus spp.
Indications et utilisation de la Crème vaginale Cleocin
La Crème vaginale Cleocin 2% est indiquée dans le traitement de la vaginose bactérienne (anciennement appelée vaginite à Haemophilus, vaginite à Gardnerella, vaginite non spécifique, vaginite à Corynebacterium ou vaginose anaérobie). Cleocin Crème vaginale 2%, peut être utilisé pour traiter les femmes non enceintes et les femmes enceintes au cours des deuxième et troisième trimestres. (Voir ÉTUDES CLINIQUES.)
REMARQUE: Aux fins de cette indication, un diagnostic clinique de vaginose bactérienne est généralement défini par la présence d’un écoulement vaginal homogène qui (a) a un pH supérieur à 4,5, (b) émet une odeur d’amine « de poisson » lorsqu’il est mélangé à une solution de KOH à 10%, et (c) contient des cellules indices à l’examen microscopique. Les résultats de coloration de Gram compatibles avec un diagnostic de vaginose bactérienne comprennent (a) une morphologie de Lactobacilles nettement réduite ou absente, (b) une prédominance du morphotype de Gardnerella et (c) une absence ou peu de globules blancs.
D’autres agents pathogènes couramment associés à la vulvovaginite, par exemple Trichomonas vaginalis, Chlamydia trachomatis, N. gonorrhoeae, Candida albicans et le virus de l’herpès simplex doivent être exclus.
Contre-indications
La crème vaginale Cleocin 2% est contre-indiquée chez les personnes ayant des antécédents d’hypersensibilité à la clindamycine, à la lincomycine ou à l’un des composants de cette crème vaginale. La crème vaginale Cleocin 2% est également contre-indiquée chez les personnes ayant des antécédents d’entérite régionale, de colite ulcéreuse ou d’antécédents de colite « associée aux antibiotiques ».
Mises en garde
La colite pseudomembraneuse a été rapportée avec presque tous les agents antibactériens, y compris la clindamycine, et sa gravité peut varier de légère à potentiellement mortelle. La clindamycine administrée par voie orale et parentérale a été associée à une colite sévère pouvant se terminer par la mort. La diarrhée, la diarrhée sanglante et la colite (y compris la colite pseudomembraneuse) ont été rapportées avec l’utilisation de clindamycine administrée par voie orale et parentérale, ainsi qu’avec des formulations topiques (cutanées et vaginales) de clindamycine. Par conséquent, il est important de considérer ce diagnostic chez les patients qui présentent une diarrhée après l’administration de clindamycine, même lorsqu’ils sont administrés par voie vaginale, car environ 5% de la dose de clindamycine est absorbée de manière systémique par le vagin.
Le traitement avec des agents antibactériens modifie la flore normale du côlon et peut permettre la prolifération des clostridies.Des études indiquent qu’une toxine produite par Clostridium difficile est l’une des principales causes de colite « associée aux antibiotiques ».
Une fois le diagnostic de colite pseudomembraneuse établi, des mesures thérapeutiques doivent être initiées. Les cas bénins de colite pseudomembraneuse répondent généralement à l’arrêt du médicament seul. Dans les cas modérés à graves, il faut envisager une prise en charge avec des liquides et des électrolytes, une supplémentation en protéines et un traitement avec un médicament antibactérien cliniquement efficace contre la colite à Clostridium difficile.
Des symptômes de colite pseudomembraneuse peuvent apparaître pendant ou après un traitement antimicrobien.
Précautions
Généralités
Crème vaginale Cleocin 2%, contient des ingrédients qui provoqueront des brûlures et une irritation des yeux. En cas de contact accidentel avec l’œil, rincez l’œil avec de grandes quantités d’eau froide du robinet.
L’utilisation de Cleocin Vaginal Cream 2% peut entraîner la prolifération d’organismes non sensibles dans le vagin. Dans les études cliniques portant sur 600 femmes non enceintes ayant reçu un traitement pendant 3 jours, Candida albicans a été détecté, soit de manière symptomatique, soit par culture, chez 8,8% des patients. Chez 9% des patients, une vaginite a été enregistrée. Études incliniques portant sur 1325 femmes non enceintes ayant reçu un traitement pendant 7 jours, Candida albicans a été détecté, soit par symptomatologie, soit par culture, chez 10,5% des patients. Une vaginite a été enregistrée chez 10,7% des patients. Chez 180 femmes enceintes ayant reçu un traitement pendant 7 jours, Candida albicans a été détecté, soit de manière symptomatique, soit par culture, chez 13,3% des patients. Chez 7,2% des patients, une vaginite a été enregistrée. Candida albicans, comme indiqué ici, comprend les termes: moniliase vaginale et moniliase (corps dans son ensemble). La vaginite comprend les termes: trouble vulvovaginal, vulvovaginite, pertes vaginales, vaginite trichomonale et vaginite.
Informations pour la patiente
La patiente doit être informée de ne pas avoir de rapports sexuels vaginaux ou d’utiliser d’autres produits vaginaux (tels que des tampons ou des douches vaginales) pendant le traitement avec ce produit.
La patiente doit également être informée que cette crème contient de l’huile minérale qui peut affaiblir les produits en latex ou en caoutchouc tels que les préservatifs ou les diaphragmes contraceptifs vaginaux. Par conséquent, l’utilisation de tels produits dans les 72 heures suivant le traitement avec Cleocin Vaginal Cream 2% n’est pas recommandée.
Interactions médicamenteuses
Il a été démontré que la clindamycine systémique possède des propriétés de blocage neuromusculaire qui peuvent améliorer l’action d’autres agents de blocage neuromusculaire. Par conséquent, il doit être utilisé avec prudence chez les patients recevant de tels agents.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Aucune étude à long terme chez l’animal n’a été réalisée avec la clindamycine pour évaluer le potentiel cancérogène.
Les tests de génotoxicité effectués comprenaient un test de micronoyau chez le rat et un test d’Ames. Les deux tests étaient négatifs. Des études de fertilité chez des rats traités par voie orale avec jusqu’à 300 mg / kg / jour (31 fois l’exposition humaine basée sur mg / m2) n’ont révélé aucun effet sur la fertilité ou la capacité d’accouplement.
Grossesse
Effets tératogènes
Dans les essais cliniques avec des femmes enceintes, l’administration systémique de clindamycine au cours des deuxième et troisième trimestres n’a pas été associée à une fréquence accrue d’anomalies congénitales.
La crème vaginale à la clindamycine ne doit être utilisée pendant le premier trimestre de la grossesse que si elle est clairement nécessaire et si les avantages l’emportent sur les risques. Il n’existe pas d’études adéquates et bien contrôlées chez la femme enceinte au cours du premier trimestre de la grossesse.
Cleocin Vaginal Cream 2% a été étudié chez la femme enceinte au cours du deuxième trimestre. Chez les femmes traitées pendant sept jours, un travail anormal a été rapporté chez 1,1% des patientes ayant reçu de la crème vaginale à la clindamycine 2% contre 0,5% des patientes ayant reçu un placebo.
Des études de reproduction ont été réalisées chez le rat et la souris à l’aide de doses orales et parentérales de clindamycine allant jusqu’à 600 mg / kg / jour (62 et 25 fois, respectivement, l’exposition humaine maximale basée sur la surface corporelle) et n’ont révélé aucune preuve de dommage pour le fœtus dû à la clindamycine. Des fentes palatines ont été observées chez des fœtus d’une souche de souris traitée par voie intrapéritonéale avec de la clindamycine à raison de 200 mg/kg/jour (environ 10 fois la dose recommandée en fonction des conversions de surface corporelle). Comme cet effet n’a pas été observé chez d’autres souches de souris ou chez d’autres espèces, l’effet peut être spécifique à la souche.
Les mères allaitantes
Des données publiées limitées basées sur l’échantillonnage du lait maternel indiquent que la clindamycine apparaît dans le lait maternel humain dans une plage de moins de 0,5 à 3,8 mcg / mL à des doses de 150 mg par voie orale à 600 mg par voie intraveineuse. On ne sait pas si la clindamycine est excrétée dans le lait maternel humain après l’utilisation du phosphate de clindamycine administré par voie vaginale.
La clindamycine peut avoir des effets indésirables sur la flore gastro-intestinale du nourrisson allaité. Si la clindamycine est requise par une mère qui allaite, ce n’est pas une raison d’interrompre l’allaitement, mais un autre médicament peut être préféré. Surveillez le nourrisson allaité pour détecter d’éventuels effets indésirables sur la flore gastro-intestinale, tels que diarrhée, candidose (muguet, érythème fessier) ou, rarement, du sang dans les selles indiquant une possible colite associée aux antibiotiques.
Les avantages pour le développement et la santé de l’allaitement maternel doivent être pris en compte, de même que les besoins cliniques de la mère en clindamycine et tout effet indésirable potentiel de la clindamycine ou de l’affection maternelle sous-jacente sur l’enfant allaité.
Utilisation pédiatrique
L’innocuité et l’efficacité chez les patients pédiatriques n’ont pas été établies.
Utilisation gériatrique
Les études cliniques sur la crème vaginale Cleocin 2% n’incluaient pas un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondaient différemment des sujets plus jeunes. D’autres expériences cliniques rapportées n’ont pas mis en évidence de différences de réponses entre les patients âgés et les patients plus jeunes.
Effets indésirables
Essais cliniques
Femmes non enceintes
Dans les essais cliniques impliquant des femmes non enceintes, 1,8% des 600 patientes ayant reçu un traitement par Cleocin Vaginal Cream 2% pendant 3 jours et 2,7% des 1325 patientes ayant reçu un traitement pendant 7 jours ont interrompu le traitement en raison d’événements indésirables liés au médicament. Des événements médicaux jugés liés, probablement liés, éventuellement liés ou de relation inconnue avec la crème vaginale au phosphate de clindamycine administrée par voie vaginale à 2%, ont été rapportés chez 20,7% des patientes recevant un traitement pendant 3 jours et 21,3% des patientes recevant un traitement pendant 7 jours. Les événements survenant chez ≥1% des patientes recevant de la crème vaginale au phosphate de clindamycine à 2% sont présentés dans le tableau 1.
| Événement | Crème vaginale Cleocin | |
|---|---|---|
| 3 Jour n = 600 |
7 Jour n=1325 |
|
| Urogénital | ||
| Moniliase vaginale | 7.7 | 10.4 |
| Vulvo-Vaginite | 6.0 | 4.4 |
| Trouble vulvo-vaginal | 3.2 | 5.3 |
| Vaginite trichomonale | 0 | 1.3 |
| Le corps dans son Ensemble | ||
| Moniliase (corps) | 1.3 | 0.2 |
Les autres événements survenant dans < 1% des groupes de 2% de crème vaginale à la clindamycine comprennent:
Système urogénital: pertes vaginales, métrorragies, infection des voies urinaires, endométriose, troubles menstruels, vaginite / infection vaginale et douleurs vaginales.
Corps dans son ensemble: douleurs abdominales localisées, douleurs abdominales généralisées, crampes abdominales, halitose, maux de tête, infection bactérienne, gonflement inflammatoire, réaction allergique et infection fongique.
Système digestif: nausées, vomissements, constipation, dyspepsie, flatulences, diarrhée et troubles gastro-intestinaux.
Système endocrinien: hyperthyroïdie.
Système nerveux central: vertiges et vertiges.
Système respiratoire : épistaxis.
Peau: prurit (site de non-application), moniliase, éruption cutanée, éruption maculopapulaire, érythème et urticaire.
Sens particuliers: la perversion du goût.
Femmes enceintes
Dans un essai clinique impliquant des femmes enceintes au cours du deuxième trimestre, 1,7% des 180 patientes ayant reçu un traitement pendant 7 jours ont interrompu le traitement en raison d’événements indésirables liés au médicament. Des événements médicaux jugés liés, probablement liés, éventuellement liés ou de relation inconnue avec la crème vaginale au phosphate de clindamycine administrée par voie vaginale 2% ont été rapportés chez 22,8% des patientes enceintes. Les événements survenant chez ≥1% des patientes recevant une crème vaginale au phosphate de clindamycine à 2% ou un placebo sont présentés dans le tableau 2.
| Événement | CLÉOCINE Crème vaginale |
Placebo |
|---|---|---|
| 7 JOUR n = 180 |
7 JOUR n=184 |
|
| Urogénital | ||
| Moniliase vaginale | 13.3 | 7.1 |
| Trouble vulvo-vaginal | 6.7 | 7.1 |
| Travail anormal | 1.1 | 0.5 |
| Le corps dans son Ensemble | ||
| Infection fongique | 1.7 | 0 |
| Peau | ||
| Prurit, site non applicatif | 1.1 | 0 |
D’autres événements survenant dans < 1% du groupe de la crème vaginale à la clindamycine 2% comprennent:
Système urogénital: dysurie, métrorragie, douleurs vaginales et vaginite trichomonale.
Corps dans son ensemble: infection des voies respiratoires supérieures.
Peau : prurit (site d’application topique) et érythème.
Expérience post-commercialisation
Étant donné que ces réactions sont rapportées volontairement à partir d’une population de taille incertaine, il n’est pas toujours possible d’estimer de manière fiable leur fréquence ou d’établir un lien de causalité avec l’exposition au médicament.
Au cours de la période post-commercialisation, des cas de colite pseudomembraneuse ont été rapportés avec l’utilisation de crème vaginale au phosphate de clindamycine.
Autres formulations de clindamycine
La crème vaginale à la clindamycine offre des concentrations sériques maximales minimales et une exposition systémique (ASC) à la clindamycine par rapport à une administration orale de 100 mg de clindamycine. Bien que ces niveaux d’exposition plus faibles soient moins susceptibles de produire les réactions courantes observées avec la clindamycine orale, la possibilité de ces réactions et d’autres ne peut être exclue à l’heure actuelle. Les données d’essais bien contrôlés comparant directement la clindamycine administrée par voie orale à la clindamycine administrée par voie vaginale ne sont pas disponibles.
Les effets indésirables suivants et les tests de laboratoire modifiés ont été rapportés avec l’utilisation orale ou parentérale de la clindamycine:
Gastro-intestinal: Douleurs abdominales, œsophagite, nausées, vomissements, diarrhée et colite pseudomembraneuse. (Voir AVERTISSEMENTS.)
Hématopoïétique: Une neutropénie transitoire (leucopénie), une éosinophilie, une agranulocytose et une thrombocytopénie ont été rapportées. Aucun lien étiologique direct avec un traitement concomitant à la clindamycine n’a pu être établi dans ces rapports.
Réactions d’hypersensibilité: Des éruptions maculopapulaires et de l’urticaire ont été observées pendant le traitement médicamenteux. Les éruptions cutanées généralisées de type morbilliforme légères à modérées sont les plus fréquemment rapportées de tous les effets indésirables. De rares cas d’érythème polymorphe, certains ressemblant au syndrome de Stevens-Johnson, ont été associés à la clindamycine. Quelques cas de réactions anaphylactoïdes ont été rapportés. En cas de réaction d’hypersensibilité, le médicament doit être arrêté.
Foie: Une jaunisse et des anomalies des tests de la fonction hépatique ont été observées pendant le traitement par la clindamycine.
Appareil locomoteur: De rares cas de polyarthrite ont été rapportés.
Rénal: Bien qu’aucune relation directe entre la clindamycine et les lésions rénales n’ait été établie, un dysfonctionnement rénal tel que mis en évidence par une azotémie, une oligurie et / ou une protéinurie a été observé dans de rares cas.
Surdosage
La crème vaginale au phosphate de clindamycine appliquée par voie vaginale à 2% pourrait être absorbée en quantités suffisantes pour produire des effets systémiques. (Voir AVERTISSEMENTS.)
Cleocin Dosage et administration de la Crème vaginale
La dose recommandée est d’un applicateur de crème vaginale au phosphate de clindamycine à 2% (5 grammes contenant environ 100 mg de phosphate de clindamycine) par voie intravaginale, de préférence au coucher, pendant 3 ou 7 jours consécutifs chez les patientes non enceintes et pendant 7 jours consécutifs chez les patientes enceintes. (Voir ÉTUDES CLINIQUES.)
Comment la Crème vaginale Cleocin est-elle fournie
La crème vaginale Cleocin 2% (crème vaginale au phosphate de clindamycine) est fournie comme suit:
tube de 40 g (avec 7 applicateurs jetables) NDC 0009-3448-01
Conserver à une température ambiante contrôlée de 20 à 25 ° C (68 à 77 ° F). Protéger du gel.
Études cliniques
Dans deux études cliniques portant sur 674 femmes non enceintes évaluables atteintes de vaginose bactérienne comparant la crème vaginale Cléocine à 2% pendant 3 ou 7 jours, les taux de guérison clinique, déterminés 1 mois après la thérapie, variaient de 72% à 81% pour le traitement de 3 jours et de 84% à 86% pour le traitement de 7 jours.
| CLÉOCINE 3 Jours | CLÉOCINE 7 Jours | |||
|---|---|---|---|---|
| Étude américaine | 94/131 | 72% | 110/128 | 86% |
| Étude Européenne | 161/199 | 81% | 181/216 | 84% |
Dans une étude clinique portant sur 249 patientes enceintes évaluables au cours des deuxième et troisième trimestres traités pendant 7 jours, le taux de guérison clinique, déterminé 1 mois après la thérapie, était de 60% (77/129) dans le bras clindamycine et de 9% (11/120) pour le bras clindamycine. bras de véhicule. La détermination de la guérison clinique était basée sur l’absence d’odeur d’amine « de poisson » lorsque les pertes vaginales étaient mélangées à une solution de KOH à 10% et l’absence de cellules indices à l’examen microscopique.
Rx seulement
L’étiquette de ce produit peut avoir été mise à jour. Pour obtenir des renseignements complets à jour sur la prescription, veuillez visiter www.pfizer.com.

LAB-0043-12.0
Révisé 03/2020
MODE D’EMPLOI
Des applicateurs en plastique jetables sont fournis avec cet emballage. Ils sont conçus pour permettre une administration vaginale correcte de la crème.
Retirer le capuchon du tube à crème. Vissez un applicateur en plastique sur l’extrémité filetée du tube.
Rouler le tube par le bas, presser doucement et forcer le médicament dans l’applicateur. L’applicateur est rempli lorsque le piston atteint son point d’arrêt prédéterminé.
Dévissez l’applicateur du tube et replacez le capuchon.
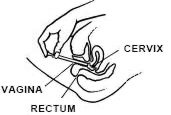
Tout en étant allongé sur le dos, saisissez fermement le canon de l’applicateur et insérez-le dans le vagin autant que possible sans causer d’inconfort.
Poussez lentement le piston jusqu’à ce qu’il s’arrête.
Retirez soigneusement l’applicateur du vagin et jetez l’applicateur.
N’OUBLIEZ PAS D’APPLIQUER UN APPLICATEUR CHAQUE SOIR AVANT LE COUCHER, OU TEL QUE PRESCRIT PAR VOTRE MÉDECIN.
INSTRUCTIONS POUR LE PATIENT
Cet emballage contient des applicateurs en plastique jetables. Les applicateurs sont conçus pour une administration correcte de la crème dans le vagin.
Retirez le capuchon du tube de crème et vissez l’applicateur en plastique sur le tube.
Pressez doucement le tube de l’extrémité inférieure et forcez le médicament dans l’applicateur. L’applicateur sera plein lorsque le piston atteindra sa longueur maximale.
Dévissez l’applicateur du tube et replacez le capuchon.
Allongez-vous sur le dos et tenez fermement l’applicateur, insérez-le dans le vagin autant que possible sans causer d’inconfort.
Poussez lentement le piston jusqu’à ce qu’il s’arrête.
Retirez délicatement l’applicateur du vagin et jetez-le.
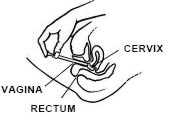
N’OUBLIEZ PAS D’APPLIQUER UN APPLICATEUR COMPLET TOUS LES SOIRS AU COUCHER OU SELON LES DIRECTIVES DE VOTRE MÉDECIN.
LAB-1058-1.0
PANNEAU D’AFFICHAGE PRINCIPAL – Étiquette du Tube De 40 g
NDC 0009-3448-01
40 Grammes
Rx uniquement
Cleocin®
phosphate de clindamycine
crème vaginale, USP
Pour usage intravaginal uniquement
2%*
PANNEAU D’AFFICHAGE PRINCIPAL – Carton Tubulaire De 40 g
NDC 0009-3448-01
40 Grammes Avec 7 Applicateurs
Rx uniquement
Cleocin®
phosphate de clindamycine
crème vaginale, USP
Pour Usage Intravaginal Uniquement
2%*
Pfizer
Distribué par
Pharmacia & Upjohn Co
Division de Pfizer Inc, NY, NY 10017
| CLEOCIN crème au phosphate de clindamycine |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Étiqueteuse – Pharmacia et Upjohn Company LLC (618054084)
| Établissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| Pharmacia et Upjohn Company LLC | 618054084 | ANALYSE (0009-3448), FABRICATION API (0009-3448), ÉTIQUETTE (0009-3448), FABRICATION (0009-3448), EMBALLAGE(0009-3448) | |
En savoir plus sur Cleocin Vaginal (clindamycine topique)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Information posologique
- Interactions médicamenteuses
- Prix & Coupons
- Disponibilité générique
- Classe de médicaments: anti-infectieux vaginaux
Ressources pour les consommateurs
- Lecture avancée
Ressources professionnelles
- Informations de prescription
- Crème vaginale à la Clindamycine (FDA)
Autres marques Clindamax, Clindagel, Clindesse, Clindacin ETZ,… + 4 plus
Autres formulations
- Cléocine
- … + 4 plus
Guides de traitement connexes
- Vaginite bactérienne
Avertissement médical