Sofia Mourgela1 *, Antonios Sakellaropoulos2, Athanasios Gouliamos3 et Sofia Anagnostopoulou4 1 Département de Neurochirurgie, Institut Anticancéreux Agios Savvas, Athènes, Grèce
2 Hôpital N. ATH MD, Division de PCCM, Endoscopie et Médecine du sommeil, Athènes, Grèce
3 2ème Département de Radiologie, Hôpital « Attikon », Université d’Athènes, Athènes, Grèce
4 Département d’anatomie, Faculté de médecine, Université d’Athènes, Athènes, Grèce
* Correspondance: Sofia Mourgela, MD, neurochirurgien, Vikatou 12 Str., 11524 Athènes, Grèce, Tél: +30 210 692 55 20 , Email:
Date de réception: 26 juillet 2009 / Date d’acceptation: 19 janvier 2010 / Date de publication: 23 février 2010
Référence: © IJAV. 2010; 3: 2–5.
Cet article en libre accès est distribué selon les termes de la licence Non commerciale Creative Commons Attribution (CC BY-NC) (http://creativecommons.org/licenses/by-nc/4.0/), qui permet la réutilisation, la distribution et la reproduction de l’article, à condition que l’œuvre originale soit correctement citée et que la réutilisation soit limitée à des fins non commerciales. Pour une réutilisation commerciale, contact
Résumé
Le cavum veli interpositi (CVI) représente un espace rempli de liquide céphalo-rachidien (LCR) formé par le corps calleux et le fornix au-dessus, le toit du troisième ventricule et du thalamus en dessous et les crus du fornix de chaque côté latéralement. Elle est fréquente chez les nourrissons mais peu fréquente chez les enfants de plus de 2 ans et les adultes. Nous décrivons le cas d’une femme de 20 ans, qui a révélé un espace de LCR en forme de casque à l’emplacement anatomique de l’ICB lors d’une IRM cérébrale réalisée en raison de maux de tête récurrents. Nous présentons ce cas afin de revoir la littérature et de discuter de la cause possible de l’existence d’une telle variation anatomique.
Mots clés
cavum veli interpositi, imagerie par résonance magnétique, pression veineuse
Introduction
Le cavum veli interpositi (CVI) est un espace formé par le pli de pia mater (tela choroidea) lors du clivage interhémisphérique en relation avec le développement du corps calleux, qui occupe la fissure cérébrale transverse (fissure choroïdale). Il représente un espace cisternal potentiel contenant du liquide céphalo-rachidien (LCR) entre les veines cérébrales internes et l’artère choroïdienne médiale postérieure.
CVI est de forme triangulaire avec une large base dorsale. Ses limites sont la commissure de l’hippocampe et le corps calleux au-dessus, la tela choroidea au-dessous et les crus du fornix de chaque côté latéralement. Il peut s’étendre antérieurement dans le toit du troisième ventricule jusqu’au foramina interventriculaire, qui s’ouvre caudalement dans la cisterna venae magnae Galeni.
Embryologiquement, l’ICB est une variation anatomique provenant de la plaque de toit du diencéphale par un processus de la pia mater, qui fait saillie dans le tube neural primitif au cours du troisième mois fœtal. C’est une partie des structures en développement normales de la ligne médiane cérébrale, qui diminue de taille après la naissance à terme. Il peut apparaître comme un kyste dans la région pinéale sur les échographies néonatales, est fréquent chez les nourrissons mais il est beaucoup moins fréquent chez les enfants de plus de 2 ans et les adultes.
Nous présentons ce cas dans le but d’associer l’existence de cette structure à l’équilibre de la pression veineuse dans le cerveau, tout en examinant en profondeur la littérature.
Rapport de cas
Α Une femme de 20 ans a subi une IRM cérébrale dans notre service ambulatoire en raison de maux de tête récurrents. L’examen neurologique n’a révélé aucune pathologie.
L’IRM cérébrale, qui comprenait des séquences Τ1-, T2-pondérées et flair avant l’administration d’un agent de contraste ainsi que des séquences post-contraste pondérées T1 dans les 3 plans (sagittal, axial, coronal), a révélé un LCR en forme de casque contenant de l’espace à l’emplacement anatomique de l’ICB. Les limites de cet espace étaient la commissure de l’hippocampe et le corps calleux au-dessus, la tela choroidea et le thalamus au-dessous, le foramen de Monro à l’avant, la région pinéale à l’arrière et les crus du fornix bilatéralement. Les veines cérébrales internes étaient visibles aux bords inférolatéraux de la citerne (Figures 1,2,3,4).
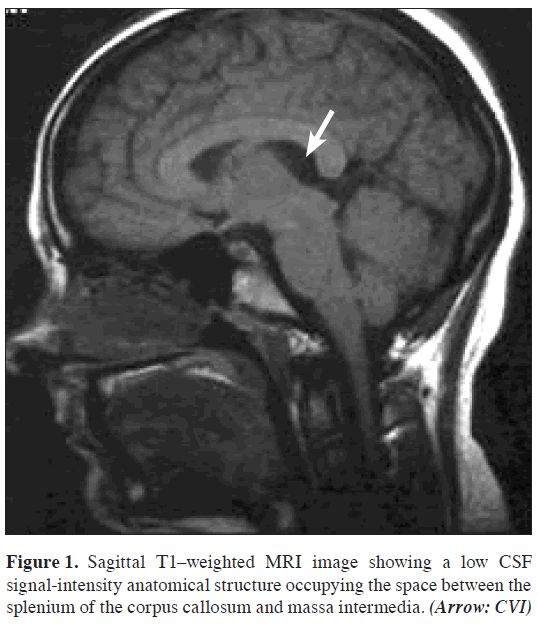
Figure 1: Image IRM sagittale pondérée Τ1 montrant une structure anatomique à faible intensité de signal du LCR occupant l’espace entre le splénium du corps calleux et la massa intermedia. (Flèche : CVI)
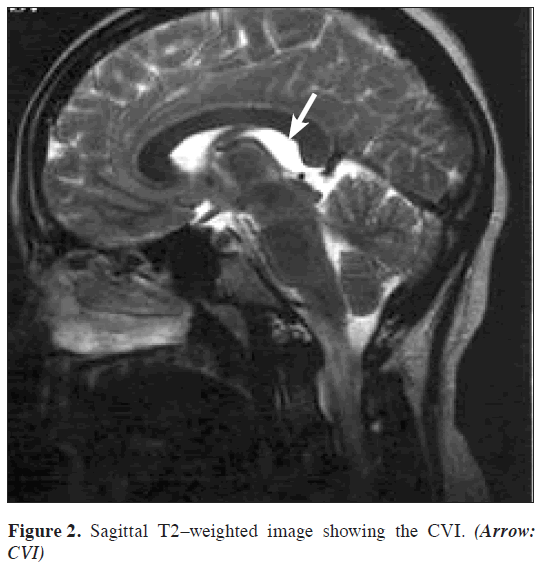
Figure 2: Image sagittale pondérée Τ2 montrant l’ICB. (Flèche : CVI)
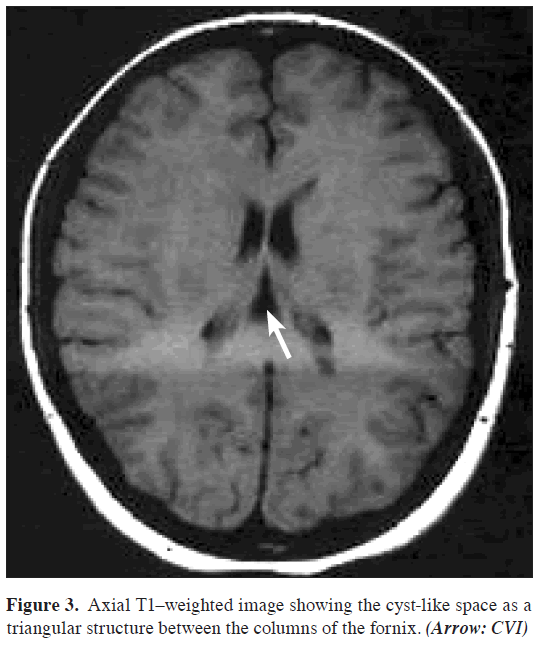
Figure 3: Image axiale pondérée en T1 montrant l’espace en forme de kyste sous forme de structure triangulaire entre les colonnes du fornix. (Flèche : CVI)
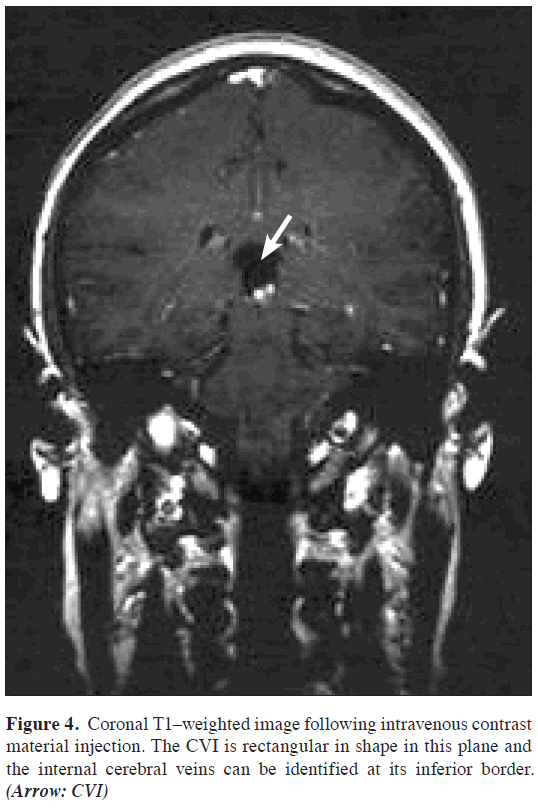
Figure 4: Image coronale pondérée T1 après injection intraveineuse de produit de contraste. L’ICB est de forme rectangulaire dans ce plan et les veines cérébrales internes peuvent être identifiées à sa bordure inférieure. (Flèche: CVI)
Discussion
Α Une variété de kystes de la ligne médiane du cerveau antérieur contenant du LCR existe et peut être trouvée, de l’avant à l’arrière, en quatre variantes: absence septum pelucidum (ASP), cavum septi pellucidi (CSP), cavum vergae (CV) et cavum veli interpositi (CVI). Ce sont toutes des anomalies kystiques du septum pellucidum, qui ont été décrites pour la première fois dans les années 1600 et sont notées dans l’embryon humain couronne-croupe de 110 mm. La génétique précise de ces kystes intracrâniens est inconnue chez l’homme. Cependant, dans une autre étude, il a été démontré que la dysmorphologie du corps calleux est le résultat de plus d’un locus génétique majeur chez des souches de souris consanguines.
Ces kystes surviennent au cours du processus de développement du cerveau dans la vie embryonnaire et sont en fait des espaces sous-arachnoïdiens, qui régressent entre le septième mois de la vie intra-utérine et la deuxième année de la vie postnatale. Ils sont normalement présents pendant la vie fœtale et dans une certaine proportion de la population adulte, ils sont donc appelés « structures primitives persistantes ».
Comme ces trois cavités du cerveau ne sont pas tapissées par des cellules de l’épendyme ou du plexus choroïde, elles ne produisent pas de liquide céphalo-rachidien et ne sont donc pas considérées comme faisant partie du système ventriculaire. Ils sont en contact direct avec l’espace sous-arachnoïdien mais pas avec le système ventriculaire.
La plupart de ces collections de liquides sont bénignes et disparaissent avec le temps, généralement peu après la naissance, sans conséquence; cependant, certains patients peuvent avoir des associations ou potentiellement devenir symptomatiques principalement en raison de l’effet de masse de ces cavités.
Α kyste septal persistant enfermé par les feuilles du septum pellucidum est appelé cavum septi pellucidi (CSP) et est situé entre les cornes frontales des ventricules latéraux. L’extension d’un CSP postérieurement, au-delà des colonnes du fornix et du foramina de Monro a été appelée cavum vergae (CV). CV coexiste toujours avec CSP.
Cisterna interventricularis, ventriculi tertii, fissure transversale et fissure sous-trigonale sont également des termes utilisés à la place de cavum velum interpositum, qui a été décrit pour la première fois dans les années 1930 par Kruse et Schaetz. Cavum veli interpositi, bien qu’il s’agisse d’une structure normale chez le fœtus, régresse généralement avec le temps et n’est pas une découverte courante chez les adultes. La persistance chez les enfants de 1 à 10 ans est d’environ 30%.
Il y a eu quelques études concernant l’incidence de l’ICC dans la population adulte générale. Cette incidence est variable et dépend de la population étudiée.
Cheng et al. dans une étude échographique sur les prématurés, l’incidence de l’IVC était de 21%.
Picard et al. en étudiant les examens pneumoencéphalographiques des nourrissons avec (n = 53) et sans (n = 105) IVC, a déclaré que l’incidence de l’IVC diminuait avec l’âge et n’avait aucune prédilection pour le sexe. L’ICB a été détectée chez 34% des nourrissons ayant subi une pneumoencéphalographie.
Dans une étude CT de 442 adultes de plus de 18 ans, qui recevaient un traitement médical dans un service de neurochirurgie sans résultats cliniques d’anomalies kystiques de la ligne médiane, il a été constaté que l’ICB avait une incidence de 7,24%.
Dans une étude IRM de 505 patients non phsychotiques âgés de 2 mois à 79 ans avec divers prédiagnostics, une incidence d’ICC de 5,54% a été déterminée. Il n’y avait pas de différence statistiquement significative dans la fréquence de l’IVC entre les sexes et entre les groupes d’âge. Il a été démontré que l’ICB est deux fois plus fréquent que le cavum vergae. CVI peut être confondu avec CV. Cependant, un CV coexiste toujours avec un CSP et la localisation des veines cérébrales internes, comme on le voit à l’IRM, peut aider à les différencier. CV se trouve au-dessus de ces veines, alors que CVI les entoure.
Il est également important de différencier l’ICB d’un kyste pinéal pathologique ou d’un kyste arachnoïdien de la citerne quadrigéminale. Encore une fois, l’emplacement des veines cérébrales internes peut fournir des informations utiles sur l’origine du kyste, car la glande pinéale se trouve en dessous des veines cérébrales internes, alors que l’ICB enferme les veines à ses frontières latérales et inférieures.
Peu d’associations ont été rapportées avec la présence de cette cavité. La signification clinique de l’ICB n’est pas claire.
Fait intéressant, dans une autre étude, il a été rapporté des jumeaux monozygotes, l’un avec cavum velum interpositum et psychose et l’autre sans une telle anomalie. Pour les auteurs, cette découverte peut indiquer un processus dysgénique au début du développement du cerveau et donc jouer un rôle dans l’étiologie de la psychose. À leur avis, un ICB important peut avoir une signification clinique. Selon cette étude, une possibilité est que les personnes présentant des anomalies du développement soient plus sujettes à la pshychose si elles portent également des facteurs de risque génétiques supplémentaires.
En étudiant les échographies de deux fœtus atteints d’ICB et d’IRM postnatales, il n’y a eu aucune anomalie concernant la croissance et le développement. Il a été conclu qu’une évaluation plus approfondie est nécessaire pour déterminer s’il existe une association entre la présence d’ICC et les troubles neuropshychiatriques.
Un syndrome a été proposé qui se caractérise par une augmentation progressive de la taille de la tête, une dilatation ventriculaire modérée sans hypertension intracrânienne et CVI. Les enfants atteints d’ICB dilaté peuvent devenir symptomatiques et présenter une grosse tête, une hydrocéphalie, un retard mental et des convulsions.
La fenestration ventriculaire endoscopique est le traitement de choix pour ces gros kystes du LCR lorsqu’ils deviennent symptomatiques, car elle assure la communication entre le kyste et le système ventriculaire et empêche le shunt venticulopéritonéal du kyste.
Dans une étude de frères jumeaux identiques présentant des kystes intracrâniens de la ligne médiane, une légère hypertrophie ventriculaire et une macrocéphalie; il a été montré que les kystes étaient oblitérés lors d’une imagerie en série et que la taille des ventricules diminuait, suivie de la chute de la circonférence de la tête de chaque enfant sur la normale. Il a été suggéré que certains nourrissons atteints de kystes intracrâniens de la ligne médiane et de macrocéphalie pourraient représenter des épisodes transitoires d’augmentation de la pression intracrânienne due à un effet de masse qui, s’ils sont simplement observés, se dissiperont avec l’effondrement de la cavité de la ligne médiane. Le shunt ou la fenestration des kystes de la ligne médiane chez les nourrissons atteints de macrocéphalie et de ventricules légèrement dilatés doivent être soigneusement décidés. Un tel phénomène ne se produit pas normalement lorsque l’ICB existe, car l’ICB communique avec les citernes adjacentes et ne provoque généralement pas d’effet de masse ni d’hydrocéphalie.
Dans la littérature, il avait été décrit une transformation de l’ICB de la citerne en kyste. L’intermittence des symptômes s’explique par une connexion de type vanne à bille entre la cisterna CVI et la cisterna venae magnae Galeni.
D’autres cavités persistantes de la ligne médiane telles que cavum septi pellucidi et cavum vergae n’ont pas été reconnues chez notre patient. L’ICB était probablement une découverte fortuite, qui s’est produite en raison de la tendance à effectuer une IRM cérébrale chez les patients souffrant de maux de tête, et n’a pas provoqué de symptômes.
Dans toutes les études concernant ces variantes anatomiques (CSP, CV, CVI), on peut observer que pour leur différenciation, la localisation des veines cérébrales internes est d’une grande importance. En d’autres termes, tous ces espaces contenant du LCR se développent autour des veines cérébrales internes. Les sinus sagittaux, les sinus sigmoïdes et les veines cérébrales internes représentent les structures veineuses les plus courantes, que l’on peut trouver chez chaque individu. La signification clinique très importante de la perméabilité des veines cérébrales internes est démontrée par le fait que, dans leur thrombose, un œdème thalamique sévère suit qui peut à son tour entraîner la mort.
La consistance d’apparition des veines cérébrales internes et la connaissance de la relation entre pression veineuse et pression du LCR nous conduisent à l’hypothèse que tous ces espaces du LCR, s’ils existent, régulent d’une certaine manière fonctionnelle l’équilibre du LCR et de la pression veineuse du cerveau.
La taille du ventricule dépend de la turgescence cérébrale et de la pression ventriculaire latérale. Si un drainage veineux altéré se produit rapidement et que les ventricules latéraux peuvent se vider, les ventricules seront petits. En cas d’infections cérébrales primaires, le cerveau devient œdémateux et les ventricules ont tendance à se vider lorsque le LCR passe dans la colonne vertébrale. L’état des patients deviendra critique lorsque les espaces sous-arachnoïdiens intracérébraux seront effacés.
Un mécanisme possible dans notre cas peut être l’augmentation du débit de LCR dans ces espaces supplémentaires (CSP, CV, CVI) à partir des espaces sous-arachnoïdiens intracérébraux et des citernes, en cas de pression élevée de LCR intraventriculaire pouvant entraîner une diminution de la pression des veines corticales. Dans les images IRM de notre patient, nous avons également observé que les espaces sous-arachnoïdiens de l’ensemble du cerveau n’étaient pas dilatés et étaient occupés par un parenchyme cérébral. On peut observer ces cavités du LCR en l’absence de compensation du LCR via des espaces sous-arachnoïdiens dilatés. D’autres études cliniques doivent être effectuées afin de soutenir cette hypothèse.
- Rossitch E Jr, Wilkins RH. Kystes intracrâniens de la ligne médiane du développement. Dans : Wilkins RH, Rengachary SS, éd. Neurochirurgie, Vol. 3, 2e Éd., New York, McGraw-Hill. 1996; 3707–3708.
- Chen CY, Chen FH, Lee CC, Lee KW, Hsiao HS. Caractéristiques échographiques du cavum velum interpositum. Le Neuroradiol. 1998; 19: 1631–1635.
- Picard L, Leymarie F, Roland J, Sigiel M, Masson JP, André JM, Renard M. Cavum veli interpositi. Anatomie de Roentgen: pathologie et physiologie. Neuroradiologie. 1976; 10: 215–220.
- Macpherson P, Teasdale E. CT démonstration d’un 5e ventricule, une découverte pour les boxeurs KO? Neuroradiologie. 1988; 30: 506–510.
- Wahlsten D, Bulman-Fleming B. Retarded growth of the medial septum: a major gene effect in acallosal mice. Brain Res Dev Brain Res. 1994; 77:203-214.
- Supprian T, Bengel D, Hofmann E, Fallgatter AJ, Franzek E. Cavum veli interpositi et trouble psychotique chez un jumeau monocygotique. Eur Arch Psychiatry Clin Neurosci. 2000; 250: 76–78.
- Bruyn GW. Agenesis septi pellucidi, cavum septi pellucidi, cavum vergae et cavum veli interpositi. Dans : Vinken PJ, Bruyn GW, éd. Manuel de neurologie clinique. Malformations congénitales du cerveau et du crâne. Amsterdam, Elsevier / Hollande du Nord. 1977; 299–336.
- Kier LE. La base évolutive et embryologique du développement et de l’anatomie du cavum veli interpositi. Le Neuroradiol. 1999; 20: 1383–1384.
- Gubbay SS, Vaughan R, Lekias JS. Hydrocéphalie intermittente due à des kystes du septum pellucidum: une étude de trois cas. Clin Exp Neurol. 1977; 14: 93–99.
- Wester K, Pedersen PH, Larsen JL, Waaler PE. Aspects dynamiques de l’expansion du cava septi pellucidi et vergae. Acta Neurochir (Vienne). 1990; 104: 147–150.
- Akgun Z, Gumusburun E, Akgun M, Goksel HM, Yucel F. Anomalies des cavités médianes du cerveau: Une étude de tomographie informatisée. Turk J Med Sci. 2000; 30: 271–274.
- Aldur MM, Celik HH, Gürcan F, Sancak T. Frequency of cavum veli interpositi in non-psychotic population: a magnetic resonance imaging study. J Neuroradiol. 2001; 28: 92–96.
- Shah PS, Blaser S, Toi A, Fong K, Glanc P, Babul-Hirji R, Rutka J, Chitayat D. Cavum veli interpositi: diagnostic prénatal et résultat postnatal. Prénat Diagn. 2005; 25: 539–542.
- Kempe LG, Busch E. Signification clinique de la cisterna veli interpositi. Acta Neurochir (Vienne). 1967; 16: 241–248.
- Raimondi AJ, Gutierrez FA, Jones RR, Winston SR. Cavum veli kystique interpositi associé à une hydrocéphalie normale ou à basse pression. Cerveau d’enfant. 1975; 1: 291–305.
- Gangemi M, Donati P, Maiuri F, Sigona L. Kyste du velum interpositum traité par fenestration endoscopique. Surg Neurol. 1997; 47: 134–137.
- Tubbs RS, Oakes WJ, Wellons JC. Kystes intracrâniens de la ligne médiane chez des frères jumeaux identiques. J Pediatr Neurol. 2004; 2: 107-110.
- Herrmann KA, Sporer B, Yousry TA. Thrombose de la veine cérébrale interne associée à un œdème thalamique unilatéral transitoire: rapport de cas et revue de la littérature. Le Neuroradiol. 2004; 25: 1351–1355.
- Portnoy HD, Branche C, Castro ME. La relation de la pression veineuse intracrânienne à l’hydrocéphalie. Enfants Nerv Syst. 1994; 10: 29–35.
- Williams H. L’hypothèse veineuse de l’hydrocéphalie. Hypothèses Med. 2008; 70: 743–747.