abstrakt
cirrhotisk kardiomyopati er en nyligt anerkendt tilstand bestående af myokardisk dysfunktion manifesteret hos cirrotiske patienter i fravær af tidligere hjertesygdom. De underliggende patogenetiske mekanismer inkluderer et” miokardiotoksisk ” miljø, der fører til et stumpt hjerterespons på stress, hvad enten det er fysisk eller farmakologisk. Denne tilstand er nu bedre forstået og kan diagnosticeres understøttet klinisk ved laboratorie elektrokardiografi og ekkokardiografi kriterier. Klinisk er systolisk inkompetence mest tydelig, når cirrotiske patienter placeres under stress, hvad enten det er fysisk eller farmakologisk. På trods af at man er godt forstået, mangler der viden til en ordentlig praktisk anvendelse. Nylige sagsrapporter har antydet, at CCM skal behandles tidligt, fordi det kan være en udløsende faktor for cirrose komplikationer. Undersøgelser er nødvendige for at identificere potentielle behandlinger, der ændrer den naturlige historie af hjertesygdomme hos cirrotiske patienter, især i de faser, hvor patienterne er asymptomatiske.
nøgleord
levercirrhose, hjertesvigt, kardiomyopati
introduktion
cirrotisk kardiomyopati (CCM) er en hjertedysfunktion, der er kendetegnet ved suboptimal kontraktil respons på stress og nedsat diastolisk funktion i fravær af tidligere hjertesygdom . I dag har forskning foreslået, at cirrotiske patienter har en iboende hjertedysfunktion, der kan påvirke udviklingen af nyresvigt ved avanceret leversygdom .
siden 2002 har resultaterne om cirkulationsdysfunktion i leversygdom udviklet sig gennem diagnostiske metoder og understreger vigtigheden af identifikation af CCM i klinisk praksis . Der er dog stadig et hul i viden om styring af denne tilstand . Tilstedeværelsen af myokardisk dysfunktion ved cirrose øger risikoen for hepatorrenalt syndrom (HRS) og uønskede hjertehændelser, og det er relateret til højere dødelighed .
vi gennemgik den tilgængelige litteratur i PubMed vedrørende markørerne for cirrose komplikationer og interaktioner mellem hjerte og lever. Formålet med denne gennemgang er at diskutere behovet for tidligt at spore og behandle CCM, da det kan være en udløsende faktor for cirrose komplikationer, hvilket bringer ny indsigt i klinisk praksis.
Definition og prævalens
CCM beskriver hjerte kronisk dysfunktion hos cirrotiske patienter på trods af ingen tidligere strukturel hjertesygdom . Det defineres af et eller flere af følgende: strukturelle abnormiteter i hjertekamre; diastolisk dysfunktion; normal eller forstærket systolisk funktion i hvile, men dårlig kontraktil reaktion på stress; og elektrofysiologiske ændringer . Disse abnormiteter kan observeres hos op til 50% af cirrotiske patienter .
Fysiopatologi
Cirrhosis fysiopatologi kendes ved overproduktion af salpetersyre (NO) i splanchniske kar og deraf følgende systemisk vasodilatation. Denne mekanisme udløser rennin-angiotensin-aldosteronsystem (RAAS) og sympatisk nervesystemaktivering og stiger serum vasopressin niveau, hvilket fører til en hyperdinamisk tilstand, der kan repercute fra cellulære til kliniske indstillinger.
disse patienter har et øget serum kulilte (CO) sekundært til sympatisk hyperaktivitet og inflammatoriske cytokiner. Der er en stigning i CO, forbundet med høje NO-niveauer, akkumulering af endocannabinoider og andre vasodilatorer. Disse stoffer øger cyklisk guanosinmonophosphat (cGMP) leves, som hæmmer cyklisk adenosinmonophosphat (cAMP) i kardiomyocitter, der er ansvarlig for calciumtilstrømning og større kontraktil kraft (figur 1,2) . Myokardcelleanalyse viser en reduktion i plasmatisk membranfluiditet på grund af kolesterolaflejring, hvilket vanskeliggør interaktionen mellem stoffer, såsom beta-adrenerge receptorer og G-proteiner . Den ventrikulære myocit kan også have et fald i kaliumkanalfunktionen, hvilket fører til en suboptimal hjerteafslapning og deraf følgende diastolisk dysfunktion .
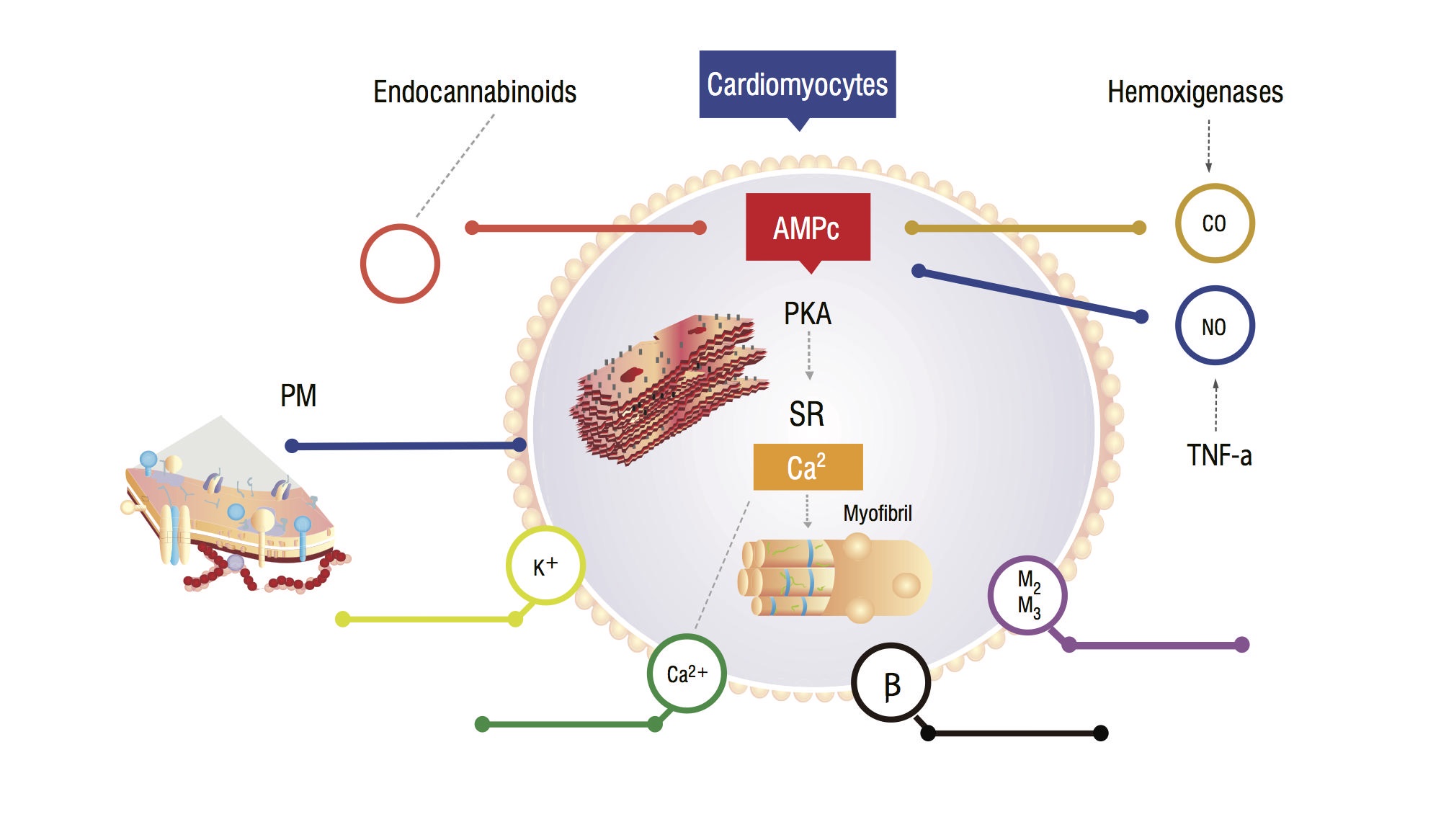
Figur 1. Fysiopatologisk model af kardiomyocyt, der viser hovedsignalveje, der fører til et blunded myocardial respons på stress. TNF-a: tumornekrosefaktor alfa; SR: Sarkoplasmatisk reticullum; AMPc: cyklisk adenosinmonophosphat; PKA: proteinkinase A.
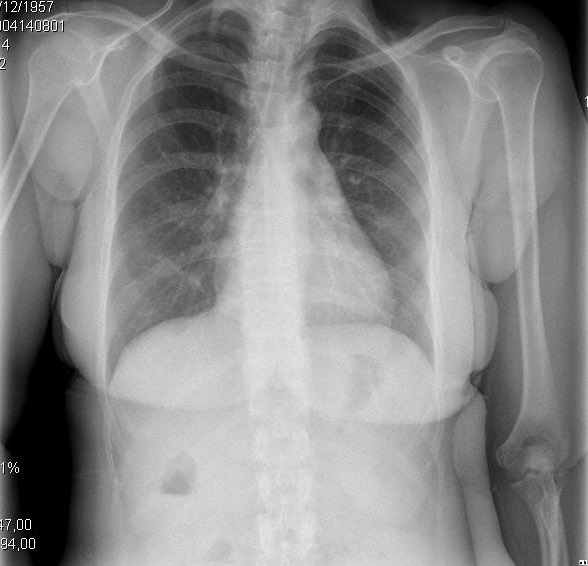
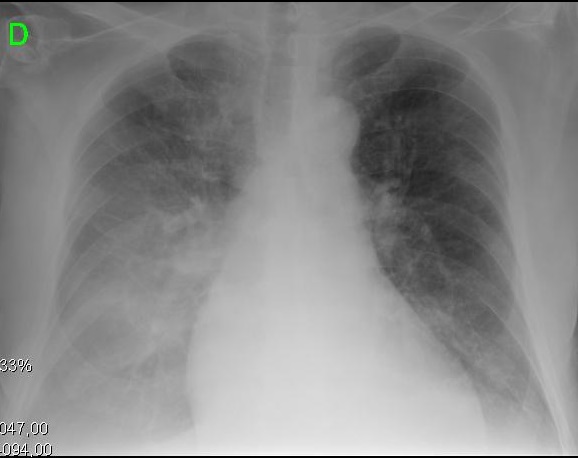
figur 2. Kliniske og radiologiske præsentationer af forskellige evolutionære stadier af cirrotisk kardiomyopati. A. venstre billede viser lille pleural effusion og CTI på 0,50. B. højre billede viser en alvorlig lungestop og CTI på 0,67.
tabel 1. Kliniske og gratis kriterier for diagnose af CCM. Tilpasset fra fra reference 29 med tilladelse.
den vedvarende beta-adrenerge stimuli inducerer nedregulering og reducerer hjertreceptortætheden, hvilket ændrer signalkaskader, der er ansvarlige for calciumkanalaktivering ; resultatet er en nedsat kontraktil funktion . Klinisk konsekvens af denne vej er en stump myokardiefunktion og en stigning i hjertebiomarkører .
identifikation af CCM er afhængig af subtile kliniske træk, der kan afsløres, når sygdommen skrider frem, eller kan blive tydeligt tydelige i specifikke kliniske scenarier af stamme og bliver en udfordring med hensyn til, om og hvornår man skal behandle.
naturhistorie og diagnose
diagnostiske kriterier er opsummeret i tabel 1 og er afhængige af kliniske, billeddannende og biomarkører.
kliniske træk
kliniske træk ved CCM kan forekomme hos patienter med en tilsyneladende normal hjertefunktion, da kronisk tilpasning af kardiomyocyten til det cirrotiske miljø fører til alle disse cellulære modifikationer .
cirrhotiske patienter udvikler sig med natrium-og væskeretention, perifer vasodilatation, sympatisk hyperaktivitet og akkumulering af “miokardiotoksiske” stoffer , der kræver en adaptiv proces af kardiomyocyt. Denne kontinuumbalance kan brydes og afmaske en latent hjertesvigt i stresssituationer, såsom levertransplantation, transjugulær intrahepatisk portosystemisk shunt eller infektioner .
selvom cirrhotisk kardiomyopati har tendens til at være en kronisk tilstand, viser undersøgelser, at kliniske tegn på myokardiedysfunktion kan vende i op til 15 måneder efter vellykket levertransplantation samt forlængelse af KVT .
laboratoriefund
da hjertedysfunktion kan afspejles af inflammatoriske biomarkører, undersøges nye hjerte-og proinflammatoriske markører for nylig og korreleres med udviklingen af komplikationer, der fører til øget dødelighed .
nylige undersøgelser beskriver korrelation mellem niveauer af pro-hormon af ANP (proANP) og B-type natriuretisk peptid (BNP), copeptin og højfølsom troponin T (hs-TnT) såvel som opløselig urokinase-type plasminogenaktivatorreceptor (suPAR) og højfølsomt C-reaktivt protein (hs-CRP) og kardiovaskulære komplikationer ved cirrose. Imidlertid evalueres dens kliniske anvendelse stadig .
natriuretisk peptid udskilles af kardiomyocytterne som reaktion på volumen-eller trykoverbelastning eller myokardisk iskæmi for at kompensere RAAS-effekt i natrium-og vandbalance . BNP kan være en af de mest tilgængelige biomarkører, der muliggør en tidlig anerkendelse af hjerteinddragelse . Det er serumkoncentration er højere, jo mere alvorlige lever-og hjertesygdomme .
lovende undersøgelser siger, at høje niveauer af adrenomedullin også ses i cirrose med eller uden klinisk hjerteinddragelse; dette stof frigives i blodgennemstrømningen for at fungere som en vasodilator og sigter mod at reducere afterload . Galectin-3, den seneste undersøgte biomarkør forhøjet hos cirrotiske patienter, har været forbundet med myocardial fibrose og kan korrelere med sværhedsgraden af cirrose. Denne markør viser sig at være mere følsom end BNP i evalueringen af diastolisk dysfunktion, men er mindre specifik .
elektrokardiogram
elektrokardiografiske (EKG) abnormiteter kan bemærkes tidligt hos en asymptomatisk CCM-patient og kan korrelere med ventrikulære arytmier og pludselig død . 30-40% af cirrhotiske patienter, hovedsageligt Child-Pugh B eller C, uanset cirrhosis etiologi .
dette EKG-mønster kan være sekundært til kardiomyocytter repolariseringsabnormiteter i kaliumkanaler og reduktion i koncentrationen af disse kanaler i plasmamembranen som reaktion på mindre modifikationer af portaltrykket . Ioniske kanaler dysfunktioner forårsager derved myokardceller aktionspotentiale forlængelse, hvilket resulterer i længere ventrikulær systole og KT . Længere sammentrækningstid indebærer nedsat afslapning, hvilket forårsager diastolisk dysfunktion .
elektromekanisk afkobling beskrives som en dyssynkroni mellem elektrisk stimulus og systolisk mekanisk respons i hjertet, hvilket fører til progressivt tab af myokardiefunktion og kongestiv hjertesvigt hos disse patienter1 . Den kronotropiske inkompetence er kendetegnet ved sinusknudens manglende evne til at reagere på fysiologiske eller farmakologiske stimuli , en determinant kendsgerning i CCM-fysiopatologi. Disse ændringer er også sekundære til portalhypertension, autonom dysfunktion, hyperdynamisk cirkulation og tilstedeværelsen af de proinflammatoriske faktorer, der påvirker patientens myokardium .
ekkokardiogram
ekkokardiogram giver relevante data om hjertefunktionen og bruges som diagnostiske kriterier for cirrhotisk kardiomyopati .
de vigtigste fund hos disse patienter er end-diastolisk venstre ventrikel (LV) forstørrelse, reduktion af spidshastighed og systolisk deformitetshastighed; øget slutdiastolisk venstre ventrikulært tryk uden passende LVEF-ekspansion. Forstørrelse af venstre atrium (LA) i mere end 34 mL/m2kan foreslå kronisk diastolisk dysfunktion og, når det er forbundet med reduktion af LV-masse, kan antyde dårligere prognose . LA evaluering kan foretages gennem to dimension ekkokardiografi og speckle tracking .
almindelige fund observeret i hjerte-doppler-ekkokardiografi indikerer nedsat myocardial afslapning hos cirrotiske patienter: fald i e / a-forholdet (< 1) og forlænget e-bølge decelerationstid (DT) og isovolumetrisk afslapningstid (IVRT) > 80ms .Jo mere alvorlig er den diastoliske dysfunktion, kortere er IVRT og mitral DT, og højere er e/a-hastighedsforholdet, der karakteriserer avanceret diastolisk dysfunktion, øget LA-tryk og dårligere funktionel klasse.
nylige undersøgelser med global longitudinal strain (GLS) evaluering viser, at dette kan være en nyttig metode til tidlig påvisning af hjertedysfunktion hos den cirrotiske patient, hovedsageligt den systoliske dysfunktion i hvile .
E/A-forhold kan være en pålidelig parameter i diagnosen diastolisk dysfunktion hos cirrotiske patienter, selv med værdier påvirket af patientens hydratiseringsgrad, selvom det kan variere på grund af ascites og en volumenoverbelastning . I mellemtiden repræsenterer den isovolumetriske afslapningstid, selvom den er meget følsom, ikke LV-fyldningen og varierer, når hjerterytmen ændres .
en mild systolisk dysfunktion og en diastolisk dysfunktion kan præsenteres uafhængigt af graden af cirrose. Imidlertid findes den diastoliske dysfunktion oftest hos cirrotiske patienter og går generelt forud for førstnævnte .
Diskussion
denne gennemgang omhandler en stigende identifikation og forståelse af fysiopatologi på CCM, det er korrelation med dårlig prognose hos cirrotiske patienter og opstår bekymring for terapeutisk tilgang.
denne artikel opsummerede de diagnostiske kriterier (tabel 1), der allerede er etableret i den medicinske litteratur, med vægt på de nye biomarkører, der er blevet undersøgt til diagnostisk komplementering. Undersøgelser har vist, at myokardiedysfunktion findes i forskellige stadier af levercirrhose. Det er blevet beskrevet, at hvis patienten har høj BNP og ventrikulær dysfunktion på ekkokardiogrammet, er behandling af nyresvigt meget vanskelig; på den anden side er tidlig indgriben hos patienter, der endnu ikke har etableret hjertesygdom, et område, der endnu ikke er undersøgt.
tabel 1. Kliniske og gratis kriterier for diagnose af CCM. Tilpasset fra fra reference 29 med tilladelse.
kliniske træk
ingen kardiopulmonale symptomer i hvile
lav funktionel hjertereserve
Hiperadrenerg tilstand med natrium-og væskeretention
biomarkører (troponin i, pro-BNP og BNP, andre)
Eletrocardiography
elektrofysiologiske abnormiteter)
ekkokardiografiske kriterier
diastolisk evaluering
E/A-forhold < 1.0 (alder korrigeret)
forlænget isovolumisk afslapningstid (>80msec)
forlænget decelerationstid (> 200msec)
venstre ventrikulær hypertrofi
systolisk evaluering
ejektionsfraktion i hvile < 55%
kontraktil underskud i stress
tegn og symptomer på leversvigt har tendens til at være for sent med subtile kliniske og laboratorie manifestationer, nogle gange vanskelige at fortolke. Specialisten eller endda den praktiserende læge kan blive udsat for en patient med dyspnø-klage uden patologisk jugular hævelse, normale indledende kardiologiundersøgelser, men med høj BNP, som kan repræsentere et tilfælde af CCM.
i modsætning til andre undersøgelser foreslår vores gruppe et fremskridt på dette område, da forståelsen af hjertesygdomme samtidig med cirrose kan muliggøre en tidlig terapeutisk intervention af komplikationer, der kan henføres til udiagnosticeret myokardieinsufficiens. Levertransplantation og tip er specielle kliniske indstillinger, der kan deflagrere hjertesvigt hos disse patienter. Da patienter overlever længere efter disse procedurer, vil klinikere blive konfronteret med forværrede hjerteparametre .
vi mener, at tidlig terapeutisk intervention i CCM er lovende, når det manifesteres af komplikationer såsom ildfast HRS, inden der præsenteres klar lungestop, der kan henføres til myokardieinsufficiens. Litteratur understøtter, at situationer med fysisk eller farmakologisk stress eller infektioner forbundet med latent cirrhotisk kardiomyopati kan resultere i timer, der kan være ildfast over for konventionelle behandlinger og forbundet med dårligere prognose, hvis systolisk dysfunktion er til stede .
vores erfaring tyder på, at præsentation af HRS er en anelse om at indlede behandlingen af myokardiekomponenten. Denne progression til HRS forstås, da eksistensen af CCM er en trigger og vedvarende faktor for HRS, så hvis CCM nærmer sig tidligt i denne sammenhæng, kan HRS have en bedre prognose .
vores gruppe har været banebrydende for behandlingen af patienter med en klinisk diagnose af CCM i progression til SHR ildfast over for konventionelle behandlinger, hvor brugen af dobutamin som redningsterapi til nyrefunktion var vellykket. Målet er at anvende denne teoretiske viden, der foregriber denne komplikation hos patienter med leversygdom i slutstadiet .
på trods af at være godt forstået, er der mangel på viden til en ordentlig praktisk anvendelse. Der kræves en høj grad af klinisk mistanke for at genkende CCM hos den asymptomatiske patient uden tilsyneladende funktionelle begrænsninger, men med subklinisk cellulær og strukturel hjertesygdom.
undersøgelser er nødvendige for at identificere potentielle behandlinger, der ændrer den naturlige historie af hjertesygdomme hos cirrotiske patienter, især i de faser, hvor patienterne er asymptomatiske. Dette repræsenterer et vidensområde, der endnu ikke er udforsket, specielt med hensyn til fremtidige terapeutiske muligheder.
interessekonflikter
forfatterne erklærede, at der ikke er nogen interessekonflikter vedrørende offentliggørelsen af dette papir.
finansiel støtte
ingen.
- Sampaio F, Pimenta J (2016) vurdering af venstre ventrikulær funktion i cirrose: nuværende metoder og fremtidige retninger. Verden J Gastroenterol 22: 112-125.
- Shin JJ, Song JG, Jun ig, Moon YJ, Kvon HM, et al. (2016) effekt af ventrikulo-arteriel kobling på transplantationsresultater i cirrotika: analyse af tryk-volumen kurveforhold. J Hepatol.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) diastolisk dysfunktion i levercirrhose: prognostisk Forudsigelse ved levertransplantation? Transplantation Proc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) overlevelse efter 2 år blandt levercirrotiske patienter påvirkes af venstre atrievolumen og venstre ventrikulær masse. Lever Int.
- m Kurtller S, Henriksen JH (2002) cirrotisk kardiomyopati: en patofysiologisk gennemgang af cirkulationsdysfunktion ved leversygdom. Hjerte 87: 9-15.
- Moccael LO, Bicca J, Jarske L, Oliveira T, Lancieri P, et al. (2016) cirrotisk kardiomyopati: et andet tilfælde af en vellykket tilgang til behandling af hepatorenalt syndrom. Sag Rep Gastroenterol 10: 531-7.
- Timoh t, Protano MA, Vagman G, Bloom M, Vittorio TJ (2011) et perspektiv på cirrhotisk kardiomyopati. Transplantation Proc 43: 1649-1653.
- Ma å, Lee SS (1996) cirrotisk kardiomyopati: at komme til hjertet af sagen. Hepatologi 24: 451-459.
- Sardi EM, Abbate a, Sardi DM, Dobrina a, Margiotta D, et al. (2010) cirrotisk kardiomyopati. J Am Coll Cardiol 56: 539-549.
- Myers RP, Lee SS (2000) cirrhotisk kardiomyopati og levertransplantation. Lever Transpl 6: S44-52.
- vise S, Mortensen C, G JP, Christensen E, Andersen O, et al. (2014) hjerte-og proinflammatoriske markører forudsiger prognose i cirrose. Lever Int 34: e19-30.
- Fattouh AM, El-Shabravi MH, Mahmoud EH, Ahmed VO (2016) evaluering af hjertefunktioner hos cirrotiske børn ved hjælp af serum hjerne natriuretisk peptid og vævsdoppler billeddannelse. Ann Pediatr Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) cirrotisk kardiomyopati?: Implikationer for perioperativ behandling af levertransplantationspatienter 7: 507-20.
- Farr M, Schulse PC (2015) nylige fremskridt inden for diagnose og styring af cirrose-associeret kardiomyopati hos Levertransplantationskandidater: avanceret ekko-billeddannelse, Hjertebiomarkører og avanceret hjertesvigt Terapi. Clin Med Insights Cardiol 8: 67-74.
- Licata A, Corrao S, Petta s, Genco C, Cardillo M, et al. (2013) NT pro BNP plasmaniveau og atrievolumen er knyttet til sværhedsgraden af levercirrhose. PLoS en 8: e68364.
- Abbas, Kasem Ahmed SM, Abdel Aal AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galactin – 3 og hjerne natriuretisk peptid versus konventionel ekkokardiografi i den tidlige påvisning af cirrhotisk kardiomyopati. Turk J Gastroenterol 27: 367-74.
- Vong F, Siu s, Liu P, Blendis LM (2001) hjerne natriuretisk peptid: er det en forudsigelse for kardiomyopati i cirrose? Clin Sci (Lond) 101: 621-628.
- Vong F (2009) cirrhotisk kardiomyopati. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tsiakas D, Ritis K, et al. (2003) forlængelse af KTC-intervallet hos patienter med cirrose. Ann Gastroenterol 16: 155-8.
- Arrhythmia i (2015) Arytmirisiko ved levercirrhose. Verden J Hepatol 7: 662-672.
- Moccael LO, Bicca J, Jarske L, Oliveira T, Lancieri P, et al. (2016) cirrotisk kardiomyopati: et andet tilfælde af en vellykket tilgang til behandling af hepatorenalt syndrom. Sag Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) dispersion: måling og fortolkning.
- P L, Tsifra A, vit l, Papp M, Paragh G, et al. (2014) patofysiologisk og klinisk tilgang til cirrhotisk kardiomyopati. J Gastrointestin Lever Dis 23: 301-310.
- Castro Hevia J, Antselevitch C, iturevne Kristiansand B, Dorantes S KRISTIANSAND M, Dortisk Kristiansand Balea F, et al. (2006) tpeak-Tend og tpeak-Tend dispersion som risikofaktorer for ventrikulær takykardi/ventrikelflimmer hos patienter med Brugada syndrom. J Am Coll Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) evaluering af TP-e-interval og TP-e/ht-forhold hos patienter med kronisk hepatitis B. Prag Med Rep 114: 239-245.
- smykker DP (2006) nye patienter, nye lektioner, ny tænkning i inflammatorisk tarmsygdom: verdenskongres for Gastroenterologi Symposium, Montreal, Canada. Kolorektal Dis 8 Suppl 1 (s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) cirrotisk kardiomyopati: en kardiologs perspektiv. Verden J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) cirrotisk kardiomyopati: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.