introduktion
Helicobacter pylori (H. pylori) er en Gram-negativ mikroaerofil bakterie, hvis naturlige habitat er maven. Selv om det typisk har en bacillær form med flere flageller i den ene ende, det vedtager en coccoid udseende i ugunstige miljøforhold.1,2
H. pylori er en vigtig etiologisk faktor i aktiv kronisk gastritis, mavesår, gastrisk slimhindeassocieret lymfoidvæv (MALT) lymfom og gastrisk kræft. Selvom bakterien anslås at være til stede i maveslimhinden hos halvdelen af verdens befolkning, udvikler disse sygdomme kun hos cirka 15-20% af koloniserede individer.2,3
de mest almindelige behandlingsregimer har resulteret i en udryddelsesrate på omkring 85% i mange geografiske områder,4-6, men effektiviteten er blevet kompromitteret, især i de senere år, af den hurtige fremkomst af antibiotikaresistente stammer og dårlig overholdelse af behandlingen.5,7
det er vigtigt at overveje, at helbredelsen (såvel som forebyggelse af komplikationer) for aktiv kronisk gastritis og mavesår og for nogle lavkvalitetsformer af gastrisk MALT lymfom afhænger af succesen med H. pylori udryddelse. Desuden ville sikring og opretholdelse af vellykket udryddelse af denne mikroorganisme i alle dens biologiske former forhindre gentagelse af infektionen og derfor tilbagefald af sygdommen.
formålet med denne gennemgang er at præsentere en generel oversigt over coccoidformen af H. pylori, der fremhæver dens mikrobiologiske profil, antibiotisk modtagelighed og virulens. Dets involvering i gastrisk sygdom vil også blive analyseret, og i hvilket omfang det er forbundet med infektionsrekrudescens og sygdomsfald vil blive undersøgt.
overlevelse og cellulær tilpasning af H. pylorigenerelle overvejelser
alle levende organismer er udstyret med mekanismer, der gør det muligt for dem at overleve i ugunstige miljøer. For nogle indebærer deres respons (ud over metaboliske tilpasninger) ændringer i cellemorfologi.8,9 flere mikroorganismer har evnen til at differentiere sig til en levedygtig, men ikke-dyrkbar (VBNC) tilstand som reaktion på miljømæssige forhold, der er ugunstige for overlevelse og vækst. Denne strategi anvendes i vid udstrækning af mikroorganismer som Salmonella, Campylobacter og Escherichia.10,11
i vbnc-tilstanden reducerer bakterier generelt deres størrelse og ændrer form til at blive små sfæriske kroppe. De reducerer deres respirationshastighed og næringsstoftransport og ændrer genekspression og molekylær syntese. I denne tilstand kan de ikke detekteres ved hjælp af konventionelle kulturteknikker. Ændringer i miljøforholdene kan dog føre til, at disse mikroorganismer enten “genopliver” (og omdannes til deres aktive tilstand) eller degenererer.10-13
Tilsvarende, H. pylori, når den oplever skadelige miljøforhold (i eller uden for dets naturlige habitat), ændrer sin klassiske bacillære form og går ind i en VBNC-tilstand, der fører til morfologiske og metaboliske ændringer samt ændringer i vækstadfærd.14,15
levedygtig, men ikke-dyrkbar tilstand af H. pylori
selvom nogle forfattere oprindeligt forsøgte at demonstrere, at omdannelsen fra bacillær til coccoidform var en passiv proces,der resulterede i celledød,og derfor at coccoidformerne var de degenererede rester af døde bakterier, 16, 17 tre former for H. pylori anses for øjeblikket for at eksistere, nemlig (i rækkefølge af mest til mindst virulent), den levedygtige, dyrkbare bacillære form, VBNC coccoidformen og den ikke-levedygtige degenerative form.18-20
morfologisk forekommer omdannelse fra bacillær til coccoidform gennem mellemliggende V – og U-former13, 14 (Fig. 1 og 2), Hvor cellestrukturer som cytoplasma og cellemembran forbliver intakte,15, 21, mens flagellaen har tendens til at vikle sig rundt om coccoidcellestrukturen og derved blive næsten usynlig. Andre ultrastrukturelle modifikationer af coccoidformen resulterer i to undertyper. Type A har uregelmæssige kanter med en ru overflade og anses for at være en død celle, mens type B har en glattere overflade, er mindre og anses for at være en levende celle.21,22
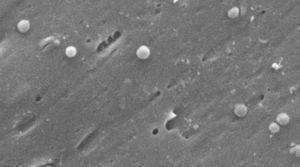
billeder af coccoidformen af Helicobacter pylori. Scanningselektronmikroskopbillede med tilladelse fra Dr. Nuno F. Lepabe-kemisk ingeniørafdeling ved Det Tekniske Fakultet ved Universitetet i Porto (Portugal).
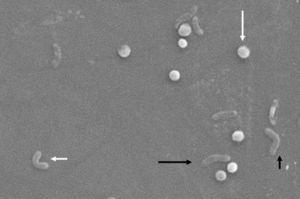
morfologiske ændringer i Helicobacter pylori. Spiralform (lang sort pil), V-form (kort sort pil), U-form (kort hvid pil) og coccoid form (lang hvid pil). Scanningselektronmikroskopbillede med tilladelse fra Dr. Nuno F. Lepabe-kemisk ingeniørafdeling ved Det Tekniske Fakultet ved Universitetet i Porto (Portugal).
i scanningselektronmikroskop (SEM) analyser af overfladen slim gel lag af mavekræftpatienter inficeret med H. pylori, Ogata et al.23 observerede sameksistensen af både bacillære og coccoide former. Andre forfattere har bekræftet tilstedeværelsen af coccoidformen i både den menneskelige mave og tolvfingertarmen,24-26, selvom det ser ud til, at procentdelen af coccoidformer er højere i tolvfingertarmen end i maven, til det punkt, hvor kun coccoidformen observeres i nogle duodenale biopsier.26,27 denne kendsgerning antyder enten, at H. pylori er tvunget til at tilpasse sig biologiske forhold i tolvfingertarmen, eller at disse forhold er ideelle for H. pylori at søge tilflugt der i vbnc-tilstanden.
in vitro-og in vivo-eksperimenter har vist, at under ugunstige forhold som aerobiosis,28,29 alkalisk pH,29,30 høj temperatur,31 lange inkubationsperioder,29,32 langvarig inkubation i vand33 eller behandling med protonpumpehæmmere32 eller antibiotika,34 coccoidfænotypen kan opretholde et vist niveau af metabolisk aktivitet, da den udtrykker en lang række gener,der er til stede i den bacillære form,35 opretholder påviselige niveauer af ureaseaktivitet, 36 fortsætter med at syntetisere proteiner, omend med i mindre mængder (mindre end 1% af mængden af proteiner syntetiseret af bacillær form)37 og producerer små mængder DNA, opretholdt selv efter 3 måneders opbevaring i fysiologisk saltvandsløsning ved 4 kg C. 29,38 alle disse data understreger det faktum, at de biologiske ændringer i H. pylori som reaktion på skadelige stimuli afspejler dens kraftige evne i løbet af dens brugstid til at bevare arten.
biofilmdannelse
som med andre bakterier er H. pylori ‘ s evne til at fortsætte som en infektiøs enhed og modstå arsenalet af antimikrobielle midler, der sigter mod at udrydde det, på grund af den genetiske variabilitet, der gør det muligt at udvikle bakteriel resistens. Dens overlevelsesstrategi forbedres yderligere, når bakterieceller danner det, der kaldes biofilm.20 biofilm er en slags mikrobielt “samfund”, hvor bakterierne klæber fast til biotiske eller abiotiske overflader ved hjælp af en selvproduceret matrice. Denne matrice, der består af ekstracellulære polymere stoffer,39,40 skaber et miljø, der er meget tolerant over for antimikrobielle midler og stærkt resistent over for fagocytose. Forskellige værtsforsvarsmekanismer undgås derfor, hvilket vanskeliggør udryddelse. Biofilm anses for at være virkelig komplekse, dynamiske systemer, der letter vandret genoverførsel mellem bakterier. De giver således bakteriepopulationer nye modificerede genomer, der bidrager væsentligt til bakteriel resistens, stammevariabilitet og tilpasningsevne.41-43
i en undersøgelse af 21 biopsier fra patienter, hvor bakterien tidligere var udryddet, blev H. pylori isoleret ved dyrkning i 7 af biopsierne, mens genekspressionsteknikker detekterede levedygtige H. pylori-celler i de fleste biopsier. SEM viste i mellemtiden grupperede coccoidbakterier arrangeret i en mikrobiel biofilm, hvilket tyder på, at coccoidformerne kunne lette bakteriel Persistens og antibiotikaresistens.44
modtagelighed for antibiotika i coccoidformen
mange undersøgelser har vist, at H. pylori kan ændre sig fra bacillær til coccoidform ved eksponering (in vitro) til forskellige antimikrobielle midler. Dette er en af de mest almindelige typer af antibiotika, der anvendes til behandling af denne sygdom.34,35,45 den største induktionseffekt er observeret med amoksicillin,27,34,46 kendt for at være yderst effektiv in vitro mod H. pylori; morfologiske observationer af kulturerne viser imidlertid, at bacillære former falder i antal til fordel for coccoidformer.34,46 Faghri et al., 47 opnåede bakteriedræbende virkninger for coccoidformerne ved over 60% med dobbelt så høj inhiberende koncentration (MIC) og ved 80-90% med clarithromycin ved MIC; imidlertid inhiberede amoksicillinbehandling med MIC og MIC-kur 2 ikke levedygtige coccoidformer. Tilsvarende Berry et al.34 bemærkede, at mens amoksicillin ved mic-10 eliminerede bacillære former af H. pylori, inducerede det også dannelsen af coccoidformer. Perkins et al.48 observerede i en undersøgelse af katte inficeret naturligt med H. pylori, at 6 uger efter udryddelsesbehandling var gastrisk juice positiv for H. pylori hos kun en kat, men alligevel identificerede polymerasekædereaktionsanalyse (PCR) H. pylori genetisk materiale hos alle katte i undersøgelsen. Selvom H. pylori blev påvist i en enkelt kat, de histologiske læsioner var i overensstemmelse med kronisk gastritis og var præget af tilstedeværelsen af lymfoide follikler.
under hensyntagen til disse mikrobiologiske og grundlæggende forskningsdata opnåede i en tidligere undersøgelse udført hos patienter inficeret med H. pylori—hvor følsomheden af de isolerede stammer til amoksicillin tidligere blev bestemt—dobbeltbehandling (protonpumpehæmmere og amoksicillin) en hærdningshastighed for amoksicillinfølsomme stammer på kun 66%. Dette resultat viser tilstedeværelsen af vigtige yderligere uafhængige bakterielle resistensfaktorer relateret til den vellykkede anvendelse af dette antibiotikum.49 dette er især tilfældet, hvis vi mener, at det synes umuligt, at coccoidformer kunne være følsomme over for kurs-lactam-antibiotika, fordi coccoidformer har forskellige penicillinbindende proteinprofiler fra bacillære former.50 det er derfor sandsynligt, at ikke alle H. pylori-organismer elimineres fuldstændigt efter udryddelsesbehandling; snarere vil nogle sandsynligvis blive omdannet til coccoidformer og således blive resistente over for antibakterielle lægemidler. Dette ville forklare behandlingssvigt og recrudescence.13,34,45
det er værd at fremhæve, at nogle meget nylige undersøgelser har vist, at frie fedtsyrer, såsom linolensyre og liposomal linolensyre, har en bakteriedræbende virkning på begge H. pylori-former, uanset deres resistens over for antibiotika.51,52 disse molekyler kunne derfor have en potentielt effektiv antimikrobiel virkning til behandling af infektion med H. pylori, især i sin coccoidform.
virulens og patogenicitet af coccoidformen
virulensfaktorerne for den bacillære form af H. pylori og de mekanismer, hvormed denne bakterie er involveret i udviklingen af gastrointestinale sygdomme, er blevet grundigt undersøgt.1,3,4 der er dog lidt kendt om virulensen og patogeniciteten af coccoidformen. Nedenfor gennemgår vi de mest relevante fund om dette emne.
ligesom den bacillære form udtrykker coccoidformen store virulensgener, såsom urinstof, ureB, hpaA, vacA og cagA, cagE og BabA.35,53,54 dette udtryk, der forekommer over en længere periode, spiller sandsynligvis en vigtig rolle i kroniske alvorlige maveforstyrrelser.
tilslutning af H. pylori til det gastroduodenale epitel er kendt for at være et vigtigt skridt i induktionen af aktiv kronisk inflammation i slimhindelaget. Sem-undersøgelser har fundet, at coccoidformen af H. pylori kan præsentere på plasmamembranoverfladen i mavepitelcellerne og ligesom den bacillære form har evnen til at invadere disse celler.15,55 hvis celleinvasion forekommer, er coccoidformerne indesluttet i dobbeltlags membranvesikler, og de gastriske epitelceller forekommer hævede og lytiske, hvilket viser erosion af slimhindelaget.56 Da coccoidformen er mindre modtagelig for antibiotika, antages det, at disse latente plasmamembranformer kan sprede sig og inficere andre nabopitelceller i fravær af en effektiv koncentration af antibiotika.57
H. pylori-infektion er også kendt for at inducere et lokalt immunrespons, der ikke udrydder bakterierne, hvorved mavesygdommen bliver kronisk. Immunresponset kan bestemmes ved antistofdetektion ved anvendelse af serologiske metoder udviklet under anvendelse af den bacillære form af H. pylori.58 faktisk kan tilstedeværelsen af disse specifikke antistoffer anvendes som en epidemiologisk indikator for infektion og for at bekræfte behandlingens succes. Der er dog ingen serologiske metoder, der detekterer coccoidformer. For at bestemme, om coccoidformer havde nogen effekt på immunresponset hos koloniserede individer, Figueroa et al.59 udtænkt en specifik immunosorbentassay (ELISA) teknik til at evaluere og sammenligne immunresponset mod coccoid og bacillære former mod et panel af sera fra symptomatiske og asymptomatiske inficerede individer. Coccoidformerne af H. pylori blev vist at inducere et humoralt immunrespons svarende til det, der induceres af bacillære former hos inficerede individer. I en anden undersøgelse udført hos børn med epigastrisk smerte blev den mulige rolle af coccoidformen i H. pylori-infektion undersøgt ved hjælp af en ELISA-teknik og antigener fremstillet ud fra bacillære og coccoidcelleformer. Det blev fundet, at 13,3% og 55,8% af cellerne var seropositive for antigener af henholdsvis bacillærformen og coccoidformen, mens seropositivitetsværdier for astmatiske børn kun var henholdsvis 7,0% og 26,5%. Denne omtrent firedoblede forskel i seropositivitet mellem coccoid – og bacillærformantigener hos symptomatiske og asymptomatiske patienter kunne antyde en mulig infektiv rolle af coccoidformen af H. pylori.60
Cellini et al.61 intragastrisk inokulerede koncentrerede suspensioner af H. pylori i coccoid form i en BALB/c musemodel. H. pylori blev isoleret 2 uger senere, histopatologiske ændringer forekom 1 måned senere, og alle de koloniserede mus viste et systemisk antistofrespons på H. pylori. I andre forsøg med BALB / C-mus udviklede dyr inokuleret med coccoidformer signifikante patologiske ændringer i maven, herunder erosive læsioner og inflammatorisk celleinfiltration af maveslimhinden.36 hun et al., 53 for at sammenligne virulens og infektivitet inokulerede intragastrisk BALB/c-mus med H. pylori, en gruppe med bacillærformen og en anden gruppe med coccoidformen. I sem-undersøgelsen af prøver fra de 2 grupper observerede de adhærens af både bacillære og coccoidformer til epithelcellerne i mavevæggen og tilstedeværelsen af flagella i coccoidformerne. Histologisk undersøgelse viste forskellige grader af læsioner i maveslimhinden, fra mild inflammatorisk celleinfiltration til erosioner og mavesår. Slimhindelæsionen var mildere hos musene inficeret af coccoidformen, mens et positivt resultat ikke blev opnået i kontrolgruppen, der modtog sterilt vand.53 Rabelo-Gonorus et al.62 viste, at coccoid former af H. pylori inducerede en akut inflammatorisk respons i musens mave fra de tidligste stadier af infektionen. Ovenstående resultater fremhæver coccoidformernes evne til at kolonisere og inficere maveslimhinden in vivo.
flere undersøgelser har afsløret tilstedeværelsen af coccoidformen i vand.33,63 en sådan undersøgelse—af vores gruppe—sammenlignede 2 grupper af fravænnede mus, den ene administrerede brøndvand og ledningsvand i en længere periode og den anden administrerede sterilt destilleret vand, idet man fandt ud af, at studiegruppemusene udviklede en kronisk inflammatorisk proces med dannelse af lymfocytiske plakker og tilstedeværelsen af baciller i overensstemmelse med H. pylori.64
som tidligere nævnt ville det være logisk at antage, at h under ugunstige forhold. pylori går ind i en” hvilende ” tilstand og ændrer sin klassiske bacillære form til coccoidformen uden at producere degenerative ændringer i dens genom og bevarer evnen til at vende tilbage til bacillærformen, når miljø-eller naturlige habitatbetingelser forbedres.
deltagelse af coccoidformen i recrudescence
gentagelse af H. pylori efter vellykket udryddelse er sjælden i udviklede lande sammenlignet med udviklingslande med årlige tilbagefaldshastigheder på henholdsvis 2,67% og 13%.65,66
der er to typer tilbagefald af H. pylori-infektion: recrudescence, når bakteriestammen, der er ansvarlig for gentagelsen, er genetisk identisk med den, der er isoleret før udryddelse; og geninfektion, når gentagelse er forårsaget af en anden stamme.67 differentiering af rekrudescens fra geninfektion kræver PCR-eller genetisk polymorfismanalyse for at identificere bakteriestammer.67,68 da disse metoder ikke anvendes rutinemæssigt, er det ofte umuligt at skelne mellem rekrudescens og reinfektion i rutinemæssig klinisk praksis.
H. pylori-gentagelse er klinisk relevant, da peptisk ulcus-tilbagefald kan observeres hos en betydelig andel af inficerede patienter, mens mikroorganismernes genopståelse kunne forklare nogle malt-lymfom-gentagelser efter behandling.69 faktorer såsom drikkevand fra hanen, tand-og tandkødssygdom, tilbagevendende tonsillitis, indlæggelse, tand-og medicinsk udstyr og kontakt med familiemedlemmer antages at påvirke H. pylori-gentagelse.70-72 andre faktorer forbundet med gentagelse af infektion er yngre alder, diabetes hos unge patienter, lav årlig indkomst og langvarig hæmning af mavesyre efter udryddelse.73-76
Rekrudescens betragtes som den mest sandsynlige årsag til gentagelse i det første år efter udryddelse, mens geninfektion kan forekomme efter en længere periode.68,77 mange tilfælde af tilbagefald i udviklede lande skyldes i virkeligheden recrudescence. Geninfektion er mere almindelig i udviklingslande, da folk tilsyneladende konstant udsættes for H. pylori.65,78
anvendelse af polyacrylamidgelproteinelektroforese teknikker, Costas et al.79 fandt, at patienter med tilbagefald 4 uger efter udryddelsesbehandling faktisk ikke var inficeret med en anden stamme af H. pylori; snarere var stammen, der havde forårsaget den oprindelige infektion, ikke blevet udryddet fuldstændigt ved behandlingen, hvilket førte til recrudescence af infektionen. Derfor er det vigtigt at tage hensyn til effektiviteten af det terapeutiske regime: H. pylori-gentagelse er hyppig hos patienter behandlet med laveffektive terapier, men er sjælden, når der anvendes højeffektive terapier. Dette blev demonstreret ved en undersøgelse af forekomsten af H. pylori-gentagelse i Spanien af Gisbert et al., 80, der fandt, at H. pylori-tilbagefald 6 måneder efter udryddelse var 8,2% hos patienter behandlet med laveffektiv behandling, men kun 1,7% hos patienter behandlet med højeffektiv behandling.
i en undersøgelse udført i Korea fra 2007 til 2010, H. pylori-tilbagefaldshastigheder blev analyseret efter 6 måneders vellykkede første – og andenlinjeudryddelsesbehandlinger med årlig opfølgning-til slutningen af undersøgelsesperioden-baseret på åndedrætsprøver, mavebiopsi og hurtige urease—tests.81 det blev fundet, at de årlige tilbagefaldshastigheder inden for og efter den 2-årige opfølgning var henholdsvis 9,3% og 2,0% efter førstelinjeterapien og henholdsvis 4,5% og 2,9% efter andenlinjeterapien. Forfatterne konkluderede, at den årlige H. pylori-tilbagefaldshastigheder for patienter, der modtog udryddelsesbehandling, viste et kraftigt fald efter den 2-årige opfølgningsperiode. Dette blev anset for tilstrækkelig tid efter behandling til at bekræfte udryddelse og også tilstrækkelig tid til at gøre det muligt at skelne mellem gentagelse og rekrudescens af H. pylori-stammer.81
afsluttende overvejelser og konklusioner
i betragtning af H ‘ s evne. pylori for at komme ind i en VBNC-tilstand, når den udsættes for ugunstige forhold inden for eller uden for dens habitat, er det rimeligt at antage, at antibiotiske behandlingsregimer, der bruges til at udrydde den bacillære form af H. pylori kan inducere VBNC coccoidformer, der er i stand til at overleve i lange perioder i det gastroduodenale miljø. Herfra kan de have direkte og indirekte patogen potentiale, der fører til recrudescence af infektionen og som følge heraf behandlingssvigt, infektion tilbagefald og gentagelse af gastroduodenal sygdom. Vellykket udryddelse kan derfor kræve ikke kun udryddelse af de bacillære former, men også af coccoidformerne eller at sikre, at coccoidformer ikke induceres.
i betragtning af, at da rutinemetoder, der i øjeblikket implementeres i klinisk praksis for at bekræfte H. pylori-udryddelse, ikke kan påvise coccoidformer, kan værter diagnosticeres forkert som fri for infektion; desuden er disse metoder muligvis ikke i stand til at give fuldstændig bevis for det kliniske potentiale for de lægemidler, der bruges til at udrydde H. pylori. For at udryddelse kan betragtes som vellykket anbefales det derfor årlig opfølgning-ved hjælp af ikke-invasive teknikker eller, hvis tilgængelig, molekylære metoder—for at afgøre, om bakterier er blevet fuldstændigt elimineret, især i områder med høj prævalens og hos patienter med risiko for gentagelse.
endelig er der behov for yderligere undersøgelser af coccoid VBNC-formen af H. pylori, dets patogene potentiale, dets involvering i infektion og rekrudescens og dets rolle i dannelsen af biofilm i maven og andre steder i værten. Sådanne undersøgelser ville muliggøre udvikling af både mere effektive diagnostiske protokoller, der undgår undervurdering af kolonisering af H. pylori og af nye terapeutiske strategier, der sigter mod at eliminere coccoidformer og “afvæbne” biofilm.
interessekonflikt
forfatterne erklærer, at de ikke har nogen interessekonflikt.