med sår af sundt væv udfolder en forudsigelig progression af fysiologiske begivenheder. Denne progression kan opdeles i faser af inflammation, proliferation og modning. Hver fase er kendetegnet ved den sekventielle udarbejdelse af karakteristiske cytokiner af specifikke celler. Se billederne nedenfor.
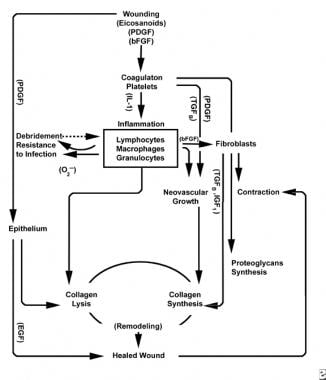 ordninger af sårhelingsprocessen.
ordninger af sårhelingsprocessen. 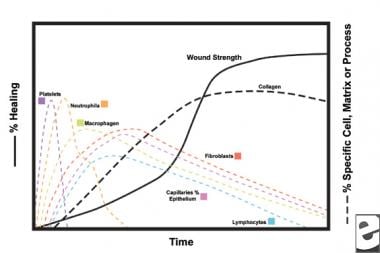 cellulære egenskaber ved sårhelingsprocessen.
cellulære egenskaber ved sårhelingsprocessen. den inflammatoriske fase
den inflammatoriske fase lancerer samtidig hæmostatiske mekanismer og veje, der skaber de klinisk genkendelige kardinal tegn på betændelse: rubor (rødme), calor (varme), tumor (hævelse), dolor (smerte) og functio laesa (tab af funktion).
skade på vaskulært væv initierer den ydre koagulationskaskade ved at frigive intracellulært calcium og vævsfaktor, der aktiverer faktor VII. den resulterende fibrinprop opnår hæmostase hjulpet af refleks vasokonstriktion. Dette stik fungerer som et gitter til aggregering af blodplader, den mest almindelige og “signatur” celletype i den tidlige inflammatoriske fase.
blodplader uddyber et antal proinflammatoriske stoffer, såsom adenosindiphosphat, vævsvækstfaktor beta (TGF-lyrus) og blodpladeafledte vækstfaktorer (PDGF). Disse vækstfaktorer virker på omgivende celler og stimulerer kemotakse af neutrofiler, monocytter og fibroblaster til skadeområdet.
skadede væv, gennem aktiveret phospholipase A, katalyserer samtidig arachidonsyrer for at producere vasoaktive prostaglandiner og tromboksan, kollektivt kendt som eicosanoider. Eicosanoider medierer aktivitet, der påvirker dannelse af blodplader, vaskulær permeabilitet og cellulær kemotakse for at påvirke sårheling. For eksempel medierer tromboksan A2 vasokonstriktion og blodpladeaggregering.
efter indledende vasokonstriktion manifesterer de klassiske tegn på betændelse sig fra øget vaskulær permeabilitet. Rubor er resultatet af vasodilatation, medieret af prostacyclin (BGB 2), prostaglandin A (PGA), prostaglandin D (PGD) og prostaglandin E (PGE). Tumor og calor udvikler sig, når vaskulære endotelhuller forstørres, hvilket tillader udgang af plasmaprotein og væske ind i det interstitielle rum. Disse ændringer forstærkes af PGE2 og prostaglandin F2a (PGF2a) og tillader indtrængen af inflammatoriske celler i skadeområdet, herunder celler, der uddyber. Dolor registreres som PGI2, PGEOG PGE2 handle på perifere nociceptorer.
i den anden fase af den inflammatoriske fase erstatter leukocytter blodplader som den dominerende celletype, tiltrukket af kemotakse. Hvide blodlegemer er de dominerende celler i de første 3 dage efter såret; deres antal topper efter cirka 48 timer. Polymorphonucleocytes (PMN ‘ er) er de første til at begynde bakteriedræbende aktiviteter ved hjælp af inflammatoriske mediatorer og iltfri radikale metabolitter. Imidlertid kan normal sårheling forekomme uden PMNs. En anden leukocyt, hjælper T-cellen, uddyber interleukin–2 (IL-2). IL – 2 fremmer yderligere t-celleproliferation for at forøge det immunogene respons på skade.
da PMN leukocytter begynder at aftage efter 24-36 timer, kommer cirkulerende monocytter ind i såret og modnes til vævsmakrofager. Disse celler debrider såret på det mikroskopiske niveau og producerer en lang række vigtige stoffer, såsom IL-1 og basisk fibroblastvækstfaktor (bFGF). IL – 1 stimulerer proliferationen af inflammatoriske celler og fremmer angiogenese gennem endotelcellereplikation. bFGF er en kemotaktisk og mitogen faktor for fibroblaster og endotelceller. I modsætning til PMN ‘ er forringer makrofagudtømning alvorligt sårheling, da debridement, fibroblastproliferation og angiogenese alle mindskes.
mod slutningen af den inflammatoriske cyklus interagerer det udviklende miljø af eicosanoider i såret med de tilstedeværende celletyper, hvilket resulterer i fibroblastsyntese af kollagen og formalet stof (fra øget forhold mellem PGF2a og PGE2). Derudover er de makrofagafledte vækstfaktorer nu på optimale niveauer, hvilket stærkt påvirker tilstrømningen af fibroblaster og derefter keratinocytter og endotelceller i såret. Da mononukleære celler fortsætter med at erstatte VBC ‘ er og makrofager, begynder den proliferative fase.
den proliferative fase
to til tre dage efter såret vandrer fibroblaster indad fra sårmargener over den fibrinøse matrice, der er etableret under den inflammatoriske fase. I løbet af den første uge begynder fibroblaster at producere glycosaminoglycaner og proteoglycaner, grundstoffet til granulationsvæv, såvel som kollagen, som reaktion på makrofag-syntetiseret bFGF og TGF-kur, såvel som PDGF.
fibroblaster bliver snart den dominerende celletype og topper efter 1-2 uger. De genererer ikke kun kollagenmolekyler, men også cytokiner , såsom PDGF, TGF-Kurt, bFGF, keratinocytvækstfaktor og insulinlignende vækstfaktor-1. Fibroblaster samler også kollagenmolekyler i fibre, som er tværbundne og organiseret i bundter. Kollagen er den vigtigste komponent i akut sårbindevæv, hvor nettoproduktionen fortsætter i de næste 6 uger. Det stigende indhold af sårkollagen korrelerer med stigende trækstyrke.
keratinocytter og endotelceller spredes også i løbet af denne tid og producerer til sidst autokrine vækstfaktorer, der opretholder deres vækst. Endoteludvidelse bidrager til angiogenese, da intakte kar genererer knopper i granulationsvæv. Neovaskularisering letter væksten af den fremrykkende linje af fibroblaster i såret, hvilket giver dem nødvendige næringsstoffer og cytokiner.
nedbrydning af fibrinklumpen og den foreløbige matrice ledsages af aflejring af granulationsvæv (grundstof, kollagen, kapillærer), som fortsætter, indtil såret er dækket. Faldende niveauer af hyaluronsyre (i formalet stof) og stigende chondroitinsulfatniveauer langsom fibroblastmigration og proliferation, mens der induceres fibroblastdifferentiering, overgang til modningsfasen af sårheling.
modningsfasen
i de første 6 uger dominerer ny kollagenproduktion sårhelingsprocessen, deponeret tilfældigt i akut sårgranulationsvæv. Når såret modnes, ombygges kollagen til en mere organiseret struktur med øget trækstyrke. Gradvist erstatter type I kollagen type III, indtil det normale hudforhold på 4:1 opnås. Som remodeling fortsætter, matrice metalloproteinase collagenolyse opnår en stabil tilstand med kollagen syntese. Trækstyrke plateauer ved 80% af den oprindelige styrke cirka 1 år efter skade.
overfladisk til denne aktivitet fortsætter epitelceller med at migrere indad fra sårkanten, indtil defekten er dækket. På dette tidspunkt inducerer kontaktinhibering transformation af fibroblaster til myofibroblaster, som indeholder kontraktile actinfibre. Sårkontraktion følger og erstatter skadet vævsvolumen med nyt væv, skønt myofibroblastens nøjagtige rolle ikke er blevet belyst fuldt ud.
afskrækkende mod sårheling
akutte sår fortsætter generelt gennem en ordnet og rettidig reparativ proces, der resulterer i en holdbar restaurering af anatomisk og funktionel integritet. Imidlertid kan forskellige fysiologiske og mekaniske faktorer forringe helingsresponsen, hvilket resulterer i et kronisk sår, der ikke fortsætter gennem den sædvanlige trinvise progression. Lokal infektion, hypoksi, traumer, fremmedlegemer eller systemiske problemer som diabetes mellitus, underernæring, immundefekt eller medicin er oftest ansvarlige.
alle sår er forurenet, men mest succesfuldt modstå invasiv infektion. Når koncentrationen overstiger 100.000 (105) organismer pr.gram væv eller immunsystemet bliver kompromitteret, opstår der ofte infektion. Cellulitis forlænger den inflammatoriske fase ved at opretholde høje niveauer af proinflammatoriske cytokiner og vævsproteaser, som nedbryder granulationsvæv og vævsvækstfaktorer og ved at forsinke kollagenaflejring.
behandling med antibiotika er en vigtig del af behandlingen med antibiotika. Debridement fjerner devitaliseret væv, som kan være en kilde til endotoksiner, der hæmmer fibroblast og keratinocytmigration i såret. Fremmedlegemer kan også kræve fjernelse, da tilstedeværelsen af en silkesutur reducerer antallet af bakterier, der kræves for at anspore infektion 10.000 gange. (For en detaljeret beskrivelse af teknik, se Medscape Reference artikel sår fremmedlegeme fjernelse.)
cellulær hypoksi forsinker sårheling på forskellige måder. Collagen fibril tværbinding kræver ilt til at hydroksylere prolin og lysin og svigter, når vævstrykket er under 40 mm Hg. Bakteriedræbende styrke leukocyt fosforylering lider også i et hypoksisk miljø, hvilket reducerer tærsklen for infektion. Foranstaltninger til forbedring af iltforsyningen afhænger af etiologien. Tobaksbrug, der forårsager vasokonstriktion og øger blodpladeadhæsion, bør stoppes. Angioplastik eller arteriel bypass-podning kan være nødvendig for perifer vaskulær sygdom. Supplerende foranstaltninger til forbedring af systemisk perfusion i tilfælde af hjertesvigt kan være indiceret. Hæmatokritværdi mindre end 15% bør behandles og euvolæmi genoprettes efter behov. Venøs stasis eller lymfatisk insufficiens kan forbedres med kompressionstøj.
systemisk sygdom kan dramatisk forlænge eller afbryde sårheling. Glykosylering i diabetes mellitus forringer neutrofil og makrofag fagocytose af bakterier, hvilket forlænger den inflammatoriske fase. Den proliferative fase er også langvarig i den samme sygdom, da erythrocytter bliver mindre bøjelige og mindre i stand til at levere ilt til såret til vævsmetabolisme og kollagensyntese.
underernæring resulterer i nedsat fibroblastproliferation, nedsat neovaskularisering og nedsat cellulær og humoral immunitet. Sår udøver øgede metaboliske krav, især inden for granulationsvæv. Aminosyrer som methionin, prolin, glycin og lysin er afgørende for normal cellefunktion og reparation af kutane sår. Fedtsyrer er kritiske bestanddele af cellemembraner og er substratet for eicosanoiderne, der medierer den inflammatoriske proces. Essentielle fedtsyrer linolensyre og linolsyre skal leveres i kosten, da den menneskelige krop ikke er i stand til de novo syntese af disse molekyler.
der skal være tilstrækkelige vitaminer og mineraler til rådighed for cellemetabolisme, der fungerer som cellulære signaler og cofaktorer. C-Vitamin (ascorbinsyre) og jern er nødvendige for hydroksylering af lysin og prolin, som tværbinder og stabiliserer den tredobbelte spiralstruktur af kollagen; kobber spiller også en rolle i stabiliseringen af kollagen. Vitamin A (retinsyre) spiller en vigtig rolle i modulering af kollagenproduktion og nedbrydning og er især vigtig i epithelialisering. En potent antioksidant, vitamin E (alpha tocopherol) ser ud til at fremskynde hud-og knogleheling hos dyr, og tilskud kan have en rolle hos mennesker. Mangel på spormetal er også forbundet med dårlig sårheling; dette bør genopfyldes, alt efter hvad der er relevant.
Ovid skrev angiveligt, ” medicin heler undertiden, undertiden dræber.”Dette er helt sikkert sandt med hensyn til sårheling. Kortikosteroider stumper processerne i hele den inflammatoriske fase. Vitamin A (topisk eller 25.000 IE/D oralt) mindsker de skadelige helbredende virkninger af kortikosteroider, men hepatotoksicitet kan skyldes langvarig brug (dvs. >1 mo). Ikke-steroide antiinflammatoriske lægemidler (NSAID ‘ er) interfererer også med arachidonsyremetabolisme og derfor sårheling. Derudover hæmmer NSAID ‘ er blodpladefunktion, en af de tidligste processer i den inflammatoriske fase.
en undersøgelse foretaget af Sutcliffe et al foreslog, at opregulering af spalteforbindelsesproteinforbindelsen er almindelig for kroniske sår. Undersøgelse af konneksin i tre typer sår-venøst ben, diabetisk fod og tryksår—efterforskerne fandt ud af, at hver type sår viste opregulering af epidermal konneksin 43, konneksin 26 og konneksin 30 såvel som dermal konneksin 43.