på trods af det dramatiske fald i human immundefektvirus type 1 (HIV-1)-relateret sygelighed og dødelighed efter opdagelsen af proteasehæmmere og fremkomsten af kombinations meget aktiv antiretroviral (ARV) – behandling i midten af 1990 ‘ erne svigtede mange patienter stadig behandling på grund af resistens og/eller intolerabilitet (1). Det var tydeligt, at der var behov for flere arv ‘ er, der virkede på forskellige trin i viruslevecyklussen, aktive mod resistente vira og bedre tolereret. Demonstrationen af nøglerollen for kemokinreceptorerne CCR5 og CKSCR4 i HIV-1-indtræden udløste interesse for denne proces som et nyt ARV-mål (2, 3). CCR5 er co-receptoren for størstedelen af HIV-1-stammer, og disse vira kaldes CCR5 tropic (R5). Virusstammer, der bruger CKSCR4, kaldes ckscr4-tropic (4), mens stammer, der kan bruge begge receptorer, er dual-tropic (4). Virus fra en patient kan ofte indeholde blandinger af R5, H4 og dual-tropic stammer, kollektivt kaldet CKS4-ved hjælp af.
CCR5 ‘ s nøglerolle i HIV-1-indtræden kombineret med demonstrationen af, at personer, der var homosygøse for en 32-basepar-deletion i CCR5-genet (CCR5-KUR32) og efterfølgende ikke udtrykker funktionel CCR5, var stærkt beskyttet mod infektion med R5 HIV-1, fokuserede opmærksomheden på CCR5 som et attraktivt mål (5). Selv om nogle undersøgelser har vist subtile virkninger af CCR5-KURR32-mutationen på immunfunktionen, såsom nedsat inflammatorisk score hos hepatitis C-inficerede individer og genopretning fra hepatitis B i heterosygoter; mens homosygoter er mere modtagelige for krydsbåren encephalitis og svær Vestnilvirussygdom, lider disse personer lidt tilsyneladende negative virkninger på deres helbred (5, 6). Dette sammen med det faktum, at medlemmer af den G-proteinkoblede receptor-superfamilie ofte kan spores til udvikling af potente, selektive og oralt biotilgængelige lægemidler (7), førte til indledningen af CCR5-ligandopdagelsesprogrammer af flere grupper, herunder et team fra Global Research and Development baseret på Smørrebrødslaboratorierne i Det Forenede Kongerige.
Maraviroc (UK-427.857, MVC) blev opdaget gennem screening med høj kapacitet af Pfiserforbindelsesbiblioteket ved hjælp af et kemokinradioligandbindende assay. Den mest lovende forbindelse fra screeningsprocessen blev optimeret til styrke mod receptoren, antiviral aktivitet, farmakokinetiske egenskaber og selektivitet mod humane cellulære mål gennem en stor medicinsk kemiindsats, hvor næsten 1000 molekyler blev karakteriseret (7). MVC binder i TRANSMEMBRANLOMMEN på CCR5 og er en langsom offset funktionel antagonist, der forhindrer internalisering (7, 8). Det har potent antiviral aktivitet mod en lang række HIV-1-isolater (7). Sammen med sin fremragende prækliniske sikkerhedsprofil og acceptable farmakokinetik resulterede dette i, at det blev nomineret som klinisk kandidat i December 2000 (7).
det var altid klart, at den kliniske udvikling af CCR5-antagonister ville være udfordrende, da disse ville være de første værtsmålrettede ARV-lægemidler, og vi vovede derfor ind i ukendt territorium. For at foregribe nøglespørgsmål blev der etableret et klinisk udviklingsteam meget kort efter starten af discovery-programmet, og jeg blev rekrutteret til at lede det tidlige udviklingsteam, der blev medlem af Pfis i februar 1999. Vi identificerede flere vigtige udfordringer at tackle i designet af det kliniske program, ud over at demonstrere sikkerhed og effektivitet. Den første af disse var, at der ikke eksisterede nogen kommercielt tilgængelig, klinisk valideret analyse til identifikation af patienter inficeret med R5 HIV-1. Dette var kritisk, da MVC kun er aktiv mod R5 HIV-1-stammer (7). For det andet var der på trods af den tilsyneladende sunde fænotype hos personer med CCR5-KR32 (5, 6) fortsat bekymring med hensyn til sikkerheden ved langvarig eksponering for CCR5-antagonister, da blokering af CCR5 kan være forskellig fra medfødt fravær af CCR5-receptoren, hvor immunsystemet er modnet i fravær af CCR5, og kompenserende mekanismer kan have udviklet sig. Endelig øges forekomsten af HIV-1-inficerede HIV-1-stammer hos HIV-1-inficerede individer med sygdomsprogression og fald i CD4-celletællinger (9), skønt der ikke er påvist nogen årsagssammenhæng mellem ckcr4-brugende virus og CD4-celledepletering. Dette har ført til bekymring for, at selektivt tryk fra en CCR5-antagonist kan få viruspopulationen til at bruge CKS4 og resultere i CD4-cellefald.
fase 1-enkelt-og flerdosisstudier med raske frivillige, udført i 2001 og første halvår af 2002, viste, at MVC var sikkert og veltolereret i flere doser op til 300 mg to gange dagligt (BID), havde en farmakokinetisk profil, der var Kompatibel med oral dosering en gang dagligt (KD) eller to gange daglig, kunne kombineres med andre arv ‘ er, og at doser på 100 mg to gange daglig resulterede i eksponering over det geometriske middel antivirale IC90 in vitro (7, 10). For at demonstrere bevis for farmakologi blev CCR5-receptormætning målt ved hjælp af en skræddersyet eks vivo MIP-1-internaliseringsassay. Dosisafhængig mætning blev påvist med doser på 25 mg daglig dosis, hvilket resulterede i næsten maksimale mætningsniveauer, hvilket øgede den interessante mulighed for, at MVC kunne være effektiv i doser så lave som 25 mg daglig dosis. Receptormætningen forblev høj i flere dage efter, at doseringen blev afbrudt, hvilket afspejler langsom forskydning fra receptoren in vivo (11).
vi var begge begejstrede og opmuntrede af fase 1-dataene og gik hurtigt videre til et fase 2a proof of concept-program. HIV-1-inficerede patienter blev kun screenet for tilstedeværelse af R5-virus ved hjælp af et nyt fænotypisk tropism-assay (Trofile Karrus, Monogram Biosciences, South San Francisco, CA, USA) og modtog MVC som monoterapi i 10 dage (12). CCR5-receptormætning blev målt i denne undersøgelse for at evaluere muligheden for at bruge dette som en biomarkør for effektivitet og i terapeutisk overvågning. De meget ventede data levede op til vores forventninger og viste, at doser på 100 mg to gange dagligt resulterede i gennemsnitlige maksimale HIV-1-RNA-reduktioner på >1.5log10 (figur 1a), med alle patienter, med undtagelse af en patient med H4-virus, der fejlagtigt er inkluderet, og opnåede en HIV-1 RNA-reduktion på mindst 1log10 (12). Dette gav os tillid til, at analysen korrekt identificerede patienter, der sandsynligvis ville reagere på MVC. HIV-1 RNA nadir forekom 1-5 dage efter den sidste dosis MVC, i overensstemmelse med forlænget receptormætning som påvist i fase 1-studierne (12). For alle doser undtagen 25 mg en gang dagligt blev der observeret en receptormætning på >80% i hele doseringsperioden. Der var imidlertid ingen sammenhæng mellem viral belastningsreduktion og grad af receptormætning. Den mest sandsynlige forklaring på dette er, at der kræves meget høje niveauer af receptormætning for antiviral effekt, og den iboende variabilitet af analysen tillader ikke differentiering i den grad (11, 12).
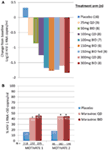
Figur 1. Maraviroc proof of concept og fase 3 effektresultater. (A) gennemsnitlig maksimal ændring fra baseline i HIV-1 RNA hos patienter, der får MVC-monoterapi. Baseret på fase 1-data og modellering og simulering blev doser fra 25 mg en gang dagligt til 300 mg to gange dagligt (inklusive 150 mg to gange dagligt fodret og fastet) valgt. HIV – 1 RNA, sikkerhed og MVC farmakokinetik blev evalueret (12). (B) motivere 1 og 2 – andel af patienter, der opnår HIV-1 RNA <50 kopier/mL ved uge 48. HIV-1-inficerede patienter med R5 HIV-1 og triple class erfaring og/eller resistens blev randomiseret til at modtage MVC-KD eller BID eller placebo i kombination med et optimeret antiretroviralt regime (OBT). P < 0.001 (13, 14).
fase 2A-dataene genererede spænding i hele virksomheden, og vi var ivrige efter at udvikle det kliniske udviklingsprogram så hurtigt som muligt, da der var et stort medicinsk behov for nye arv ‘ er til behandling af patienter uden eller begrænsede behandlingsmuligheder. Det omfattende fase 1-program (inklusive flere lægemiddelinteraktionsundersøgelser) og bredt dosisområde evalueret i fase 2a bevis for konceptundersøgelser sammen med modellering og simulering gav os en meget god forståelse af den sandsynlige effektive dosis af MVC i kombination med andre arv ‘ er. Vi var derfor i stand til at gå direkte til fase 3 effektivitetsundersøgelser, der evaluerede MVC ved 300 mg (eller tilsvarende, afhængigt af co-administrerede lægemidler), uden at det var nødvendigt at udføre enkeltstående fase 2B dosisintervaller og derved forkorte udviklingstidslinjen markant. I slutningen af 2004 indledte vi fire store undersøgelser; Motivere 1 og 2 hos behandlingserfarne patienter med R5 HIV-1 (13, 14), MERIT (et fase 3-studie med en fase 2B-roll-in) hos behandling-na-patienter med R5 HIV-1 (15) og studie a4001029, et fase 2B-sikkerhedsstudie hos behandlingserfarne patienter med ikke-CCR5 tropic virus (CKSCR4-brugende eller ikke-fænotypbar virus) (16).
dette var en massiv virksomhed med 4794 patienter screenet på mere end 200 steder i USA, Canada, Europa, Australien, Sydafrika, Argentina og Argentina. To andre små molekyle CCR5-antagonister (aplaviroc og vicriviroc) blev også evalueret i fase 2b-studier på dette tidspunkt (17, 18). Ud over de sædvanlige udfordringer ved styring af store kliniske studier blev vi kastet to kurvekugler, den første af disse var seponering af aplaviroc på grund af idiosynkratisk hepatotoksicitet. Der var spekulationer om, at dette kunne være en klasseeffekt af CCR5-antagonister, da CCR5-knockout-mus er mere modtagelige concanavalin-en medieret hepatoksicitet (17). Derudover udviklede en patient i MERIT-undersøgelsen alvorlig hepatotoksicitet. Dataene antydede, at det sandsynligvis var relateret til MVC, men en medvirkende rolle for MVC kunne ikke udelukkes (15). En grundig gennemgang af alle data for tegn på hepatotoksicitet for MVC og en høj grad af årvågenhed for eventuelle signaler fandt ingen tegn på en systematisk stigning i levertal eller andre markører for hepatotoksicitet. Kort efter blev der rejst betænkeligheder med hensyn til en potentiel øget risiko for visse maligniteter efter forekomsten af lymfom hos fire patienter, der fik vicriviroc i studie ACTG5211 (18). Oprindeligt var der bekymring for, at dette kunne være en klasseeffekt baseret på CCR5-antagonisternes immunmodulatoriske potentiale, men gennemgang af data fra andre vicriviroc-undersøgelser såvel som de igangværende MVC-undersøgelser understøttede ikke denne teori (18).
data fra Motive 1 og 2 og A4001029 var tilgængelige forud for MERIT, da studiets varighed typisk er kortere for studier med behandlingserfarne patienter. Det var med stor spænding, at vi ventede på uge 24 interimanalyser for MOTIVATIONSUNDERSØGELSERNE i oktober 2006, og vi var glade for at se, at signifikant flere patienter, der fik MVC, havde et HIV-1 RNA på <50 kopier/mL (nøglemarkøren for effekt) sammenlignet med dem, der fik placebo OBT. Dette blev bekræftet af uge 48-dataene, der viste responsens holdbarhed (figur 1b) (13, 14). I modsætning hertil syntes patienter med ikke-CCR5 tropic HIV-1, der fik MVC i A4001029, ikke at opnå signifikant virologisk fordel sammenlignet med placebo (16). Analysen af sikkerhedsdata gav ikke anledning til væsentlige betænkeligheder. Specifikt var der ingen tegn på en negativ effekt på immunfunktionen uden stigning i episoder med infektion eller maligniteter hos MVC-behandlede patienter. Vurdering af virustropisme ved svigt viste, at > 50% af patienterne, der ikke havde MVC-behandling, havde ckscr4-brug af virus ved svigt, men der var ingen tegn på en skadelig virkning på CD4-celletællingstal (14). Virologisk vurdering viste, at den CKS4-anvendte virus, der opstod under MVC-selektivt tryk, var fra en allerede eksisterende minoritetspopulation og ikke opstod de novo (19). Alt i alt viste disse resultater tydeligt fordelene ved MVC i håndteringen af behandlingserfarne patienter med R5 HIV-1. En overordnet indsats fra teamet resulterede i indsendelse af dossierer til registrering i både USA og Europa kun 2 måneder efter, at de midlertidige data blev tilgængelige. MVC (300 mg BID) modtog godkendelse til brug (i kombination med andre arv ‘ er) i USA i August 2007, kun 6.5 år efter det blev nomineret som kandidat til klinisk udvikling. En måned senere blev det også godkendt til brug i denne befolkning i EU.
uge 48-analysen af MERIT-studiet var skuffende, da MVC plus mvidovudin/lamivudin (HIV-1 RNA <50 kopier/mL, 65,3%) ikke opfyldte de forud fastsatte kriterier for non-inferioritet (nedre grænse for det 1-sidede 97,5 konfidensinterval under -10%) til efaviren plus mvidovudin/lamivudin (HIV-1 RNA <50 kopier/mL, 69, 3%) (15). Imidlertid blev patienter til denne undersøgelse screenet for R5-virus ved hjælp af det originale Trofile-assay. Dette assay er i mellemtiden blevet forbedret for at være mere følsomt for påvisning af mindretalspopulationer af cks4-brugende virus. Alle screeningsprøver til patienter i MERIT blev efterfølgende testet igen ved hjælp af den forbedrede analyse og en post hoc-analyse udført, herunder kun patienter, der kun havde R5-virus ved den mere følsomme analyse. I denne analyse var responsraterne for MVC og efaviren 68,3% og 68,5% med den nedre grænse for 97,5% konfidensintervallet over -10% (15). Baseret på disse data blev MVC også godkendt til brug i behandling-na-kurstve-patienter i November 2009 af United States Food and Drug Administration.
MVC har ikke kun vist sig at være en værdifuld tilføjelse til det stadigt voksende ARV drug armamentarium, men data fra disse undersøgelser har forbedret vores forståelse af HIV-tropisme og forholdet mellem tropisme og sygdomsprogression. For mig repræsenterede dette personligt en periode med stor spænding og tilfredshed, både som læge og videnskabsmand.
Forfatterbidrag
ER udarbejdede dette manuskript baseret på hendes personlige erfaring som medlem af MVC-udviklingsholdet. Alle data er blevet offentliggjort i sin helhed andetsteds. Alle undersøgelser blev udført i overensstemmelse med principperne i Helsinki-erklæringen og med alle internationale konference om harmonisering retningslinjer for god klinisk praksis og lokale lovgivningsmæssige og juridiske krav. Alle undersøgelser blev godkendt af uafhængige etiske udvalg, og alle patienter gav skriftligt informeret samtykke.
interessekonflikt Erklæring
Elna Van der Ryst var ansat hos PFIS Global Research and development på det tidspunkt, hvor MVC blev udviklet. Hun leverer i øjeblikket konsulenttjenester til PF.
anerkendelser
jeg vil gerne takke kolleger fra Pfisser, der bidrog til MVC-opdagelses-og udviklingsprogrammet, samt efterforskere og patienter, der deltog i de kliniske studier.
1. Richman DD, Morton SC, Krin T, Hellmann N, Berry S, Schapiro MF, et al. Forekomsten af antiretroviral lægemiddelresistens i USA. AIDS (2004) 18: 1393-401. doi: 10.1097 / 01.støtte.0000131310.52526.c7
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst | Google Scholar
2. T, T, T, T, GP, Martin SR, Huang Y, Nagashima KA, et al. HIV-1-indtræden i CD4+ – celler medieres af kemokinreceptoren CC-CKR-5. Natur (1996) 381: 667-73. doi:10.1038 / 381667a0
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst | Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. HIV-1 entry cofaktor: funktionel cDNA-kloning af en syv-transmembran, G-proteinkoblet receptor. Videnskab (1996) 272: 872-7. doi:10.1126 / videnskab.272.5263.872
CrossRef Fuld Tekst | Google Scholar
4. Berger EA, Doms RV, Feny Larsen EM, Korber BT, Littman DR, Moore JP, et al. En ny klassifikation for HIV-1. Natur (1998) 391: 240. doi:10.1038/34571
CrossRef fuldtekst / Google Scholar
5. Samson M, Libert F, Dorant BJ, Rucker J, Liesnard C, Farber C, et al. Modstand mod HIV-1-infektion hos kaukasiske individer, der bærer mutante alleler af CCR5-kemokinreceptorgenet. Natur (1996) 382:722-5. doi:10.1038 / 382722a0
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst | Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Klinisk anvendelse af CCR5-hæmmere hos HIV og derover. J Transl Med (2011) 9 (Suppl 1): S9. doi:10.1186/1479-5876-9-S1-S9
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst / Google Scholar
7. Dorr P, Vestby M, Dobbs S, Griffin P, Irvine B, Macartney M, et al. Maraviroc (UK-427,857), en potent, oralt biotilgængelig og selektiv lille molekylehæmmer af kemokinreceptor CCR5 med bredspektret anti-human immundefektvirus type 1-aktivitet. Antimicrob Agenter Chemother (2005) 49: 4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Fuld Tekst | Google Scholar
8. T, Rotstein D, Sankuratri S, et al. Molekylære interaktioner af CCR5 med større klasser af små molekyle anti-HIV-1 CCR5 antagonister. Mol Pharmacol (2008) 73:789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstrakt | Pubmed Fuld Tekst | CrossRef Fuld Tekst | Google Scholar
9. Berger EA, Murphy PM, Farber JM. Kemokinreceptorer som HIV-1 co-receptorer: roller i viral indrejse, tropisme og sygdom. Annu Rev Immunol (1999) 17:657-700. doi: 10.1146 / annurev.immunol.17.1.657
Pubmed Abstrakt | Pubmed Fuld Tekst | CrossRef Fuld Tekst | Google Scholar
10. Abel S, van der Ryst E, Rosario MC, James I, Medhurst C, et al. Vurdering af farmakokinetik, sikkerhed og tolerance af maraviroc, en ny CCR5-antagonist, hos raske frivillige. Br J Clin Pharmacol(2008) 65 (S1): 5-18. doi: 10.1111 / j. 1365-2125.2008.03130.
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst | Google Scholar
11. Rosario MC, Dorr P, James i, Jenkins T, Abel S, et al. Farmakokinetisk-farmakodynamisk analyse af CCR5-receptorbelægning af maraviroc hos raske forsøgspersoner og HIV-positive patienter. Br J Clin Pharmacol(2008) 65 (S1): 86-94. doi: 10.1111 / j. 1365-2125.2008.03140.
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst | Google Scholar
12. Hr. formand, hr.formand, hr. formand for Rådet. Effekt af kortvarig monoterapi med maraviroc, en ny CCR5-antagonist hos HIV-1-inficerede patienter. Nat Med (2005) 11:1170-2. doi:10.1038 | Nm1319
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst / Google Scholar
13. Gulick RM, Lalesari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maraviroc til tidligere behandlede patienter med R5 HIV-1-infektion. N Engl J Med (2008) 359:1429-41. doi:10.1056 / NEJMoa0803152
CrossRef Fuld tekst / Google Scholar
14. H, Nelson M, Konourina i, Hoepelman IM, Lampiris H, et al. Undergruppeanalyser af maraviroc ved tidligere behandlet R5 HIV-1-infektion. N Engl J Med (2008) 359:1442-55. doi:10.1056 / NEJMoa0803154
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Taadrous M, Saag M, DeJesus E, et al. Til behandling af antiretroviral-na-Purpur-patienter med CCR5-tropisk HIV-1. J Inficere Dis (2010) 201: 803-13. doi:10.1086/650697
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst / Google Scholar
16. Saag M, Goodrich J, F J. G., Clotet B, Clumeck N, Sullivan J, et al. Et dobbeltblindt, placebokontrolleret forsøg med maraviroc hos behandlingserfarne patienter inficeret med ikke-CCR5-tropic HIV-1: 24-ugers resultater. J Inficere Dis (2009) 11: 1638-47. doi:10.1086/598965
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst / Google Scholar
17. HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Hepatotoksicitet observeret i kliniske forsøg med aplaviroc (GV873140). Antimicrob Agenter Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Abstrakt | Pubmed Fuld Tekst | CrossRef Fuld Tekst | Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su, Henrich TJ, Krambrink A, et al. Lymfomdiagnose og plasma Epstein-Barr-virusbelastning under vicriviroc-terapi: resultater af AIDS-kliniske forsøgsgruppe a5211. Clin Inficere Dis (2009) 48:642-9. doi:10.1086/597007
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst / Google Scholar
19. Han er en af de mest kendte i verden. CKCR4-brug af virus påvist hos patienter, der fik maraviroc i fase III-studierne motive 1 og 2, stammer fra et allerede eksisterende mindretal af ckcr4-brugende virus. Antivir Ther (2007) 12:S65.
Google Scholar