- introduktion
- ChREBP struktur og regulering Via låg/Grace domæner
- aktivering af ChREBP med Glucosemetabolitter
- ChREBP Co-faktorer og partnere
- Chrebp ‘ s rolle i kulhydratmetabolisme og Hepatokinproduktion
- ChREBP som Regulator for hepatisk fedtsyresyntese og VLDL-sekretion
- regulering af Fruktosemetabolisme ved ChREBP i lever og tarm
- regulering af BDK:PPM1K akse i leveren
- ChREBP er påkrævet til Glukosemedieret regulering af FGF21
- Chrebp ‘s rolle i det Interorganiske netværk, der styrer Energihomeostase
- hepatisk ChREBP’ s rolle i kontrollen af Insulinfølsomhedsbalancen
- Adipose ChREBP forbinder lipogenese med insulinfølsomhed
- ny interaktion mellem hormonfølsom Lipase og ChREBP i fedtvæv
- konklusion og fremtidige retninger
- Forfatterbidrag
- finansiering
- interessekonflikt Erklæring
introduktion
øget forbrug af enkle sukkerarter såsom saccharose og majssirup med høj fructose i de senere år har ført til en øget risiko for metaboliske sygdomme som fedme, dyslipidæmi, type 2-diabetes og / eller ikke-alkoholisk fedtleversygdom (NAFLD). Leveren er det vigtigste organ, der er ansvarlig for omdannelsen af overskydende kulhydrater til fedt. De resulterende triglycerider (TG) kan pakkes i lipoproteiner med meget lav densitet (VLDL) og udskilles enten i kredsløbet, opbevares som lipiddråber eller metaboliseres gennem beta-iltningsvejen. Insulin, der udskilles som reaktion på forhøjet blodsukker, stimulerer ekspressionen af gener af de novo fedtsyresyntese (lipogenese) gennem transkriptionsfaktoren sterolregulerende element bindende protein-1C (SREBP-1C)., 1999). SREBP-1C virker i synergi med en anden transkriptionsfaktor kaldet kulhydratresponselementbindingsprotein (ChREBP), som formidler responsen på kulhydrater i kosten. ChREBP-proteinstrukturen indeholder et lavt glukoseinhiberende domæne (låg) og et glukoseresponsaktiveringsbevaret element (GRACE) placeret i dets N-terminal (Li et al., 2006). Aktivering af GRACE-domænet med glukosemetabolitter fremmer chrebp-transkriptionsaktivitet og binding til en stærkt konserveret sekvens kaldet kulhydratresponselement (ChoRE). I nogle tilfælde kan det være nødvendigt at anvende en række forskellige metoder til behandling af chrebp-target-gener, der er til stede på promotorerne af ChREBP-målgener, som koder for nøglesymmer af de novo lipogenese inklusive L-pyruvatkinase (L-pk), et hastighedsbegrænsende middel i glykolyse, fedtsyresyntase (Fas), acetyl-CoA-carboksylase (Acc) og stearoyl-CoA-desaturase (Scd1)., 2001). En nylig undersøgelse rapporterede den indbyrdes afhængighed mellem ChREBP (aktiveret af glucose) og SREBP-1C (aktiveret af insulin) til fuld induktion af glycolytisk og lipogen genekspression i leveren (Linden et al., 2018). Viral genoprettelse af den nukleare aktive form af SREBP-1C i leveren af chrebp-mangelfulde mus (ChREBPKO) normaliserede lipogen genekspression, mens den ikke havde nogen virkning på redning af glycolytisk genekspression. Spejleksperimentet, hvor chrebp-ekspression blev induceret i leveren af srebp-1C knockout-mus, reddede glykolytisk genekspression, men overraskende ikke lipogen genekspression, på trods af den velkendte rolle ChREBP i kontrollen af fedtsyresyntesegener. Ikke desto mindre antyder denne undersøgelse vigtigheden af den dobbelte virkning af ChREBP og SREBP-1C i kontrolgenerne involveret i reguleringen af fedtsyresyntese (Linden et al., 2018).
ChREBP er stærkt beriget i leveren og er blevet undersøgt som en master regulator af lipidmetabolisme., 2004; Osorio et al., 2016). ChREBP udtrykkes også markant i bugspytkirteløer, tyndtarm, skeletmuskulatur og i mindre grad i nyrerne og hjernen (se Richards et al., 2017 til gennemgang). Interessant nok blev en anden isoform af ChREBP, Chrebp Kris, der stammer fra en alternativ første eksonpromotor, først identificeret i fedtvæv (Herman et al., 2012) og senere beskrevet i andre celletyper (se Abdul-Vahed et al., 2017 til gennemgang). Som vi vil diskutere, beskrives Chrebp Krist som en konstitutivt aktiv isoform. Det er håbet, at det fremtidige arbejde vil tage fat på de respektive roller ChREBP og Chrebp kur i reguleringen af glukose og lipidmetabolisme samt identificere deres specifikke og/eller overlappende mål.
ChREBP struktur og regulering Via låg/Grace domæner
ChREBP tilhører Mondo familien af bHLH/lynlås transkriptionsfaktorer. N-terminus-domænet (1-251 rester) indeholder to nukleare eksportsignaler (NES) og et nukleart lokaliseringssignal (NLS), der regulerer subcellulær lokalisering ved at interagere med kromosomregionsvedligeholdelse 1 (CRM1) også kaldet eksportin 1 og/eller 14-3-3 proteiner (Sakiyama et al., 2008). C-terminusregionen indeholder et polyprolindomæne, et bHLH-domæne (660-737 rester) og et leucin-lynlåslignende domæne (Lynlåslignende, 807-847 rester), der er forbundet med co-faktorer og DNA-binding (Yamashita et al., 2001; Fukasa et al., 2010; Ge et al., 2012). Lokalisering og transkriptionel aktivering af ChREBP bestemmes af næringsstoftilgængelighed. Glukosemedieret regulering af ChREBP forekommer mest på niveauet af glukosesensormodulet (GSM) eller mondo-konserveret region( MCR), som er sammensat af låg og GRACE-domæner, som nævnt i indledningen (figur 1A; Li et al., 2006; Singh og Irvin, 2016). I 2012, Herman et al. (2012) beskrev en anden ChREBP-isoform, Chrebp-promotor, der transkriberes fra en alternativ første eksonpromotor 1b til ekson 2 (Figur 1b). Dette transkript er oversat fra ekson 4, der genererer et kortere protein på 687 aminosyrer (ChREBP-isoformen i fuld længde, omdøbt til karrus, indeholder 864 aminosyrer, kaldet ChREBP i manuskriptet), hvor de to NES, NLS og LÅGDOMÆNET mangler. Chrebp-kur er meget aktiv i hvidt fedtvæv på en GLUT-4-afhængig måde og foreslås at blive direkte reguleret af ChREBPa, da en akkordsekvens blev identificeret i eksonpromotoren 1-kur (Herman et al., 2012; figur 1b). Chrebpa ‘ s regulering af Chrebp-krus antyder eksistensen af en fremføringssløjfe, der potentielt forværrer responsen på glukose under hyperglykæmiske tilstande. Imidlertid skal reguleringsmekanismen (- erne) for Chrebp-Kristisoformen og endnu vigtigere dens specifikke funktion belyses.
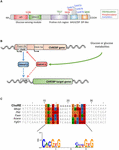
Figur 1. (A) struktur af carbohydratresponselementbindende protein-Krish (ChREBPa). ChREBPa består af 864 aminosyrer og indeholder flere regulatoriske domæner. Ved N-terminalen indeholder proteinet et glukosesensormodul sammensat af det lave glukoseinhiberende domæne (låg) og det glukoseaktiverede konserverede element (nåde). Proteinet indeholder også et polyprolin-rige, et bHLH/lse og et leucin-lynlås-lignende (lynlås-lignende) domæne placeret ved C-terminalen. Posttranslationelle modifikationer er angivet i deres respektive rester, phosphorylering (rød), acetylering (blå) og de nyligt identificerede O-Glcnacyleringer (grøn). B) genstruktur af ChREBP-genet og generering af de to ChREBP-isoformer Rog og ROG. Chrebp-Kris transkriberes fra en alternativ første eksonpromotor 1b.dette transkript oversættes fra ekson 4, der genererer et kortere protein på 687 aminosyrer, hvor de to NES, NLS og LÅGDOMÆNET mangler. Chrebp-Kristisoformen er blevet foreslået at blive direkte reguleret af ChREBPa, da en akkordsekvens blev identificeret i eksonpromotoren 1b. hvorvidt begge ChREBP-kristis-og kristisisoformer begge binder til akkorden vides i øjeblikket ikke. Figur tilpasset fra Herman et al. (2012). (C) Multijustering af akkord-konsensussekvenser præsenteres i flere chrebp-målgenpromotorer. Nukleotidbaseret justering præsenteres øverst på figuren sammen med konsensussekvensopgaven beskrevet i Poungvarin et al. (2015). Logoet, der svarer til konsensussekvensen, der er knyttet til denne særlige justering, er også repræsenteret.
aktivering af ChREBP med Glucosemetabolitter
under faste betingelser, den glucagonafhængige aktivering af proteinkinase a (PKA)., 2002) phosphorylerer ChREBP på rester Ser196 og Thr666, hvilket fører til chrebp-binding til proteinet 14-3-3 og dets tilbageholdelse i cytosolen., 2001, 2002; Davies et al., 2008). AMP-aktiveret proteinkinase (AMPK), en central cellulær energisensor, phosphorylerer også ChREBP på Rest Ser568, hvilket igen nedsætter bindingen af ChREBP til promotorer af dets målgener., 2002; Sato et al., 2016). Det blev påvist, at metabolitter genereret under faste, såsom AMP og ketonlegemer fremstillet af fedtsyreoksidering, spiller en allosterisk hæmmende rolle ved at ændre ChREBP og 14-3-3 proteinaffinitet, øge kompleks stabilisering og favorisere cytosolisk retention (Sakiyama et al., 2008; Mathias et al., 2013; Sato et al., 2016). Som reaktion på kulhydrater reguleres ChREBP på transkriptionelle, translationelle og post-translationelle niveauer. Forhøjede glucosekoncentrationer efter et måltid fremmer syntesen af mellemliggende metabolitter, såsom ksylulose-5-phosphat (H5P), oprindeligt foreslået som en aktivator af proteinphosphatase 2a (PP2A) (Kugaguchi et al., 2001; Kabashima et al., 2003). PP2A blev tidligere beskrevet for at dephosphorylere ChREBP ved ser196-remanensen, hvilket tillod dens translokation til kernen, hvor den yderligere dephosphoryleres på en H5P – og PP2A-afhængig måde (på Thr666 og Ser568). Imidlertid blev denne model udfordret gennem årene, og andre metabolitter såsom glucose-6-phosphat (G6P) blev foreslået at være potentielle aktivatorer af ChREBP-translokation/aktivitet (dentin et al., 2012). McFerrin et al. (2012) identificerede et formodet motiv til G6P-binding (253-SDTLFT-258) på GRACE-domænet, som også er bevaret i MondoA, en chrebp/MondoB ortolog (se Richards et al., 2017 til gennemgang). Ifølge denne hypotese kunne G6P fremme en allosterisk konformationsændring, der inducerer en åben konformation for ChREBP, hvilket letter interaktionen med co-faktorer og efterfølgende translokation til kernen (McFerrin et al., 2012).
inden i kernen kan ChREBP modificeres gennem O-Glcnacylering, en posttranslationel modifikation afhængig af glukosemetabolismen og identificeres som vigtig for chrebp-transkriptionsaktivitet., 2010). O-Glcnacylering forekommer på serin-og threoninrester gennem aktiviteten af O-GlcNAc-transferase (OGT), hvilket tilføjer N-acetylglucosamin (GlcNAc) – rester til målproteiner, hvorved deres aktivitet, stabilitet og/eller subcellulære placering modificeres. Yang et al. (2017) afslørede for nylig flere chrebp-rester modificeret ved O-Glcnacylering. Mutationer af disse rester ved bhlh / lynlås og dimeriserings-og cytoplasmatisk placeringsdomæne (DCD) domæner har tilladt identifikation af Thr517 og Ser839 som væsentlige steder for den glukoseafhængige aktivering af ChREBP (figur 1a). ChREBP kan også modificeres ved acetylering via histonacetyltransferaseaktiviteten af p300 (Bricambert et al., 2010). Glukoseaktiveret p300 acetylerer ChREBP på Lys672 og øger dens transkriptionsaktivitet ved at forbedre dens rekruttering til Akkordsekvensen, som er optimal konsensusbindingssekvens er CAYGYCnnnnnCRCRTG (figur 1C). Poungvarin et al. (2015) analyserede chrebp-bindingssteder med Chipsekv i lever og hvidt fedtvæv hos mus, der blev fodret igen med en fedtfri diæt med højt kulhydratindhold. De rapporterede, at chrebp-binding er beriget i veje involveret i insulinsignalering, vedhængende kryds og kræft, hvilket antyder en ny involvering af ChREBP i tumorigenese og kræftprogression. Endvidere rapporterede en nylig undersøgelse betydningen af ChREBP i hepatocellulært carcinom (HCC) (Ribback et al., 2017). Forfatterne fandt, at genetisk deletion af ChREBP (i chrebpko-mus) nedsat hepatocarcinogenese drevet af proteinkinase B/Akt-overekspression hos mus. Desuden resulterede siRNA-medieret hæmning af ChREBP i mus og/eller humane HCC-celler i nedsat proliferation og apoptose.
ChREBP Co-faktorer og partnere
flere co-faktorer og/eller partnere af ChREBP blev identificeret i de seneste år (se Richards et al., 2017 til gennemgang). Det er en af de mest almindelige typer af transskriptioner, der findes i den menneskelige krop, og som er en af de mest almindelige bindingspartnere for Mondo-familien (Stoeckman et al., 2004). Dimerisering af ChREBP med MLKs er nødvendig for både nuklear translokation som reaktion på glucose og binding til Akkordelementer. Kernereceptorer såsom hepatocyt-kernefaktor 4 (hnf4a) og farnesoid-receptor blev også beskrevet som chrebp-partnere. HNF4a interagerer fysisk med ChREBP ved at binde til den direkte repeat-1 (DR-1) region på promotoren af ChREBP-målgener (Adamson et al., 2006; Meng et al., 2016). Desuden blev P300/CBP-transkriptionelle co-aktivatorproteiner vist at stabilisere ChREBP / HNF4a-komplekset (Burke et al., 2009). P300 / CBP transkriptionelle co-aktivatorproteiner spiller en central rolle i koordineringen og integrationen af flere signalafhængige hændelser med transkriptionsapparatet. En anden nøgleegenskab ved p300/CBP er tilstedeværelsen af histonacetyltransferase (HAT) aktivitet, som giver p300/CBP kapacitet til at påvirke kromatinaktivitet ved at modulere nukleosomale histoner. I humane hepatocytter udløser binding til chrebp-HNF4a-komplekset frigivelsen af ChREBP fra CBP/p300, hvilket fører til rekruttering af histondeacetylase SMRT på Lpk-promotoren og fungerer derved som en co-repressor af ChREBP-transkriptionsaktivitet (Caron et al., 2013). Derudover ændrer CBP / p300 HAT-aktivitet ChREBP på Lys 672, hvilket fører til dets transkriptionelle aktivering som respons på glukose (Bricambert et al., 2010).
Bricambert et al. (2018) identificerede for nylig histondemethylase-planten homeodomain finger 2 (Phf2), som hører til histonlysindemethylase (KDM7) – familien, som en ny cofaktor for ChREBP. Interaktion mellem Phf2 og ChREBP forbedrer chrebp-transkriptionsaktivering ved at slette H3K9-methylmærker på promotoren af dets målgener. Interessant nok bidrager specifik Co-rekruttering af Phf2 og ChREBP til promotoren af nuklear faktor erythroid 2 som 2 (Nrf2) til den beskyttende virkning af Phf2 mod øget reaktiv iltart (ROS) og NAFLD-progression i sammenhæng med hyperglykæmi (Bricambert et al., 2018).
Chrebp ‘ s rolle i kulhydratmetabolisme og Hepatokinproduktion
ChREBP som Regulator for hepatisk fedtsyresyntese og VLDL-sekretion
ikke-alkoholisk fedtleversygdom er et kendetegn for metabolisk syndrom, og undersøgelser hos mennesker afslører, at de novo lipogenese bidrager til ca.25% af de samlede leverlipider hos patienter med NAFLD (Donnelly et al., 2005). I insulinresistente tilstande forbedrer hyperglykæmi og hyperinsulinæmi lipogenese delvist gennem aktivering af ChREBP og SREBP-1C. Chrebp-hæmning i leveren hos overvægtige og insulinresistente ob/ob-mus gennem RNAi eller genetisk ablation fører til reversering af leversteatose (dentin et al., 2006; Iisuka et al., 2006). Ændret sekretion af VLDL i leveren bidrager også til patogenesen af NAFLD. Mikrosomalt triglyceridoverførselsprotein (MTTP) er det protein, der har ansvaret for samling og udskillelse af apolipoprotein B-holdige lipoproteiner. Mangel på MTTP hos mus og mennesker forårsager hypolipidæmi og fedtlever. Regulering af dette protein er blevet forbundet med et par stærkt konserverede cis-elementer i dets promotor inklusive kritiske positive og negative regulatoriske domæner (Cuchel et al., 2013; Hussain et al., 2011). For nylig blev ChREBP påpeget som en potentiel regulator af MTTP, da mangel på funktionel ChREBP i leveren undertrykker mttp-ekspression og VLDL-samling og sekretion., 2018). Da der imidlertid ikke kunne identificeres nogen opgave på mttp-promotoren, vil der være behov for yderligere analyse for at identificere den mekanisme, som ChREBP regulerer Mttp med.
regulering af Fruktosemetabolisme ved ChREBP i lever og tarm
forbindelsen mellem chrebp og fruktosemetabolisme blev først påvist ved den fænotypiske analyse af chrebp knockout-mus (chrebpko-mus). Chrebpko-mus blev rapporteret at dø inden for flere dage efter fodring med høj fructose (hfrd)., 2004). Denne store intolerance over for fructose blev tilskrevet reduktionen i ekspressionen af fructokinase og triosekinase, to fruktosemetabolisme, der kræves til fruktosemetabolisme., 2004). Kim et al. (2016) rapporterede senere vigtigheden af ChREBP for effektiv omdannelse af fruktose til glukose i lever-og helkropsfruktoseclearance, men også under indtagelse af fruktose kunne ChREBP bidrage til hyperglykæmi ved direkte transaktivering af G6pc-ekspression, et Nøglegen for glukoneogenese. Denne effekt kan føre til en ond cirkel, hvor fruktoseforbrug forværrer glukoseproduktionen gennem ChREBP-aktivitet (Kim et al., 2016). Det følgende år, undersøgelsen af Jang et al. (2017) rapporterede, at chrebpko-mus fodret med HFrD udvikler alvorlig leverskade på grund af overaktivering af endoplasmatisk retikulumspænding og CCAAT-enhancer-bindende protein homologt protein (CHOP)-medieret hepatocyt-apoptose. Apoptose i hepatocytter i disse mus var sandsynligvis forbundet med øget kolesterolbiosyntese, da hæmning af denne vej via HMG-CoA-reduktase (HMGCR) eller srebp2-hæmning reddede chrebpko-mus fra HFrD-induceret leverskade. Mangel på ChREBP var også for nylig forbundet med en dysregulering af saccharose-og fructosemetabolisme, der førte til sukkerintolerance og malabsorption hos mus (Kato et al., 2018). Disse virkninger var forbundet med nedsat ekspression af intestinal saccharose-isomaltase (SI), som fordøjer saccharose i glucose og fructose, glucosetransportørerne 5 (Glut5) og 2 (Glut2) og ketoheksokinasen (Khk), som regulerer fructolyse (figur 2). Dette kan føre til akkumulering af ufordøjet saccharose og fructose med potentielle konsekvenser for tarmmikrobiotasammensætningen. Sammenligningen mellem chrebpko og leverspecifik chrebp knockout (chrebpliverko) mus fodret med HFrD havde tidligere afsløret, at hepatisk chrebp-mangel alene ikke fører til fruktoseintolerance, men at ChREBP-mangel i tyndtarmen sandsynligvis er ansvarlig for svækkelsen i fruktosetolerance observeret hos disse mus (Kim et al., 2017). Alt i alt understreger disse undersøgelser betydningen af ChREBP i reguleringen af fructosemetabolisme og understreger behovet for en bedre forståelse af dets rolle og regulering i tyndtarmen.
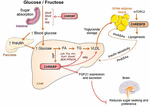
figur 2. ChREBP regulerer multipla signalering / metaboliske veje som reaktion på glucose og fructose. ChREBP udtrykkes i flere væv, herunder tarm, lever og hvidt fedtvæv. I disse celletyper aktiveres chrebp som reaktion på glucose og/eller fructose og inducerer specifikt genisk program som angivet på figuren. I tarmen blev stimulering af si, Glut5, Glut2 og Ketoheksokinase (Khk) ekspression ved ChREBP (enten direkte eller indirekte) beskrevet for at forbedre saccharosetolerance og fructoseabsorption. I leveren er ChREBP en nøglemodulator for glykolytisk, lipogen og mikrosomal triglyceridoverførselsprotein (Mttp) genekspression, hvorved både fedtsyreakkumulering og VLDL-eksport kontrolleres fra leveren. ChREBP regulerer også produktionen af hepatokiner, såsom fibroblastvækstfaktor 21 (FGF21). Denne lever-til-hjerne-akse udvider leverchrebp-funktionen fra en leverregulator til en systemisk modulator, der ikke kun påvirker substrathåndtering i leveren, men også næringsstofpræference. Chrebp-aktivering i hvidt fedtvæv er forbundet med forbedret metabolisk homeostase ved at producere beskyttende cirkulerende signaler. En ny klasse af pattedyrs lipider karakteriseret ved en forgrenet esterforbindelse mellem en fedtsyre og en hydroksi-fedtsyre (palmitinsyre hydroksyl-stearinsyre) blev rapporteret at have gavnlige virkninger på glukosehomeostase ved direkte og inkretinmedieret modulering af RR-cellefunktionen, forbedret optagelse af adipose og reduceret inflammation. Interessant nok blev mTORC2 for nylig identificeret som en ny regulator af Chrebp Kurtisoform i fedtceller.
regulering af BDK:PPM1K akse i leveren
det første engagerede trin af forgrenet aminosyre (BCAA ‘ er) katabolisme reguleres af det forgrenede ketoaciddehydrogenase (BCKDH)-kompleks, der styres af to niveauer, den forgrenede alfa-keto-syre dehydrogenase kinase (BDK) og proteinphosphatasen, Mg2+/Mn22+ afhængig 1k (PPM1K). Hvid et al. (2018) for nylig associeret ChREBP med opregulering af BDK og nedregulering af PPM1K i leveren og identificerede et konserveret Akkordmotiv i promotoren af begge disse gener. En positiv korrelation mellem ekspressionen af BDK og andre typiske chrebp-målgener (Fasn, Pklr, Chrebp-Kurt) blev observeret hos lever af rotter fodret med en diæt med høj glukose eller fruktose. På det fysiologiske niveau førte stigning i BDK:PPM1K-forholdet til phosphorylering og aktivering af ATP-citratlyase (ACLY) og derved stimulere de novo lipogenese. Disse fund afslører, at BDK og PPM1K kan være nye lipogeneseaktiverende gener reguleret af Chrebp larr. I betragtning af deres rolle i reguleringen af lipid -, glucose-og aminosyremetabolisme kunne BDK og PPM1K betragtes som potentielle terapeutiske mål i leveren i den nærmeste fremtid (Hvid et al., 2018).
ChREBP er påkrævet til Glukosemedieret regulering af FGF21
ChREBP var for nylig forbundet med produktion og sekretion af hepatokiner, såsom fibroblastvækstfaktor 21 (FGF21)., 2009; Dushay et al., 2015, Irosa et al., 2017). FGF21 er et metabolisk hormon syntetiseret af leveren med flere gavnlige virkninger i perifere væv (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Indtil for nylig blev FGF21 betragtet som et fastende hormon, der forbedrer fedtsyreoksidering, ketogenese og lipolyse under transkriptionel kontrol af peroksisomproliferatoraktiveret receptor-kar (PPARa) (Inagaki et al., 2007). En opgave på FGF21-promotoren er tidligere blevet identificeret i både mus (-74 til -52 bp) og mennesker (-380 til -366 bp)., 2009) men funktionelle undersøgelser har manglet indtil for nylig. Forbrug af glukose og fruktose blev rapporteret at føre til en hurtig forhøjelse af FGF21-niveauer hos raske frivillige og patienter med metabolisk syndrom (Dushay et al., 2015). Yderligere undersøgelser rapporterede også en mekanistisk forbindelse mellem ChREBP-afledt FGF21 og makronæringsstofpræference gennem en lever-hjerneakse (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Denne lever-til-hjerne-akse udvider ChREBP-funktionen fra en hepatisk metabolisk regulator til en systemisk modulator, der ikke kun påvirker håndtering af leversubstrat, men også global fodringsadfærd., 2017).
Chrebp ‘s rolle i det Interorganiske netværk, der styrer Energihomeostase
hepatisk ChREBP’ s rolle i kontrollen af Insulinfølsomhedsbalancen
vores laboratorium rapporterede tidligere, at ChREBP fungerer som en nøglemodulator for leverfedtsyresammensætning og insulinfølsomhed i forbindelse med ikke-alkoholiske og alkoholiske leversygdomme (se Abdul-Vahed et al., 2017 til gennemgang). Mus, der overudtrykker ChREBP, udviklede større hepatisk steatose end kontroller, men interessant forblev fri for metaboliske komplikationer og udviklede ikke insulinresistens. Lipidomisk analyse har afsløret, at ChREBP-medieret steatose er forbundet med et fald i mættede fedtsyrer og en stigning i enumættede fedtsyrer, sidstnævnte, som har vist sig at være forbundet med ChREBP-medierede gavnlige virkninger på insulinfølsomhed (Benhamed et al., 2012). Disse resultater viser ChREBP ‘ s rolle i lipidpartitionering og antyder, at specifikke lipidarter, når de er til stede på det rigtige sted og tidspunkt, kan udløse signaler, der modulerer tilpasning til metabolisk stress (Benhamed et al., 2012; Bricambert et al., 2018). Interessant, Jois et al. (2017) foreslog også en beskyttende rolle for hepatisk ChREBP med hensyn til hele kroppen glukose homeostase og insulinfølsomhed. Chrebpliverko-mus udviser forværret glukosetolerance, mens de er beskyttet mod hepatisk steatose. Hepatisk chrebp-deletion resulterede også i genekspressionsændringer i hvidt og brunt fedtvæv, hvilket antyder kommunikation mellem væv. Chrebp ‘ s bidrag til energibalancen i hele kroppen kan derfor stole på dens regulering af lipidarter og/eller hepatokinproduktion, der bidrager til koordinering mellem væv af energihomeostase (Jois et al., 2017).
Adipose ChREBP forbinder lipogenese med insulinfølsomhed
nedsat insulinsignalering i fedtvæv er et kritisk træk ved insulinresistens. Undersøgelser har rapporteret, at chrebp-aktivering i hvidt fedtvæv kan forbedre metabolisk homeostase ved at producere beskyttende cirkulerende signaler (Yore et al., 2014; Tang et al., 2016). En klasse af pattedyrs lipider karakteriseret ved en forgrenet esterforbindelse mellem en fedtsyre og en palmitinsyre, palmitinsyre hydroksyl stearinsyre (PAHSA), blev rapporteret at udøve gavnlige virkninger på glukosehomeostase gennem direkte og inkretinmedieret modulering af larr-cellefunktion, glukoseoptagelse og reduktion i inflammation (Yore et al., 2014). Tilsvarende er fedtspecifik ChREBP-knockout (ChREBPadiposeKO), der udviser lave lipogenesehastigheder i fedtvæv, insulinresistente med nedsat insulinvirkning i lever, muskel og hvidt fedtvæv under både mad og diæt med højt fedtindhold. Chrebpadiposeko-mus har lavere serumniveauer af PAHSAs, mens PAHSA-tilskud, især 9-PAHSA-isomeren, redder chrebpadiposeko global insulinresistens og fedtvævsbetændelse, hvilket bekræfter, at tab af adipose-ChREBP er tilstrækkeligt til at forårsage insulinresistens (Vijayakumar et al., 2017). En nylig undersøgelse identificerede det mekanistiske mål for rapamycinkompleks 2 (mTORC2) som en ny regulator af ChREBP (især kurtisoformen) i fedtceller. Specifik ablation af rapamycin-ufølsom ledsager af mTOR (Rictor) i modne adipocytter nedsat insulin-stimuleret glukoseoptagelse i fedtvæv, der fører til nedregulering af Chrebp-larr og målgenekspression involveret i lipogenesekontrol (Tang et al., 2016). I overensstemmelse med en vigtig fedtleverkrosstalk medieret af ChREBP er disse virkninger forbundet med hepatisk insulinresistens og forbedret glukoneogenese. Alt i alt understøtter disse undersøgelser en vigtig rolle for adipose ChREBP i udløsningen af insulinfølsomme signaler (Tang et al., 2016).
ny interaktion mellem hormonfølsom Lipase og ChREBP i fedtvæv
ChREBP blev for nylig identificeret som en partner af lipolytisk hormonfølsom lipase (HSL) i fedtvæv (Morigny et al., 2019). Det er påvist, at nedbrydning af HSL i humane adipocytter og musefedtvæv øger insulinfølsomheden og inducerer forlængelsen af meget langkædede fedtsyrer (Elovl6). Elov16 er et mikrosomalt middel, der regulerer forlængelsen af C12-16 mættede og enumættede fedtsyrer på en ChREBP-afhængig måde (Morigny et al., 2019). På det mekanistiske niveau forringede fysisk interaktion mellem HSL og ChREBP den nukleare translokation af ChREBPa og den efterfølgende induktion af Chrebp-og målgener, især Elovl6 (Morigny et al., 2019). Denne undersøgelse afslører en ny regulering for ChREBP i fedtvæv. Hæmning af interaktionen mellem HSL og ChREBP kan føre til potentielle terapeutiske strategier til forbedring af insulinfølsomheden i fedtceller.
konklusion og fremtidige retninger
ChREBP er nu en veletableret kulhydratføler. Selvom de fleste undersøgelser har været dedikeret til dets implikation i kontrollen af de glykolytiske og lipogene veje, har nylige data også afsløret nye bidrag fra ChREBP i hepatocytter og i fedtceller, hvor det kunne være medvirkende til at producere hepatokiner og/eller lipokiner, der udløser krydsstalk mellem organer. Som diskuteret kan nyligt identificerede cofaktorer (epigenetiske modifikatorer) og/eller partnere (adipose HSL) i disse væv også repræsentere potentielle terapeutiske strategier for NAFLD og/eller til forbedring af systemisk insulinfølsomhed. Nylige undersøgelser har også understøttet betydningen af ChREBP i reguleringen af fruktosemetabolisme og har understreget behovet for en bedre forståelse af dets rolle og regulering i tyndtarmen. Endelig vil det i de kommende år være af særlig betydning at identificere specifikke og/eller overlappende mål for Chrebpa-og Chrebp-Kris i nøglecelletyper samt bestemme deres specifikke indvirkning på insulinfølsomheden.
Forfatterbidrag
alle forfattere, der er anført, har ydet et væsentligt, direkte og Intellektuelt Bidrag til Værket og godkendt det til offentliggørelse.
finansiering
Postic ‘ s lab (U1016-Institut Cochin) støttes af tilskud fra ChroME-netværket (Marie Curie sk-aktion H2020-MSCA-ITN-2015-675610), Instituttet for medicinsk forskning (FRM) (DEK20150331744) og ANR-15-CE14-0026-hepatokind.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.