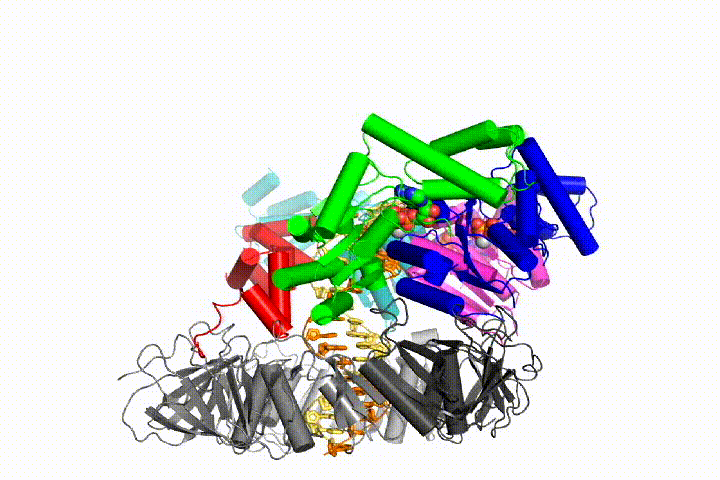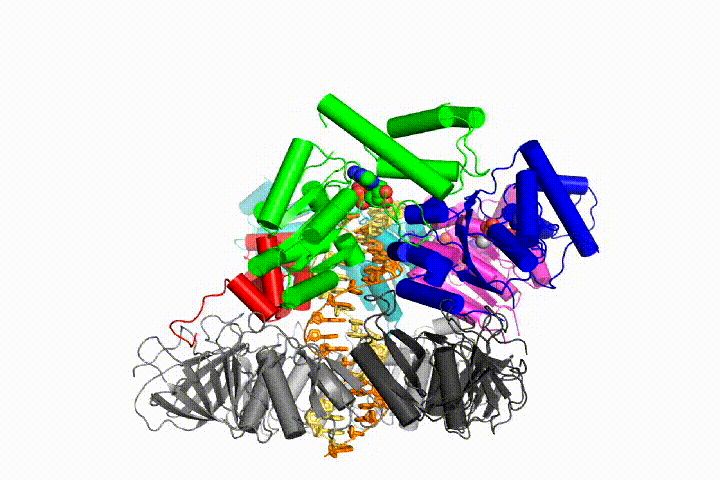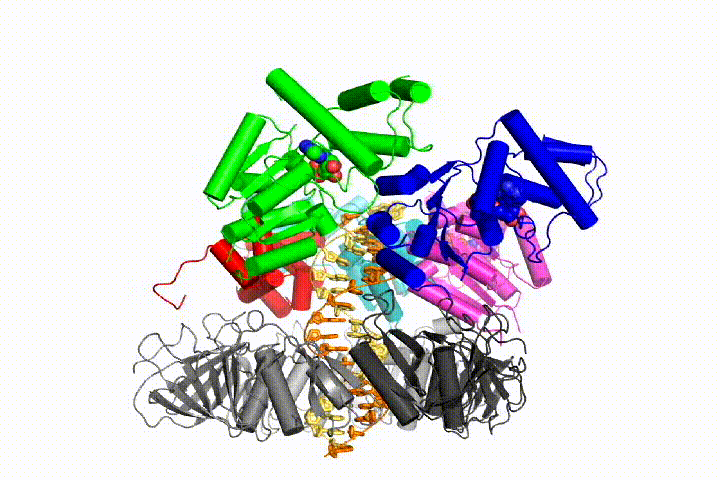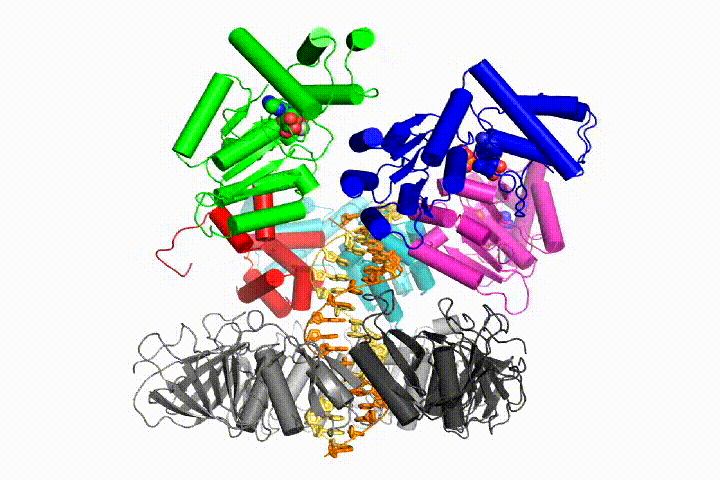
kromosomal DNA-replikation kræver, at DNA-polymeraser er bundet til ringformede glideklemmer, der omkranser DNA ‘ et og muliggør hurtig, processiv replikation. Glideklemmer lægges på DNA af klemlæsserkomplekset, en pentamerisk samling af proteiner fra AAA+ – familien af atpaser.
vi ønsker at forstå den funktion og mekanisme af klemme læssemaskiner i atomare detaljer. Nylige strukturer af T4-bakteriofagklæsseren i kompleks med primer-skabelon-DNA og glideklemmen har foreslået en arbejdsmodel til klemlæssermekanismen som vist nedenfor (se Kelch et al videnskab 2011):
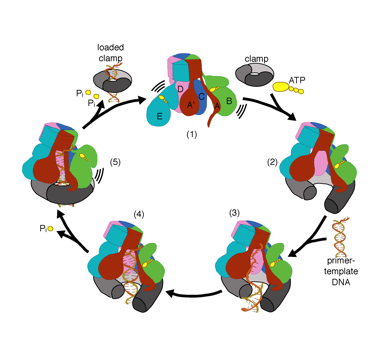
vores model forudsiger, at ATP-hydrolyse begynder i slutningen af AAA+ – spiralen og fortsætter sekventielt op ad spiralen, hvilket resulterer i udstødning af klemlæsseren fra DNA ‘ et og den lukkede klemme. Vores hypotese er illustreret i denne animation af tre på hinanden følgende ATP-hydrolysehændelser:
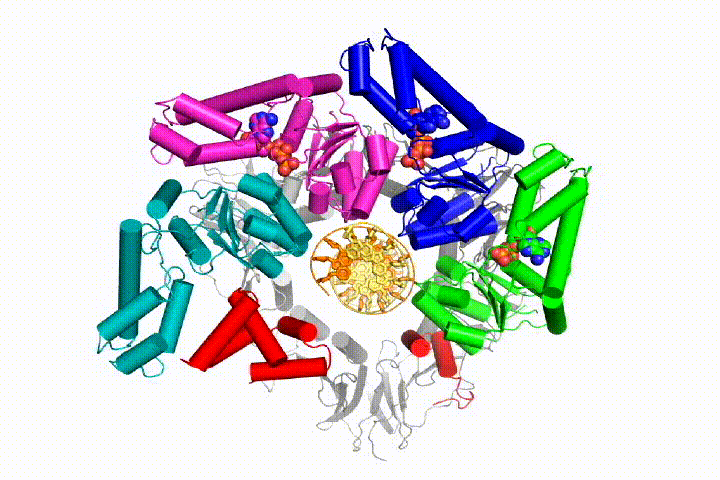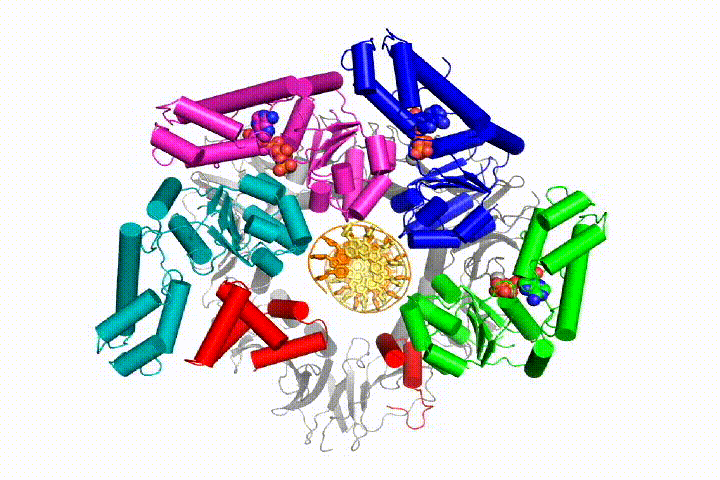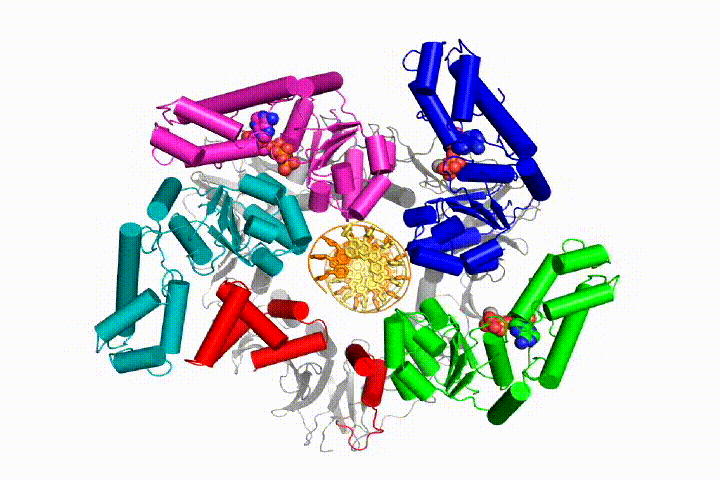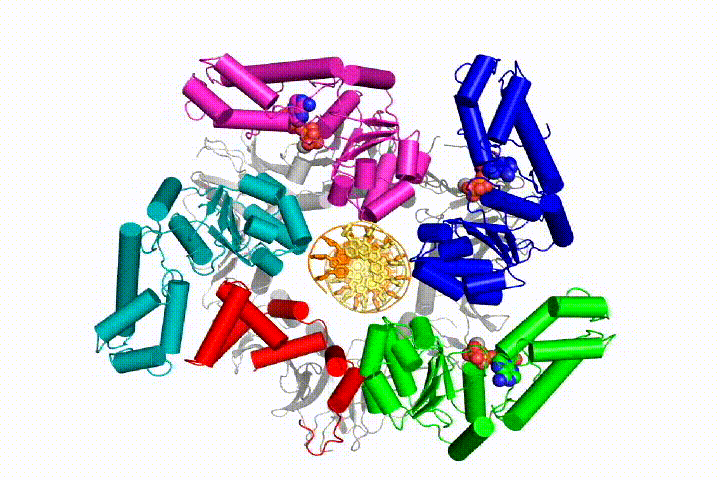
vi vil teste disse modeller for klemme loader mekanisme ved hjælp af en bred vifte af biokemiske, biofysiske og strukturelle metoder. Forståelse af klemlæssermekanismen i atomdetaljer vil have vigtige konsekvenser for forståelsen af DNA-replikation såvel som mekanismen for relaterede AAA+ proteinsamlinger. I sidste ende forventer vi at bruge vores mekanistiske forståelse til at udvikle nye nanodevices og små molekyleffektorer af AAA+ – funktion.