introduktion
healthcare-associerede infektioner (Hai ‘ er) som bakteriæmi forårsaget af multidrugresistente Pseudomonas aeruginosa-stammer resulterer i en øget sygelighed og dødelighed, hvilket forlænger indlæggelsen og højere omkostninger sammenlignet med infektioner forårsaget af modtagelige stammer.1-3 infektioner forårsaget af disse resistente mikroorganismer er ofte forbundet med alder, kræft, hjertesygdom, diabetes, intensiv brug af antibiotika og invasive procedurer såsom hæmodialyse, mekanisk ventilationskateter, trakeostomi og andre.4
den stigende forekomst af multiresistent P. aeruginosa som årsag til nosokomial infektion er et globalt problem, en konsekvens af denne mikroorganismes evne til at udvikle resistens over for næsten alle andre antimikrobielle midler under antimikrobiel kemoterapi, enten ved udvælgelse af mutationer i kromosomale gener eller ved vandret genoverførsel.5,6 i Brasilien er dette problem endnu mere betydningsfuldt, da der er en meget høj tæthed af antibiotikabrug, især larrus-lactamer, carbapenemer og fluorokinoloner.7,8 modstanden i P. aeruginosa til carbapenemer er op til 60% på nogle brasilianske hospitaler9,10 og forekommer hovedsageligt ved produktion af metallo-Kurt-lactamaser (MBL).
ti underklasser af MBL-symbolerne er kendt: IMP (Imipenemase), Vim (Verona Imipenemase), SPM-1 (s Larso Paulo MBL), GIM (tysk Imipenemase), SIM-1 (Seul Imipenemase),11 AIM-1 (Australsk Imipenemase),12 KHM (Kyorin Universitetshospital),13 NDM-1 (Ny Delhi MBL),14 DIM-1 (nederlandsk imipenemase),15 og TMB (Tripoli MBL).16 i Brasilien er de mest udbredte underklasser IMP – 1 og SPM-1.11
flere andre virulensgener såvel som dannelse af biofilm kan bidrage til patogeniciteten af alvorlige infektioner, især inklusive dem, der er forbundet med invasive procedurer.17 blandt de vigtigste virulensfaktorer, der er beskrevet i litteraturen, fremhæver vi dem, der er relateret til vedhæftning af mikroorganismer til værtsceller gennem flagella, fimbriae og alginat18 og dem, der letter forstyrrelsen af epitelintegriteten og forstyrrer immunsystemet, såsom elastase, phospholipase C og proteasealkalk, yderligere eksotoksin a, pyocyanin og pyoverdin.19 biofilmproduktionen er især forbundet med antibiotikas vanskelighed med at trænge ind i cellerne, da de udskiller en polymermatrice sammensat af polysaccharider, proteiner og DNA.20,21
formålet med denne undersøgelse var at identificere risikofaktorer forbundet med bakteriæmi forårsaget af carbapenem-resistent P. aeruginosa samt produktion af MBL. Derudover undersøgte vi hyppigheden af virulensgener og deres evne til at danne biofilm.
materialer og metoderpatienter og hospital
P. aeruginosa-stammer blev genvundet fra patienter, der blev indlagt på Uberlandia Universitetshospital (Brasilien), Federal University of Uberl Larsndia (HC-UFU), og opnået fra Mikrobiologilaboratoriet i HC-UFU i perioden fra maj 2009 til December 2012, idet man kun overvejede den første episode af infektion.
studiedesign
vi gennemførte en case (patienter med bakteriæmi på grund af P. aeruginosa resistent over for carbapenemer) versus kontrol (patienter med bakteriæmi forårsaget af P. aeruginosa modtagelig for carbapenemer) undersøgelse for at identificere risikofaktorer blandt patienter inficeret med P. aeruginosa resistent over for carbapenemer. Derudover evaluerede vi sekundære resultater, herunder perioder med indlæggelse, adgang til intensivafdelingen (ICU) og brug af invasive procedurer. Demografiske, kliniske og epidemiologiske karakteristika for hver patient inkluderet i undersøgelsen blev genvundet fra de kliniske optegnelser.
definitioner
healthcare-associerede infektioner (Hai ‘ er) defineres som enhver infektion erhvervet efter en patients indlæggelse på hospitalet. HAIs kan manifestere sig under indlæggelse eller efter udskrivning, da de er relateret til indlæggelse eller procedurer udført under indlæggelse.22 bakteriæmi,ifølge Centers for Disease Control and Prevention, 23 kan defineres som tilstedeværelsen af levedygtige bakterier i blodet dokumenteret ved et positivt blodkulturresultat. Bakteriæmi blev klassificeret som primær, når det ikke var relateret til et andet infektionsfokus, eller når det var relateret til et intravenøst kateter, og sekundært, når det var klinisk relateret til infektion på et andet anatomisk sted.9 Multidrugresistens defineres som erhvervet ikke-modtagelighed for mindst et middel i tre eller flere antimikrobielle kategorier.24 den antimikrobielle behandling blev anset for uhensigtsmæssig, når en isoleret mikroorganisme viste in vitro-resistens over for antimikrobielle stoffer anvendt til behandling af patienten og/eller manglende behandling i 24 timer efter diagnose af mikrobielle infektioner.25
Klinisk Mikrobiologisk og molekylær test
kulturer blev opsamlet i henhold til den protokol, der blev anvendt af Mikrobiologilaboratoriet i HC-UFU og blev behandlet ved hjælp af det automatiserede system bast/Alert larr (Biomarrieuks, Durham, USA). Identifikations-og antimikrobielle følsomhedstest blev udført ved automatisering ved hjælp af VITEK II-systemet, og de stammer, der viste mellemfølsomhed, blev betragtet som resistente. Kvalitetskontrolprotokoller blev anvendt i henhold til standarderne fra Clinical and Laboratory Standard Institute.26-28 den carbapenem-resistente P. aeruginosa-isolater blev fænotypisk screenet for MBL-produktion ved hjælp af synergiforsøg med dobbelt disk, som tidligere beskrevet.29,30 for at vurdere tilstedeværelsen af MBL-gener i P. aeruginosa-stammer blev der desuden udført en multipleks PCR som beskrevet tidligere.31 cykelforholdene var: 94 liter C i 5 minutter efterfulgt af 30 denatureringscyklusser ved 94 liter C i 30 ‘erne, udglødning ved 53 liter C i 45’ erne og forlængelse ved 72 liter C i 30 ‘ erne efterfulgt af endelig forlængelse ved 72 liter C ved 10 minutter, alt sammen i en MasterCycler personal (Eppendorf). Påvisning af virulensgener, der kodificerer alkalisk protease (aprA), elastase a (lasA), elastase (lasB), 32 hæmolytisk phospholipase C (plcH), ikke-hæmolytisk phospholipase C (plcN), eksotoksin a (toksa) og alginat (algD)33 blev bestemt ved hjælp af unipleks PCR ved anvendelse af følgende protokol: 94 kur C i 3 minutter, 30 cyklusser ved 94 kur C i 30 ‘erne, 55 kur C i 1min og 72 i 1min og 30’ erne og 72 C i 5 min.
indledende vedhæftningsanalyse34
for at evaluere den indledende vedhæftning blev 200 liter af en cellesuspension indeholdende 1 liter 107 celler/mL fremstillet i TSB tilsat til 96-brønds polystyrenplader. Indledende vedhæftning fik lov til at forekomme i 2 timer ved 37 liter C med rotation ved 120 rpm. Bakterier klæbet i 96-brønd polystyrenplader blev vasket to gange med en 0,9% NaCl-opløsning og høstet ved at skrabe brøndene i 90 ‘ erne. den opnåede cellesuspension blev belagt på TSA til kolonidannende enhed (CFU) optælling. Alle eksperimenter blev udført i tre eksemplarer i tre uafhængige eksperimenter. Stammen ATCC15692 (PAO1) blev anvendt som en positiv kontrol, og TSB uden bakterier blev anvendt som en negativ kontrol.
biofilmdannelsesanalyse35
200 liter af en cellesuspension indeholdende 1 liter 107 celler/mL fremstillet i TSB blev sat til 96-brønds polystyrenplader. Biofilmdannelse fik lov til at forekomme i 24 timer ved 37 liter C med rotation ved 120 rpm. Bakterier dyrket i 96-brønd polystyrenplader blev vasket to gange med en 0,9% NaCl-opløsning og efterladt til tørring i en omvendt position. Den samlede biomasse blev målt ved methanol (Merck) fiksering, krystalviolet (Merck) farvning og syre eddikesyre (Merck) eluering som tidligere beskrevet. Det eluerede farvestof blev fjernet fra hver brønd og anbragt i en ny 96-brønds mikrotiterplade, og dens absorbans blev læst på en ELISA-pladelæser (BioTek Instruments Inc., Vermont, USA) ved 570nm. Eksperimenterne blev udført med otte replikater for hver Stamme i tre uafhængige eksperimenter. TSB uden bakterier blev brugt som en negativ kontrol. Den optiske densitetsafskæringsværdi (ODc) blev etableret som tre standardafvigelser (SD) over gennemsnittet af den optiske densitet (OD) for den negative kontrol: ODc=gennemsnitlig OD for negativ kontrol+3 gange SD for negativ kontrol. For lettere fortolkning af resultaterne blev stammer opdelt i følgende kategorier i henhold til optisk tæthed: (ODi): ODi Lars ODc eller ODc
Odi2 gange ODc=ikke-biofilm producent/svag biofilm producent; 2 gange Odcodi4 gange ODc=moderat biofilm producent; 4 gange Odcoder=stærk biofilm producent.Biofilmcellekoncentration36
biofilmcellekoncentrationen blev bestemt ved CFU-optælling. Efter biofilmdannelse blev biofilmerne vasket to gange med en 0,9% NaCl-opløsning og høstet efter skrabning af brøndene i 90 ‘ erne. den opnåede cellesuspension blev belagt på TSA-plader. Alle eksperimenter blev udført i tre eksemplarer ved tre uafhængige lejligheder.
statistisk analyse
statistisk analyse blev udført ved hjælp af GraphPad Prism v. 5 (GraphPad-program, San Diego, CA). Kvantitative analyser blev sammenlignet ved hjælp af Kruskal–Vægis, anvendelse af Dunns multiple sammenligningstest. Alle forsøg blev udført med et konfidensniveau på 95%, og statistisk signifikans blev defineret som p
0,05.Etisk godkendelse
Forskningsetikudvalget for Federal University Uberlandia evaluerede og godkendte vores studiedesign.
resultater
fra 1.maj 2009 til 31. December 2012 blev der udført en hospitalsovervågning af forekomsten af P. aeruginosa-bakteriæmi i mikrobiologilaboratoriet på Universitetshospitalet. I denne periode blev 157 ikke-gentagne patienter med P. aeruginosa bakteriæmi inkluderet i undersøgelsen. De detaljerede oplysninger om faktorer forbundet med udviklingen af bakteriæmi og de kliniske og demografiske egenskaber samt fordelingen af patienter efter afdelinger er vist i tabel 1 og 2. Den primære bakteriæmi forekom hos 75,8%, og dem med ukendt fokus tegnede sig for 62.4% af tilfældene. Sekundær bakteriæmi tegnede sig for 24,2% af patienterne, hvor luftvejene var hovedfokus for infektion (17,2%). Desuden havde 43,9% af patienterne bakteriæmi med carbapenemresistent P. aeruginosa, og de fleste af disse patienter blev indlagt på ICU. De fleste patienter var mænd (66,8%) med et gennemsnitligt hospitalsophold på 63,2 g 80,17 dage og en gennemsnitlig alder på 52,01 g 20,24 år.
fordeling af patienter inficeret med Pseudomonas aeruginosa i forskellige enheder på det kliniske Hospital ved Federal University of Uberl Larsndia fra maj/2009 til December/2012.
| klinikker | i alt | carbapenem-resistent Pseudomonas aeruginosa |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| kirurgi | 35 (22.3) | 16 (23.2) |
| medicinsk klinik | 24 (15.3) | 10 (14.5) |
| onkologi | 14 (8.9) | 2 (2.9) |
| Emergency room | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| Neonatal ICU | 2 (1.3) | 0 |
| pædiatrisk ICU | 2 (1.3) | 1 (1.5) |
| transplantation | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
intensivafdeling.
Burneds, thoracic pain unit.
risikofaktorer forbundet med carbapenemresistens hos patienter med bakteriæmi forårsaget af Pseudomonas aeruginosa.
| risikofaktorer | i alt | carbapenemresistent | Multisensitivea | Univariat | multivariat | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIc 95%) | pd | eller (CI 95%) | p | |
| alder-gennemsnit (år) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| mand / kvinde | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| tidspunkt for indlæggelse, gennemsnit (dage) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| intensivafdeling | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| kirurgi | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| Invasive procedurer (72 timer) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| venøst centralt kateter | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| kirurgisk afløb | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| prober enteral / gastrisk ernæring | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| hæmodialyse | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| Parenteral ernæring | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Comorbiditetsbetingelser | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| hjertesvigt | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| kræft | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| kronisk nyresvigt | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| Human immundefektvirus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| primær bakteriæmi | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| central linje kateter relateret | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| ukendt | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| sekundær bakteriæmi | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| luftveje | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| urinveje | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| uhensigtsmæssig behandling | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| tidligere brug af antibiotika | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| dødelighed | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisensitive stammer blev betragtet som dem, der viste følsomhed over for alle testede antimikrobielle stoffer.
Odds ratio.
konfidensinterval.
p værdi.
gennemsnitlig sværhedsgrad af sygdomsscore.
statistisk signifikant (p-0,05).
den tidligere brug af antibiotika (78,3%), invasive procedurer (88,5%), comorbiditeter (77,7%) og tidligere operation (43,9%) var almindelige. Det blev konstateret, at 31,2% af patienterne fik utilstrækkelig behandling, og dødsfrekvensen var 58,6%. Flere indre og ydre faktorer for udvikling af bakteriæmi ved stammer af P. aeruginosa resistent over for carbapenemer blev påvist ved univariat analyse. Imidlertid var kun mekanisk ventilation, enterale/nasogastriske rør, primær bakteriæmi med ukendt fokus og uhensigtsmæssig behandling risikofaktorer uafhængigt forbundet med udviklingen af carbapenem-resistent P. aeruginosa bakteriæmi.
MBL-produktion blev analyseret for 56 carbapenem-resistente P. aeruginosa-isolater. Ni (25,0%) isolater var fænotypisk positive, og i alt 16,1% (n= 9/56) var i overensstemmelse med amplicons MBL-generne, idet de var 10,71% blaSPM-1 og 5.3% blaVIM-gener generelt viste stammerne en multidrugresistensprofil. For andre virulensgener evalueret (aprA, plcH, plcN, lasA, lasB, toksa og algD) viste alle stammer en høj frekvens (88%).
blandt de 88 carbapenem-modtagelige P. aeruginosa-stammer var 21 (23,9%) resistente over for andre kurr-lactamer. For 69 stammer, der var resistente over for carbapenemer, var resistensprofilen høj: prislactam 50/69 (72,5%), fluorokinoloner 48/69 (69,6%) og aminoglycosider 50/69 (72,5%) (tabel 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
ud over MBL-forskning blev fem stammer valgt (to indeholdende SPM-1, En indeholdende vim og to fænotypisk positive for MBL) til evalueringen af biofilmdannelsen ved anvendelse af kvantitative analyser af total biomasse ved farvning med krystalviolet. I betragtning af tilstedeværelsen af MBL-gener blev alle stammer identificeret som stærkt biofilmproducenter med et gennemsnit på 0,90 liter 0,61 biomasse. Forskelle i initial adhæsion af individuelle stammer blev ikke observeret. Der var imidlertid en lavere OD for stammen indeholdende blaVIM-genet (Fig. 1).
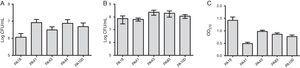
(a) antal celler klæbet til en polystyrenoverflade efter 2 timer, udtrykt som log CFU/mL for 5 prøver af Pseudomonas aeruginosa isoleret fra blod. B) antal levedygtige celler i biofilmen (log CFU/mL). C) biomasse af biofilm udtrykt som optisk tæthed af krystalviolet (OD570nm).
Diskussion
hospitalsbakteræmi forårsaget af multiresistente mikroorganismer, hvad enten de er Gram-positive eller Gram-negative, er ofte blevet beskrevet som et betydeligt helbredsproblem, der øger hospitalsomkostningerne og gør det vanskeligt at etablere en passende antimikrobiel terapi, hvilket resulterer i en dårligere prognose.37 den høje andel af hospitalsbakteræmi forårsaget af P. aeruginosa resistent over for carbapenemer indikerer vigtigheden af denne organisme som en væsentlig årsag til denne infektion på vores hospital. Den høje andel af hospitalsbakteræmi forårsaget af P. aeruginosa resistent over for carbapenemer indikerer vigtigheden af denne organisme som en væsentlig årsag til denne infektion på vores hospital. Resultaterne af forskellige undersøgelser har antydet, at iboende risikofaktorer såsom mekanisk ventilation, brug af et nasogastrisk rør og tidligere brug af antibiotika øger risikoen for bakteriæmi udvikling forårsaget af P. aeruginosa resistent over for carbapenemer, samt risikoen for sygelighed og dødelighed.38
i denne undersøgelse var mere end 50% af risikofaktorerne forbundet med infektion med denne mikroorganisme ifølge univariat analyse. Imidlertid blev kun mekanisk ventilation, enterale/gastriske fodringsrør, primær bakteriæmi af ukendt oprindelse og uhensigtsmæssig behandling betragtet som uafhængige risikofaktorer ved multivariat analyse.
et centralt venekateter er en af de mest signifikante risikofaktorer for erhvervet bakteriæmi på hospitalet, da det var forbundet med mere end 90% af disse infektioner.39 selvom det ikke var en signifikant risikofaktor i denne undersøgelse, havde 85,5% af patienterne med bakteriæmi med carbapenemresistent P. aeruginosa denne invasive procedure.
ofte har bakteriæmi forårsaget af P. aeruginosa resistent over for antibiotika en højere dødelighed på grund af især administration af upassende antibiotikabehandling.40 i denne undersøgelse undersøgte vi en kohorte på 157 patienter med bakteriæmi forårsaget af P. aeruginosa-stammer, hvor 69 af dem var inficeret af carbapenem-resistente P. aeruginosa-isolater. Den samlede dødelighed var højere i den carbapenemresistente gruppe; tilstedeværelsen af resistente stammer var imidlertid signifikant forbundet med uhensigtsmæssig antimikrobiel terapi, hvilket viste, at denne gruppe normalt har en dårligere prognose. I lighed med vores fund viste tidligere undersøgelser, at P. aeruginosa isoleret fra patienter, der fik upassende behandling, havde en dårligere prognose med satser på 46,1% 41 og 53,8%.42
udover at være forbundet med alvorlige infektioner resulterer resistens over for carbapenemer i P. aeruginosa ofte i produktion af MBL.43 vores resultater viste, at carbapenem-resistent P. aeruginosa var udbredt i hele hospitalet med gener, der koder for disse stammer i 16,1% af stammerne, hvilket er 10,7% af genotype blaSPM-1 og 5,4% af genotype blaVIM. Da hyppigheden af multidrugresistente stammer var høj, antyder disse resultater, at andre resistensmekanismer eksisterer sammen i disse stammer, såsom efflukspumper og membranens uigennemtrængelighed.44
forekomsten af MBL som modstandsmekanisme er steget, især i Latinamerika.45 i Brasilien er forekomsten af MBL-producerende P. aeruginosa varierer mellem forskellige regioner og mellem hospitaler med satser fra 7,5% til 44%.11
SPM-1 betragtes som den mest almindelige i Brasilien, efterfulgt af IMP-1,11,46 der har dog også været en stigning i hyppigheden af P. aeruginosa isolater indeholdende Vim.45,47 i vores undersøgelse blev SPM-1 påvist i 16,7% af fænotypisk producerende prøver af MBL efterfulgt af VIM, som blev påvist i 8,3% af tilfældene. Disse resultater indikerer en signifikant spredning af MBL-kodende gener i vores region.
i betragtning af tilstedeværelsen af MBL-og biofilmproduktion blev 100% af stammerne klassificeret som stærke producenter. En anden undersøgelse i Brasilien viste, at 40% af P. aeruginosa klassificeret som stærk biofilmproducerende også var MBL-producenter.35 vi mener, at disse resultater er vigtige, når disse egenskaber (biofilmproduktion og MBL) overlapper hinanden, og infektioner forårsaget af disse bakterier er vanskelige at behandle. Dette er delvis berettiget, fordi væksten af bakterier i biofilmen er omkring 64 gange mere resistent over for antimikrobielle stoffer.48
P. aeruginosa har et stort antal ekstracellulære virulensfaktorer, der også bidrager til patogeniciteten og sværhedsgraden af disse infektioner, såsom den kodet af APRA, plcH, plcN, lasA, lasB, toksa og algD gener.32,33 vores data viste, at tilstedeværelsen af en multiresistent profil i de fleste stammer (88%) var positiv for APRA -, plcH -, plcN -, lasA -, lasB -, toksa-og algD-virulensgener, undtagen i en stamme, der ikke viste toksa-og plcH-generne, hvilket yderligere kan bidrage til en dårligere prognose forbundet med alvorlige infektioner.
vores resultater bekræfter tidligere fund vedrørende risikofaktorer for udvikling af P. aeruginosa carbapenem-resistent bakteriæmi samt formidling af MBL-producerende stammer af SPM-1-type. Denne undersøgelse bidrager imidlertid til yderligere bevis for spredning af MBL-producerende stammer, især VIM-typen, i stærkt virulente stammer og stærkt biofilmproducenter.
interessekonflikter
forfatterne erklærer ingen interessekonflikter.