Úvod
infekce spojené se zdravotní péčí (HAIs), jako je bakterémie způsobená multirezistentními kmeny Pseudomonas aeruginosa, mají za následek zvýšenou morbiditu a mortalitu, prodloužení hospitalizace a vyšší náklady ve srovnání s infekcemi způsobenými citlivými kmeny.1-3 infekce způsobené těmito rezistentními mikroorganismy jsou často spojeny s věkem, rakovinou, srdečními chorobami, cukrovkou, intenzivním užíváním antibiotik a invazivními postupy, jako je hemodialýza, mechanický ventilační katétr, tracheostomie a další.4
zvyšující se výskyt Multirezistentního P. aeruginosa jako příčina nozokomiální infekce je globálním problémem, což je důsledek schopnosti tohoto mikroorganismu vyvinout rezistenci na téměř všechny ostatní antimikrobiální látky během antimikrobiální chemoterapie, a to buď výběrem mutací v chromozomálních genech nebo horizontálním přenosem genů.5,6 v Brazílii je tento problém ještě významnější, protože existuje velmi vysoká hustota užívání antibiotik, zejména β-laktamů, karbapenemů a fluorochinolonů.7,8 odboj v P. aeruginosa na karbapenemy je až 60% v některých brazilských nemocnicích9, 10 a vyskytuje se hlavně produkcí metallo-β-laktamáz (MBL).
je známo deset podtříd enzymů MBL: IMP (Imipenemáza), VIM (Verona Imipenemáza), SPM-1 (São Paulo MBL), GIM (německá Imipenemáza), SIM-1 (seul Imipenemáza),11 AIM-1 (australská Imipenemáza),12 KHM (Kyorin University Hospital),13 NDM-1 (New Delhi MBL),14 DIM-1 (holandská Imipenemáza),15 a TMB (Tripolis mbl).16 v Brazílii jsou nejrozšířenějšími podtřídy IMP-1 a SPM-1.11
několik dalších virulenčních genů a tvorba biofilmu může přispívat k patogenitě závažných infekcí, zejména těch, které jsou spojeny s invazivními postupy.17 Mezi hlavní faktory virulence popsané v literatuře zdůrazňujeme ty, které souvisejí s adherencí mikroorganismů k hostitelským buňkám prostřednictvím bičíků, fimbrií a alginátu18 a ty, které usnadňují narušení epiteliální integrity a interferují s imunitním systémem, jako je elastáza, fosfolipáza C a proteáza alkalická, dále exotoxin a, pyokyanin a pyoverdin.19 produkce biofilmu je zvláště spojena s obtížemi antibiotik proniknout do buněk, protože vylučují polymerní matrici složenou z polysacharidů, proteinů a DNA.20,21
cílem této studie bylo identifikovat rizikové faktory spojené s bakterémií způsobenou P. aeruginosa rezistentní na karbapenem a produkcí MBL. Dále jsme zkoumali frekvenci virulenčních genů a jejich schopnost tvořit biofilm.
materiály a metodypacienti a Nemocnice
P. kmeny aeruginosa byly získány od pacientů přijatých do Univerzitní nemocnice Uberlandia (Brazílie), Federální univerzity v Uberlândii (HC-UFU) a získané z mikrobiologické laboratoře HC-UFU v období od května 2009 do prosince 2012, s ohledem pouze na první epizodu infekce.
design studie
provedli jsme případ (pacienti s bakterémií způsobenou P. aeruginosa rezistentní na karbapenemy) versus kontrola (pacienti s bakterémií způsobenou P. aeruginosa citlivou na karbapenemy) studie k identifikaci rizikových faktorů u pacientů infikovaných P. aeruginosa rezistentní na karbapenemy. Dále jsme hodnotili sekundární výsledky, včetně období hospitalizace, přijetí na jednotku intenzivní péče (JIP) a použití invazivních výkonů. Demografické, klinické a epidemiologické charakteristiky každého pacienta zahrnutého do studie byly získány z klinických záznamů.
definice
infekce spojené se zdravotní péčí (Hai) jsou definovány jako jakákoli infekce získaná po přijetí pacienta do nemocnice. Hai se mohou projevit během hospitalizace nebo po propuštění, protože souvisejí s hospitalizací nebo postupy prováděnými během hospitalizace.22 bakterémie,podle Centra pro kontrolu a prevenci nemocí, 23 může být definována jako přítomnost životaschopných bakterií v krvi dokumentovaných pozitivním výsledkem krevní kultury. Bakterémie byla klasifikována jako primární, pokud nesouvisela s jiným zaměřením infekce nebo pokud souvisela s intravenózním katétrem, a sekundární, pokud byla klinicky spojena s infekcí v jiném anatomickém místě.9 multirezistence je definována jako získaná necitlivost na alespoň jedno činidlo ve třech nebo více antimikrobiálních kategoriích.24 antimikrobiální terapie byla považována za nevhodnou, pokud izolovaný mikroorganismus vykazoval in vitro rezistenci na antimikrobiální látky používané k léčbě pacienta a / nebo nedostatečnou léčbu po dobu 24 hodin po diagnóze mikrobiálních infekcí.25
klinické mikrobiologické a molekulární testování
kultury byly odebrány podle protokolu používaného mikrobiologickou laboratoří HC-UFU a byly zpracovány pomocí automatizovaného systému BACT/Alert® (BioMérieux, Durham, USA). Testy identifikace a antimikrobiální citlivosti byly provedeny automatizací pomocí systému VITEK II a kmeny, které vykazovaly Střední citlivost, byly považovány za rezistentní. Protokoly kontroly kvality byly použity v souladu s normami klinického a laboratorního standardního Institutu.26-28 karbapenem rezistentní P. izoláty aeruginosa byly fenotypicky vyšetřeny na produkci MBL pomocí synergických testů s dvojitým diskem, jak bylo popsáno výše.29,30 navíc k posouzení přítomnosti genů MBL v kmenech P. aeruginosa byla provedena multiplexní PCR, jak bylo popsáno výše.31 cyklické podmínky byly: 94°C po dobu 5 minut, následovalo 30 denaturačních cyklů při 94°C po dobu 30 s, žíhání při 53°C po dobu 45 s a prodloužení při 72°C po dobu 30 s, následovalo konečné prodloužení při 72°C po dobu 10 minut, vše v MasterCycler personal (Eppendorf). Detekce genů virulence kodifikujících alkalickou proteázu (aprA), elastázu a (lasA), elastázu (lasB),32 hemolytickou fosfolipázu C (plcH), nehemolytickou fosfolipázu C (plcN), exotoxin a (toxA) a alginát (algD)33 byla stanovena pomocí uniplex PCR pomocí následujícího protokolu: 94°C po dobu 3 minut, 30 cyklů při 94°C po dobu 30 s, 55°C po dobu 1 minuty a 72 po dobu 1 minuty a 30 s a 72°C po dobu 5min.
počáteční adhezní test34
aby se vyhodnotila počáteční adheze, bylo do 96jamkových polystyrenových desek přidáno 200 µl buněčné suspenze obsahující 1×107buněk/mL připravené v TSB. Počáteční adheze byla umožněna po dobu 2h při 37°C s rotací při 120 ot / min. Bakterie ulpívající v 96jamkových polystyrenových deskách byly dvakrát promyty 0,9% roztokem NaCl a sklizeny škrábáním jamek po dobu 90. let. získaná buněčná suspenze byla nanesena na TSA pro stanovení počtu jednotek tvořících kolonie (CFU). Všechny experimenty byly provedeny ve třech vyhotoveních ve třech nezávislých experimentech. Kmen ATCC15692 (PAO1) byl použit jako pozitivní kontrola a TSB bez bakterií byl použit jako negativní kontrola.
test tvorby Biofilmu35
200µL buněčné suspenze obsahující 1×107buněk / mL připravené v TSB bylo přidáno do 96jamkových polystyrenových desek. Tvorba biofilmu byla umožněna po dobu 24 hodin při 37°C s rotací při 120 ot / min. Bakterie pěstované v 96jamkových polystyrenových deskách byly dvakrát promyty 0,9% roztokem NaCl a ponechány zaschnout v obrácené poloze. Celková biomasa byla měřena fixací methanolu (Merck), barvením krystalově fialové (Merck) a elucí kyseliny octové (Merck), jak bylo popsáno výše. Eluované barvivo bylo odstraněno z každé jamky a umístěno do nové 96 jamkové mikrotitrové desky a jeho absorbance byla přečtena na čtečce desek ELISA (BioTek Instruments Inc., Vermont, USA) na 570nm. Pokusy byly provedeny s osmi replikáty pro každý kmen ve třech nezávislých experimentech. TSB bez bakterií byl použit jako negativní kontrola. Mezní hodnota optické hustoty (ODC) byla stanovena jako tři směrodatné odchylky (SD) nad průměrem optické hustoty (OD) negativního řízení: ODc=průměr od negativního řízení+3x SD negativního řízení. Pro snadnější interpretaci výsledků byly kmeny rozděleny do následujících kategorií podle optické hustoty: (ODi): ODI≤ODc nebo ODC
ODi2x ODc=výrobce biofilmu / slabý výrobce biofilmu; 2x ODcODi4x ODc=střední výrobce biofilmu; 4x ODcODi=silný výrobce biofilmu.Koncentrace biofilmových buněk 36
koncentrace biofilmových buněk byla stanovena vyčíslením CFU. Po vytvoření biofilmu byly biofilmy dvakrát promyty 0,9% roztokem NaCl a sklizeny po seškrabání jamek po dobu 90. let. získaná buněčná suspenze byla nanesena na desky TSA. Všechny experimenty byly provedeny ve trojím vyhotovení, při třech nezávislých příležitostech.
Statistická analýza
Statistická analýza byla provedena pomocí GraphPad Prism v. 5 (GraphPad Software, San Diego, CA). Kvantitativní testy byly porovnány pomocí Kruskal-Wallis, za použití Dunnova vícenásobného srovnávacího testu. Všechny testy byly provedeny s úrovní spolehlivosti 95% a statistická významnost byla definována jako p
0,05.Etické schválení
Etická komise pro výzkum Federální univerzity Uberlandia vyhodnotila a schválila náš návrh studie.
výsledky
od 1. května 2009 do 31.Prosince 2012 byl v mikrobiologické laboratoři Fakultní nemocnice proveden nemocniční dohled nad výskytem bakterémie P. aeruginosa. V tomto období bylo do studie zařazeno 157 opakujících se pacientů s bakterémií P.aeruginosa. Podrobné informace o faktorech spojených s vývojem bakterémie a klinických a demografických charakteristik, jakož i distribuce pacientů odděleními jsou uvedeny v tabulkách 1 a 2. Primární bakterémie se vyskytla u 75,8% a u pacientů s neznámým zaměřením na 62.4% případů. Sekundární bakterémie představovala 24,2% pacientů, kde byl respirační trakt hlavním zaměřením infekce (17,2%). Kromě toho mělo 43,9% pacientů bakterémii S P. aeruginosa rezistentní na karbapenem a většina z těchto pacientů byla přijata na JIP. Většina pacientů byli muži (66,8%) s průměrným pobytem v nemocnici 63,2±80,17 dne a průměrným věkem 52,01±20,24 let.
distribuce pacientů infikovaných Pseudomonas aeruginosa v různých jednotkách klinické nemocnice Federální univerzity v Uberlândii od května / 2009 do prosince / 2012.
| kliniky | celkem | Pseudomonas aeruginosa rezistentní na karbapenem |
|---|---|---|
| N=157 (%) | N=69 (%) | |
| chirurgie | 35 (22.3) | 16 (23.2) |
| lékařská klinika | 24 (15.3) | 10 (14.5) |
| onkologie | 14 (8.9) | 2 (2.9) |
| pohotovost | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| novorozenecká JIP | 2 (1.3) | 0 |
| Dětská JIP | 2 (1.3) | 1 (1.5) |
| transplantace | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
jednotka intenzivní péče.
popáleniny, jednotka hrudní bolesti.
rizikové faktory spojené s rezistencí na karbapenem u pacientů s bakterémií způsobenou Pseudomonas aeruginosa.
| rizikové faktory | celkem | karbapenem rezistentní | Multisenzitivnía | Univariate | Multivariate | ||
|---|---|---|---|---|---|---|---|
| N=157 (%) | N=69 (%) | N=65 (%) | ORb (CIC 95%) | pd | nebo (CI 95%) | p | |
| věk-průměr (roky) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| muž / žena | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| doba hospitalizace, průměr (dny) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| Jednotka intenzivní péče | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| chirurgie | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| invazivní postupy (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| žilní centrální katétr | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| chirurgický odtok | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| sondy enterální / žaludeční výživa | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| hemodialýza | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| parenterální výživa | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| podmínky komorbidity | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| srdeční selhání | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| rakovina | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| chronické selhání ledvin | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| virus lidské imunodeficience | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| primární bakterémie | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| související s katétrem centrální linky | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| Neznámý | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| sekundární bakterémie | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| dýchací cesty | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| močové cesty | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| nevhodná terapie | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| předchozí použití antibiotik | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| úmrtnost | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Multisenzitivní kmeny byly považovány za kmeny, které vykazovaly citlivost na všechny testované antimikrobiální látky.
poměr šancí.
interval spolehlivosti.
hodnota p.
průměrné skóre závažnosti nemoci.
statisticky významné (P≤0,05).
předchozí použití antibiotik (78, 3%), invazivních postupů (88, 5%), komorbidit (77, 7%) a předchozího chirurgického zákroku (43, 9%) bylo časté. Bylo zjištěno, že 31,2% pacientů dostalo nedostatečnou léčbu a úmrtnost byla 58,6%. Několik vnitřních a vnějších faktorů pro vývoj bakterémie kmeny P. aeruginosa rezistentní na karbapenemy byla zjištěna jednorozměrnou analýzou. Avšak pouze mechanická ventilace, enterální/nazogastrické trubice, primární bakterémie s neznámým zaměřením a nevhodná léčba byly rizikovými faktory nezávisle spojenými s vývojem bakterémie P.aeruginosa rezistentní na karbapenem.
produkce MBL byla analyzována na 56 izolátů P.aeruginosa rezistentních na karbapenem. Devět (25,0%) izolátů bylo fenotypicky pozitivních a celkem 16,1% (n = 9/56)bylo v souladu s amplicony MBL genů, což bylo 10,71% blaSPM-1 a 5.3% blavim geny kmeny obecně vykazovaly profil rezistence vůči více léčivům. U dalších hodnocených virulenčních genů (aprA, plcH, plcN, lasA, lasB, toxA a algD) vykazovaly všechny kmeny vysokou frekvenci (88%).
z 88 kmenů P. aeruginosa citlivých na karbapenem bylo 21 (23,9%) rezistentních na jiné β-laktamy. U 69 kmenů rezistentních na karbapenemy byl profil rezistence vysoký: β-laktam 50/69 (72,5%), fluorochinolony 48/69 (69,6%) a aminoglykosidy 50/69 (72,5%) (Tabulka 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
kromě výzkumu MBL bylo vybráno pět kmenů (dva obsahující SPM-1, jeden obsahující VIM a dva fenotypicky pozitivní pro MBL) k vyhodnocení tvorby biofilmu pomocí kvantitativních testů celkové biomasy barvením krystalovou fialkou. Vzhledem k přítomnosti genů MBL byly všechny kmeny identifikovány jako silně producenti biofilmu s průměrem 0,90±0,61 biomasy. Rozdíly v počáteční adhezi jednotlivých kmenů nebyly pozorovány. Nicméně, tam byl nižší OD pro kmen obsahující Gen blaVIM (obr. 1).
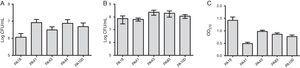
(a) počet buněk přilepených k povrchu polystyrenu po 2 hodinách, vyjádřený jako log CFU/mL pro 5 vzorků Pseudomonas aeruginosa izolovaných z krve. B) počet životaschopných buněk v biofilmu (log CFU/mL). C) biomasa biofilmu vyjádřená jako optická hustota krystalové fialky (OD570nm).
diskuse
nemocniční bakterémie způsobená multirezistentními mikroorganismy, ať už grampozitivními nebo gramnegativními, byla často popisována jako významný zdravotní problém, který zvyšuje náklady na nemocnici a ztěžuje stanovení vhodné antimikrobiální terapie, což má za následek horší prognózu.37 vysoký podíl nemocniční bakterémie způsobené P. aeruginosa rezistentní na karbapenemy naznačuje význam tohoto organismu jako významné příčiny této infekce v naší nemocnici. Vysoký podíl nemocniční bakterémie způsobené P. aeruginosa rezistentní na karbapenemy naznačuje význam tohoto organismu jako významné příčiny této infekce v naší nemocnici. Výsledky různých studií naznačují, že vnitřní rizikové faktory, jako je mechanická ventilace, použití nasogastrické trubice a předchozí použití antibiotik, zvyšují riziko vzniku bakterémie způsobené P.aeruginosa rezistentní na karbapenemy, stejně jako riziko morbidity a mortality.38
v této studii bylo více než 50% rizikových faktorů spojeno s infekcí tímto mikroorganismem podle jednorozměrné analýzy. Avšak pouze mechanická ventilace, enterální/žaludeční krmné zkumavky, primární bakterémie neznámého původu a nevhodná léčba byly považovány za nezávislé rizikové faktory multivariační analýzou.
centrální žilní katétr je jedním z nejvýznamnějších rizikových faktorů získané bakterémie v nemocnici, protože byl spojen s více než 90% těchto infekcí.39 ačkoli to nebyl významný rizikový faktor v této studii, 85, 5% pacientů s bakterémií S P. aeruginosa rezistentní na karbapenem mělo tento invazivní postup.
bakterémie způsobená P. aeruginosa rezistentní na antibiotika má často vyšší úmrtnost zejména v důsledku podávání nevhodné antibiotické terapie.40 v této studii jsme zkoumali kohortu 157 pacientů s bakterémií způsobenou kmeny P.aeruginosa, přičemž 69 z nich bylo infikováno izoláty P. aeruginosa rezistentními na karbapenem. Celková mortalita byla vyšší ve skupině rezistentní na karbapenem; přítomnost rezistentních kmenů však byla významně spojena s nevhodnou antimikrobiální terapií, což dokazuje, že tato skupina má obvykle horší prognózu. Podobně jako naše zjištění, předchozí studie ukázaly, že P. aeruginosa izolovaná od pacientů, kteří dostávali nevhodnou léčbu, měla horší prognózu, s mírou 46, 1% 41 A 53, 8%.42
kromě toho, že je spojena se závažnými infekcemi, vede rezistence na karbapenemy u P. aeruginosa často k produkci MBL.43 naše výsledky ukázaly, že karbapenem rezistentní P. aeruginosa byla převládající v celé nemocnici s geny, které kódují tyto enzymy v 16,1% kmenů, což je 10,7% genotypu blaSPM-1 a 5,4% genotypu blaVIM. Protože frekvence multirezistentních kmenů byla vysoká, tyto výsledky naznačují, že v těchto kmenech koexistují další mechanismy rezistence, jako jsou efluxní pumpy a nepropustnost membrány.44
prevalence MBL jako mechanismu rezistence se zvýšila, zejména v Latinské Americe.45 v Brazílii, prevalence MBL produkující P. aeruginosa se liší mezi různými regiony a mezi nemocnicemi, přičemž sazby se pohybují od 7,5% do 44%.11
enzym SPM-1 je považován za nejběžnější v Brazílii, následovaný IMP-1,11,46 došlo však také ke zvýšení frekvence izolátů P. aeruginosa obsahujících enzym VIM.45,47 v naší studii byl enzym SPM-1 detekován u 16,7% fenotypicky produkujících vzorků MBL, následovaný enzymem VIM, který byl detekován v 8,3% případů. Tyto výsledky naznačují významné rozšíření genů kódujících MBL v našem regionu.
vzhledem k přítomnosti produkce MBL a biofilmu bylo 100% kmenů klasifikováno jako silní producenti. Další studie v Brazílii zjistila, že 40% P. aeruginosa klasifikovaných jako silně produkující biofilm byli také výrobci MBL.35 věříme, že tyto výsledky jsou důležité, jakmile se tyto vlastnosti (produkce biofilmu a MBL) překrývají a infekce způsobené těmito bakteriemi je obtížné léčit. To je částečně opodstatněné, protože růst bakterií v biofilmu je asi 64krát odolnější vůči antimikrobiálním látkám.48
P. aeruginosa má velké množství extracelulárních virulenčních faktorů, které také přispívají k patogenitě a závažnosti těchto infekcí, jako jsou geny kódované APRA, plcH, plcN, lasA, lasB, toxA a algD.32,33 naše data ukázala, že přítomnost multirezistentního profilu ve většině kmenů (88%) byla pozitivní na geny virulence aprA, plcH, plcN, lasA, lasB, toxA a algD, s výjimkou jednoho kmene, který nevykazoval geny toxA a plcH, což může dále přispět k horší prognóze spojené se závažnými infekcemi.
naše výsledky potvrzují předchozí zjištění týkající se rizikových faktorů pro vývoj bakterémie rezistentní na P. aeruginosa karbapenem, stejně jako šíření kmenů produkujících MBL typu SPM-1. Tato studie však přispívá k dalšímu důkazu šíření kmenů produkujících MBL, zejména typu VIM, u vysoce virulentních kmenů a silně producentů biofilmu.
střet zájmů
autoři nehlásí žádný střet zájmů.