Abstrakt
Cirhotická kardiomyopatie je nedávno uznávaný stav spočívající v dysfunkci myokardu projevující se u pacientů s cirhózou v nepřítomnosti předchozího srdečního onemocnění. Základní patogenetické mechanismy zahrnují“ miokardiotoxické “ prostředí, které vede k tupé srdeční reakci na stres, ať už fyzické nebo farmakologické. Tento stav je nyní lépe pochopen a může být diagnostikován klinicky, laboratorními elektrokardiografickými a echokardiografickými kritérii. Klinicky je systolická neschopnost nejzřetelnější, když jsou pacienti s cirhózou vystaveni stresu, ať už fyzickému nebo farmakologickému. Navzdory tomu, že je dobře pochopen, chybí znalosti o správné praktické aplikaci. Nedávné kazuistiky naznačují, že CCM musí být léčena brzy, protože může být spouštěcím faktorem komplikací cirhózy. Studie jsou potřebné k identifikaci potenciální léčby, která mění přirozenou historii srdečních chorob u pacientů s cirhózou, zejména ve fázích, ve kterých jsou pacienti asymptomatičtí.
klíčová slova
cirhóza jater, srdeční selhání, kardiomyopatie
Úvod
cirhózní kardiomyopatie (CCM) je srdeční dysfunkce charakterizovaná suboptimální kontraktilní odpovědí na stres a zhoršenou diastolickou funkcí v nepřítomnosti předchozího srdečního onemocnění . V současné době výzkum navrhl, že pacienti s cirhózou mají vnitřní srdeční dysfunkci, která může ovlivnit vývoj selhání ledvin u pokročilého onemocnění jater .
od roku 2002 se nálezy o cirkulační dysfunkci u onemocnění jater vyvinuly diagnostickými metodami, které zdůrazňovaly význam identifikace CCM v klinické praxi . Stále však existuje mezera znalostí o řízení tohoto stavu . Přítomnost dysfunkce myokardu u cirhózy zvyšuje riziko hepatorrenálního syndromu (HRS) a nežádoucích srdečních příhod a souvisí s vyšší mortalitou .
přezkoumali jsme dostupnou literaturu v PubMed týkající se markerů komplikací cirhózy a interakcí srdce a jater. Účelem tohoto přezkumu je diskutovat o potřebě včasného sledování a léčby CCM, protože může být spouštěcím faktorem pro komplikace cirhózy, čímž přináší nové poznatky do klinické praxe.
definice a prevalence
ccm popisuje srdeční chronickou dysfunkci u pacientů s cirhózou navzdory předchozímu strukturálnímu srdečnímu onemocnění . Je definována jedním nebo více z následujících: strukturální abnormality v srdečních komorách; diastolická dysfunkce; normální nebo rozšířená systolická funkce v klidu, ale špatná kontraktilní reakce na stres; a elektrofyziologické změny . Tyto abnormality mohou být pozorovány až u 50% pacientů s cirhózou .
Fyziopatologie
fyziopatologie cirhózy je známa nadprodukcí oxidu dusnatého (NO) ve splanchnických cévách a následnou systémovou vazodilatací. Tento mechanismus spouští rennin-angiotensin-aldosteronový systém (RAAS) a aktivaci sympatického nervového systému a zvyšuje hladinu vazopresinu v séru, což vede k hyperdinamickému stavu, který může reagovat z buněčného na klinické prostředí.
tito pacienti mají zvýšený sérový oxid uhelnatý (CO) sekundární k sympatické hyperaktivitě a zánětlivým cytokinům. Existuje nárůst CO, spojený s vysokými hladinami NO, akumulací endokanabinoidů a dalších vazodilatačních látek. Tyto látky zvyšují hladiny cyklického guanosin monofosfátu (cGMP), který inhibuje cyklický adenosin monofosfát (cAMP) v kardiomyocitech, který je zodpovědný za příliv vápníku a větší kontraktilní sílu (obrázek 1,2). Analýza buněk myokardu ukazuje snížení tekutosti plazmatické membrány v důsledku ukládání cholesterolu, což ztěžuje interakci látek, jako jsou beta-adrenergní receptory a G-proteiny . Komorový myokit může mít také snížení funkce draslíkových kanálů, což vede k suboptimální srdeční relaxaci a následné diastolické dysfunkci .
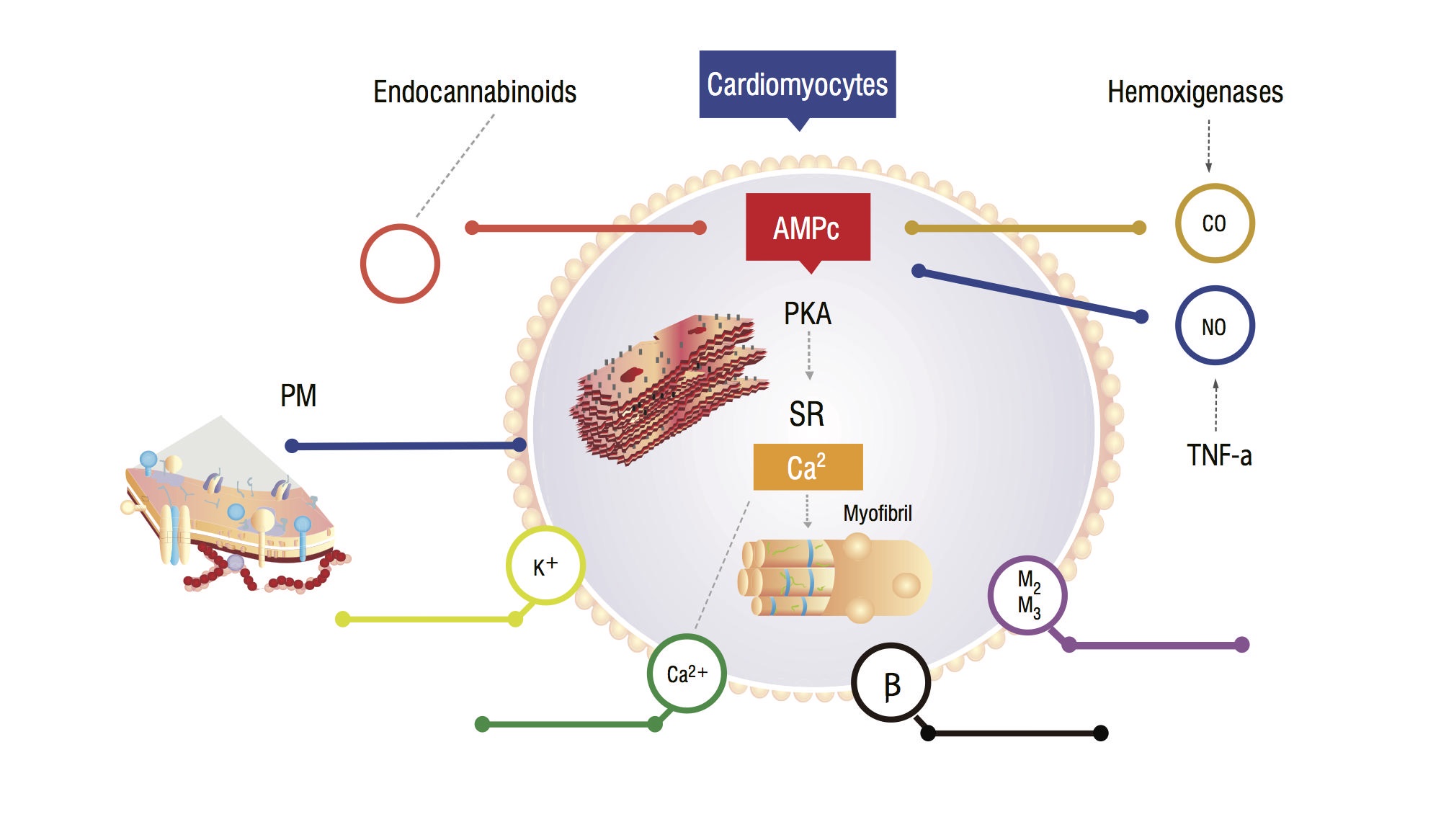
Obrázek 1. Fyziopatologický model kardiomyocytů ukazující hlavní signální dráhy, které vedou k tupé reakci myokardu na stres. PM: plazmatická membrána; CO: oxid uhličitý; NO: oxid dusnatý; TNF-a: faktor nekrózy nádorů alfa; SR: Sarkoplazmatický reticullum; AMPc: cyklický adenosinmonofosfát; PKA: Protein kináza a.
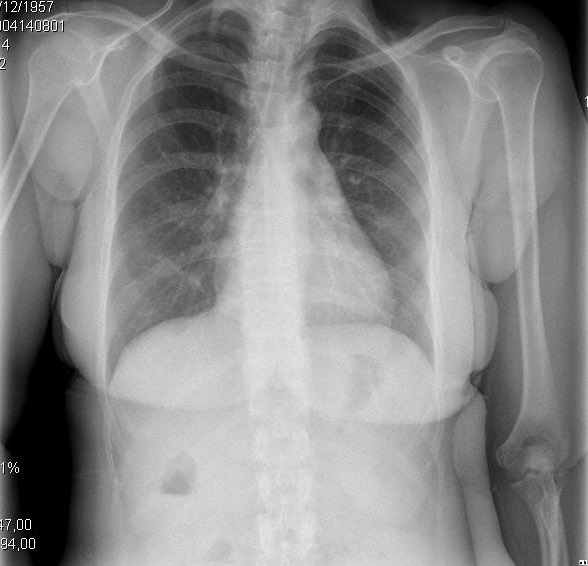
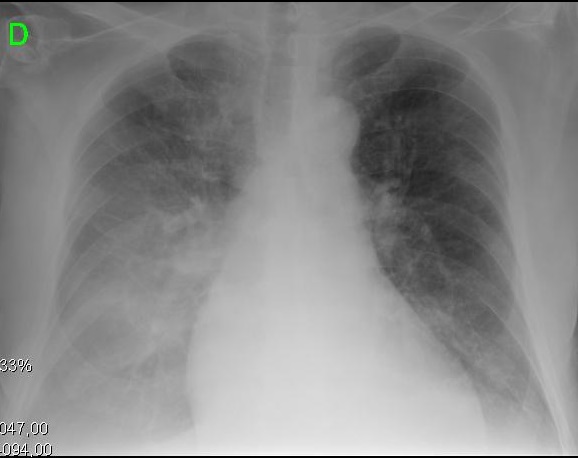
Obrázek 2. Klinické a radiologické prezentace různých evolučních stadií cirhotické kardiomyopatie. A. levý obrázek ukazuje malý pleurální výpotek a CTI 0,50. B. pravý obrázek zobrazuje těžkou plicní kongesci a CTI 0,67.
Tabulka 1. Klinická a doplňková kritéria pro diagnostiku CCM. Upraveno z odkazu 29 se svolením.
perzistentní beta-adrenergní podněty indukují down-regulaci a snižují hustotu srdečních receptorů, modifikují signální kaskády zodpovědné za aktivaci kalciového kanálu; výsledkem je zhoršená kontraktilní funkce . Klinickým důsledkem této cesty je tupá funkce myokardu a zvýšení srdečních biomarkerů .
identifikace CCM závisí na jemných klinických rysech,které mohou být odhaleny v průběhu onemocnění, nebo se mohou jasně projevit ve specifických klinických scénářích kmene, a stává se výzvou ohledně toho, zda a kdy léčit.
přírodní historie a diagnostika
diagnostická kritéria jsou shrnuta v tabulce 1 a opírají se o klinické, zobrazovací a biomarkery.
klinické příznaky
klinické příznaky CCM se mohou objevit u pacientů se zjevně normální srdeční funkcí, protože chronická adaptace kardiomyocytů na cirhotické prostředí vede ke všem těmto buněčným modifikacím .
cirhózní pacienti se vyvíjejí s retencí sodíku a tekutin, periferní vazodilatací, sympatickou hyperaktivitou a akumulací“ miokardiotoxických “ látek, což vyžaduje adaptivní proces kardiomyocytů. Tato rovnováha kontinua může být přerušena a odhalena latentní srdeční selhání ve stresových situacích, jako je transplantace jater, transjugulární intrahepatální portosystémový zkrat nebo infekce .
ačkoli cirhotická kardiomyopatie má tendenci být chronickým stavem, studie ukazují, že klinické příznaky dysfunkce myokardu se mohou zvrátit až 15 měsíců po úspěšné transplantaci jater, stejně jako prodloužení QT.
laboratorní nálezy
vzhledem k tomu, že srdeční dysfunkce může být odrazena zánětlivými biomarkery, nové srdeční a prozánětlivé markery jsou nedávno studovány a korelovány s vývojem komplikací vedoucích ke zvýšené mortalitě .
nedávné studie popisují korelaci mezi hladinami pro-hormonu ANP (proANP) a natriuretického peptidu typu B (BNP), kopeptinu a troponinu T s vysokou citlivostí (hs-TnT), stejně jako rozpustného receptoru aktivátoru plazminogenu typu urokinázy (suPAR) a vysoce citlivého C-reaktivního proteinu (hs-CRP) a kardiovaskulárních komplikací při cirhóze. Jeho klinické použití se však stále hodnotí .
natriuretický peptid je vylučován kardiomyocyty v reakci na přetížení objemu nebo tlaku nebo ischemii myokardu, aby kompenzoval účinek RAAS v rovnováze sodíku a vody . BNP může být jedním z nejvíce dostupných biomarkerů, který umožňuje včasné rozpoznání postižení srdce . Koncentrace v séru je vyšší, čím závažnější jsou onemocnění jater a srdce .
slibné studie uvádějí, že vysoké hladiny adrenomedullinu jsou také pozorovány u cirhózy s klinickým srdečním postižením nebo bez něj; tato látka se uvolňuje v průtoku krve, aby působila jako vazodilatátor a má za cíl snížit následné zatížení . Galektin-3, nejnovější studovaný biomarker zvýšený u pacientů s cirhózou, byl spojen s fibrózou myokardu a může korelovat se závažností cirhózy. Tento marker se ukázal být citlivější než BNP při hodnocení diastolické dysfunkce, i když je méně specifický .
elektrokardiogram
elektrokardiografické (EKG) abnormality mohou být včas zaznamenány u asymptomatického pacienta s CCM a mohou korelovat s komorovými arytmiemi a náhlou smrtí . Nejběžnějším nálezem EKG je prodloužení QT intervalu, které lze pozorovat přibližně u 30-40% pacientů s cirhózou, zejména Child-Pugh B nebo C, bez ohledu na etiologii cirhózy .
tento vzor EKG může být sekundární k abnormalitám repolarizace kardiomyocytů v draslíkových kanálech a snížení koncentrace těchto kanálů v plazmatické membráně v reakci na drobné modifikace portálního tlaku . Dysfunkce iontových kanálů tak způsobuje prodloužení akčního potenciálu buněk myokardu, což má za následek delší komorovou systolu a QT . Delší doba kontrakce znamená zhoršenou relaxaci, což způsobuje diastolickou dysfunkci .
elektromechanické odpojení je popsáno jako dyssynchronie mezi elektrickým stimulem a systolickou mechanickou odpovědí srdce, přičemž u těchto pacientů dochází k progresivní ztrátě funkce myokardu a městnavému srdečnímu selhání1 . Chronotropní neschopnost je charakterizována neschopností sinusového uzlu reagovat na fyziologické nebo farmakologické podněty, což je determinant ve fyziopatologii CCM. Tyto změny jsou také sekundární k portální hypertenzi, autonomní dysfunkci, hyperdynamické cirkulaci a přítomnosti prozánětlivých faktorů ovlivňujících myokard pacienta .
echokardiogram
echokardiogram poskytuje relevantní údaje o srdeční funkci a používá se jako diagnostická kritéria pro cirhotickou kardiomyopatii .
hlavními nálezy u těchto pacientů jsou end-diastolická zvětšení levé komory (LV), snížení maximální rychlosti a rychlost systolické deformity; zvýšený koncový diastolický tlak levé komory bez vhodné expanze LVEF. Zvětšení levé síně (LA) o více než 34 mL / m2může naznačovat chronickou diastolickou dysfunkci a pokud je spojeno se snížením hmotnosti LV, může naznačovat horší prognózu . La hodnocení může být provedeno pomocí dvourozměrné echokardiografie a sledování skvrn .
časté nálezy pozorované v srdeční dopplerovské echokardiografii naznačují poruchu relaxace myokardu u pacientů s cirhózou: snížení poměru E/a (<1) a prodloužená doba zpomalení e vln (DT) a isovolumetrická doba relaxace (IVRT) > 80ms .Závažnější je diastolická dysfunkce, kratší je IVRT a mitrální DT a vyšší je rychlostní poměr E / A, charakterizující pokročilou diastolickou dysfunkci, zvýšený tlak LA a horší funkční třídu.
nedávné studie s hodnocením globálního podélného kmene (GLS) ukazují, že to může být užitečná metoda pro včasnou detekci srdeční dysfunkce u pacientů s cirhózou, zejména systolické dysfunkce v klidu .
poměr E/a může být spolehlivým parametrem v diagnostice diastolické dysfunkce u pacientů s cirhózou, a to i při hodnotách ovlivněných stupněm hydratace pacienta, i když se může lišit v důsledku ascitu a přetížení objemu . Mezitím izovolumetrický relaxační čas, i když je vysoce citlivý, nepředstavuje plnění LV a mění se se změnou srdeční frekvence .
mírná systolická dysfunkce a diastolická dysfunkce mohou být prezentovány nezávisle na stupni cirhózy. Diastolická dysfunkce se však vyskytuje nejčastěji u pacientů s cirhózou a obecně předchází první .
diskuse
tento přehled se zabývá rostoucí identifikací a porozuměním fyziopatologie na CCM, je to korelace se špatnou prognózou u pacientů s cirhózou a vyvolává obavy z terapeutického přístupu.
tento článek shrnul diagnostická kritéria (Tabulka 1) již zavedená v lékařské literatuře, s důrazem na nové biomarkery, které byly studovány pro diagnostickou komplementaci. Studie ukázaly, že dysfunkce myokardu existuje v různých stádiích jaterní cirhózy. Bylo popsáno, že pokud má pacient na echokardiogramu vysokou BNP a ventrikulární dysfunkci, je léčba selhání ledvin velmi obtížná; na druhé straně včasná intervence u pacientů, kteří dosud neprokázali srdeční onemocnění, je oblast, která dosud nebyla prozkoumána.
Tabulka 1. Klinická a doplňková kritéria pro diagnostiku CCM. Upraveno z odkazu 29 se svolením.
klinické příznaky
žádné kardiopulmonální příznaky v klidu
nízká funkční srdeční rezerva
Hiperadrenergní stav s retencí sodíku a tekutin
biomarkery (troponin I, pro-BNP a BNP, další)
Eletrokardiografie
elektrofyziologické abnormality (prodloužení QT a další)
Echokardiografická kritéria
diastolické hodnocení
E/a poměr <1.0 (věk opraven)
Prodloužený isovolumický relaxační čas (>80 msec)
prodloužená doba zpomalení (> 200 msec)
hypertrofie levé komory
systolické hodnocení
ejekční frakce v klidu < 55%
kontraktilní deficit ve stresu
příznaky a příznaky selhání jater mají tendenci být pozdě, s jemnými klinickými a laboratorními projevy, někdy obtížně interpretovatelné. Specialista nebo dokonce praktický lékař může čelit pacientovi se stížností na dušnost, bez patologického jugulárního otoku, normálních počátečních kardiologických vyšetření, ale s vysokým BNP, což může představovat případ CCM.
na rozdíl od jiných studií naše skupina navrhuje pokrok v této oblasti, protože pochopení srdečních chorob souběžných s cirhózou může umožnit včasný terapeutický zásah komplikací způsobených nediagnostikovaným selháním myokardu. Transplantace jater a tipy jsou speciální klinická nastavení, která mohou u těchto pacientů deflagrovat srdeční selhání. Protože pacienti po těchto postupech přežívají déle, lékaři by čelili zhoršujícím se srdečním parametrům .
věříme, že včasná terapeutická intervence u CCM je slibná, když se projevuje komplikacemi, jako je refrakterní HRS, před zjevnou plicní kongescí způsobenou selháním myokardu. Literatura podporuje, že situace fyzického nebo farmakologického stresu nebo infekcí spojených s latentní cirhotickou kardiomyopatií mohou mít za následek HRS, které mohou být refrakterní vůči konvenční léčbě a spojené s horší prognózou, pokud je přítomna systolická dysfunkce .
naše zkušenosti naznačují, že prezentace HRS je vodítkem k zahájení léčby složky myokardu. Tento postup do HRS je chápán, protože existence CCM je spouštěcím a udržujícím faktorem HRS, takže pokud je CCM v této souvislosti osloven brzy, HRS může mít lepší prognózu .
naše skupina byla průkopníkem léčby pacientů s klinickou diagnózou CCM v progresi k SHR refrakterní ke konvenční léčbě, při které bylo použití dobutaminu jako záchranné terapie pro renální funkce úspěšné. Cílem je aplikovat tyto teoretické znalosti předvídající tuto komplikaci u pacientů v konečném stádiu onemocnění jater .
přestože je dobře pochopen, chybí znalosti o správné praktické aplikaci. K rozpoznání CCM u asymptomatického pacienta bez zjevných funkčních omezení, ale se subklinickým buněčným a strukturálním srdečním onemocněním je nutný vysoký stupeň klinického podezření.
studie jsou potřebné k identifikaci potenciální léčby, která mění přirozenou anamnézu srdečních chorob u pacientů s cirhózou, zejména ve fázích, ve kterých jsou pacienti asymptomatičtí. To představuje oblast znalostí, která dosud nebyla prozkoumána, zejména pokud jde o budoucí terapeutické možnosti.
střet zájmů
autoři prohlásili, že v souvislosti se zveřejněním tohoto příspěvku nedochází ke střetu zájmů.
finanční podpora
žádná.
- Sampaio F, Pimenta J (2016) hodnocení funkce levé komory v cirhóze: současné metody a budoucí směry. Svět J Gastroenterol 22: 112-125.
- Shin WJ, Song JG, Jun IG, Moon YJ, Kwon HM, et al. (2016) vliv ventrikulo-arteriální vazby na výsledky transplantace v cirhotice: analýza vztahů křivky tlaku a objemu. J.
- Carvalheiro F, Rodrigues C, Adrego T, Viana J, Vieira H, et al. (2016) diastolická dysfunkce u jaterní cirhózy: prognostický prediktor při transplantaci jater? Transplantace Proc 48: 128-31.
- Merli M, Torromeo C, Giusto M, Iacovone G, Riggio O, et al. (2016) přežití po 2 letech u pacientů s cirhózou jater je ovlivněno objemem levé síně a hmotností levé komory. Játra Int.
- Møller S, Henriksen JH (2002) Cirhotická kardiomyopatie: patofyziologický přehled oběhové dysfunkce u onemocnění jater. Srdce 87: 9-15.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Cirhotická kardiomyopatie: další případ úspěšného přístupu k léčbě hepatorenálního syndromu. Případ Rep Gastroenterol 10: 531-7.
- Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ (2011) pohled na cirhotickou kardiomyopatii. Transplantační Proc 43: 1649-1653.
- Ma Z, Lee SS (1996) Cirhotická kardiomyopatie: dostat se k jádru věci. Hepatologie 24: 451-459.
- Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, et al. (2010) Cirhotická kardiomyopatie. J Am Sb. 56: 539-549.
- Myers RP, Lee SS (2000) Cirhotická kardiomyopatie a transplantace jater. Jaterní Transpl 6: S44-52.
- Wiese S, Mortensen C, Gøtze JP, Christensen E, Andersen O, et al. (2014) srdeční a prozánětlivé markery předpovídají prognózu cirhózy. Játra int 34: e19-30.
- Fattouh AM, El-Shabrawi MH, Mahmoud EH, Ahmed WO (2016) hodnocení srdečních funkcí cirhózních dětí pomocí sérového mozku natriuretického peptidu a tkáňového Dopplerovského zobrazování. Ann Pediatr Cardiol 9: 22-8.
- Rahman S, Mallett S V (2015) cirhózní kardiomyopatie?: Důsledky pro perioperační léčbu pacientů po transplantaci jater 7: 507-20.
- Farr M, Schulze PC (2015) nedávné pokroky v diagnostice a léčbě kardiomyopatie spojené s cirhózou u kandidátů na transplantaci jater: pokročilé zobrazování ozvěny, srdeční biomarkery a pokročilá terapie srdečního selhání. Clin Med Insights Cardiol 8: 67-74.
- Licata A, Corrao S, Petta S, Genco C, Cardillo M, et al. (2013) plazmatická hladina NT pro BNP a objem síní jsou spojeny se závažností jaterní cirhózy. PLoS One 8: e68364.
- Abbas WA, Kasem Ahmed SM, Abdel AAL AM, Mahmoud AA, Abdelmalek MO, Mekky MA, et al. Galaktin-3 a mozkový natriuretický peptid versus konvenční echokardiografie při včasné detekci cirhotické kardiomyopatie. Turek Jarolím 27: 367-74.
- Wong F, Siu S, Liu P, Blendis LM (2001) mozkový natriuretický peptid: je to prediktor kardiomyopatie při cirhóze? Clintonová (Lond) 101: 621-628.
- Wong F (2009) cirhózní kardiomyopatie. Hepatol Int 3: 294-304.
- Mimidis K, Papadopoulos V, Thomopoulos K, Tziakas D, Ritis K, et al. (2003) prodloužení QTc intervalu u pacientů s cirhózou. Ann Gastroenterol 16: 155-8.
- Mozos I (2015) riziko arytmie u jaterní cirhózy. Svět Jiří 7: 662-672.
- Mocarzel LO, Bicca J, Jarske L, Oliveira T, Lanzieri P, et al. (2016) Cirhotická kardiomyopatie: další případ úspěšného přístupu k léčbě hepatorenálního syndromu. Případ Rep Gastroenterol 10: 531-537.
- Batchvarov V, Camm AJ (2014) Qt disperze: měření a interpretace.
- Páll A, Czifra A, Vitális Z, Papp M, Paragh G, et al. (2014) patofyziologický a klinický přístup k cirhotické kardiomyopatii. J Gastrointestinální Játra Dis 23: 301-310.
- Castro Hevia J, Antzelevič C, Tornés Bárzaga F, Dorantes Sánchez M, Dorticós Balea F, et al. (2006) disperze Tpeak-Tend a tpeak-tends jako rizikové faktory pro komorovou tachykardii / ventrikulární fibrilaci u pacientů s Brugadovým syndromem. J Am Sb Cardiol 47 (9): 1828-34.
- Demir C, Demir M (2013) hodnocení intervalu Tp-e a poměru TP-e/QT u pacientů s chronickou hepatitidou B.Prague Med Rep 114: 239-245.
- Jewell DP (2006) noví pacienti, nové lekce, nové myšlení při zánětlivém onemocnění střev: Světový kongres gastroenterologického sympozia, Montreal, Kanada. Kolorektální Dis 8 Suppl 1(s1): 1-2.
- Gassanov N, Caglayan E, Semmo N, Massenkeil G, Er F (2014) Cirhotická kardiomyopatie: perspektiva kardiologa. World J Gastroenterol 20: 15492-15498.
- Chayanupatkul M, Liangpunsakul S (2014) cirhózní kardiomyopatie: review of pathophysiology and treatment. Hepatol Int 8: 308-315.
- Møller S, Henriksen JH, Bendtsen F (2014) Extrahepatic complications to cirrhosis and portal hypertension: haemodynamic and homeostatic aspects. World J Gastroenterol 20: 15499–517.
- Møller S, Bendtsen F (2015) Cirrhotic Multiorgan Syndrome. Dig Dis Sci 60: 3209-3225.