spinocelulární karcinom hlavy a krku (SCCHN) je šestým nejčastějším novotvarem na světě s ~600 000 případy diagnostikovanými ročně. Posledních 20 let přineslo množství údajů z klinických studií, což změnilo standardy péče o léčbu SCCHN. Historicky špatná lokální kontrola onemocnění a celkové přežití poskytly impuls pro řadu klinických studií hodnotících multimodální terapii u pacientů s SCCHN. Složitá anatomie a kritické funkční a sociální role oblasti hlavy a krku nepochybně také motivovaly značné úsilí k identifikaci alternativ k onkologické resekci maligních nádorů v této oblasti. V tomto přehledu, shrnujeme historický vývoj kombinované chemoradiační terapie při léčbě SCCHN, Poskytnout aktualizaci nedávné literatury v této oblasti, a diskutovat o současných klinických otázkách, které mohou budoucí studie vyřešit.
souběžná Chemoradiace-od experimentální po preferovanou léčbu
klinické vyšetřování úlohy kombinované chemoradiační léčby pro SCCHN se datuje alespoň do konce 1960, s časnými studiemi zkoumajícími sekvenční a souběžné použití jednotlivých látek včetně fluorouracilu (5FU), bleomycinu, cisplatiny, methotrexátu a mitomycinu.1 takové studie prokázaly špatnou odpověď na chemoterapii jednou látkou samotnou, zatímco poukazovaly na cisplatinu jako na nejúčinnější monoterapii s 25-30% mírou odpovědi.2-4 následné studie zkoumaly úlohu multiagentních chemoterapií a prokázaly výrazné zlepšení odpovědi na onemocnění na 70% při kombinované cisplatině a bleomycin5 a >90% četnosti odpovědí při cisplatině a kontinuální infuzi 5FU.6,7 důležité je, že tyto rané studie ukázaly na potenciální přínos pro přežití z přidání chemoterapie k tradiční definitivní léčbě záření a / nebo chirurgického zákroku pro SCCHN a podnítily další vyšetřování ve větších randomizovaných studiích fáze III.
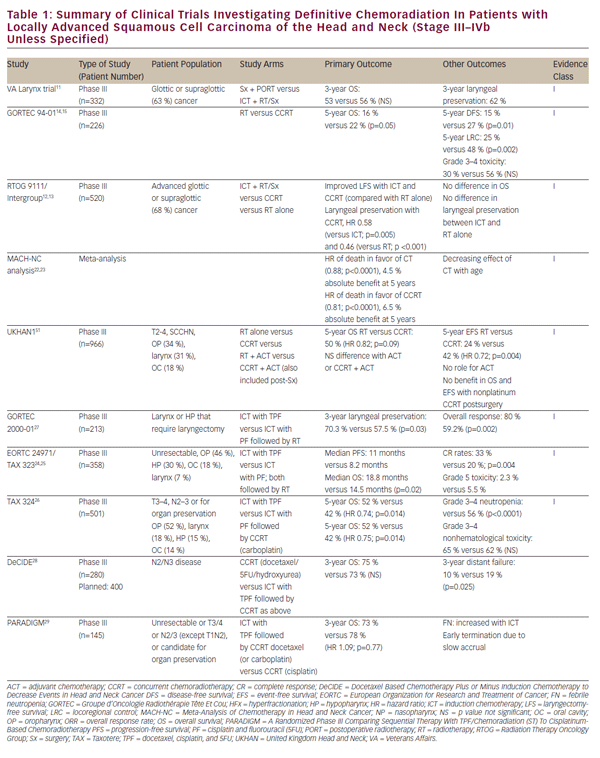
se zdokonalením chemoterapeutických režimů, zvážení se obrátilo na potenciál definitivních a orgánově šetřících chemoradiačních přístupů u pacientů s lokálně pokročilým SCCHN. Tato práce byla zpočátku rozšířena řadou studií s jednou institucí prokazujících životaschopnost definitivní chemoradiace jako alternativy k chirurgickému zákroku pro glottické a supraglottické nádory hrtanu.8-10 historicky důležitá studie o rakovině hrtanu veteránů nakonec prokázala, že indukční chemoterapie (ICT) následovaná zářením by mohla dosáhnout uchování orgánů u pacientů s SCCHN bez kompromisů v celkovém přežití.11 tato studie stanovila zdůvodnění studie landmark Radiation Therapy Oncology Group (RTOG) 9111, která se zabývala vhodným sekvenováním chemoterapie a záření u pacientů s lokálně pokročilým supraglotickým nebo glottickým karcinomem hrtanu. Pacienti byli randomizováni do: ICT následované zářením; souběžná chemoradiace (CCRT); nebo záření samotné.12,13 výsledky RTOG 9111 prokázaly nadřazenost CCRT, pokud jde o kontrolu lokoregionálního onemocnění a zachování hrtanu, zatímco nebyl pozorován žádný rozdíl v celkovém přežití mezi třemi rameny. Následně studie Groupe d ‚ Oncologie Radiothérapie Tête Et Cou (GORTEC) 94-01 randomizovala pacienty s lokálně pokročilými primárními nádory orofaryngeálního záření nebo CCRT s karboplatinou / 5FU a prokázala zlepšenou lokální kontrolu onemocnění i celkové přežití.14,15 podobné zlepšení přežití a lokoregionální kontroly bylo hlášeno u pacientů s nosohltanem léčených CCRT.16-21 zpráva z metaanalýzy chemoterapie u rakoviny hlavy a krku (MACHNC) naznačila celkový přínos pro přežití 6, 5% po 5 letech s CCRT, ale ne s ICT nebo adjuvantní chemoterapií.22,23 v této metaanalýze bylo pozorováno, že účinek chemoterapie na přežití klesá s věkem u osob starších 50 let bez prokazatelného přínosu u osob starších 71 let. Společně, i když se tyto studie liší v kritériích pro zařazení a vyloučení, klinických cílových parametrech a metodikách léčby (viz tabulka 1), potvrzují přínos CCRT oproti samotné radioterapii jako definitivní léčbě lokálně pokročilého SCCHN.
Indukční Chemoterapie Předcházející (Chemo) Záření-Životaschopná Strategie?
ačkoli přímé srovnání s CCRT naznačilo v klinické studii RTOG 9111 inferioritu IKT z hlediska lokální kontroly onemocnění, 12 o tento terapeutický přístup zůstává zájem. Údaje z RTOG 9111 naznačují rovnocennost těchto přístupů z hlediska toxicity vysokého stupně, což ztěžuje zdůvodnění volby IKT na základě tolerance pacienta. Nicméně následné studie týkající se RTOG 9111 se snažily vyvinout na platformě informačních a komunikačních technologií, aby se tato možnost stala životaschopnější. Studie EORTC 24971 / TA x 323 trial24, 25 prokázala zlepšení celkového přežití přidáním docetaxelu (TPF) k IKT režimu cisplatiny a 5FU (PF) použitému ve studii RTOG 9111 u pacientů s neresekovatelnou SCCHN. Studie TA x 324 podobně hodnotila TPF versus PF v nastavení CCRT a nahrazování týdenní karboplatiny cisplatinou v těchto režimech. Tato studie prokázala lepší lokoregionální a vzdálenou kontrolu onemocnění a také lepší celkové přežití s TPF ve srovnání s PF.26 další následná studie (GORTEC 2000-01) u lokálně pokročilého karcinomu hrtanu a hypofaryngu potvrdila zlepšenou odpověď na onemocnění a zachování hrtanu s indukčním TPF ve srovnání s PF, ale neprokázala žádný účinek na přežití.27 ačkoli se tyto studie liší, pokud jde o kritéria pro zařazení a vyloučení, klinické cílové parametry a metodiky léčby (viz tabulka 1), společně podporují nadřazenost TPF nad IKT založenou na PF. Přímé srovnání IKT s CCRT na bázi cisplatiny se standardní péčí však chybí.
metaanalýza MACH-NC, jak již bylo uvedeno, naznačovala méněcennost IKT ve srovnání s CCRT, pokud jde o celkové přežití a kontrolu lokoregionálních onemocnění.22 je však pozoruhodné, že přínos IKT byl výraznější než přínos CCRT z hlediska míry vzdálených metastáz.22 To může odrážet odlišnou úlohu chemoterapie v těchto léčebných přístupech. Souběžná chemoterapie může hrát převládající radiosenzibilizující roli, což má za následek dominantní účinek na lokální kontrolu onemocnění, zatímco multiagentní IKT může poskytnout účinnou systémovou léčbu mikrometastatického onemocnění. Toto pozorování vytvářející hypotézy naznačuje potenciálně komplementární povahu těchto léčebných postupů a vyvolalo zájem o jejich kombinaci. Dosavadní snahy o zkoumání kombinace ICT a CCRT vedly ke špatným akruálním a neprůkazným zjištěním (studie DeCIDE a PARADIGM).28,29 probíhající randomizovaná studie fáze III porovnává IKT s PF nebo TPF následovanou CCRT na bázi cisplatiny versus samotnou ccrt jako první linie léčba lokálně pokročilého SCCHN (NCT00261703). Výsledky z výše uvedených studií o CCRT a IKT jsou rovněž shrnuty v tabulce 1.
adjuvantní Chemoradiace
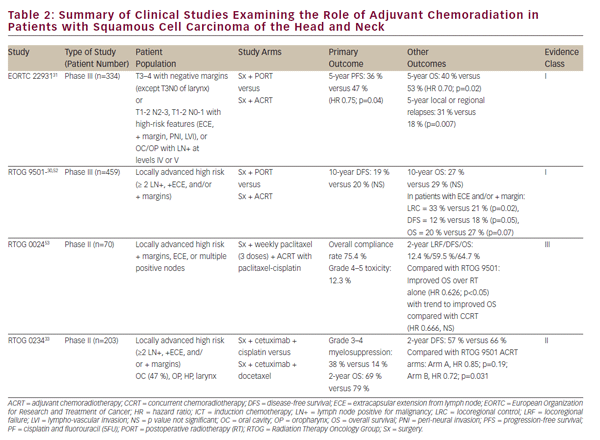
výše uvedené klinické studie prokázaly CCRT jako životaschopnou definitivní léčbu pro uchování orgánů v Lokálně pokročilém SCCHN. Nicméně definitivní onkologická resekce zůstává důležitou možností léčby lokalizovaného onemocnění a důležitou součástí multimodální terapie pokročilých nádorů ústní dutiny, hrtanu a hypofaryngu. Úloha chemoradiace v adjuvantním prostředí po onkologické resekci byla do značné míry definována dvěma randomizovanými studiemi fáze III-EORTC 22931 a RTOG 950130,31 (viz tabulka 2). Tyto studie zkoumaly použití pooperačního záření versus adjuvantní chemoradiace s cisplatinou podávanou každé 3 týdny po dobu tří cyklů u pooperačních pacientů s SCCHN. Obě studie prokázaly zlepšení kontroly lokoregionálního onemocnění a přežití bez progrese, zatímco studie EORTC také ukázala zlepšení celkového přežití. Post-hoc analýza těchto dvou studií naznačila, že přínos adjuvantní CCRT byl největší u pacientů s pozitivními chirurgickými okraji a / nebo extrakapsulárním rozšířením (ECE) z resekovaných lymfatických uzlin.32 úloha adjuvantní CCRT u pacientů s blízkými chirurgickými okraji je méně jasná a byla podpořena EORTC 22931, která zahrnovala pacienty s ≤5 mm chirurgickými okraji. Na druhé straně rtog 9501 zahrnoval pacienty na základě pozitivních, ale ne blízkých marží. Post-hoc analýza neprokázala žádný zřejmý přínos CCRT pro pacienty splňující vstupní kritéria pouze pro jednu z těchto studií.32 v podobném duchu nebyla adjuvantní léčba CCRT dostatečně studována u starších pacientů, protože pacienti starší 70 let byli vyloučeni z EORTC 22931 a tvořili pouze malou menšinu (5%) pacientů ve studii RTOG 9501.30,31
Pursuant to EORTC 22931 and RTOG 9501, adjuvant CCRT has now become standard-of-care treatment in high-risk postoperative SCCHN patients. The phase II RTOG 0234 study has explored alternative adjuvant chemoradiation treatment regimens, randomizing patients with multiple involved lymph nodes, ECE, or positive margins to the epidermal growth factor receptor (EGFR) antibody, cetuximab, plus docetaxel or cetuximab plus cisplatin. This study demonstrated an apparent survival benefit from concurrent adjuvant cetuximab and docetaxel.33 výsledky této zajímavé studie fáze II vyžadují validaci ve studii fáze III před začleněním do klinické praxe.
vliv frakcionace radioterapie na Chemoradiaci
ve snaze zvýšit účinnost zkoumaly předchozí klinické studie alternativní frakcionační schémata pro podávání radioterapie se souběžnou chemoterapií nebo bez ní u pacientů s SCCHN. Studie RTOG 9003 a Danish Head and Neck Cancer Group (DAHANCA) prokázaly zlepšení kontroly lokoregionálních onemocnění pomocí akcelerovaných nebo hyperfrakcionovaných radioterapeutických režimů, pokud se záření používá samostatně.34,35 následná metaanalýza dokonce naznačila mírný přínos pro přežití z hyperfrakcionace záření, pokud se používá jako jediný způsob léčby.36 v prostředí souběžné chemoterapie však studie RTOG 0129 a GORTEC 99-02 neprokázaly žádné zlepšení klinického výsledku s využitím akcelerované versus konvenční radioterapie.37,38 Hyper-frakcionovaná CCRT ve srovnání se samotným hyper-frakcionovaným zářením vedla ke zlepšení kontroly lokoregionálních nemocí v jedné instituci studie z Duke University a studie fáze III z Jugoslávie, přičemž druhá z nich také ukázala lepší celkové přežití a vzdálené přežití bez metastáz.39,40 tyto studie naznačují, že přínos CCRT přetrvává při hyperfrakcionované radioterapii. Přímé srovnání konvenčně frakcionovaného CCRT a hyper-frakcionovaného CCRT nebylo dosud provedeno. Je však pozoruhodné, že metaanalýza MACH-NC nezjistila žádný rozdíl ve výsledku u pacientů léčených CCRT pomocí konvenčních nebo změněných frakcionačních technik.22
toxicita-náklady na Chemoradiaci
v souladu s mnoha studiemi jednotlivých institucí, které jí předcházely, RTOG 9111 naznačil, že přínosy chemoterapie, ať už podávané sekvenčně nebo souběžně s ozařováním, přicházejí na úkor další toxicity.12 podobně v adjuvantním prostředí klinické studie EORTC 2291 a RTOG 9501 prokázaly přibližné zdvojnásobení toxicity stupně 3 s chemoradiací ve srovnání se samotným zářením.30,31 takový trend přetrvává i v nastavení hyper-frakcionované radioterapie.39 ačkoli očekávaná míra jakékoli specifické toxicity stanovená z historických studií je pravděpodobně nadhodnocena v současné době vysoce konformních radioterapeutických technik, jako je radioterapie modulovaná intenzitou (IMRT). Dvě malé randomizované studie uváděly významné snížení incidence a závažnosti xerostomie s použitím IMRT ve srovnání s konvenční trojrozměrnou konformní radioterapií u karcinomů hlavy a krku (modulovaná intenzita šetřící příušnice oproti konvenční radioterapii u rakoviny hlavy a krku a studie Tata Memorial Hospital).41,42 nejnovější studie zkoumající CCRT umožňují podávání léčby založené na IMRT jako standardní přístup při řízení SCCHN. Zbývá zjistit, jaký dopad bude mít IMRT na míru toxicity v kombinaci s chemoterapií v těchto větších randomizovaných studiích.
vylepšené radioterapeutické techniky spojené se zvyšujícím se významem a dostupností podpůrné péče a pomocných služeb, jako je patologie speechswallow a zubní péče, ještě více omezují výskyt závažných nehematologických toxicit. Očekává se však, že toxicita očekávaná z CCRT bude vyšší než samotná radioterapie. Tato přetrvávající toxicita odráží klinické „náklady“ na kombinaci chemoterapie a ozařování. V tomto nastavení zůstává prvořadé, aby lékaři komplexně vyhodnotili pacienty, aby zjistili, že potenciální přínosy CCRT ospravedlňují tyto náklady. Použití jednomodální radioterapeutické léčby u pacientů s výraznými komorbiditami/nízkým výchozím stavem výkonnosti nebo s nízkým rizikem, časné stadium onemocnění může být rozumným přístupem k maximalizaci terapeutického poměru. Tato analýza rizik a přínosů se stává ještě důležitější s příchodem molekulárně cílených látek, které nabízejí životaschopnou alternativu pro souběžnou terapii.
vznikající Role molekulárně cílených látek
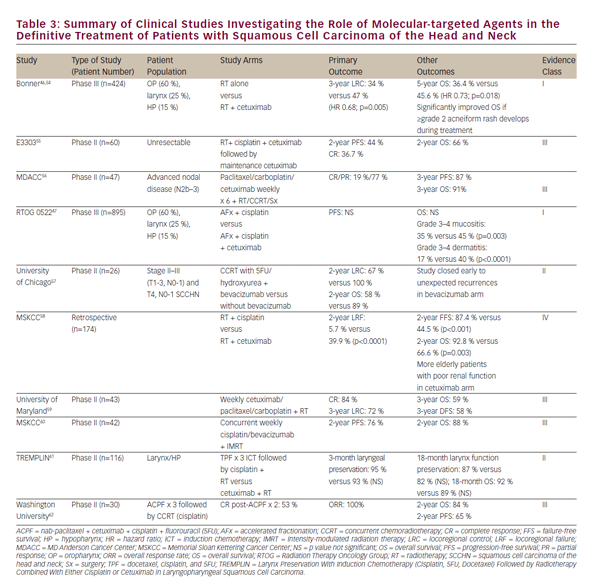
toxicita chemoradiační léčby, stejně jako touha dále zlepšovat klinické výsledky, podpořila rostoucí zájem o roli molekulárně cílených látek pro léčbu SCCHN. EGFR je nadměrně exprimován nebo mutován u 80-90% nádorů SCCHN, což je spojeno se sníženou odpovědí na radioterapii a horšími klinickými výsledky.43-45 v roce 2006, Bonner a kol. hlášeno v mezníkové studii u pacientů s lokálně pokročilým SCCHN léčených buď samotným zářením nebo zářením souběžně s protilátkou EGFR, cetuximabem. Tato studie prokázala, že současné cetuximab a záření zvyšují kontrolu lokoregionálních onemocnění a celkové přežití bez zhoršení běžné toxicity záření.46 tato studie definovala úlohu souběžného podávání cetuximabu a ozařování u pacientů, kteří nejsou kandidáty na cisplatinu.
následné studie se snažily porovnat CCRT se současným cetuximabem s cisplatinou. Retrospektivní a časné fáze studie se v tomto hodnocení lišily a v RTOG 1016 probíhá randomizované srovnání fáze III. Studie RTOG 0522 zejména vyhodnotila potenciální přínos cetuximabu k režimu založenému na cisplatině CCRT47. Tato studie ukázala, že po přidání ke standardní CCRT na bázi platiny cetuximab dále nezlepšoval přežití bez progrese onemocnění ani celkové přežití. V pooperačním prostředí bude rtog 0920 Hodnotit adjuvantní radioterapii s nebo bez cetuximabu v Lokálně pokročilém resekovaném SCCHN, zatímco studie fáze II / III RTOG 1216 vyhodnotí adjuvantní CCRT se souběžnou cisplatinou versus docetaxel versus docetaxel a cetuximab pro vysoce rizikové SCCHN.
bylo provedeno nebo probíhá mnoho časných klinických studií s dalšími molekulárně cílenými látkami spolu s ozařováním pro léčbu SCCHN. Jejich výběr je shrnut v tabulce i>3. S výjimkou studií s cetuximabem, žádné jiné molekulárně cílené činidlo nepostoupilo do bodu ovlivnění současné praxe mimo nastavení klinického hodnocení. Zatímco vyhlídka na molekulárně cílené látky je slibná, současná chemoterapie cisplatinou s vysokou dávkou zůstává preferovaným doporučením úrovně 1 současných pokynů pro národní komplexní péči (NCCN) pro CCRT.
Chemoradiační terapie u rakoviny hlavy a krku-vyvíjející se paradigma
za posledních 20 let došlo k vzniku chemoradiace jako standardu péče při definitivní léčbě SCCHN. U vhodně vybraných pacientů převažuje prokazatelný přínos přežití této léčby nad riziky další toxicity. Zůstávají však důležité otázky týkající se optimálního využití chemoradiace. Řada klinických studií dále zkoumala potenciální klinickou užitečnost IKT u lokálně pokročilých pacientů s SCCHN a zatímco tyto studie prokázaly zlepšení režimů IKT na úkor toxicity, žádná z nich přesvědčivě neprokázala významné klinické zlepšení ve srovnání s CCRT na bázi cisplatiny.
budoucí studie budou bezpochyby pokračovat ve zkoumání alternativních chemoterapeutických režimů a dávkovacích schémat, jakož i radioterapeutické frakcionace, dávkování a způsoby podání ve snaze pokročit ve stávajících technikách. Navíc, s pokračujícím vývojem nových molekulárně cílených chemoterapeutik, budoucí studie téměř jistě definují rostoucí roli těchto látek v léčbě SCCHN. Obzvláště zajímavé může být použití těchto látek v indukčním prostředí před CCRT, kde se mohou zaměřit na mikrometastatické onemocnění a snížit relaps vzdáleného onemocnění bez uložení omezení souvisejících s toxicitou na míru dokončení ccrt. Zatímco použití CCRT se vyvíjí, je také oprávněné pokračovat ve vyšetřování vhodné úlohy chirurgického zákroku v SCCHN. Pokroky v robotické chirurgii i chemoradiační léčbě poskytují equipoise pro takové vyšetřování. Současné pokyny pro praxi doporučují adjuvantní chemoradiaci pro pooperační pacienty s pozitivními okraji nebo ECE, zatímco adjuvantní záření samotné nebo zvážení chemoradiace se doporučuje pro pooperační pacienty s primární pT3 nebo pT4, PN2 nebo pN3 nodální onemocnění, úroveň IV nebo v postižení lymfatických uzlin, nebo s peri-neurální nebo lymfo-vaskulární invazí. Další studie identifikující předoperační radiografické a klinické prediktory vysoce rizikového stavu u pacientů s časným stádiem SCCHN se ukáží jako cenné při vedení léčby takových pacientů, kteří by mohli být ušetřeni chirurgický zákrok s přístupem k definitivní chemoradiační léčbě.
nedávné rozpoznání infekce lidským papilomavirem (HPV) jako příčiny a příznivého prognostického faktoru v SCCHN pocházející z orofarynx48 a potenciálně dalších míst transformuje koncepci SCCHN jako entity nemoci. V retrospektivní analýze RTOG 0129 bylo 3leté celkové přežití u pacientů s nádory pozitivními na HPV 82,4% oproti 57% u HPV negativního onemocnění (p49, 50 s ohledem na to budou budoucí studie nutně stratifikovány podle stavu HPV nebo přizpůsobeny podskupině HPV pozitivních nebo negativních pacientů, což vyvolá rostoucí schizma v léčebných přístupech. Již se zvyšuje vyhlídka na zkoumání méně toxických léčebných přístupů pro nádory pozitivní na HPV a agresivnější definitivní léčby nádorů negativních na HPV, aby se zohlednily výrazné rozdíly v jejich příslušných reakcích na současné způsoby léčby. RTOG 1016 je jedna taková studie, která specificky hodnotí HPV-pozitivní pacienty pro léčbu de-intenzifikace pomocí souběžného cetuximabu s ozařováním oproti standardní CCRT na bázi cisplatiny. Interakce specifických léčebných režimů a konkrétních molekulárně cílených látek se stavem nádorového HPV bezpochyby prokáže úrodnou půdu pro budoucí výzkum. Zbývá zjistit, jaký dopad bude mít narůstající epidemie HPV a současné očkovací programy na klinické výsledky a léčebné přístupy u pacientů s SCCHN.