obecný název: klonidin hydrochlorid
dávková forma: Tableta
lékařsky hodnoceno Drugs.com. Naposledy aktualizováno 1. července 2020.
- přehled
- nežádoucí účinky
- dávkování
- Profesionální
- tipy
- interakce
- více
- klonidin hydrochloridové tablety, USP
- popis klonidinu
- klonidin-Klinická farmakologie
- farmakokinetika
- indikace a použití pro klonidin
- kontraindikace
- upozornění
- vysazení
- bezpečnostní opatření
- Obecné
- perioperační použití
- informace pro pacienty
- lékové interakce
- Toxikologie
- karcinogeneze, mutageneze, zhoršení Fertility
- těhotenství
- kojící matky
- pediatrické použití
- nežádoucí účinky
- předávkování
- dávkování a podání klonidinu
- jak se klonidin dodává
- hlavní zobrazovací PANEL
- hlavní zobrazovací PANEL
- PRINCIPAL DISPLAY PANEL
- více o klonidinu
- spotřebitelské zdroje
- odborné zdroje
- související průvodce léčbou
klonidin hydrochloridové tablety, USP
perorální antihypertenzivum
tablety 0,1 mg, 0,2 mg a 0.3 mg
pouze Rx
informace o předepisování
popis klonidinu
klonidin hydrochlorid, USP je centrálně působící alfa-agonista hypotenzní látka dostupná ve formě tablet pro perorální podání ve třech dávkových silách: 0,1 mg, 0,2 mg a 0,3 mg. 0, 1 mg tableta odpovídá 0, 087 mg volné báze.
neaktivními složkami jsou koloidní oxid křemičitý, kukuřičný škrob, hydroxypropylcelulóza, mikrokrystalická celulosa, monohydrát laktosy a magnesium-stearát. Kromě toho, the 0.1 mg tablety obsahují FD&C červené č. 40 a tablety 0, 2 mg a 0, 3 mg obsahují FD&C žluté č. 6 jako barevné přísady.
klonidin hydrochlorid je derivát imidazolinu a existuje jako mezomerní sloučenina. Chemický název je 2-(2,6-dichlorfenylamino)-2-imidazolin hydrochlorid. Následující je strukturní vzorec:
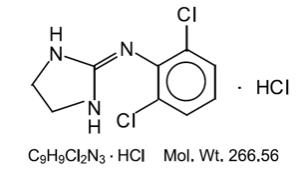
klonidin hydrochlorid je bez zápachu, hořká, bílá, krystalická látka rozpustná ve vodě a alkoholu.
klonidin-Klinická farmakologie
klonidin stimuluje alfa-adrenoreceptory v mozkovém kmeni. Tento účinek má za následek snížení sympatického odtoku z centrálního nervového systému a snížení periferní rezistence, renální vaskulární rezistence, srdeční frekvence a krevního tlaku. Tablety hydrochloridu klonidinu působí relativně rychle. Krevní tlak pacienta klesá během 30 až 60 minut po perorální dávce, maximální pokles nastává během 2 až 4 hodin. Průtok krve ledvinami a rychlost glomerulární filtrace zůstávají v podstatě nezměněny. Normální posturální reflexy jsou neporušené, proto jsou ortostatické příznaky mírné a vzácné.
akutní studie s klonidin-hydrochloridem u lidí prokázaly mírné snížení (15% až 20%) srdečního výdeje v poloze na zádech bez změny periferní rezistence: při sklonu 45′ dochází k menšímu snížení srdečního výdeje a snížení periferní rezistence. Během dlouhodobé léčby má srdeční výdej tendenci se vracet k kontrolním hodnotám, zatímco periferní rezistence zůstává snížena. Zpomalení tepové frekvence bylo pozorováno u většiny pacientů, kterým byl podáván klonidin, ale lék nemění normální hemodynamickou odpověď na cvičení.
u některých pacientů se může vyvinout Tolerance k antihypertenznímu účinku, což vyžaduje přehodnocení léčby.
jiné studie u pacientů prokázaly snížení plazmatické reninové aktivity a vylučování aldosteronu a katecholaminů. Přesný vztah těchto farmakologických účinků k antihypertenznímu účinku klonidinu nebyl zcela objasněn.
klonidin akutně stimuluje uvolňování růstového hormonu u dětí i dospělých, ale při dlouhodobém užívání nevytváří chronické zvýšení růstového hormonu.
farmakokinetika
farmakokinetika klonidinu je úměrná dávce v rozmezí 100 až 600 mcg. Absolutní biologická dostupnost klonidinu při perorálním podání je 70% až 80%. Maximální plazmatické hladiny klonidinu jsou dosaženy přibližně za 1 až 3 hodiny.
po intravenózním podání vykazuje klonidin dvoufázové dispozice s distribučním poločasem přibližně 20 minut a poločasem eliminace v rozmezí od 12 do 16 hodin. U pacientů se závažným poškozením funkce ledvin se poločas zvyšuje až na 41 hodin. Klonidin prochází placentární bariérou. Bylo prokázáno, že prochází hematoencefalickou bariérou u potkanů.
po perorálním podání se asi 40% až 60% absorbované dávky získá v moči v nezměněné formě za 24 hodin. Asi 50% absorbované dávky se metabolizuje v játrech. Ani jídlo, ani rasa pacienta neovlivňují farmakokinetiku klonidinu.
antihypertenzního účinku je dosaženo při plazmatických koncentracích mezi přibližně 0, 2 a 2, 0 ng/mL u pacientů s normální vylučovací funkcí. Další zvýšení plazmatických hladin nezvýší antihypertenzní účinek.
indikace a použití pro klonidin
klonidin hydrochlorid tablety, USP jsou indikovány při léčbě hypertenze. Klonidin hydrochlorid tablety, USP mohou být použity samostatně nebo současně s jinými antihypertenzivy.
kontraindikace
tablety klonidin-hydrochloridu by neměly být používány u pacientů se známou přecitlivělostí na klonidin (viz opatření).
upozornění
vysazení
pacienti by měli být poučeni, aby nepřerušovali léčbu bez konzultace se svým lékařem. Náhlé ukončení léčby klonidinem mělo v některých případech za následek příznaky, jako je nervozita, agitovanost, bolest hlavy a třes, doprovázené nebo následované rychlým zvýšením krevního tlaku a zvýšenými koncentracemi katecholaminu v plazmě. Pravděpodobnost takových reakcí na přerušení léčby klonidinem se zdá být vyšší po podání vyšších dávek nebo pokračování souběžné léčby betablokátory, a proto se v těchto situacích doporučuje zvláštní opatrnost. Po vysazení klonidinu byly hlášeny vzácné případy hypertenzní encefalopatie, cerebrovaskulárních příhod a úmrtí. Při přerušení léčby klonidinem by měl lékař dávku postupně snižovat po dobu 2 až 4 dnů, aby se zabránilo symptomatologii z vysazení.
nadměrné zvýšení krevního tlaku po přerušení léčby klonidinem lze zvrátit podáním perorálního hydrochloridu klonidinu nebo intravenózním fentolaminem. Pokud má být léčba přerušena u pacientů užívajících beta-blokátory a klonidin současně, betablokátor by měl být vysazen několik dní před postupným vysazením klonidinu.
protože děti mají často gastrointestinální onemocnění, která vedou ke zvracení, mohou být zvláště citlivé na hypertenzní epizody vyplývající z náhlé neschopnosti užívat léky.
bezpečnostní opatření
Obecné
u pacientů, u kterých se vyvinula lokalizovaná kontaktní senzibilizace na transdermální klonidin, může být pokračování transdermálního klonidinu nebo substituce perorální terapie klonidinem hydrochloridem spojeno s rozvojem generalizované kožní vyrážky.
u pacientů, u kterých se objeví alergická reakce na transdermální klonidin, může substituce perorálního klonidin-hydrochloridu vyvolat také alergickou reakci (včetně generalizované vyrážky, kopřivky nebo angioedému.)
sympatolytický účinek klonidinu může zhoršit dysfunkci sinusových uzlin a atrioventrikulární (AV) blok, zejména u pacientů užívajících jiné sympatolytické léky. Existují postmarketingové zprávy o pacientech s abnormalitami vedení a / nebo užívajících jiné sympatolytické léky, u kterých se během užívání klonidinu vyvinula závažná bradykardie vyžadující IV atropin, IV isoproterenol a dočasnou srdeční stimulaci.
u hypertenze způsobené feochromocytomem nelze očekávat žádný terapeutický účinek tablet hydrochloridu klonidinu.
perioperační použití
podávání tablet klonidin hydrochloridu by mělo pokračovat do čtyř hodin po operaci a poté pokračovat co nejdříve. Krevní tlak by měl být během chirurgického zákroku pečlivě sledován a v případě potřeby by měla být k dispozici další opatření ke kontrole krevního tlaku.
informace pro pacienty
pacienti by měli být upozorněni na přerušení léčby tabletami klonidin-hydrochloridu bez doporučení lékaře.
vzhledem k tomu, že se u pacientů může při užívání klonidinu objevit možný sedativní účinek, závrať nebo porucha ubytování, varujte pacienty před aktivitami, jako je řízení vozidla nebo obsluha zařízení nebo strojů. Také informujte pacienty, že tento sedativní účinek může být zvýšen současným užíváním alkoholu, barbiturátů nebo jiných sedativních léků.
pacienti, kteří nosí kontaktní čočky, by měli být upozorněni, že léčba tabletami klonidin-hydrochloridu může způsobit suchost očí.
lékové interakce
klonidin může potencovat depresivní účinky alkoholu, barbiturátů nebo jiných sedativ na CNS. Pokud pacient užívající klonidin-hydrochlorid také užívá tricyklická antidepresiva, může být hypotenzní účinek klonidinu snížen, což vyžaduje zvýšení dávky klonidinu. Pokud pacient užívající klonidin také užívá neuroleptika, mohou být vyvolány nebo zhoršeny poruchy ortostatické regulace (např. ortostatická hypotenze, závratě, únava).
monitorujte srdeční frekvenci u pacientů užívajících klonidin současně s látkami, o nichž je známo, že ovlivňují funkci sinusových uzlin nebo AV nodální vedení, např. digitalis, blokátory kalciových kanálů a beta-blokátory. V souvislosti s užíváním klonidinu současně s diltiazemem nebo verapamilem byla hlášena sinusová bradykardie vedoucí k hospitalizaci a zavedení kardiostimulátoru.
amitriptylin v kombinaci s klonidinem zvyšuje projevy lézí rohovky u potkanů (viz Toxikologie).
na základě pozorování u pacientů ve stavu alkoholického deliria bylo navrženo, že vysoké intravenózní dávky klonidinu mohou zvýšit arytmogenní potenciál (prodloužení QT, ventrikulární fibrilace) vysokých intravenózních dávek haloperidolu. Příčinná souvislost a význam pro perorální tablety klonidinu nebyly stanoveny.
Toxikologie
v několika studiích s perorálním klonidin-hydrochloridem bylo u albínských potkanů léčených po dobu šesti měsíců nebo déle pozorováno zvýšení incidence a závažnosti spontánní degenerace sítnice závislé na dávce. Studie tkáňové distribuce u psů a opic prokázaly koncentraci klonidinu v cévnatce.
vzhledem k degeneraci sítnice pozorované u potkanů byla oční vyšetření prováděna během klinických studií u 908 pacientů před zahájením léčby klonidinem a pravidelně po ní. U 353 z těchto 908 pacientů byla oční vyšetření prováděna po dobu 24 měsíců nebo déle. S výjimkou určité suchosti očí nebyly zaznamenány žádné abnormální oftalmologické nálezy související s léčivem a podle specializovaných testů, jako je elektroretinografie a makulární oslnění, se funkce sítnice nezměnila.
v kombinaci s amitriptylinem vedlo podávání klonidin-hydrochloridu k rozvoji lézí rohovky u potkanů během 5 dnů.
karcinogeneze, mutageneze, zhoršení Fertility
chronické podávání klonidinu v potravě nebylo kancerogenní u potkanů (132 týdnů) nebo myší (78 týdnů) podávaných až 46 nebo 70násobkem maximální doporučené denní dávky u člověka v mg/kg (9 nebo 6násobek MRDHD na bázi mg / m2). V amesově testu na mutagenitu ani v myším mikronukleárním testu na klastogenitu nebyly prokázány žádné známky genotoxicity.
Fertilita samců nebo samic potkanů nebyla ovlivněna dávkami klonidinu až 150 mcg / kg (přibližně 3násobek MRDHD). V samostatném experimentu se ukázalo, že Fertilita samic potkanů byla ovlivněna dávkami 500 až 2000 mcg / kg (10 až 40násobek perorálního MRDHD v dávce mg/kg; 2 až 8násobek mrdhd v dávce mg / m‘.
těhotenství
teratogenní účinky: těhotenství kategorie C. reprodukční studie provedené u králíků v dávkách až do přibližně 3násobku perorální maximální doporučené denní dávky u člověka (MRDHD) tablet klonidin-hydrochloridu neprokázaly teratogenní nebo embryotoxický potenciál u králíků. U potkanů však dávky až 1/3 perorálního MRDHD (1/15 mrdhd v mg/m2) klonidinu byly spojeny se zvýšenou resorpcí ve studii, ve které byly přehrady léčeny nepřetržitě 2 měsíce před pářením. Zvýšené resorpce nebyly spojeny s léčbou současně nebo při vyšších dávkách (až 3násobek perorálního MRDHD), když byly přehrady léčeny 6. až 15. den těhotenství. Zvýšení resorpce bylo pozorováno při mnohem vyšších dávkách (40násobek perorálního MRDHD v mg / kg; 4 až 8násobek MRDHD v dávce mg / m2) u myší a potkanů léčených 1. až 14. den těhotenství (nejnižší dávka použitá ve studii byla 500 mcg / kg).
nebyly provedeny žádné adekvátní, dobře kontrolované studie u těhotných žen. Klonidin prochází placentární bariérou (viz Klinická farmakologie, farmakokinetika). Protože reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék užíván během těhotenství pouze v případě, že je to nezbytně nutné.
kojící matky
vzhledem k tomu, že se klonidin-hydrochlorid vylučuje do mateřského mléka, je třeba opatrnosti při podávání tablet klonidin-hydrochloridu kojící ženě.
pediatrické použití
bezpečnost a účinnost u dětských pacientů nebyla stanovena v adekvátních a dobře kontrolovaných studiích(Viz Upozornění, stažení).
nežádoucí účinky
Většina nežádoucích účinků je mírná a mají tendenci se snižovat s pokračující léčbou. Nejčastějšími (které se zdají být závislé na dávce) jsou sucho v ústech, které se vyskytuje přibližně u 40 ze 100 pacientů; ospalost, asi 33 ze 100; závratě, asi 16 ze 100; zácpa a sedace, každý asi 10 ze 100.
následující méně časté nežádoucí účinky byly hlášeny také u pacientů užívajících tablety klonidin-hydrochloridu, ale v mnoha případech byli pacienti současně léčeni a příčinná souvislost nebyla stanovena.
tělo jako celek: únava, horečka, bolest hlavy, bledost, slabost a abstinenční syndrom. Hlášeny byly také slabě pozitivní Coombsův test a zvýšená citlivost na alkohol.
kardiovaskulární: Bradykardie, městnavé srdeční selhání, elektrokardiografické abnormality (tj. zástava sinusových uzlin, junkční bradykardie, vysoký stupeň AV blokády a arytmie), ortostatické příznaky, palpitace, Raynaudův jev, synkopa a tachykardie.
byly hlášeny případy sinusové bradykardie a atrioventrikulárního bloku, a to jak s použitím souběžného digitalisu, tak bez něj.
Centrální Nervový Systém: Agitovanost, úzkost, delirium, bludné vnímání, halucinace (včetně zrakového a sluchového), nespavost, duševní deprese, nervozita, jiné změny chování, parestézie, neklid, porucha spánku a živé sny nebo noční můry.
dermatologické: alopecie, angioneurotický edém, kopřivka, svědění, vyrážka a kopřivka.
gastrointestinální: bolest břicha, anorexie, zácpa, hepatitida, malátnost, mírné přechodné abnormality v jaterních funkčních testech, nauzea, parotitida, pseudo-obstrukce (včetně pseudo-obstrukce tlustého střeva), bolest slinných žláz a zvracení.
genitourinární: snížená sexuální aktivita, potíže s močením, erektilní dysfunkce, ztráta libida, nokturie a retence moči.
Hematologické: Trombocytopenie.
metabolické: gynekomastie, přechodné zvýšení hladiny glukózy v krvi nebo kreatinfosfokinázy v séru a přírůstek hmotnosti.
muskuloskeletální: křeče v nohou a bolest svalů nebo kloubů.
Oro-otolaryngeální: suchost nosní sliznice.
oftalmologické: porucha ubytování, rozmazané vidění, pálení očí, snížené slzení a suchost očí.
předávkování
hypertenze se může vyvinout brzy a může být následována hypotenzí, bradykardií, respirační depresí, hypotermií, ospalostí, sníženými nebo nepřítomnými reflexy, slabostí, podrážděností a miózou. Frekvence deprese CNS může být vyšší u dětí než u dospělých. Velké předávkování může mít za následek reverzibilní defekty srdečního vedení nebo dysrytmie, apnoe, kóma a záchvaty. Známky a příznaky předávkování se obvykle objevují během 30 minut až dvou hodin po expozici. Již 0,1 mg klonidinu vyvolalo u dětí známky toxicity.
neexistuje žádné specifické antidotum pro předávkování klonidinem. Předávkování klonidinem může vést k rychlému rozvoji deprese CNS; proto se nedoporučuje vyvolání zvracení sirupem ipecac. Výplach žaludku může být indikován po nedávném a/nebo velkém požití. Podávání aktivního uhlí a/nebo katartika může být prospěšné. Podpůrná péče může zahrnovat atropin sulfát pro bradykardii, intravenózní tekutiny a / nebo vazopresorová činidla pro hypotenzi a vazodilatátory pro hypertenzi. Naloxon může být užitečným doplňkem k léčbě respirační deprese, hypotenze a/nebo kómatu vyvolané klonidinem; krevní tlak by měl být sledován, protože podávání naloxonu občas vedlo k paradoxní hypertenzi. Podávání tolazolinu vedlo k nekonzistentním výsledkům a nedoporučuje se jako léčba první linie. Dialýza pravděpodobně významně nezvýší eliminaci klonidinu.
dosud největší hlášené předávkování zahrnovalo 28letého muže, který požil 100 mg prášku klonidin hydrochloridu. U tohoto pacienta se vyvinula hypertenze následovaná hypotenzí, bradykardií, apnoe, halucinacemi, semikomem a předčasnými komorovými kontrakcemi. Pacient se po intenzivní léčbě plně zotavil. Plazmatické hladiny klonidinu byly 60 ng / mL po 1 hodině, 190 ng / mL po 1, 5 hodině, 370 ng / mL po 2 hodinách a 120 ng / mL po 5, 5 a 6, 5 hodinách. U myší a potkanů je perorální LD50 klonidinu 206 a 465 mg / kg.
dávkování a podání klonidinu
Dospělí
dávka tablet klonidin hydrochloridu musí být upravena podle individuální odpovědi pacienta na krevní tlak. Následuje obecný návod k jeho správě.
počáteční dávka
0, 1 mg tableta dvakrát denně (ráno a před spaním). Starší pacienti mohou mít prospěch z nižší počáteční dávky.
udržovací dávka
v případě potřeby lze v týdenních intervalech provádět další přírůstky o 0,1 mg denně, dokud není dosaženo požadované odpovědi. Užívání větší části perorální denní dávky před spaním může minimalizovat přechodné účinky úpravy sucha v ústech a ospalost. Nejčastěji používané terapeutické dávky se pohybovaly od 0, 2 mg do 0, 6 mg denně podávaných v rozdělených dávkách.
studie ukázaly, že 2, 4 mg je maximální účinná denní dávka, ale dávky tak vysoké, jako je tato, byly použity jen zřídka.
porucha funkce ledvin
pacientům s poruchou funkce ledvin může být prospěšná nižší počáteční dávka. Pacienti by měli být pečlivě sledováni. Vzhledem k tomu, že během rutinní hemodialýzy je odstraněno pouze minimální množství klonidinu, není třeba po dialýze podávat doplňkový klonidin.
jak se klonidin dodává
klonidin hydrochlorid tablety, USP se dodávají následovně:
0,1 mg: růžová tableta ve tvaru “  „.
„.
NDC 58657-647-01 (láhev 100)
NDC 58657-647-50 (láhev 500)
NDC 58657-647-10 (láhev 1000)
0,2 mg: oranžová tableta ve tvaru “  „.
„.
NDC 58657-648-01 (láhev 100)
NDC 58657-648-50 (láhev 500)
NDC 58657-648-10 (láhev 1000)
0,3 mg: světle oranžová tableta ve tvaru “  „.
„.
NDC 58657-649-01 (láhev 100)
NDC 58657-649-50 (láhev 500)
NDC 58657-649-10 (láhev 1000)
uchovávejte při teplotě 25°C (77°F); povolené exkurze do 15°C-30°C (59°F-86°F) . Dávkujte v těsném obalu odolném proti světlu.
výrobce:
Yung Shin Pharmaceutical Ind. Spolupráce., Ltd.
Tachia, Taichung 43769
TAIWAN
distribuováno podle:
Method Pharmaceuticals, LLC
7333 Jack Newell Blvd. North, Suite 300
Fort Worth, Texas 76118
Chcete-li nahlásit nežádoucí účinky, zavolejte prosím Method Pharmaceuticals na 1-877-250-3427
revidováno: 06/20
hlavní zobrazovací PANEL
NDC 58657-647-10
klonidin
hydrochlorid
tablety, USP
0.1 mg
Rx Only
1000 tablet

hlavní zobrazovací PANEL
NDC 58657-648-10
klonidin
hydrochlorid
tablety, USP
0.2 mg
Rx Only
1000 Tablets

PRINCIPAL DISPLAY PANEL
NDC 58657-649-10
Clonidine
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx Only
1000 Tablets

| Clonidine HYDROCHLORIDE Clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| klonidin hydrochlorid klonidin hydrochlorid tableta |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| klonidin hydrochlorid klonidin hydrochlorid tableta |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-Method Pharmaceuticals, LLC (060216698)
více o klonidinu
- vedlejší účinky
- během těhotenství nebo kojení
- informace o dávkování
- Tipy pro pacienty
- obrázky léků
- lékové interakce
- porovnat alternativy
- skupina podpory
- ceny & kupóny
- 619 recenze
- třída léčiv: antiadrenergní látky, centrálně působící
- upozornění FDA (1)
spotřebitelské zdroje
- informace o pacientech
- … + 5 více
odborné zdroje
- informace o předepisování
- klonidin (profesionální poradenství pro pacienty)
- Klonidinové tablety s prodlouženým uvolňováním (FDA)
- Klonidinová injekce (FDA)
- Klonidinová náplast (FDA)
- Klonidinové tablety (FDA)
ostatní značky Catapres, kapvay, Catapres-TTS, duraclon, nexiclon xr
související průvodce léčbou
- úzkost
- ADHD
- abstinence alkoholu
- fibrilace síní
- … + 19 více
lékařské zřeknutí se odpovědnosti