- Úvod
- výsledky
- značky ovladače DBH-Cre a jsou omezeny na noradrenergní oblasti exprimující TH v mozkovém kmeni, které jsou inhibovány podáním CNO
- CNO-hM4D zprostředkovaná porucha noradrenergních neuronů u dospělých myší
- porucha neuronů DBH-Cre CNO-hM4D vede k Hyperkapnickému deficitu
- Habituované sourozenecké kontroly injikované 10 mg/kg CNO vykazovaly Hyperkapnický ventilační Deficit
- Habituovaná a neobývaná Zvířata divokého typu injekčně s fyziologickým roztokem nevykazovala žádné změny Presalin a Postsalin
- poměr koncentrace klozapinu k CNO je vyšší v mozku než v séru
- diskuse
- materiály a metody
- etické schválení
- chov, genetické pozadí a údržba myší
- histologie
- elektrofyziologie
- pletysmografie
- kapalinová chromatografie-hmotnostní spektrometrie
- sběr a analýza dat
- pletysmografie
- Statistika
- pletysmografie
- kapalinová chromatografie – hmotnostní spektrometrie
- etické prohlášení
- autorské příspěvky
- financování
- Prohlášení o střetu zájmů
- poděkování
Úvod
neuronové sítě, které jsou základem respiračního chemosenzorického reflexu, jsou primárním cílem pro pochopení etiologie několika behaviorálních a fyziologických poruch. Předpokládá se, že narušené chemosenzorické reflexy hrají roli jak u vrozených, tak u dospělých poruch, včetně syndromu náhlého úmrtí kojenců (SIDS), vrozeného centrálního Hypoventilačního syndromu (CCHS), centrálních spánkových apnoe, abnormálního dýchání u Rettova syndromu a hypoventilačního syndromu obezity (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa a kol., 2011; Lavezzi a kol., 2013). Podle hypotézy falešného poplachu udušení se předpokládá, že nevhodná chemosenzorická aktivace nebo přecitlivělost hrají roli u podskupin pacientů trpících panickou poruchou (Klein, 1993). Chemosenzorická dysfunkce může také hrát roli u neurodegenerativních onemocnění dýcháním narušeným spánkem, které je spojeno se zrychlenou progresí (Hakim et al ., 2012; Verbraecken a McNicholas, 2013; Bahia a Pereira, 2015; Snyder a kol., 2017). Lepší porozumění chemosenzorickým sítím mozkového kmene tak poskytne důležité vodítka k řadě behaviorálních a fyziologických patologií.
Farmakogenetické designérské receptory výhradně aktivované designovými léky (DREADDs) (Armbruster et al., 2007) byly použity v řadě studií k mapování neurálních populací v respiračním chemoreflexu (reakce dýchání na zvýšené hladiny CO2 v krvi). Technologie DREADD v kombinaci s intersekcionálním genetickým nasazením byla využita k umlčení vysoce cílených neuronálních populací při pozorování respiračních funkcí u vědomých a neomezených myší naší laboratoří a dalšími, čímž se vyhneme mnoha zmatkům z dřívějších přístupů k mapování obvodů (Ray et al ., 2011, 2013; Brust et al., 2014; Hennessy a kol., 2017; slunce a paprsek, 2017; slunce a kol., 2017). Tyto a většina dalších studií téměř vždy zahrnovaly CNO pouze bez strachu exprimující sourozenecké kontroly, které nevykazovaly žádné chemosenzorické nebo jiné respirační účinky, a tvrdily, že CNO nemělo žádné off-cílové účinky na dýchání u vědomých a neomezených myší navzdory vysoké použité dávce, 10 mg / kg. V několika dalších studiích však bylo zjištěno, že CNO a jeho produkty metabolismu zad mohou mít v různých testech mimo cílový účinek na chování a pohyb, ale respirační výdej nebyl řešen (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gomez a kol., 2017; Ilg a kol., 2018; Mahler a Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez a Knackstedt, 2018). Bylo také prokázáno, že CNO a jeho metabolity nejsou rovnocenně distribuovány mezi oběhový systém a mozek (Gomez et al ., 2017).
druhá, neadresná obava vyplývá ze stresu vyvolaného experimentálním paradigmatem, včetně držení zvířat v celotělové barometrické pletysmografické komoře, manipulace, intra-peritoneální injekce a měření rektální teploty. V předchozích respiračních studiích DREADD byly naivní myši zavedeny do malé komory (140-400 mls)a nechaly se aklimatizovat 20-40 minut před získáním dat (Ray et al ., 2011, 2013; Brust et al., 2014; Hennessy a kol., 2017; slunce a paprsek, 2017; slunce a kol., 2017). Není však jasné, zda je toto množství času dostatečné k minimalizaci respiračních změn vyvolaných stresem, které mohou působit jako interakční faktor s účinky klozapinu.
v našich studiích, abychom zkoumali roli noradrenergního (NA) systému v respirační kontrole, jsme se snažili využít dobře zavedené RC::P_hm4d DREADD alele (Ray et al., 2011) testovat roli neuronů NA ve výchozím a hyperkapnickém dýchání u neomezených dospělých zvířat pomocí celotělové pletysmografie. Protože je také známo, že noradrenalin a na neurony hrají ústřední roli ve stresových reakcích (Valentino a Van Bockstaele, 2008; Chen et al. , 2018), provedli jsme řadu studií, abychom porovnali rozsáhlé návyky (vícenásobné expozice experimentálnímu paradigmatu, kdy se zvíře dozví, že zkušenost není ohrožující nebo přežívající) a vysoká vs. nízké (1 mg/kg) dávky CNO s dříve publikovanými protokoly DREADD (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy a kol., 2017; slunce a paprsek, 2017; slunce a kol., 2017). Zde poprvé ukazujeme, že vysoké systémové dávky CNO jsou schopny vyvolat mimo cílové účinky na autonomní respirační funkci u vědomých myší. Také odhalujeme, že off-cílový účinek CNO na chemosenzorický respirační výdej je účinně odhalen rozsáhlým návykem,a proto by nebyl patrný v dřívějších kontrolních studiích CNO, které nezvykly zvířata před měřením dýchání, s využitím pouze krátké aklimatizační doby před sběrem dat. Společně tyto výsledky naznačují, že dříve mapované populace neuronů mohou nepřímo ovlivnit kontrolu dýchání prostřednictvím potenciálních rolí při regulaci stresových reakcí. Tyto údaje jsou v souladu s nedávnými zprávami, které naznačují, že CNO není biologicky inertní při vysokých dávkách metabolickou konverzí na klozapin (MacLaren et al ., 2016; Gomez a kol., 2017) a že off-cílové behaviorální účinky se mohou projevit nejen z poruchy behaviorálních obvodů, ale také z narušení základních autonomních obvodů a homeostázy.
výsledky
značky ovladače DBH-Cre a jsou omezeny na noradrenergní oblasti exprimující TH v mozkovém kmeni, které jsou inhibovány podáním CNO
abychom prozkoumali expresi a specificitu linie DBH-Cre, použili jsme jediné schéma šlechtění rekombinázy (obrázek 1A), ve kterém jsme překročili ovladač k linii Ai9 (Madisen et al ., 2010), který vyjadřuje floxované tdTomato. Barvení protilátkou tyrosinhydroxylázy (TH) odhalilo, že exprese tdTomato v mozkovém kmeni byla omezena na oblasti exprimující TH, včetně jádra locus coeruleus, A5, A1, A2, A7, SubCV a SubCD podle očekávání (obrázek 1B). Abychom potvrdili, že neurony na exprimující receptor hM4D reagovaly na CNO, provedli jsme záznamy na neuronech locus coeruleus (LC), kde jsme pozorovali inhibici vypalování neuronů při aplikaci lázně CNO (n = 3, obrázek 1C).
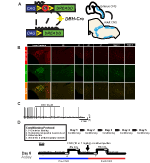
Obrázek 1. Chovatelské schéma a respirační protokoly. RC::Alela P_hM4D je kombinována s linií dopamin-beta-hydroxylázy (DBH)-Cre, aby se dosáhlo buněčné exprese receptoru hM4D v noradrenergních (NA) neuronech (A). Fluorescenční exprese tdTomato v DBH-Cre; AI9 koronální části mozku koexprimuje s tyrosin-hydroxylázou (TH) v jádrech mozkového kmene NA (B). V řezu záznam NA locus coeruleus před a po aplikaci CNO, prokazující funkčnost DREADD receptoru v cílených neuronech (C). Respirační protokol. Habituované myši jsou podrobeny 5dennímu habituovanému protokolu sestávajícímu z manipulace, měření teploty rektální sondy, injekce fyziologického roztoku a expozice pletysmografické komoře. Šestý den, jak habituované, tak neobývané myši pod hyperkapnickým testem, kde je zvíře umístěno do dýchací komory a nechá se aklimatizovat za základních podmínek vzduchu v místnosti. Zvíře je pak vystaveno 20 min 5% CO2 následované 20 min vzduchu v místnosti. Zvíře se pak injikuje intraperitoneálně CNO nebo fyziologickým roztokem, následuje dalších 20 minut vzduchu v místnosti po injekci, 20 minut 5% CO2 a 20 minut vzduchu v místnosti. Otevřená pole vymezují dobu sběru dat (D).
CNO-hM4D zprostředkovaná porucha noradrenergních neuronů u dospělých myší
abychom zkoumali roli neuronů NA pod výchozí hodnotou a hyperkapnickým dýcháním, použili jsme RC: p_hm4d inhibiční DREADD systém zkřížený s ovladačem DBH-Cre. Použití celotělové pletysmografie (Ray et al., 2011), měřili jsme ventilační reakce neomezených dospělých zvířat za podmínek vzduchu v místnosti (21% O2/79% N2) A hyperkapnic (5% CO2/21% O2 / 74% N2) před a po podání CNO (obrázek 1D). K řešení dávkování CNO a potenciálního stresu vyvolaného naším experimentálním designem byla zvířata podrobena jedné ze čtyř podmínek: (1) neobývané a injikované 10 mg/kg CNO; (2) habituované a injikované 10 mg/kg CNO; (3) neobývané a injikované 1 mg/kg CNO; nebo (4) habituované a injikované 1 mg/kg CNO. Habituace sestávala z 5denního procesu zahrnujícího manipulaci, rektální teplotní sondu, injekci fyziologického roztoku a expozici pletysmografické komoře každý den po dobu 30 minut, zatímco naivní zvířata byla vystavena pouze aklimatizační době 20-45 minut bezprostředně před sběrem dat, jak bylo provedeno v dřívějších studiích (Ray et al ., 2011, 2013; Brust et al., 2014; Hennessy a kol., 2017; slunce a paprsek, 2017; slunce a kol., 2017). Měřené respirační parametry zahrnovaly respirační frekvenci RR, přílivový objem (VT), minutovou ventilaci (VE), spotřebu kyslíku (VO2), minutovou ventilaci normalizovanou na spotřebu kyslíku (VE/VO2), frekvenci apnoe, frekvenci povzdechu a variační koeficienty pro interval interbreath a amplitudu (periodická a objemová nestabilita). Jako dodatečnou kontrolu jsme také porovnali zvyklá a neobývaná divoká zvířata injikovaná fyziologickým roztokem.
porucha neuronů DBH-Cre CNO-hM4D vede k Hyperkapnickému deficitu
za tří podmínek, DBH – Cre; RC::Zvířata P_hM4D vykazovala po podání CNO snížení ve a ve/VO2, zatímco kontroly sourozenců neprokázaly žádné rozdíly v hodnotách před a po CNO. Neobývaná zvířata, kterým byla podána injekce 10 mg/kg CNO, vykazovala významně sníženou RR (-12,17%, p = 0,034) a VT (-30,87%, p = 0,0016), což mělo za následek snížení VE (-38,64%, p = 0,0031) a mírné snížení VO2 (-14,25%, p = 0,042) (Obrázek 2). Snížení VE bylo větší než snížení VO2, což mělo za následek celkové snížení VE / VO2(-26,89%, p = 0,0095). Neobývaná zvířata, kterým byla podána 1 mg/kg CNO, vykazovala trend ke snížení RR (-12,88%, p = 0,066) a významně ke snížení VT (-16,52%, p = 0,00085) a VE (-28,08%, p = 0,0070), což vedlo k celkovému snížení VE/VO2 (-22,23%, p = 0,016) (obrázek 3). Konečně, zvyklá zvířata injekčně podávaná 1 mg/kg CNO vykazovala sníženou RR (-10, 77%, p = 0, 074), trend ke snížení VE (-25, 07%, p = 0, 074) a celkové snížení VE/VO2 (-23, 70%, p = 0, 024) (obrázek 4). V žádné kohortě nebyly pozorovány žádné významné změny frekvence apnoe, frekvence povzdechu, periodické nebo objemové nestability nebo teploty.
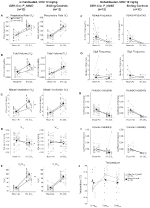
Obrázek 2. Neobývaný DBH-Cre; RC:: p_hm4d zvířata podaná 10 mg / kg CNO vykazují hyperkapnický deficit, zatímco kontroly sourozenců nevykazují žádnou změnu. Po podání CNO, DBH-CRE; RC::Zvířata P_hM4D nevykazují žádnou změnu ventilace vzduchu v místnosti a snížení RR (a), VT (B), ve (C), VO2 (D) a VE/VO2 (E) za hyperkapnických podmínek bez změn frekvence apnoe (F), frekvence povzdechu (G), periodické (H) nebo objemové nestability (I) a teploty (J). Kontroly sourozenců neprokázaly žádný rozdíl ve všech hodnotách před a po CNO.
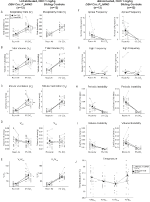
obrázek 3. Neobývaný DBH-Cre; RC:: p_hm4d zvířata podaná 1 mg / kg CNO vykazují hyperkapnický deficit, zatímco kontroly sourozenců nevykazují žádnou změnu. Po podání CNO, DBH-CRE; RC::Zvířata P_hM4D nevykazují žádnou významnou změnu ventilace vzduchu v místnosti nebo RR (a) a vykazovala snížení VT (B), ve (C) a VE/VO2 (E) za hyperkapnických podmínek bez změn VO2 (D), frekvence apnoe (F), frekvence povzdechu (G), periodické (H) nebo objemové nestability (I) a teploty (J). Kontroly sourozenců neprokázaly žádný rozdíl ve všech hodnotách před a po CNO.
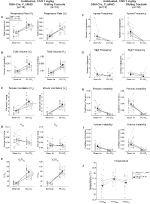
obrázek 4. Habituovaný DBH-Cre; RC:: p_hm4d zvířata podaná 1 mg / kg CNO vykazují hyperkapnický deficit, zatímco kontroly sourozenců nevykazují žádnou změnu. Po podání CNO, DBH-Cre; RC:: zvířata P_hM4D nevykazují žádnou změnu ventilace vzduchu v místnosti a snížení RR (A) a ve/VO2 (E) za hyperkapnických podmínek bez významných změn VT (B),ve (C),VO2 (D), frekvence apnoe (F), frekvence povzdechu (G), periodické (H) nebo objemové nestability (I) a teploty (J). Kontroly sourozenců neprokázaly žádný rozdíl ve všech hodnotách před a po CNO.
Habituované sourozenecké kontroly injikované 10 mg/kg CNO vykazovaly Hyperkapnický ventilační Deficit
v obou DBH – Cre; RC::P_hm4d a sourozenecká kontrolní zvířata, kterým byla podána injekce 10 mg/kg CNO, Zaznamenali jsme významné snížení VE / VO2 (p = 0,0235) zprostředkované snížením RR (p = 0,00036) a VE (p = 0,037) (obrázek 5). Na rozdíl od ostatních kohort však nebyl rozdíl mezi DBH-Cre; RC:: P_hM4D a sourozeneckými kontrolními zvířaty v těchto parametrech: RR (-12,72 vs. -10,22%, p = 0,6268), VE (-24,88 vs. -23,94%, p = 0,4150) nebo VE/VO2 (-15,4 vs. -22,55%, p = 0,4643).
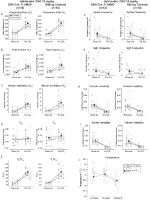
obrázek 5. Oba habituované DBH-Cre; RC::Zvířata P_hM4D a kontroly sourozenců podávané 10 mg / kg CNO vykazují hyperkapnický deficit. Po podání CNO DBH-CRE; RC:: p_hm4d zvířata a kontroly sourozenců nevykazují žádnou změnu ventilace vzduchu v místnosti a snížení RR (a), ve (C) a VE/VO2 (E) za hyperkapnických podmínek bez významných změn VT (B), VO2 (D), frekvence apnoe (F), frekvence povzdechu (G), periodické (H) nebo objemové nestability (I) a teploty (J).
Habituovaná a neobývaná Zvířata divokého typu injekčně s fyziologickým roztokem nevykazovala žádné změny Presalin a Postsalin
ačkoli nebyly pozorovány žádné fenotypy u kontrol, kterým byla podána injekce 1 mg/kg CNO, řešili jsme možnost, že samotná injekce způsobila fenotyp pozorovaný u kontrol, kterým byla podána injekce 10 mg/kg CNO, testováním habituovaných a neobývaných zvířat divokého typu injekčně s fyziologickým roztokem (obrázek 6). V habituovaných i neobydlených kohortách zvířata nevykazovala žádný rozdíl v respiračních parametrech podávání presalinu a postsalinu. Nebyly pozorovány žádné významné změny frekvence apnoe, frekvence povzdechu, periodické nebo objemové nestability nebo teploty.
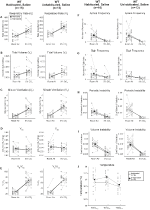
obrázek 6. Jak neobývaná, tak i zvyklá zvířata divokého typu, kterým byl podáván fyziologický roztok, nevykazují žádný rozdíl mezi hodnotami před a po injekci. Po podání fyziologického roztoku nevykazovala jak neobývaná, tak habituovaná divoká zvířata žádné změny v podmínkách RR (A), VT (B), ve (C), VO2 (D), VE/VO2 (E), frekvence apnoe (F), frekvence povzdechu (G), periodické (H) nebo objemové nestability (I) a teploty (J).
poměr koncentrace klozapinu k CNO je vyšší v mozku než v séru
pro stanovení biologické dostupnosti CNO a klozapinu jsme měřili jejich koncentrace v séru a mozku hmotnostní spektrometrií. Třicet minut po intraperitoneální injekci CNO u myší se CNO nachází v nižší relativní hojnosti ve srovnání s jeho zpětným metabolitem klozapinem v séru a mozku pro všechny testované dávky, 0, 1 mg/kg (sérum p = 0, 0054, mozek p = 0, 0001) (obrázek 7A), 1 mg/kg (sérum p > 0, 05, mozek p = 0, 0197) (obrázek 7B) a 10 mg/kg (sérum p = 0, 0036, mozek p = 0.0005) (obrázek 7C). Když byly analyzovány celkové poměry klozapinu a CNO, byly vždy nad nulou a byly vyšší v mozku než v séru (vehikulum p > 0, 5, 0, 1 mg / kg p > 0, 5, 1 mg/kg p = 0, 0018, 10 mg/kg p = 0, 0160) (obrázek 7D).
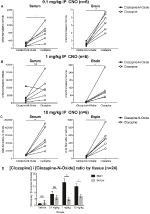
Obrázek 7. Poměr koncentrací klozapinu k CNO je vyšší v mozku než v séru. Vzorky séra a mozku byly odebrány od myší divokého typu 30 minut po podání CNO ve 3 různých dávkách 0, 1 mg / kg (A), 1 mg/kg (B) a 10 mg/kg (C). Jednotlivé datové body představují relativní množství klozapin-N-oxid nebo klozapin získané LC-MS. klozapin k CNO poměr pro každou dávku a SEM jsou také uvedeny (D).
diskuse
počátečním cílem této studie bylo prozkoumat roli neuronů DBH-Cre v respirační fyziologii po akutní poruše u neomezených a vědomých dospělých zvířat. Protože noradrenalin a na neurony hrají dobře zdokumentovanou roli ve stresovém chování (Valentino a Van Bockstaele, 2008; Chen et al. , 2018), snažili jsme se také prozkoumat, zda by návyk na pravděpodobný stresující fyziologický protokol měl vliv na dříve pozorované respirační fenotypy. V celotělové pletysmografii DREADD protokol používaný v naší laboratoři a dalších, zvířata jsou manipulována, rektálně sondována na teplotu, vystavena novému prostředí (pletysmografická komora) a intraperitoneálně injikována. Předchozí studie ukázaly, že manipulace a návyk na injekci a další „rutinní“ postupy mohou modifikovat behaviorální a fyziologické parametry, včetně dýchání (Misslin et al ., 1982; Andrews and File, 1993; Lapin, 1995; Ryabinin et al., 1999). Jiné aplikované stresory také modifikují dýchání za výchozích i hyperkapnických ventilačních podmínek (Isom a Elshowihy, 1982; Kinkead et al., 2001).
v našich studiích využívajících vysoké dávky CNO jsme zjistili, že inhibice na neuronů definovaných DBH-Cre zprostředkovaná hM4D vedla ke snížení hyperkapnického reflexu ve ve/VO2 ve čtyřech definovaných experimentálních kohortách se sníženou RR, VT a VE, podporující předchozí studie (Biancardi et al ., 2008; Viemari, 2008; Gargaglioni a kol., 2010). Avšak zvyklé kontroly sourozenců, kterým byla podána dávka CNO 10 mg / kg použitá v předchozích respiračních studiích, vykazovaly ventilační deficit za hyperkapnických podmínek stejného rozsahu jako u zvířat DBH-CRE; RC:: P_hM4D. Žádné jiné kontrolní skupiny sourozenců neprokázaly tento fenotyp, včetně habituované kohorty, která dostávala pouze (1 mg/kg CNO) nebo fyziologický roztok. Tyto výsledky naznačují, že vyšší dávky CNO (10 mg / kg) mají vliv na hyperkapnickou odpověď, která je odhalena po rozsáhlém návyku, přičemž se předpokládá snížení hladiny stresu zvířat, a že nižší dávky CNO nemají vliv na kontrolu dýchání u návykových zvířat. Tyto výsledky jsou také v souladu s prací Korsak et al. who prokázala, že nízká dávka CNO (2 mg / kg)nevyvolává mimo cílové účinky na pracovní kapacitu v zátěžovém testu, který zahrnoval předchozí trénink (Korsak et al., 2018) a Fleury Curado et al. who nevykazovala žádné specifické účinky nízké dávky CNO (1 mg/kg) na respirační výdej (Fleury Curado et al., 2018).
zvýšené poměry klozapinu k hladinám CNO v séru a v mozku (Obrázek 7) jsou v souladu s nedávnými studiemi, které naznačují, že CNO je snadno zpětně metabolizován na klozapin a vykazuje větší permeabilitu mozku ve srovnání s CNO u myší a jinde (Jann et al., 1994; Chang et al., 1998; Guettier et al., 2009; Gomez a kol., 2017; Raper a kol., 2017). Není však jasné, zda pozorované účinky mimo cíl jsou způsobeny CNO nebo klozapinem. Vzhledem k tomu, že k našim hyperkapnickým měřením došlo <30 minut po aplikaci CNO, je pravděpodobné, že off-cílové respirační účinky jsou zprostředkovány klozapinem. Naše výsledky (Obrázek 7) ukazují vysoké relativní hladiny klozapinu v mozku, i když CNO zcela chybí. Huckstepp a jeho kolegové však použili přímou aplikaci CNO na ventrální dřeň u anestetizovaných potkanů, aby prokázali, že pouze při vzduchu v místnosti, a nikoli při hyperkapnických nebo hypoxických výzvách, má aplikace CNO malý účinek, zvyšuje frekvenci a snižuje dobu výdechu, ale ponechává VT beze změny, bez jasného účinku pozorovaného během hyperkapnie (Huckstepp et al ., 2015). Vzhledem k přímé aplikaci u anestetizovaných potkanů a časovému rámci experimentů je pravděpodobné, že malé pozorované účinky mimo cíl byly zprostředkovány CNO a nikoli klozapinem.
zadní metabolit klozapin je běžně používaný sedativní a antipsychotický lék u schizofrenie s mnoha endogenními cíli, včetně antagonistických účinků s nízkou afinitou na dopaminergní receptory D1, D2 a D4, 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 a 5-HT7 serotonergní receptory, H1 histaminové receptory a α1 a α2 adrenergní receptory, mimo jiné (Fitton a Heel, 1990; Ashby a Wang, 1996). Zde pozorované účinky mimo cíl mohou vyplývat z odlišných nebo kombinovaných mechanismů a cílů. Klozapin může ovlivnit dýchání jako sedativum. Předchozí studie ukázala snížené RR a VT pod 5 a 10% CO2 během spánkových stavů s pomalými vlnami a rychlým pohybem očí ve srovnání s klidným bdělým stavem u myší (Nakamura et al ., 2007). Alternativně může inhibice cílených neuronů exprimujících strach vést k antianxiogennímu nebo anxiolytickému účinku podobnému našemu habituačnímu protokolu k odhalení chemosenzorických účinků mimo cíl zprostředkovaných CNO / klozapinem. Obě vysvětlení jsou podporována několika studiemi, které ukázaly, že CO2 hraje roli v vrozených a naučených reakcích na strach a v chování souvisejícím s úzkostí (Ziemann et al., 2009; Feinstein a kol., 2013; Taugher a kol., 2014; dlouhé a kol., 2015; Winter et al., 2017). Neurony zaměřené na některé z těchto studií tedy mohou skutečně hrát roli při řízení anxiogenních behaviorálních reakcí spíše než fyziologických chemosenzorických reflexů, protože katecholaminergní i serotonergní systémy jsou zapojeny do chování strachu/úzkosti a chemosenzorické homeostázy (Brust et al ., 2014; Hennessy a kol., 2017).
naopak chemosenzorické fenotypy pozorované s vysokými hladinami CNO mohou být pravé, protože jsme byli schopni rekapitulovat na-zprostředkovaný hyperkapnický deficit při dávkách CNO, což je velikost nižší u návykových myší, zatímco kontrolní skupiny nevykazovaly žádný účinek CNO. Úplné srovnání mezi dřívějšími studiemi je však obtížné kvůli nedostatku v některých případech hlášených údajů VO2, VT, RR a VE/VO2. Například změny tělesné teploty nebo rychlosti metabolismu mohou také mnoha způsoby ovlivnit respirační a chemosenzorický výkon a že teploty pletysmografické komory byly v některých případech značně odlišné (34 vs. 30°C v našich studiích), což ovlivnilo dynamický rozsah barometrické složky křivky a tím i přílivový objem. Zejména jsme neviděli ani znatelné změny charakteristik respiračního průběhu v žádném z našich stavů, ani akutní kardio – respirační zástavu, která byla pozorována v našich dřívějších vysokých dávkách, celých studiích kosočtverců (Sun et al ., 2017).
naše výsledky poprvé ukazují, že CNO má neočekávaný účinek na hyperkapnický chemosenzorický reflex, který je odhalen rozsáhlým návykem. Důležité je, že navzdory vysokým hladinám byl CNO mimo cílový účinek dříve vyloučen kvůli nedostatku fenotypu v kontrolách sourozenců, ale to, co ukazujeme, se stává jasným po návyku. Nabízíme mimocílovou charakterizaci CNO v systému myších modelů pro doplnění studií u potkanů a nelidských primátů. Výsledky zde zvyšují možnost, že další CNO-zprostředkované, mimo cílové účinky na studované obvody nebo na autonomní nebo homeostatické obvody mohou existovat, ale mohou být maskovány v jiných kontrolovaných experimentech. Důležité je, že tato data ukazují, že vyšetřovatelé by se měli snažit používat minimální dávky aktivačního ligandu možné v kombinaci s vysokou úrovní návyku a že správné kontroly musí být zahrnuty do chemických genetických manipulací, aby bylo možné plně ocenit a interpretovat experimentální data.
materiály a metody
etické schválení
studie byly schváleny Baylor College of Medicine institucionální Výbor pro péči o zvířata a použití podle protokolu AN-6171.
chov, genetické pozadí a údržba myší
udržovali jsme kolonie všech našich heterozygotních myších kmenů zpětným křížením na myši C57BL/6J a homozygotní kmeny sourozeneckými kříži. Pro histologické experimenty byly DBH-Cremice pářeny s homozygotní myší Ai9 (Madisen et al., 2010) (JAX 007909). Pro pletysmografické experimenty byly myši DBH-Cre pářeny s homozygotním RC:: P_hM4D (Ray et al., 2011) myši k odvození zvířat, ve kterých všechny myši nesly alelu RC:: P_hM4D. Sourozenecká zvířata, která alelu Cre nezdědila, byla použita jako kontrolní zvířata pro potomky Cre pozitivních. Rosa26 specifické primery pro AI9, RC::P_hM4D a RC::Epe myši byly 5′ – GCACTTGCTCTCCCAAAGTC, 5 ‚- GGGCGTACTTTGGCATATGAT a 5 ‚ – CTTTAAGCCTGCCCAGAAGA a poskytly pásmo 495 bp (cílené) a pásmo 330 bp (wt). Primery specifické pro CRE pro všechny ovladače rhombomere Cre byly 5‘ – ATCGCCATCTTCCAGCAGGCACCATTGCCC a 5 ‚ – GCATTTCTGGGGATTGCTTA a pokud byly pozitivní, poskytly pásmo 550 bp. Pro experimenty s LC-MS byly myši c57bl / 6J získány z centra srovnávací medicíny (CCM), Baylor College of Medicine.
histologie
čtyři až osm týdnů starý DBH-Cre; Ai9 dospělé myši byly transkardiálně perfundovány 0,1 M fyziologickým roztokem pufrovaným fosfátem (PBS) a poté 4% paraformaldehydem (PFA) v PBS. Mozky byly vyříznuty a upuštěny fixovány po dobu 2 hodin ve 4% PFA před vyplachováním PBS a ekvilibrací v 20% sacharózy v PBS. Mozky byly poté rozděleny do 30 µm sekcí, namontovány na sklíčka a označeny imunofluorescenčními protilátkami. Obarvili jsme přes noc protilátkou proti tyrosinhydroxyláze, abychom identifikovali katecholaminergní neurony (1: 1 000, Millipore AB152) následované 2 h S oslím anti-králíkem Cy3 sekundární (1: 500, Jackson 711-165-152) v 0,1% Triton-X v PBS (PBST) s 5% oslím sérem. Snímky byly shromážděny na vzpřímeném epifluorescentním mikroskopu Zeiss.
elektrofyziologie
horizontální plátky mozku obsahující lokus coeruleus (300 µm) byly řezány vibratomem (Leica VT 1000S, Leica Microsystems, Buffalo Grove, IL) z dospělých DBH-Cre; RR2P; RC::Epe myši (~1 měsíc staré) v 4°C umělé mozkomíšní tekutině (ACSF). Plátky byly ponořeny do komory perfundované okysličeným ACSF (95% O2 a 5% CO2) obsahujícím v mM: 124 NaCl, 2,0 KCl, 1,3 MgSO4, 2,5 CaCl2, 1,2 KH2PO4, 25 NaHCO3 a 10 glukózy (2-3 ml/min). Celobuněčné záznamy byly prováděny při 30°C pomocí konvenčních technik patch-clamp a multiclamp 700b zesilovače (Molecular Devices, Union City, CA). GFP-pozitivní neurony z lokusu coeruleus byly vizuálně identifikovány a následně zobrazovány infračerveným diferenciálním interferenčním kontrastním videem na jevišti vzpřímeného mikroskopu (Axioskop FS2, Carl Zeiss, Oberkochen, Německo). Náplast pipety (odpory 4-6 MU) byly naplněny (v mM): 110 K-glukonát, 10 KCI, 10 HEPES, 10 NA2-fosfokreatin, 2 Mg3-ATP a 0,2 na3-GTP; pH bylo upraveno na 7,2 a osmolarita na 300 mOsm. Podílový potenciál byl -70 mV. CNO byla použita koupel.
pletysmografie
pletysmografie na vědomých, neomezených myších byla provedena tak, jak je popsáno u dospělých zvířat ve věku 6 až 12 týdnů (Ray et al ., 2011). Habituované myši byly podrobeny 5dennímu habituačnímu protokolu, přičemž každý den sestával z několika minut manipulace,teploty odebrané rektální sondou, intraperitoneální injekce fyziologického roztoku a 30 minut v pletysmografické komoře. Myši byly poté testovány do 1 týdne od posledního dne návyku. Neobývané myši nebyly vystaveny manipulaci ani pletysmografické komoře. Všechny myši byly naivní na CNO a byly použity pouze jednou.
v den testování byly myši odebrány z domácí klece, zváženy a byla odebrána rektální teplota. Zvířata byla poté umístěna do průtočné, teplotně řízené pletysmografické komory (ve vodě obalené při 30°C)a nechala se aklimatizovat po dobu nejméně 20 minut v podmínkách vzduchu v místnosti (21% O2/79% N2). Po aklimatizaci a měření pod vzduch v místnosti byl komorový plyn přepnut na hyperkapní směs 5% CO2/21% O2/74% N2 po dobu 20 minut. Komorový plyn byl poté přepnut zpět na vzduch v místnosti po dobu 20 minut. Myši byly krátce odstraněny pro měření rektální teploty a intra-peritoneální injekci CNO (National Institute of Mental Health Chemical Synthesis and Drug Supply Program) rozpuštěného ve fyziologickém roztoku (1 nebo 0, 1 mg / ml)pro účinnou koncentraci 10 nebo 1 mg / kg. Zvíře bylo vráceno do komory dalších 20 minut vzduchu v místnosti, 20 minut hyperkapnie a 20 minut vzduchu v místnosti. Zvíře bylo poté odstraněno z komory a rektální teplota byla odebrána ihned po ukončení experimentu.
kapalinová chromatografie-hmotnostní spektrometrie
dvacet čtyři myší divokého typu, rovnoměrně rozdělených podle pohlaví, bylo zváženo a ošetřeno 10 mg / kg CNO, 1 mg / kg CNO, 0,1 mg / kg CNO nebo vehikulem. Třicet minut po injekci byly vzorky krve odebrány srdeční punkcí a umístěny do Mikrotainerů BD. Vzorky byly centrifugovány při 4°C při 13 500 ot / min v odstředivce na stole a byly odebrány supernatanty. Sérum a mozek byly udržovány při -20°C až do extrakce.
z Sigma-Aldrich (St. Louis, MO) byla získána rozpouštědla třídy HPLC voda, acetonitril chloroform a methanol a kyselina mravenčí hmotnostní spektrometrie. Kalibrační roztok obsahující více kalibrantů v roztoku acetonitrilu, kyseliny trifluoroctové a vody byl zakoupen od společnosti Agilent Technologies (Santa Cruz, CA). Metabolity a vnitřní standardy, včetně kyseliny N-acetyl asparagové-d3, tryptofanu-15N2, kyseliny glutamové-d5, thyminu-d4, kyseliny gibberelové, trans-zeatinu, kyseliny jasmonové, kyseliny 15N anthranilové a testosteronu-d3, byly zakoupeny od společnosti Sigma-Aldrich (St.Louis, MO). Mikrotainer R SST TM byl získán z Becton Dickinson(Franklin Lakes, NJ).
extrakce sestávala z 750 µl ledově studeného methanolu: voda (4:1) obsahující 20 µl špičatých vnitřních standardů, které byly přidány do každého vzorku mozku (50 mg) a kontroly kvality a poté byly homogenizovány po dobu 1 minuty. Poté bylo přidáno 750 µl 100% acetonitrilu obsahujícího 20 µl špičatých vnitřních standardů k promytí vzorku (100 µl)a kontroly kvality a poté se sonikuje po dobu 5 minut. Všechny vzorky byly odstředěny při 5 000 ot / min po dobu 10 minut při 4°C. Výsledný supernatant byl odebrán a 20 µl bylo injikováno do LC-MS.
všechny vzorky byly analyzovány pomocí 6,490 trojitého kvadrupólového hmotnostního spektrometru (Agilent Technologies, Santa Clara, CA) spojeného s HPLC systémem (Agilent Technologies, Santa Clara, CA) pomocí vícenásobného sledování reakcí (MRM). Na detekovaný metabolit bylo získáno přibližně 8-11 datových bodů. Zjištěné metabolity byly klozapin, CNO a norklozapin(N-desmethyl klozapin). V metodě byl použit pozitivní režim ESI. Kolona HPLC byla ACQUITYUPLC C18 kolona (100 Å, 1,8 µm a 2,1 mm × 100 mm. Milford, MA, USA) s průtokem 0,5 ml / min.
sběr a analýza dat
pletysmografie
pletysmografie změny tlaku byly měřeny pomocí převodníku diferenciálního tlaku Validyne DP45 a referenční komory a DEMODULÁTORU nosiče CD15 a zaznamenány pomocí LabChartPro v reálném čase. Průběhy byly analyzovány offline pomocí LabChartPro a vlastního písemného kódu MATLAB k určení respirační frekvence (RR), přílivového objemu (VT) (Ray et al., 2011), minutová ventilace (VE) a analýza vzorů. Respirační průběhy byly shromažďovány offline během období, kdy bylo zvíře v klidu, a údaje byly bez pohybových artefaktů. Minimálně 1 min kumulativní data sestavená ze stop alespoň 10 S dlouhá od posledního 10 min daného experimentálního stavu byly analyzovány. Spotřeba O2 byla stanovena porovnáním složení plynu mezi kalibrací v prázdné komoře a živým dýcháním pomocí kyslíkového senzoru a analyzátoru AEI. Teplota v komoře byla neustále sledována pomocí sondy ThermoWorks MicroThermo 2 a byla zaznamenávána pomocí LabChartPro v reálném čase.
Poincaré měření a frekvence povzdechu a apnoe byly stanoveny pomocí 1 minuty stop bez pohybu z každého dýchacího stavu. Vzdechy byly definovány jako dech s amplitudou nejméně dvakrát větší než průměrný dech. Apnoe byly definovány jako interbreath interval (IBI) nejméně dvakrát větší než průměrný IBI. Variační koeficient (CV) IBI a amplitudy byl také vypočítán ze stejné 1-min stopové kompilace každého stavu dýchání(standardní chyba IBI nebo amplituda / střední IBI nebo amplituda).
Statistika
pletysmografie
výsledky (RR, VT, ve, VO2, VE/VO2, počet apnoe a povzdechů a CVs IBI a amplitudy) pro údaje o vzduchu v místnosti a hyperkapnic byly porovnány mezi DBH-Cre; RC::kohorty P_hM4D a kontroly sourozenců pomocí lineárního regresního modelu se smíšenými efekty s typem zvířat (experimentální vs. kontrola) a podáním CNO (před vs. po injekci) jako fixní efekty a zvířecí id jako náhodný efekt. Údaje o teplotě byly porovnány pomocí lineárního regresního modelu se smíšenými efekty s typem zvířat (experimentální vs. kontrola) jako fixní efekt. P < 0,05 byl použit k označení statistické významnosti a jednotlivé datové body, Průměr a standardní chyba průměru jsou zobrazeny na všech grafech.
kapalinová chromatografie – hmotnostní spektrometrie
získaná plocha pod vrcholem pro každý vzorek byla normalizována vnitřní kontrolou a poté do vehikula před provedením statistické analýzy. Nepárový t test byl použit k porovnání relativního množství klozapinu a CNO v každé tkáni podle koncentračních skupin.
etické prohlášení
všechny experimenty byly schváleny institucionálním Výborem pro péči o zvířata a použití Baylor College of Medicine. Pokusy byly v souladu s národními normami pro péči a používání pokusných zvířat stanovenými Asociací pro hodnocení a akreditaci laboratorní péče o zvířata.
autorské příspěvky
JS, FS-M, MC-M a RR koncipovány a navrženy experimenty. JS, FS-M A PZ provedly experimenty a přispěly k analýze dat. Js, FS-M, VM, MC-M a RR napsal papír.
financování
tato studie byla podpořena granty R01HL130249 a R01HL130249-S1 od Národního institutu pro srdce, plíce a krev; March of Dimes Basil O ‚ Connor Award; a McNair Medical Institute.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
poděkování
Děkujeme Dr. Shaila k. Mani a Benjamin Arenkiel za užitečné diskuse. Děkujeme také Baylor College of Medicine Proteomics Core facility za provedení kapalinové chromatografie-hmotnostní spektrometrie.
Amiel, J., Dubreuil, v., Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). PHOX2B v respirační kontrole: poučení z vrozeného centrálního hypoventilačního syndromu a jeho myších modelů. Respire. Fyziol. Neurobiol. 168, 125–132. doi: 10.1016 / j. resp.2009.03.005
CrossRef Plný Text / Google Scholar
Andrews, N., and File, S. E. (1993). Manipulace s anamnézou potkanů modifikuje behaviorální účinky léků ve zvýšeném plus-maze testu úzkosti. Euro. J. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, s., and Roth, B. L. (2007). Vyvíjení zámku tak, aby odpovídal klíči, aby se vytvořila rodina receptorů spřažených s G proteinem, silně aktivovaných inertním ligandem. Proc. Natle. Acad. Věda. USA 104, 5163-5168. doi: 10.1073 / pnas.0700293104
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ashby, C. R., and Wang, R. Y. (1996). Farmakologické účinky atypického antipsychotického léčiva klozapin: přehled. Synapse 24, 349-394. doi: 10.1002/(SICI)1098-2396(199612)24:4<349::podpora-SYN5>3.0.CO;2-D
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Bahia, C. M. C. d. S., and Pereira, J. S. (2015). Obstrukční spánková apnoe a neurodegenerativní onemocnění: obousměrný vztah. Dement. Neuropsychol. 9, 9–15. doi: 10.1590 / S1980-57642015DN91000003
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Biancardi, v., Bícego, K. C., Almeida, M. C., and Gargaglioni, L. H. (2008). Locus coeruleus noradrenergní neurony a CO2 vedou k dýchání. Pflugersův Oblouk. – Euro. J. Physiol. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Brust, R. D., Corcoran, A. E., Richerson, G. B., Nattie, E., and Dymecki, S.M. (2014). Funkční a vývojová identifikace molekulárního podtypu serotonergního neuronu mozku specializovaného na regulaci dynamiky dýchání. Buňka Rep. 9, 2152-2165. doi: 10.1016 / j. celrep.2014.11.027
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Chang, W. H., Lin, s. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Reverzibilní metabolismus klozapinu a N-oxidu klozapinu u schizofrenních pacientů. Pořada. Neuropsychofarmakol. Biol. Psychiatrie 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Chen, Y. – W., Das, m., Oyarzabal, E. a., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Genetická identifikace populace noradrenergních neuronů zapojených do útlumu reakcí souvisejících se stresem. Molo. Psychiatrie 1-16. doi: 10.1038 / s41380-018-0245-8
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
dlouhý, B. J., Gehlbach, B. K., Kreple, C. J., Kawasaki, h., Oya, h., Buzza, C., et al. (2015). Dýchání inhibováno, když se záchvaty rozšířily do amygdaly a po stimulaci amygdaly. J. 35, 10281–10289. doi: 10.1523/JNEUROSCI.0888-15. 2015
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Feinstein, J. S., Buzza, C., Hurlemann, R., Follmer, R. L., Dahdaleh, N. S., Coryell, W. H., et al. (2013). Strach a panika u lidí s bilaterálním poškozením amygdaly. Adresa. Neurovědci. 16, 270–272. doi: 10.1038 / nn.3323
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Fitton, A., and Heel, R. C. (1990). Klozapin. Přehled jeho farmakologických vlastností a terapeutického použití u schizofrenie. Drogy 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Fleury Curado, T. A., Pho, h., Děrgačeva, o., Berger, s., Lee, R., Freire, C., et al. (2018). Umlčení hypoglossálních motoneuronů vede k poruchám spánku u chudých myší. Před. Neurol. 9:962. doi: 10.3389 / fneur.2018.00962
CrossRef Plný Text / Google Scholar
Gargaglioni, L. H., Hartzler, L. K., and Putnam, R.W. (2010). Locus coeruleus a centrální chemosenzitivita. Respire. Fyziol. Neurobiol. 173, 264–273. doi: 10.1016 / j. resp.2010.04.024
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). Chemogenetika odhalena: DREADD obsazení a aktivace pomocí převedeného klozapinu. Věda 357, 503-507. doi: 10.1126 / věda.aan2475
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Guettier, J. M., Gautam, D., Scarselli, m., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). Chemicko-genetický přístup ke studiu regulace g proteinu funkce beta buněk in vivo. Proc. Natle. Acad. Věda. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
CrossRef Plný Text / Google Scholar
Hakim, F., Gozal, D., and Kheirandish-Gozal, L. (2012). Sympatické a katecholaminergní změny spánkové apnoe se zvláštním důrazem na děti. Před. Neurol. 3:7. doi: 10.3389 / fneur.2012.00007
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Hennessy, M. L., Corcoran, A. E., Brust, R. D., Chang, y., Nattie, E. E., and Dymecki, S. M. (2017). Aktivita neuronů Pet1 raphe exprimujících Tachykinin1 moduluje respirační chemoreflex. J. 37, 1807–1819. doi: 10.1523/JNEUROSCI.2316-16. 2016
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
huckstepp, R. T. R., Cardoza, K. P., Henderson, L. E., and Feldman, J. L. (2015). Úloha parafaciálních jader při kontrole dýchání u dospělých potkanů. J. 35, 1052–1067. doi: 10.1523/JNEUROSCI.2953-14. 2015
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ilg, a. – k., Enkel, T., Bartsch, D., and Bähner, F. (2018). Behaviorální účinky akutního systémového nízkodávkového klozapinu u potkanů divokého typu: důsledky pro použití strachu v behaviorální neurovědě. Před. Chovej se. Neurovědci. 12:173. doi: 10.3389 / fnbeh.2018.00173
CrossRef Plný Text / Google Scholar
isom, G.E., and Elshowihy, R. M. (1982). Interakce akutního a chronického stresu s dýcháním: modifikace naloxonem. Farmakol. Biochem. Chovej se. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Jann, M.W., Lam, Y. W., and Chang, W. H. (1994). Rychlá tvorba klozapinu u morčat a člověka po podání klozapinu-N-oxidu. Oblouk. Int. Farmakodyn. Další. 328, 243–250.
PubMed Abstrakt / Google Scholar
Joober, R. (2010). Klozapin: zřetelná, špatně pochopená a nedostatečně používaná molekula. J. Psychiatrie Neurovědci. 35, 147–149. doi: 10.1503 / jpn.100055
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Kinkead, R., Dupenloup, L., Valois, N., and Gulemetova, R. (2001). Stres vyvolaný útlum hyperkapnické ventilační odpovědi u vzhůru potkanů. J.Appl. Fyziol. 90, 1729–1735. doi: 10.1152 / jappl.2001.90.5.1729
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Klein, D. F. (1993). Falešné alarmy udušení, spontánní paniky a související podmínky. Integrační hypotéza. Oblouk. Generál Psychiatrie 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Korsak, a., Sheikhbahaei, s., Machhada, a., Gourine, a. V., and Huckstepp, R. T. R. (2018). Úloha parafaciálních neuronů při kontrole dýchání během cvičení. Věda. Rep. 8: 400. doi: 10.1038 / s41598-017-17412-z
CrossRef Plný Text / Google Scholar
Lapin, I. P. (1995). Pouze kontroly: vliv manipulace, falešné injekce a intraperitoneální injekce fyziologického roztoku na chování myší ve zvýšeném plusovém bludišti. J. Toxikol. Metody 34, 73-77. doi: 10.1016 / 1056-8719 (95)00025-D
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Lavezzi, A. M., Alfonsi, G., and Matturri, L. (2013). Patofyziologie komplexu lidského lokusu coeruleus při náhlé nevysvětlitelné smrti plodu/novorozence. Neurol. Rez.35, 44-53. doi: 10.1179 / 1743132812Y. 000000108
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
MacLaren, D. A. a., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, s., Khare, P., España, R. A., et al. (2016). Podávání klozapinu N-oxidem produkuje behaviorální účinky u potkanů s dlouhým Evansem: důsledky pro navrhování hrůzných experimentů. eNeuro 3, 1-14. doi: 10.1523/ENEURO.0219-16. 2016
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, h. a., Gu, H., et al. (2010). Robustní a vysoce výkonný systém vytváření zpráv a charakterizace pro celý myší mozek. Adresa. Neurovědci. 13, 133–140. doi: 10.1038 / nn.2467
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Mahler, s. V., and Aston-Jones, G. (2018). CNO zlo? Úvahy o použití strachu v behaviorální neurovědě. Neuropsychofarmakologie 43, 934-936. doi: 10.1038 / npp.2017.299
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Manvich, D. F., Webster, K.a., Foster, S. L., Farrell, m. s., Ritchie, J. C., Porter, J. H., et al. (2018). DREADD agonista klozapin N-oxid (CNO) je reverzně metabolizován na klozapin a vyvolává interoceptivní stimulační účinky podobné klozapinu u potkanů a myší. Věda. Rep. 8, 3840. doi: 10.1038 / s41598-018-22116-z
CrossRef Plný Text / Google Scholar
Misslin, R., Herzog, F., Koch, B., and Ropartz, P. (1982). Účinky izolace, manipulace a novosti na hypofýzu–nadledvinová odpověď u myší. Psychoneuroendokrinologie 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Nakamura, a., Zhang, W., Yanagisawa, m., Fukuda, Y., and Kuwaki, T. (2007). Bdělost stavově závislý útlum hyperkapnického chemoreflexu a přehnaná spánková apnoe u myší s knockoutem orexinu. J.Appl. Fyziol. 102, 241–248. doi: 10.1152 / japplphysiol.00679.2006
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
obonai, T., Yasuhara, m., Nakamura, T., and Takashima, s. (1998). Změna katecholaminových neuronů v mozkovém kmeni obětí syndromu náhlého úmrtí kojenců. Pediatrie 101, 285-288. doi: 10.1542 / peds.101.2.285
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ozawa, y., Takashima, s., and Tada, h. (2003). Alfa2-adrenergní receptorové podtypy změny v mozkovém kmeni u syndromu náhlého úmrtí kojenců. Brzy Hučení. Rozvoj. 75 (Suppl.), S129-S138. doi: 10.1016 / j. pathophys.2004.01.015
CrossRef Plný Text / Google Scholar
Padovan-Hernandez, y., and Knackstedt, L.a. (2018). Na dávce závislé snížení lokomoce vyvolané kokainem klozapinem-n-oxidem u potkanů s anamnézou samopodání kokainu. Neurovědci. Lette. 674, 132–135. doi: 10.1016 / j. neulet.2018.03.045
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ramanantsoa, N., Hirsch, M. – R., Thoby-Brisson, m., Dubreuil, v., Bouvier, J., Ruffault, P.-L., et al. (2011). Dýchání bez CHEMOSENZITIVITY CO (2)u podmíněných mutantů Phox2b. J. 31, 12880–12888. doi: 10.1523/JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Egr2-neurony kontrolují respirační odpověď dospělých na hyperkapnii. Brain Res.1511, 115-125. doi: 10.1016 / j. brainres.2012.12.017
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Kim, J. C., Richerson, G. B., Nattie, E., et al. (2011). Zhoršená kontrola respirační a tělesné teploty při akutní inhibici serotonergních neuronů. Věda 333, 637-642. doi: 10.1126 / věda.1205295
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Rjabinin, A. E., Wang, Y. M., a Finn, D.a. (1999). Různé úrovně imunoreaktivity Fos po opakované manipulaci a injekčním stresu u dvou inbredních kmenů myší. Farmakol. Biochem. Chovej se. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Snyder, B., Shell, B., Cunningham, J. T., and Cunningham, R. L. (2017). Chronická intermitentní hypoxie indukuje oxidační stres a zánět v mozkových oblastech spojených s neurodegenerací v rané fázi. Fyziol. Rep. 5, 1-13. doi: 10.14814/phy2.13258
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Sun, JJ, Huang, T.-W., Neul, Jl, and Ray, R. S. (2017). Embryonální geny pro vzorování zadního mozku vymezují odlišné kardio-respirační a metabolické homeostatické populace u dospělých. Věda. Rep. 7: 9117. doi: 10.1038 / s41598-017-08810-4
CrossRef Plný Text / Google Scholar
Sun, J. J., and Ray, R. S. (2017). Tg (Th-Cre)FI172Gsat (Th-Cre) definuje neurony, které jsou potřebné pro plné hyperkapnické a hypoxické reflexy. Biol. Otevřeno 6, 1200-1208. doi: 10.1242 / bio.026823
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Taugher, R. J., Lu, y., Wang, y., Kreple, C. J., Ghobbeh, a., Fan, R., et al. (2014). Jádro lůžka stria terminalis je rozhodující pro chování související s úzkostí vyvolané CO2 a acidózou. J. 34, 10247–10255. doi: 10.1523/JNEUROSCI.1680-14. 2014
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Valentino, R. J., and Van Bockstaele, e. (2008). Konvergentní regulace aktivity locus coeruleus jako adaptivní reakce na stres. Euro. J. Farmakol. 583, 194–203. doi: 10.1016 / j. ejphar.2007.11.062
CrossRef Plný Text / Google Scholar
Verbraecken, J., and McNicholas, W. T. (2013). Respirační mechanika a ventilační kontrola v překrývajícím se syndromu a hypoventilaci obezity. Respire. Rez.14:132. doi: 10.1186/1465-9921-14-132
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Viemari, J. – C. (2008). Noradrenergní modulace respirační neuronové sítě. Respire. Fyziol. Neurobiol. 164, 123–130. doi: 10.1016 / j. resp.2008.06.016
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Winter, a., Ahlbrand, R., Naik, D., and Sah, R. (2017). Diferenciální behaviorální citlivost na inhalaci oxidu uhličitého (CO2) u potkanů. Neuroscience 346, 423-433. doi: 10.1016 / j. neurověda.2017.01.003
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ziemann, A. E., Allen, J. E., Dahdaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, A. M., et al. (2009). Amygdala je chemosenzor, který detekuje oxid uhličitý a acidózu a vyvolává chování strachu. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar