- Úvod
- materiály a metody
- sklizeň oocytů a mikroinjekce cRNA
- izolace membránových frakcí a imunoblotování
- imunohistochemie
- Freeze Fracture elektronová mikroskopie
- párový-Oocytový test a kvantifikace kontaktních oblastí
- hydrostatický tlakový impulsní test
- Kaprátová inkubace
- Statistická analýza
- výsledky
- exprese Claudin-5 a integrace do X. laevis Oocytová plazmatická membrána
- v oocytech exprimujících Claudin-5
- Paired oocyte Assay for Analysis of Claudin Trans-Interaction
- hydrostatický tlakový impulsní test odhaluje Klaudin-specifické spojení párů oocytů
- inkubace s Kaprátem
- diskuse
- Claudiny přispívají k silnějším adhezním vlastnostem
- závěr
- Prohlášení o dostupnosti dat
- etické prohlášení
- autorské příspěvky
- financování
- střet zájmů
- poděkování
- doplňkový materiál
Úvod
rodina těsných spojovacích proteinů je pro fyziologii buněk zásadní, protože nedostatek nebo poškození je spojeno s onemocněními a dysfunkcí mnoha orgánů a tkání, jak je ukázáno např. ve vnitřním uchu (Wilcox et al ., 2001; Florian et al., 2003), ledvina (Konrád et al., 2006; Günzel et al., 2009), gastrointestinální trakt (Resnick et al., 2005; Amasheh et al., 2009), epidermis (Furuse et al., 2002; Tebbe et al., 2002) a mozkové kapiláry (Nitta et al., 2003; Wolburg et al., 2003). Claudiny představují transmembránovou proteinovou rodinu obsahující nejméně 27 členů (Mineta et al ., 2011). Kromě svých čtyř transmembránových domén šroubovice obsahují dvě extracelulární smyčky (ECL1 a ECL2), krátký N-konec A C-konec (Suzuki et al., 2014). Specifické vzorce claudinovy exprese určují a odrážejí selektivní permeabilitu epitelu a schopnost claudinových proteinů interagovat v cis (ve stejné membráně) a v trans (mezi membránami sousední buňky) umožňuje tvorbu bariér tvořících a pórů tvořících těsné spojovací prameny (Van Itallie a Anderson, 2006).
Claudin-5 je silně exprimován v kapilárním endotelu a dominuje těsnému spojení (TJ) hematoencefalické bariéry (BBB), protože exprese je >100krát vyšší ve srovnání s jakýmkoli jiným claudinem (Ohtsuki et al., 2007). Kromě toho je exprimován v různých epiteliálních tkáních včetně plic (Soini, 2011), exokrinních tkání (Comper et al., 2009), střevní (Garcia-Hernandez et al., 2017) a močových cest (Koda et al., 2011). Claudin-5 však způsobuje silnější bariéru v mozkových kapilárách než v jiných tkáních (Reinhold a Rittner, 2017) a jeho funkce je narušena u neurodegenerativních a neuroinflamačních poruch(Greene a kol., 2019). Proto je claudin-5 zásadní pro udržení BBB. BBB však není jen ochranný, ale také omezuje terapeutické možnosti, protože lékům brání pronikat touto bariérou.
Nitta et al. (2003) uvádí, že BBB je propustnější pro molekuly o velikosti 800 Da u myší s deficitem claudin-5 ve srovnání s myší divokého typu (Nitta et al ., 2003). To bylo v souladu s transfekčními experimenty prokazujícími těsnící účinek claudinu-5 v monovrstvách buněk Caco-2 (Amasheh et al., 2005).
dalším významným bariérově tvořícím claudinem je claudin-3, o kterém se uvádí, že selektivně utěsňuje bariéru proti průchodu iontů buď náboje, nebo nenabitých rozpuštěných látek (Milatz et al., 2010). Je také exprimován v endoteliálním těsném spojení mozkových kapilár a jeho funkční ztráta je pozorována ve fázích zánětu mikrovessel, glioblastomu a choroidního plexu pacientů s roztroušenou sklerózou (Engelhardt et al ., 2001; Wolburg et al., 2003).
bariérové vlastnosti lze dynamicky modifikovat, např. bylo prokázáno, že inkubace s kaprátem sodným rychle a reverzibilně snižuje transepiteliální elektrický odpor v lidské střevní buněčné linii HT-29 / B6 (Krug et al ., 2013). Kaprát sodný přechodně otevírá bariéry obsahující claudin-5 v těsných spojích epiteliálních a endotelových buněk (Del Vecchio et al ., 2012).
to naznačuje, že claudin-5 je slibným cílem pro zlepšení dodávky léků v BBB.
v této studii jsme se zaměřili na použití heterologního expresního systému oocytů Xenopus laevis (Vitzthum et al., 2019) pro analýzu interakce a pertubace claudin-5 a claudin-3. Vzhledem k nedostatku endogenních kontaktů mezi buňkami umožňuje tento jednobuněčný expresní systém analýzu specifických claudinů bez interference jiných těsných spojovacích proteinů.
materiály a metody
sklizeň oocytů a mikroinjekce cRNA
oocyty byly odebrány z dospělých ženských afrických drápů žab chirurgickou laparotomií. Za anastézie, 0.2% MS222 (ethyl-3-aminobenzoát methanesulfonát, Sigma-Aldrich, Taufkirchen, Německo) byl použit jako roztok lázně po dobu 5-10 minut při 20°C.po dosažení chirurgické anastézie byly provedeny řezy kůže a břišního svalu a ovariální hmota byla exteriorizována a odstraněna ovariální tkáň. Izolace oocytů byla prováděna enzymatickým štěpením při pokojové teplotě po dobu 90 minut v 1,5 mg / ml kolagenázových Fisherových Bioreagentů BP2649-1 (Fisher Scientific, Schwerte, Německo) rozpuštěných v Ringerově roztoku oocytů (ORi), jak je popsáno Vitzthum et al. (2019). Folikulární buňky byly odstraněny inkubací v ORi bez Ca2+obsahujících (v mM): NaCl (90), KCl (1), EGTA (kyselina triethylenglykol diamin tetraoctová) (1), 5 HEPES (5); pH 7,4 po dobu 10 minut na mechanickém třepačce s 50 ot / min. Oocyty stupňů v a VI (>1000 µm) byly injikovány (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Spojené státy americké) s 1 ng cRNA kódující lidskou claudin-5, claudin-3 nebo vodu bez Rnázy jako kontroly. Objem injekce byl 50,6 nl na oocyt. Po injekci byly oocyty inkubovány při 16°C za ORi 3 dny pro expresi proteinu.
izolace membránových frakcí a imunoblotování
deset injikovaných oocytů bylo shromážděno pro analýzu western blot a resuspendováno v 500 µl homogenizačním pufru obsahujícím (v mM) MgCl2 (5), NaH2PO4 (5), EDTA (kyselina ethylendiamintetraoctová) (1), sacharózu (80) a Tris(Tris (hydroxymethyl)aminomethan) (20); pH 7.4. Extrakty oocytů byly centrifugovány dvakrát při 200 ot / min po dobu 10 minut při 4°C, aby se zlikvidovaly zbytky buněk. Supernatant byl odstředěn při 13 000 ot / min po dobu 30 minut při 4°C, aby se pelety buněčné membrány, jak je popsáno Leduc-Nadeau et al. (2007). Pelety byly resuspendovány v 80 µl homogenizačním pufru. Kvantifikace proteinů byla provedena kolorimetricky pomocí Pierce 600 nm Protein Assay Kit (Thermo Fisher Scientific, Hennigsdorf, Německo) podle pokynů výrobce v 96 jamkové desce. Čtečka destiček (PerkinElmer Enspire Multimode Plate Reader, Waltham, MA, Spojené státy americké) byla upravena na 562 nm a pro hodnocení byl použit Standard bovinního sérového albuminu (Thermo Fisher Scientific, Hennigsdorf, Německo) v rozmezí od 125 do 2000 µg/ml. Před imunoblotováním byly vzorky smíchány s 4× laemmli pufrem (Bio-Rad Laboratories, Mnichov, Německo), naloženy na 10% SDS polyakrylamidový gel a elektroforovány. Pro přenos proteinů byly použity PVDF membrány a blokovány v 5% netučném suchém mléce v Tris-pufrovaném fyziologickém roztoku po dobu 120 minut. Proteiny byly detekovány imunoblotováním pomocí primárních protilátek zvýšených proti claudinu-3 nebo claudinu-5 (invitrogen # 35-2500, # 34-1700, #34-1600, Life Technologies, Carlsbad, CA, Spojené státy americké).
peroxidázou konjugované kozí anti-králičí a anti-myší protilátky (#7074, #7076 Cell Signaling Technology, Danvers, MA, Spojené státy americké) byly použity k vazbě na primární protilátky, a proto byly inkubovány po dobu minimálně 45 minut při pokojové teplotě. Pro detekci byl použit substrát Clarity Western ECL Blotting (#1705061, Bio-Rad Laboratories GmbH, Mnichov, Německo)a signály byly vizualizovány systémem ChemiDoc MP (Bio-Rad Laboratories).
imunohistochemie
injikované oocyty byly fixovány ve 4% PFA (16% paraformaldehydu, E15700, Science Service, Mnichov, Německo) po dobu 4 hodin při pokojové teplotě následované dehydratačním gradientem ze 70% ethanolu na xylol (Carl Roth, Karlsruhe, Německo) během 48 hodin. vzorky byly vloženy do parafínu a křížově řezány (5 µm) pomocí mikrotomu Leica RM 2245 (Leica Microsystems Heidelberg, Německo). Krátce před imunohistochemickou léčbou byl parafin odstraněn gradientem xylolu na ethanol. Nespecifická vazebná místa byla blokována použitím 5% kozího séra ve fyziologickém roztoku pufrovaném fosfáty a inkubována se stejnými primárními protilátkami jako pro imunoblotování. Vzorky byly inkubovány se sekundárními protilátkami Alexa Fluor-488 goat anti-rabbit a Alexa Fluor-594 goat anti-mouse (Life Technologies, Karlovy Vary, CA, Spojené státy americké) a vyšetřeny konfokální laserovou skenovací imunofluorescenční mikroskopií (LSM 710, Zeiss, Oberkochen, Německo).
Freeze Fracture elektronová mikroskopie
Freeze fracture elektronová mikroskopie byla provedena, jak bylo nedávno hlášeno (Greene et al., 2019). Pro fixaci byly injikované oocyty inkubovány v glutaraldehydu (2, 5% V 0, 1 M kakodylátového pufru) přes noc při 4°C.po promytí kakodylátovým pufrem byly oocyty připraveny pro zlomení zmrazením. Vzorky byly kryoprotekovány v 30% glycerolu a zmrazeny v kapalném dusíku. Po štěpení a stínování platinou a uhlíkem (BAF400D; Balzers, Lichtenštejnsko) byl zbývající organický materiál odstraněn promytím chlornanu sodného. Oocyty byly analyzovány v transmisním elektronovém mikroskopu (EM-10, Zeiss, Oberkochen, Německo)a fotografovány digitálním fotoaparátem (Tröndle GmbH). Morfometrická analýza těsných spojovacích pramenů byla provedena při zvětšení 20 000×.
párový-Oocytový test a kvantifikace kontaktních oblastí
Mannitol byl implementován ke zmenšení injikovaných oocytů a umožnění mechanického odstranění membrány vitelline pomocí kleští bez poškození plazmatické membrány. 5-10 oocytů bylo umístěno do Petriho misky (průměr 35 mm, Thermo Fisher, Henningsdorf, Německo, #153066) naplněné ORi. Mannitol byl přidáván a rozpuštěn, dokud nebylo dosaženo hypertonického smršťování buněk (přibližně 400 mOsmol / l po dobu 10 minut). Po manuální devitellinizaci byly oocyty okamžitě přeneseny na destičku s 24 jamkami (1 . 86 cm2 povrchová plocha, TPP Techno Plastic Products, Trasadingen, Švýcarsko, # 92024) obsahující 2 ml ORi. V každé jamce byly dvě buňky jemně seskupeny tak, že je tlačily spolu s pasteurovou pipetou (1 ml, Thermo Fisher, Henningsdorf, Německo, #PP88SB) a cibulovitou sondou.
páry oocytů exprimujících claudin-5 (cldn5-cldn5), claudin − 3 exprimujících (cldn3-cldn3), claudin-3 a claudin − 5 koexprimujících (cldn3,5-cldn3,5) a kontrolních oocytů (control-control) byly udržovány pohromadě po dobu až 48 hodin v ORi při 16°C.
pro kvantifikaci kontaktní plochy shlukovaných oocytů po 1, 24 a 48 h.v těchto časových bodech byly pořízeny snímky naivních párů oocytů ve 24 kultivačních miskách pomocí mikroskopu Leica dmi6000 b (Leica Microsystems, Wetzlar, Německo). Průměr kontaktní plochy byl měřen pomocí mikronové stupnice (LAS – af 3.2.0). Kontaktní plochy jsou považovány za kruhové, a proto byla kontaktní plocha vypočtena pomocí kruhové rovnice a=π∙r2.
hydrostatický tlakový impulsní test
vitellinové membrány byly mechanicky odstraněny, jak bylo popsáno výše, a oocyty se seskupily analagózně do spárovaného testu oocytů. Dále byly testovány smíšené páry oocytů (control–cldn5 a control–cldn3) v testu hydrostatického tlakového impulsu (HPI). Po 24 h stabilizace byl vytvořen definovaný hydrostatický impuls pomocí jednokanálové elektronické pipety (EE-300R, Eppendorf Research Pro, verze softwaru 2.06.00, Hamburg, Německo).
oocyty byly uchovávány ve 24 jamkových destičkách obsahujících 2 ml ORi a před aplikací pipetovacího objemu 250 µl ORi bylo zkontrolováno centrální umístění. Dávkovací rychlost byla jednotně nastavena na maximální rychlost, což se rovnalo dávkovací rychlosti 0,9 s. Dále byl rovnoměrně aplikován úhel (45°) a vzdálenost aplikace (1.3 1,3 cm). Okolní tlak, viskozita ORi a průměr otvoru špičky pipety byly udržovány za stálých podmínek. Mikroskopie jasného pole byla použita pro kvantifikaci kontaktních oblastí 30 min po aplikaci hydrostatického tlaku a porovnání s kontaktními oblastmi před aplikací. Experimentální nastavení je popsáno na obrázku 1.
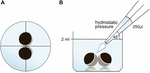
Obrázek 1. Experimentální nastavení impulsního testu hydrostatického tlaku (a) schematický pohled shora na vrt: před aplikací hydrostatického tlaku bylo zkontrolováno centrální umístění páru oocytů. B) Schematický boční pohled na jamku: 250 µl ORi bylo přidáno pomocí jednokanálové elektronické pipety. Rychlost výdeje byla jednotně nastavena na maximální rychlost. Úhel (45°) a vzdálenost aplikace byly rovnoměrně aplikovány. Okolní tlak, viskozita ORi a průměr otvoru špičky pipety byly udržovány za stálých podmínek.
Kaprátová inkubace
pro kaprátovou inkubaci byl do oocytů přidán kaprát sodný (#C4151, Sigma Aldrich, Taufkirchen, Německo) v konečných koncentracích 50, 100 a 500 µM nebo ORi jako referenční skupina 24 hodin po párování. Oocyty byly uchovávány ve 24 jamkových destičkách obsahujících 2 ml ORi a kaprátový roztok byl rozpuštěn v definovaném adičním objemu 250 µl ORi na jamku. Šířka kontaktní plochy byla kvantifikována na 30, 60 a 120 minut po přidání.
Statistická analýza
Statistická analýza byla provedena s JMP pro 14.0.0 (NC, Spojené státy americké). Data jsou prezentována jako mediány a zobrazena jako procentuální změna na základě seskupené kombinace v prvních vyšetřovacích bodech. Obrázky 4, 5 jsou prezentovány jako krabicové grafy, zobrazující první kvartil (25 procent), medián (50 procent) a druhý kvartil (75 procent). Vousy jsou taženy dolů na 10. percentil a až na 90. percentil. Normální distribuce byla kontrolována pomocí Shapiro-Wilk-test.
Kruskal-Wallisův test byl použit pro vícenásobné srovnání, následované korekcí Dunn-Bonferroni. p-hodnoty jsou uvedeny jako kontinuální čísla.
výsledky
exprese Claudin-5 a integrace do X. laevis Oocytová plazmatická membrána
pro testování úspěšné exprese a integrace těsného spojovacího proteinu claudin-5 do plazmatické membrány oocytů byly 3 dny po injekci claudin-5 cRNA analyzovány membránové frakce imunoblotováním. Všechny vzorky ze tří jednotlivých zvířat (d1–d3) odhalily specifické signály claudin-5 při 23 kDa, zatímco oocyty bez Rnázy bez vody nevykazovaly žádný specifický signál pro expresi claudin-5 (obrázek 2A).
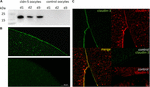
Obrázek 2. Detekce heterologně exprimovaných claudinů v oocytech Xenopus laevis. (A) Imunoblotová analýza těsného spojovacího proteinu claudin-5 v oocytech X. laevis tří zvířat (d1-d3). Lyzáty buněčné membrány byly podrobeny SDS-PAGE následované imunoblotem na PVDF membrány. Membrány byly inkubovány s primárními protilátkami a sekundárními peroxidázou konjugovanými protilátkami (n = 3). (B) imunofluorescenční barvení odhalilo specifické signály claudin-5 (zelené) v membránách oocytů všech oocytů injikovaných cRNA, zatímco u kontrol vstřikovaných vodou nebyly v konfokální mikroskopii detekovány žádné signály specifické pro claudin. Reprezentativní obrazy oocytů odvozených od tří zvířat. Stupnice: 50 µm. (C) imunofluorescenční barvení oocytů exprimujících claudin-5 a claudin-3 odhalilo specifické signály claudin-3 (zelené) a claudin-5 (červené) v membránách oocytů injikovaných cRNA, zatímco u kontrol vstřikovaných vodou nebyly detekovány žádné signály specifické pro claudin. Kolokalizace exprimovaných klaudinových proteinů v plazmatické membráně oocytů je odhalena dvojitým imunofluorescenčním barvením (žlutá). Měřítko: 10 µm.
pro vizualizaci exprimovaných proteinů v plazmatické membráně byla provedena imunohistochemická barvení a analyzována konfokální laserovou skenovací mikroskopií (obrázek 2B). Specifické signály byly detekovány a rovnoměrně distribuovány v plazmatické membráně oocytů exprimujících claudin-5. Podle imunoblotů nebyly v plazmatických membránách kontrolních oocytů detekovány žádné specifické signály.
po injekci cRNA byl tedy claudin-5 úspěšně exprimován a integrován do plazmatické membrány oocytů X. laevis.
Koexprese claudin-3 a claudin-5 v párech oocytů odhalila specifické signály pro claudin-5 (červená) a claudin-3 (zelená) v obou buňkách (obrázek 2C). Plazmatické membrány oocytů vykazovaly fúzi sousedních buněk poskytovanou přímou interakcí cldn3,5–cldn3,5 (žlutá).
v oocytech exprimujících Claudin-5
byly analyzovány plazmatické membrány oocytů a vizualizace těsných spojovacích řetězců byla úspěšná (obrázek 3). Freeze fracture elektronová mikroskopie ukázala skvrny morfologie pramenů v plazmatických membránách oocytů injikovaných claudinem-5 a organizace pramenů oocytů exprimujících claudin-5 byla vysoce organizovaná a úhlového tvaru (obrázek 3A). Pevné spojovací prameny byly primárně detekovány v protoplazmatickém (P-) povrchu membrány. Oocyty injikované claudinem-3 vykazovaly zaoblené vysoce organizované těsné spojovací prameny, jak bylo uvedeno výše (Vitzthum et al., 2019; obr. 3B). Freeze fracture elektronová mikroskopie claudin-3 a claudin-5 koexpressujících oocytů odhalila fibrily, které obě nesou vlastnosti claudin-3 a claudin-5. Fibrilová struktura koexprimujících oocytů se jevila jako zaoblená a složitá jako oocyty exprimující claudin-3, ale také diskontinuální a více šikmá, jak je ukázáno pro buňky exprimující claudin-5 (obrázek 3C). Kontrolní oocyty měly typický hladký povrch (obrázek 3D).
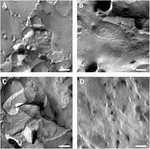
obrázek 3. Zmrazte zlomeninovou elektronovou mikroskopii. (A) zmrazená zlomenina elektronová mikroskopie odhaluje těsný spojovací protein cldn-5 jako síťovina úhlových diskontinózních fibril v řadách v oocytech Xenopus laevis. (B) zmrazená zlomenina elektronová mikroskopie odhaluje těsný spojovací protein cldn-3 jako síť zaoblených fibril v oocytech X. laevis. (C) Freeze fracture elektronová mikroskopie oocytů claudin-3 a claudin-5 coexpressing odhaluje fibrily, které obě nesou vlastnosti claudin-3 a claudin-5. (D) kontrolní oocyty vstřikované vodou mají hladký povrch. Reprezentativní obrazy oocytů odvozených od tří zvířat. Měřítko: 250 nm.
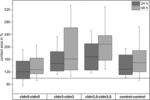
obrázek 4. Střední kontaktní oblasti seskupených kombinací oocytů cldn5–cldn5, cldn3–cldn3, cldn3,5–cldn3,5 A control–control 24 a 48 h po Shlukování v % počátečních kontaktních oblastí krátce po shlukování (n = 8-38).

obrázek 5. Kontaktní oblasti oocytů claudin-5, claudin-3 a coexpressing claudin-3 a claudin-5 v hydrostatickém tlakovém impulsu (HPI) po stabilizačním období a 30 min po HPI (n = 16-70, * p < 0,05, * * p < 0.01, Kruskal-Wallis následovaný korekcí Dunn-Bonferroni).
Paired oocyte Assay for Analysis of Claudin Trans-Interaction
všechny seskupené kombinace vykazovaly časově závislé zvýšení kontaktní plochy během měřeného časového období (obrázek 4 a tabulka 1).
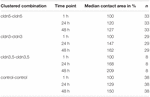
Tabulka 1. Kontaktní oblasti oocytů do 48 hodin po shlukování.
kontaktní plocha kontrolních oocytů vstřikovaných vodou se zvýšila na 129% po 24 hodinách a 150% po 48 hodinách. Seskupené páry oocytů exprimujících claudin-3 také vykazovaly zvýšení kontaktních oblastí na 147% (24 h) a 162% (48 h). Seskupené páry oocytů koexprimujících claudin-3 a claudin-5 vykazovaly kontaktní oblasti 168% (24 h) a 209% (48 h). Seskupené páry oocytů exprimujících samotný claudin-5 vykazovaly kontaktní oblasti 120% (24 h) a 127% (48 h). Proto byly kontaktní plochy ve všech testovaných kombinacích srovnatelné.
hydrostatický tlakový impulsní test odhaluje Klaudin-specifické spojení párů oocytů
v samostatném přístupu byly oocyty exprimující claudin-3 nebo claudin-5 nebo koexpresující oba klaudiny seskupeny po mechanické devitellinizaci. Oocyty byly napadeny použitím HPI a kontaktní oblasti byly měřeny a vypočteny 30 minut po provokaci a porovnány s počátečními oblastmi po 24hodinovém stabilizačním období (obrázek 5 A tabulka 2). Po výzvě hydrostatickým tlakem se kontaktní plocha kontrolních oocytů vstřikovaných vodou snížila na 89%. Seskupené páry oocytů exprimujících claudin-5, claudin-3 nebo koexprimujících claudin-3 a claudin-5 si zachovaly větší kontaktní oblasti (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Kontaktní oblasti smíšených kontrolních oocytů vstřikovaných vodou a oocytů exprimujících claudin (control-cldn5 a control–cldn3) se významně nelišily od kontrolních oocytů (93%, p = 0, 2900; 83%, p = 0, 4455).
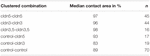
Tabulka 2. Hydrostatický tlakový impulsní test.
inkubace s Kaprátem
v pilotním inkubačním experimentu byly oocyty injikovány a spárovány v kombinacích buď exprimujících claudin-5 (cldn5-cldn5–, nebo injikovány vodou bez Rnázy jako kontroly (control-control). Páry byly inkubovány s konečnými koncentracemi kaprátu sodného 50, 100 nebo 500 µM. Inkubace párů oocytů s ORi sloužila jako referenční skupina. Oocyty byly seskupeny a po 24 hodinách stabilizace byla zahájena inkubace a byly měřeny kontaktní šířky 30, 60 a 120 minut po přidání (Doplňkový obrázek S1).
přidání ORi vedlo k počátečnímu snížení kontaktních oblastí jak v párech oocytů exprimujících klaudin, tak ve vodě vstřikovaných, které jsou dispergovány 60 nebo 120 minut po přidání. To je nastíněno parabolickým tvarem spojovací čáry mezi středními kontaktními oblastmi v čase (červené křivky v doplňkovém obrázku S1). Inkubace se 100 a 500 µM kaprátem sodíku však mírně zvýšila kontaktní plochy (100 µM) nebo silně (500 µM) 30 minut po přidání caprate z 5,1 × 105 na 5,2 × 105 µm2 a 4,3 × 105 na 4,9 × 105 µm2.
diskuse
v této studii jsme použili klasický model pro transportéry a modelování lidských nemocí (Tammaro et al., 2009; Nenni et al., 2019), oocyty X. laevis, pro hloubkovou analýzu interakce claudin-5 a funkčního příspěvku ke spojovacímu těsnění. Za tímto účelem byl zaveden nový přístup, zavedení HPI pro náročnou interakci v kontaktní oblasti seskupených Xenopusových oocytů.
Claudiny přispívají k silnějším adhezním vlastnostem
v souladu s předchozími výsledky Vitzthum et al. (2019), jednotlivé klaudiny exprimované v oocytech nevedly ke zvýšení interakčních kontaktních oblastí ve srovnání s kontrolními oocyty. Imunoblot a imunohistochemická vizualizace však prokázaly úspěšnou expresi a integraci do plazmatické membrány oocytů X.laevis. Dále použití konfokální laserové skenovací mikroskopie umožnilo přesnou lokalizaci exprimovaných klaudinů v plazmatické membráně, protože dírka blokovala fluorescenci mimo zaostření. Kvantifikace imunohistochemických signálů nebyla sledována, protože afinita protilátek pro vazbu jejich cílů se liší.
Vedula et al. (2009) použil aspirační techniku mikropipety ke zkoumání aspektů interakce claudin-claudin pomocí l-fibroblastů transfektovaných OKLUDINEM označeným GFP, cldn-1 a cldn-2. Separační síla potřebná k oddělení dvou buněk od sebe byla větší v transfekovaných buňkách cldn-1 a cldn-2 (∼2,8 a 2,3 nN). Ačkoli se tento přístup může zdát také slibný pro analýzu exprimujících oocytů claudin-claudin – interakcí, předběžné testy odhalily, že Oddělení seskupených oocytů není možné bez narušení plazmatických membrán oocytů.
proto byla jako nový přístup změřena síla spojení pomocí HPI. Ačkoli HPI neposkytuje kvantifikaci separační síly v absolutních hodnotách (např. v Newtonově), umožňuje rychlou a nákladově efektivní analýzu claudinovy interakce bez narušení jiných těsných spojovacích proteinů (např., okludin, tricelulin, JAM-A). Claudiny přispívají ke spojení párů oocytů, protože vykazují větší kontaktní plochu ve srovnání s oocyty vstřikovanými vodou po HPI. To naznačuje silnou homofilní trans-interakci mezi buňkami exprimujícími claudin.
vláknitá architektura je specifická pro jednotlivé claudiny (Colegio et al ., 2002). V elektronové mikroskopii se zlomeninou zmrazením bylo hlášeno, že claudin-3 sestavuje více zaoblené pletivo ve smyčkových tvarech v Xenopus oocytech (Vitzthum et al ., 2019; Obrázek 3B) zatímco v naší studii vytvořil claudin-5 síť více hranatou a uspořádanou v řadách. Snímky odhalily, že těsný spojovací protein claudin-5 tvoří síť fibril v diskontinózních, hranaté řádky v oocytech X.laevis. To je v souladu s řetězci claudin-5, o nichž je známo, že se vyskytují jako řetězce částic spojených s P-fází (Piontek et al., 2011). V našich experimentech se zdálo, že geometrický tvar fibril nemá žádný vliv na adhezní vlastnosti oocytů. V souladu s tím bylo hlášeno, že paracelulární rezistence nesouvisí s počtem fibrilů a vlastnostmi tvořícími fibrily (Colegio et al., 2002). Dále je prokázáno, že claudin-3 a claudin-5 mají podobnou schopnost pro homofilní trans-interakci v buňkách HEK293 (Piontek et al ., 2011).
tento model oocytů X. laevis, exprimující proteiny s jedním těsným spojením, umožňuje pozorování účinku látek, jako je kaprát sodný, na tvorbu kontaktních oblastí mezi seskupenými oocyty. Může proto poskytnout užitečný nástroj pro časově a nákladově efektivní screening látek ovlivňujících těsnou spojovací bariéru.
koncentrace kaprátu sodného 100 a 500 µM mohou mít ochranný účinek na oocyty exprimující claudin-5, což má za následek zvýšení kontaktních oblastí po 30 minutách inkubace.
Krug et al. (2013) prokázalo, že inkubace s kaprátem sodným vedla k rychlému a reverzibilnímu snížení transepiteliální rezistence v lidské střevní buněčné linii HT-29 / B6. Konfokální laserová skenovací mikroskopie navíc odhalila výraznou redukci claudinu-5 v buňkách HT-29 / B6 ošetřených laurátem mastné kyseliny se středním řetězcem (Dittmann et al ., 2014). První extracelulární smyčka claudinů (ECL1) je důležitá pro bariérové vlastnosti těsného spojení, zatímco druhá extracelulární smyčka (ECL2) se podílí na tvorbě řetězce trans-interakce (Piontek et al., 2008; Rossa et al., 2014; Greene a kol., 2019). Claudin – 5 pojiva zaměřená na ECL1 nebo ECL2 claudinu-5 mohou indukovat intracelulární vychytávání těsného spojovacího proteinu, čímž maří trans-interakce claudinu-5 v těsném spojovacím těsnění mezi sousedními buňkami a uvolňují paracelulární prostor (Hashimoto et al ., 2017).
předpokládali jsme tedy, že inkubace s kaprátem sodným by vedla ke snížení kontaktní plochy klastrovaných claudin-5 exprimujících oocytů X.laevis. Neočekávaně zvyšující se koncentrace kaprátu sodného (100 a 500 µM) vedly ke zvýšení kontaktních oblastí seskupených oocytů exprimujících claudin-5, což naznačuje ochranný účinek kaprátu sodného na těsné spojovací těsnění. Dále je popsán kaprát sodný, který indukuje kontrakci perijunkčního kruhu aktomyosinu a rozšiřuje paracelulární prostor (Lindmark et al ., 1998; Maher a kol., 2009). Tento účinek je založen na fosforylaci regulačního lehkého řetězce myosinu aktivací fosfolipázy C, která vede k štěpení fosfatidylinositolu 4,5-bisfosfátu (PIP2) na inositoltrifosfát (IP3)a diacylglycerol (Tomita et al ., 1995). Těsný spojovací komplex spojený lešenářským proteinem ZO-1 s aktinovým cytoskeletem je pak redistribuován z těsného spojení do cytoplazmy (Lindmark et al., 1998; Turner, 2000). Cytoarchitektura oocytu X. laevis je rozhodující pro cytoplazmatickou regionalizaci během oogeneze (Wylie et al ., 1985). Ačkoli před oplodněním, expresí genu tjp-1, je gen kódující ZO-1 exprimován pouze 1,9 TPM ve stádiích oocytů V-VI (Session et al ., 2016). Snížená interakce claudinů s cytoskeletálním lešením proto může vysvětlit neočekávaný výsledek inkubace caprate. Je rozsah budoucích studií k ověření mechanistického základu nálezu.
v literatuře byl však dříve popsán variantní účinek kaprátu sodného na paracelulární permeabilitu. V Peyerově náplastové tkáni odebrané ze střeva dospělých prasat byl zjištěn podobný posilující účinek. Claudin-5 byl významně zvýšen po inkubaci s 5 mM caprate. V této studii kaprát vedl k významně vyššímu transepiteliálnímu elektrickému odporu (TEER)v epitelu spojeném s folikuly (Radloff et al ., 2019).
závěr
na závěr heterologní exprese těsného spojovacího proteinu claudin-5 V X. laevis oocyty umožňují nový pohled na příspěvek jednotlivých klaudinů k interakci mezi buňkami a adhezním vlastnostem sousedních buněk. Použití modelu těsného spojení X. laevis pro claudin-5 tedy umožňuje analýzu komponent BBB v jednobuněčném modelu.
Prohlášení o dostupnosti dat
datové sady vytvořené pro tuto studii jsou k dispozici na vyžádání příslušnému autorovi.
etické prohlášení
ošetření zvířat bylo v souladu s pokyny německé legislativy se souhlasem úředníka pro dobré životní podmínky zvířat pro Freie Universität Berlin a pod správou Berlínského veterinárního zdravotního inspektorátu (Landesamt für Gesundheit und Soziales Berlin, povolení G0025 / 16).
autorské příspěvky
všichni autoři přečetli a schválili rukopis. NB a SA navrhli, plánovali a dohlíželi na experimenty a napsali rukopis. NB, LS, VC, RK a PF-B provedly experimenty a analýzu dat.
financování
tato studie byla financována Deutsche Forschungsgemeinschaft, Grant No. AM141 / 11-1 a H. Wilhelm Schaumann Stiftung.
střet zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
poděkování
Děkujeme Martinovi Grunauovi, Gisele Manzové, Katharině Söllig a Susanne Trappe za vynikající technickou pomoc. Uznáváme podporu Open Access publikační iniciativy Freie Universität Berlin.
doplňkový materiál
doplňkový materiál k tomuto článku lze nalézt online na adrese: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
obrázek S1 / kontaktní oblasti claudin-5 exprimujících párů oocytů v µm2 během inkubace s kaprátem sodným v různých koncentracích (n = 6-8) a oocyty vstřikovanými vodou jako kontroly (n = 5-7).
Amasheh, s., Dullat, s., Fromm, m., Schulzke, J. D., Buhr, H. J., and Kroesen, a. J. (2009). Zánět sliznice vaku má změněné těsné spoje indikující recidivu zánětlivého onemocnění střev. Int. J. Colorect. Dis. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Amasheh, s., Schmidt, T., Mahn, m., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Příspěvek claudinu-5 k bariérovým vlastnostem v těsných spojích epiteliálních buněk. Cell Tissue Res.321, 89-96. doi: 10.1007/s00441-005-1101-0
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C., and Anderson, J. M. (2002). Úloha claudinových extracelulárních domén v architektuře těsných spojů a selektivitě paracelulárního náboje. Mol Biol Cell. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, s., Gobbo, s., Montagna, L., Pederzoli, P., et al. (2009). Exprese klaudinů 5 a 7 rozlišuje pevné pseudopapilární od pankreatoblastomu, acinárních buněk a endokrinních nádorů pankreatu. Rána. J. Surg. Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, k., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). Kaprát sodný přechodně otevírá bariéry obsahující claudin-5 v těsných spojích epiteliálních a endotelových buněk. Molo. Pharme. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Dittmann, i., Amasheh, m., Krug, S. M., Markov, a. G., Fromm, M., and Amasheh, s. (2014). Laurát proniká paracelulární cestou pro malé molekuly ve střevním epiteliálním buněčném modelu HT-29 / B6 otevřením těsných spojů reverzibilním přemístěním claudinu-5. Pharme. Res.Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., and Wolburg, h. (2001). Zapojení choroidního plexu do zánětu centrálního nervového systému. Microsc. Res.Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::podpora-jemt13>3.0.co;2-5
CrossRef Plný Text / Google Scholar
Florian, P., Amasheh, s., Lessidrensky, m., Todt, i., Bloedow, a., Ernst, A., et al. (2003). Claudins v těsných spojích okrajových buněk stria vaskularis. Biochem. Biophys. Res.Co. 304, 5–10. doi: 10.1016/s0006-291x(03)00498-4
CrossRef Plný Text / Google Scholar
Furuse, m., Háta, m., Furuse, k., Yoshida, y., Haratake, a., Sugitani, y., et al. (2002). Těsné křižovatky založené na claudinu jsou zásadní pro epidermální bariéru savců: lekce od myší s deficitem claudin-1. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Garcia-Hernandez, v., Quiros, M., and Nusrat, a. (2017). Střevní epiteliální klaudiny: exprese a regulace při homeostáze a zánětu. Anna. Ny Acad. Věda. 1397, 66–79. doi: 10.1111 / nyas.13360
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Greene, C., Hanley, N., and Campbell, m. (2019). Claudin-5: strážce neurologické funkce. Tekutiny Barr. CNS 16: 4321.
Google Scholar
günzel, D., Amasheh, s., Pfaffenbach, s., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudin-16 ovlivňuje transkelulární sekreci Cl v MDCK buňkách. J. Physiol. Londe. 587, 3777–3793. doi: 10.1113 / jphysiol.2009.173401
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Hašimoto, y., Shirakura, k., Okada, y., Takeda, h., Endo, k., Tamura, M., et al. (2017). Claudin-5-pojiva zvyšují pronikání rozpuštěných látek přes hematoencefalickou bariéru v modelu savců. J. Expo. Další. 363, 275–283. doi: 10.1124/jpet.117.243014
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
koda, R., Zhao, L. N., Yaoita, e., Yoshida, y., Tsukita, s., Tamura, A., et al. (2011). Nová exprese claudinu-5 v glomerulárních podocytech. Cell Tissue Res.343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Konrad, m., Schaller, a., Seelow, D., Pandey, a. v., Waldegger, s., Lesslauer, A., et al. (2006). Mutace v těsném spojení genu claudin 19 (CLDN19) jsou spojeny s plýtváním ledvinovým hořčíkem, selháním ledvin a závažným očním postižením. Rána. J. Hum. Genete. 79, 949–957. doi: 10.1086/508617
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Krug, S. M., Amasheh, m., Dittmann, i., Christoffel, i., Fromm, M., and Amasheh, s. (2013). Kaprát sodný jako zesilovač permeace makromolekul přes tribuněčné těsné křižovatky střevních buněk. Biomateriály 34, 275-282. doi: 10.1016 / j. biomateriály.2012.09.051
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Leduc-Nadeau, a., Lahjouji, k., Bissonnette, P., Lapointe, J. Y., and Bichet, D. G. (2007). Vypracování nové techniky čištění plazmatických membrán z oocytů Xenopus laevis. Rána. J. Physiol. Buňka. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y., and Artursson, P. (1998). Zvýšení absorpce prostřednictvím intracelulární regulace propustnosti těsného spojení mastnými kyselinami se středním řetězcem v buňkách Caco-2. J. Expo. Další. 284, 362–369.
Google Scholar
Maher, s., Leonard, T. W., Jacobsen, J., and Brayden, D. J. (2009). Bezpečnost a účinnost kaprátu sodného při podpoře absorpce perorálního léčiva: od in vitro po kliniku. ADV. Drug Delivery. Rev. 61, 1427-1449. doi: 10.1016 / j. addr.2009.09.006
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
milatz, s., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin-3 působí jako těsnící složka těsného spojení pro ionty buď náboje a nenabitých rozpuštěných látek. Biochim. Biophys. Acta 1798, 2048-2057. doi: 10.1016 / j. bbamem.2010.07.014
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Mineta, k., Yamamoto, y., Yamazaki, y., Tanaka, h., Tada, y., Saito, k., et al. (2011). Předpokládané rozšíření rodiny claudin multigene. FEBS Lett. 585, 606–612. doi: 10.1016 / j. febslet.2011.01.028
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Nenni, M. J., Fisher, m. e., James-Zorn, C., Pells, T. J., Ponferrada, v., Chu, s., et al. (2019). Xenbase: usnadnění používání Xenopus k modelování lidských chorob. Před. Fyziol. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Nitta, T., Hata, m., Gotoh, s., Seo, y., Sasaki, h., Hashimoto, N., et al. (2003). Velikost-selektivní uvolnění hematoencefalické bariéry u myší s deficitem claudin-5. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Ohtsuki, s., Sato, s., Yamaguchi, h., Kamoi, m., Asashima, T., and Terasaki, T. (2007). Exogenní exprese claudinu-5 indukuje bariérové vlastnosti v kultivovaných kapilárních endotelových buňkách mozku potkanů. J. Buněčný Fyziol. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, s., Hartwig, J., Walter, M., et al. (2011). Objasnění principů molekulární organizace heteropolymerních těsných spojovacích pramenů. Buňka Mol. Life Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Piontek, J., Winkler, L., Wolburg, h., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Tvorba těsného spojení: determinanty homofilní interakce mezi klasickými claudiny. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Radloff, J., Cornelius, v., Markov, a. G., and Amasheh, s. (2019). Caprate moduluje funkci střevní bariéry v epitelu spojeném s prasečím Peyerem. Int. J. Mol. Věda. 20:1418. doi: 10.3390 / ijms20061418
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Reinhold, a. K., and Rittner, H. L. (2017). Bariérová funkce v periferním a centrálním nervovém systému-přehled. Pflug. Oblouk. Euro. J.Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Skládání a sestavování proteinu Claudin-3 a Claudin-5 do těsného spojení je řízeno nezachovávanými zbytky v segmentech transmembrány 3 (TM3) a extracelulární smyčky 2 (ECL2). J.Biol. Cheme. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Session, a. M., uno, y., Kwon, T., Hapman, J. A. C., Toyoda, a., Takahashi, S., et al. (2016). Vývoj genomu v allotetraploidní žábě Xenopus laevis. Příroda 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudins v plicních onemocněních. Resp. Rez.12:70.
Google Scholar
Suzuki, h., Nišizawa, T., Tani, k., Yamazaki, y., Tamura, a., Ishitani, R., et al. (2014). Krystalová struktura Claudina poskytuje vhled do architektury úzkých křižovatek. Věda 344, 304-307. doi: 10.1126 / věda.1248571
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Tammaro, P., Shimomura, K., and Proks, P. (2009). „Xenopus oocyty jako heterologní expresní systém pro studium iontových kanálů technikou patch-clamp“, v draselných kanálech: metody a protokoly, ed. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, s., Fromm, m., Assaf, C., et al. (2002). Pevné spojovací proteiny: nová třída integrálních membránových proteinů-exprese v lidské epidermis a v hacat keratinocytech. Arch Dermatol. 294, 14-18. doi: 10.1007/s00403-001-0290-y
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Tomita, m., Hayashi, M., and Awazu, s. (1995). Mechanismus zvyšující absorpci kaprátu sodného a dekanoylkarnitinu v buňkách Caco-2. J. Expo. Další. 272, 739–743.
Google Scholar
Turner, J. R. (2000). „Uvedení squeeze“ na těsném spojení: porozumění cytoskeletální regulaci. Sperma. Cell Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Van Itallie, C. M., and Anderson, J. M. (2006). Claudiny a epiteliální paracelulární transport. Annu. Rev. Physiol. 68, 403–429. doi: 10.1146 / annurev.fyziol.68.040104.131404
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Kvantifikační síly zprostředkované integrálními těsnými spojovacími proteiny v adhezi buněk a buněk. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutace v genu kódujícím těsné spojení claudin-14 způsobují autozomálně recesivní hluchotu DFNB29. Cela 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
CrossRef Plný Text / Google Scholar
Wolburg, h., Wolburg-Buchholz, k., Kraus, J., Rascher-Eggstein, G., Liebner, s., Hamm, S., et al. (2003). Lokalizace claudin-3 v těsných spojích hematoencefalické bariéry je selektivně ztracena během experimentální autoimunitní encefalomyelitidy a multiformního lidského glioblastomu. Acta Neuropatol. 105, 586–592. doi: 10.1007/s00401-003-0688-z
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Wylie, C. C., Brown, D., Godsave, s. F., Quarmby, J., and Heasman, J. (1985). Cytoskelet Xenopus oocytů a jeho role ve vývoji. J. Embryol. Expo. Morphe. 89, 1–15.
Google Scholar