- Úvod
- vícečetné funkce Chymázy
- Chymázy v žírných buňkách
- mnohočetné enzymatické funkce Chymázy
- enzymatická funkce Chymázy v NASH
- zapojení Chymázy do NASH zvířecích modelů
- účinek inhibitoru Chymázy na zvířecích modelech Nash
- účinek inhibitoru Chymázy na zvířecích modelech Nash
- mechanismus zánětu jater oslabený inhibitorem Chymázy
- mechanismus jaterní steatózy oslabený inhibitorem Chymázy
- mechanismus jaterní fibrózy oslabený inhibitorem Chymázy
- závěr
- autorské příspěvky
- Prohlášení o střetu zájmů
Úvod
nealkoholické tukové onemocnění jater (NAFLD)bylo uznáno jako nejčastější forma onemocnění jater (Angulo, 2002; Clark et al ., 2002). Nealkoholická steatohepatitida (NASH) napodobuje alkoholickou hepatitidu navzdory absenci pití v anamnéze (Ludwig et al., 1980). NAFLD a NASH jsou spojeny s metabolickým syndromem způsobeným obezitou, inzulínovou rezistencí, hyperlipidemií a hypertenzí. NAFLD je považován za nejčastější onemocnění jater a obvykle se projevuje jako jednoduchá steatóza jater (Tiniakos et al ., 2010). Naproti tomu NASH je charakterizován těžkou steatózou, lobulárním zánětem a fibrózou jater (Powell et al ., 1990; Bertot a Adams, 2016). Ačkoli mechanismus zodpovědný za vývoj NASH zůstává nejasný, Nash se navrhuje být způsoben procesem „vícenásobného zásahu“, přičemž steatóza jater je „prvním zásahem“ a následnými zásahy, jako je zánět, oxidační stres a endotoxiny (Tilg a Moschen, 2010). NASH úzce souvisí s metabolickým syndromem a několik klinických studií zkoumalo terapeutickou léčbu NASH zaměřením na příznaky diabetu, hyperlipidémie a hypertenze (Georgescu et al ., 2009; Park a kol., 2010; Mahady a kol., 2011). Nebyla však stanovena žádná běžně přijímaná terapeutická činidla.
Chymáza se může podílet na patogenezi jaterní fibrózy. Aktivita chymázy byla významně zvýšena v játrech pacientů s fibrózou nebo cirhózou a existovala významná korelace mezi hladinou chymázy a stupněm fibrózy (Komeda et al ., 2008). Ačkoli zvýšená aktivita chymázy nebyla hlášena u pacientů s NASH, byla pozorována na zvířecích modelech NASH (Tashiro et al ., 2010; Masubuchi a kol., 2013; Miyaoka a kol., 2017). Naproti tomu inhibice chymázy pomocí inhibitorů s nízkou molekulou vedla k významnému snížení zánětu, steatózy a fibrózy u modelů potkanů a křečků NASH (Tashiro et al ., 2010; Masubuchi a kol., 2013; Miyaoka a kol., 2017). Tato zjištění naznačují, že chymáza může být zapojena do zánětu, steatózy a fibrózy během vývoje a progrese NASH (Obrázek 1).
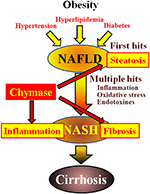
OBRÁZEK 1. NAFLD a NASH jsou spojeny s metabolickým syndromem obezitou, inzulínovou rezistencí, hyperlipidemií a hypertenzí. Předpokládá se, že NASH se vyvíjí procesem „vícenásobného zásahu“, s jaterní steatózou jako „prvním zásahem“ a následnými zásahy, jako je zánět, oxidační stres a endotoxiny, a je charakterizován těžkou steatózou, zánět, a fibróza. Chymáza se může podílet na progresi steatózy, zánětu a fibrózy v játrech.
vícečetné funkce Chymázy
Chymázy v žírných buňkách
Chymáza (EC 3.4.21.39) je exprimována v sekrečních granulích žírných buněk. Chymáza je produkována jako neaktivní prochymáza v sekrečních granulích a pro aktivaci vyžaduje dipeptidyl peptidázu I (DPPI). DPPI je thiol proteináza a její optimální pH je 6,0. Optimální hodnota pH je v souladu s navrženou funkcí DPPI pro aktivaci prochymázy, protože pH v sekrečních granulích je regulováno na pH 5,5 (De Young et al ., 1987) (Obrázek 2). Chymáza však nemá enzymatickou aktivitu v žírných buňkách při tomto pH, protože optimální pH pro chymázu je mezi 7 a 9 (Takai et al ., 1996, 1997). Po aktivaci granulí žírných buněk stimuly, jako je zánět a poranění, se chymáza uvolňuje a vykazuje enzymatickou funkci při optimálním pH 7,4 (Obrázek 2).
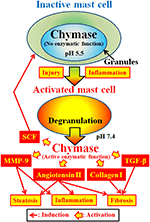
OBRÁZEK 2. Chymáza je uložena v sekrečních granulích neaktivních žírných buněk. PH v granulích je udržováno na pH 5,5, což je stav, kdy chymáza nemá enzymatickou aktivitu. Chymáza vykazuje své enzymatické funkce, jako je tvorba angiotensinu II, MMP-9, TGF-β, kolagenu I a SCF, po uvolnění z granulí žírných buněk po aktivaci zánětem a zraněním.
mnohočetné enzymatické funkce Chymázy
Chymáza je serinová proteáza a štěpí C-koncovou stranu proteinů po aromatických aminokyselinách, jako je Phe, Tyr a Trp obecně. Chymáza může štěpit vazbu Phe8-His9 ne bioaktivního peptidu angiotensinu I a tvořit jeho bioaktivní peptid angiotensinu II v savčích tkáních včetně člověka (Urata et al ., 1990; Takai a kol., 1996, 1997). Kromě toho chymáza enzymaticky štěpí prekurzory maticové metaloproteinázy (MMP)-9, transformující růstový faktor (TGF)-β a kolagen I na jejich aktivní formy (Kofford et al., 1997; Takai a kol., 2003; Furubayashi et al., 2008). Kromě toho může enzymatická funkce chymázy produkovat faktor kmenových buněk (SCF) enzymatickým štěpením neaktivní formy SCF vázané na membránu, která indukuje tvorbu zralých žírných buněk z nezralých žírných buněk stimulací receptoru c-kit (Longley et al., 1997). Chymáza má tedy více enzymatických funkcí, včetně aktivace angiotensinu II, MMP-9, TGF-β, kolagenu I a SCF (Obrázek 2).
enzymatická funkce Chymázy v NASH
Angiotensin II může podporovat steatózu a zánět jater zvýšením reaktivních druhů kyslíku (ROS) po stimulaci receptorů angiotensinu II u zvířecích NASH modelů (Hirose et al., 2007; Nabeshima a kol., 2009). Angiotensin II také indukoval jaterní fibrózu indukcí aktinu α-hladkého svalstva (SMA) v jaterních stelátových buňkách (HSCs) (Yoshiji et al., 2001). Bylo hlášeno, že MMP-9 indukuje infiltraci neutrofilů a makrofágů degradací mezibuněčných matic, jako je vitronektin a fibronektin, což vede k augmentaci zánětu (Medina et al ., 2006). U pacientů s NASH bylo pozorováno významné zvýšení exprese genu MMP-9 v játrech ve srovnání s normálními kontrolami (Ljumovic et al ., 2004). Nadměrná exprese TGF-β u transgenních myší vyvolala těžkou jaterní fibrózu prostřednictvím augmentace exprese genu prokolagenu I (Casini et al ., 1993). Je známo, že tvorba TGF-β i akumulace kolagenu i indukují jaterní fibrózu. Aktivace SCF indukuje zvýšení počtu žírných buněk a jeho enzymatická funkce může vést ke zvýšení aktivity chymázy ve fibrotických tkáních (Maruichi et al ., 2004). Tyto enzymatické funkce chymázy se mohou podílet na steatóze, zánětu a fibróze, které jsou všechny pozorovány v játrech pacientů s NASH a zvířecích modelech (Obrázek 2).
zapojení Chymázy do NASH zvířecích modelů
dieta s deficitem methioninu a cholinu (MCD) byla široce používána k indukci typického modelu NASH. U křečků krmených MCD dietou bylo v plazmě pozorováno významné zvýšení celkového bilirubinu, triglyceridů a kyseliny hyaluronové (Tashiro et al., 2010). Kromě toho byla v játrech pozorována akumulace zánětlivých buněk a zvýšení oblasti ukládání lipidů a fibrotické oblasti. V tomto Nashově modelu vyvolaném MCD dietou byla významně zvýšena aktivita jaterní chymázy a související faktory, jako je angiotensin II, MMP-9 a kolagen I (Tashiro et al., 2010; Masubuchi a kol., 2013). Nedávno byl vyvinut nový model NASH, ve kterém byly spontánně hypertenzní krysy náchylné k mrtvici 5/Dmcr (SHRSP5/Dmcr)krmeny dietou s vysokým obsahem tuku a cholesterolu (hfc) (Kitamori et al ., 2012). Tento model ukázal příznaky metabolického syndromu, o nichž se předpokládá, že se klinicky podobají příznakům pacientů NASH (Kitamori et al., 2012). V Nashově modelu vyvolaném dietou hfc byla pozorována hypertenze a hyperlipidemie a v játrech byla zjištěna závažná steatóza, fibróza a akumulace zánětlivých buněk (Miyaoka et al., 2017). Dále bylo pozorováno významné zvýšení aktivity chymázy spolu s MMP-9, TGF-β a kolagenem I v játrech (Miyaoka et al ., 2017). Zdá se tedy, že existuje úzký vztah mezi chymázou a NASH patogenezí ve zvířecích modelech NASH.
účinek inhibitoru Chymázy na zvířecích modelech Nash
účinek inhibitoru Chymázy na zvířecích modelech Nash
inhibitor chymázy s nízkou molekulou významně oslabil aktivitu chymázy a snížil hladiny angiotensinu II, MMP-9 a kolagenu I v játrech v modelu MCD krmeném křečkem NASH, když bylo podávání inhibitoru zahájeno současně s dietou MCD (Tashiro et al ., 2010; Masubuchi a kol., 2013). Inhibitor chymázy významně zabránil jaterní steatóze, fibróze a akumulaci zánětlivých buněk v tomto Nashově modelu (Tashiro et al ., 2010; Masubuchi a kol., 2013). Předpokládá se, že oxidační stres hraje roli v teorii „vícenásobného zásahu“ vývoje NASH a augmentace markeru oxidačního stresu malondialdehyd byl významně oslaben v játrech inhibitorem chymázy (Masubuchi et al., 2013). V modelu Nash vyvolaném stravou křečků MCD vykazoval inhibitor chymázy zlepšující účinek, když byl podáván v zavedené NASH (Masubuchi et al ., 2013). Stupně steatózy i fibrózy v játrech byly sníženy ve srovnání s před podáním inhibitoru chymázy (Masubuchi et al ., 2013).
v játrech modelu NASH vyvolaného hypertenzním krysím hfc dietou tlumil inhibitor chymázy s nízkou molekulou hladiny chymázy, stejně jako MMP-9, TGF-β a kolagen I, což jsou všechny faktory spojené s chymázou (Miyaoka et al., 2017). Inhibitor chymázy významně oslabil jaterní steatózu a fibrózu a snížil myeloperoxidázu jako marker zánětu, zejména infiltrace neutrofilů (Miyaoka et al., 2017). V tomto modelu vyvolaném dietou HFC bylo přežití skupiny léčené placebem 0% 14 týdnů po zahájení stravy HFC a bylo výsledkem závažného selhání jater (Miyaoka et al., 2017). Skupina léčená inhibitorem chymázy, ve které byly krysy léčeny inhibitorem chymázy bezprostředně po zahájení stravy HFC, však vykazovala 100% přežití po 14 týdnech. Navíc byla hlášena 50% míra přežití u potkanů léčených inhibitorem chymázy počínaje 8 týdny po zahájení krmení dietou HFC, kdy byla stanovena NASH (Miyaoka et al., 2017).
proto by inhibitory chymázy mohly být užitečnými látkami pro prevenci a zlepšení NASH na zvířecích modelech. Na druhé straně angiotensin II také nepřímo podporuje zánět jater, steatózu a fibrózu zvýšením exprese genu MMP-9 a TGF-β. MMP-9 i TGF-β jsou úzce zapojeny do patogeneze NASH, ale tyto faktory nejsou nutně indukovány pouze angiotensinem II (Takai et al ., 2010). Jiné faktory než stimulace angiotensinem II přispívají ke zvýšení exprese genu MMP-9 a TGF-β (Takai et al ., 2010). V takových případech blokátor receptoru angiotenzinu II (ARB) není schopen tlumit účinky MMP-9 a TGF-β; inhibitor chymázy by však mohl mít oslabující účinky prostřednictvím inhibice aktivace MMP-9 a TGF-β, což naznačuje potenciální léčebný průběh pro prevenci progrese NASH.
mechanismus zánětu jater oslabený inhibitorem Chymázy
inhibitor Chymázy byl schopen snížit zánět v modelech NASH vyvolaných dietou křečků MCD a potkanů hfc (Tashiro et al ., 2010; Masubuchi a kol., 2013; Miyaoka a kol., 2017). Léčba inhibitorem chymázy významně oslabila aktivitu chymázy v játrech a snížila hladiny angiotensinu II a MMP-9 (Tashiro et al., 2010; Masubuchi a kol., 2013; Miyaoka a kol., 2017). V HSC indukuje angiotensin II tvorbu ROS, jako je peroxid vodíku a superoxid, aktivací oxidázy nikotinamidadenin dinukleotid fosfátu (NADPH) (De Minicis a Brenner, 2007). Inhibitor chymázy vedl ke snížení genové exprese NADPH oxidázové složky Rac-1 a markeru oxidačního stresu malondialdehyd kromě snížení hladin angiotensinu II v modelu Nash indukovaném křečkem MCD (Masubuchi et al ., 2013). Angiotensinem II indukovaná augmentace ROS podporovala expresi genu MMP-9 u neutrofilů a makrofágů (Yaghooti et al ., 2011; Kurihara a kol., 2012). Proto inhibitor chymázy přímo inhibuje aktivaci proMMP-9 na MMP-9 a nepřímo snižuje expresi genu MMP-9 prostřednictvím sníženého angiotensinu II. MMP-9 štěpí složky extracelulární matrice, jako je vitronektin a fibronektin, vede k rozpadu jaterní integrity a indukuje infiltraci makrofágů a neutrofilů (Medina et al ., 2006). V Nashově modelu vyvolaném dietou hfc bylo pozorováno významné zvýšení exprese myeloperoxidázy v makrofágech a neutrofilech v játrech a bylo sníženo inhibitorem chymázy (Miyaoka et al ., 2017). Mechanismus zánětu oslabený inhibitorem chymázy proto může být závislý na snížení hladin angiotensinu II a MMP-9 v játrech.
mechanismus jaterní steatózy oslabený inhibitorem Chymázy
Angiotensin II může ovlivnit jaterní steatózu prostřednictvím produkce ROS. U myší HSC inhibitor NADPH oxidázy významně snížil produkci ROS a ARB zpomalil vývoj jaterní steatózy prostřednictvím útlumu produkce ROS (Hirose et al ., 2007; Guimarães et al., 2010). V Nashově myším modelu indukovaném MCD dietou byl pozorován významný útlum steatózy u myší s deficitem receptoru angiotenzinu II (Nabeshima et al ., 2009). Experimenty in vivo I in vitro ukázaly, že exprese genu angiotensin II upregulovaný protein vázající regulační prvek sterolu (SREBP)-1c a syntáza mastných kyselin (FAS), které jsou důležitými faktory v regulaci lipogeneze, po augmentaci ROS (Kim et al., 2001; Hongo et al., 2009). Naproti tomu ARB atenuovala jaterní steatózu spolu s downregulací genové exprese SREBP-1c a FAS prostřednictvím útlumu ROS v myším Nashově modelu (Kato et al ., 2012). V modelu Nash vyvolaném stravou křečků MCD bylo pozorováno významné útlum exprese genu SREBP-1c a FAS po léčbě inhibitorem chymázy s nízkou molekulou (Masubuchi et al ., 2013). Proto může být ameliorativní mechanismus jaterní steatózy inhibitorem chymázy závislý na snížení produkce ROS prostřednictvím snížené generace angiotensinu II v játrech.
mechanismus jaterní fibrózy oslabený inhibitorem Chymázy
Chymáza může být úzce spojena s progresí tkáňové fibrózy, protože přispívá k tvorbě TGF-β z ne bioaktivního prekurzoru TGF-β a je známo, že TGF-β silně indukuje růst fibroblastů (Takai et al., 2003; Oyamada a kol., 2011). Je známo, že TGF-β hraje ústřední roli v progresi fibrózy u pacientů s NASH prostřednictvím aktivovaného HSC (Williams et al., 2000). Inhibice funkce TGF-β prostřednictvím genové exprese a signalizace vedla ke zlepšení jaterní fibrózy v experimentálních modelech (George et al ., 1999; Arias et al., 2003). V Nashově modelu vyvolaném dietou u potkanů hfc vedlo útlum aktivity chymázy inhibitorem chymázy ke snížení hladiny TGF-β a fibrotické oblasti v játrech (Miyaoka et al., 2017). Snížení TGF-β inhibitorem chymázy tedy může přispět k prevenci jaterní fibrózy.
Angiotensin II se může také podílet na indukci jaterní fibrózy. Angiotensin II indukuje kontrakci a proliferaci HSC a také indukuje genovou expresi TGF-β ve fibroblastech in vitro (Kagami et al ., 1994; Bataller et al., 2000). Jak hladiny TGF-β, tak stupeň akumulace kolagenu a fibrotické léze byly pozorovány ligací žlučovodů u myší divokého typu, tyto však byly oslabeny u myší s deficitem receptoru angiotensinu II (Yang et al., 2005). V krysím Nashově modelu ARB také oslabila jaterní fibrózu snížením exprese genu TGF-β (Hirose et al., 2007). Může také existovat vztah mezi angiotensinem II a jaterní fibrózou jinou než expresí TGF-β genu indukovanou angiotensinem II. U pacientů s chronickou hepatitidou C ARB snížila expresi kolagenového genu prostřednictvím exprese genu Rac-1 (Colmenero et al ., 2009). HSC jsou uznávány jako hlavní produkující buňky kolagenu v játrech a augmentace v expresi aktinu α-hladkého svalstva (SMA) v HSC silně indukuje depozici extracelulární matrice, včetně kolagenu I (De Minicis a Brenner, 2007). Angiotensin II může indukovat expresi genu α-SMA u potkaních HSC. Naproti tomu blokáda angiotensinu II vede k útlumu jaterní fibrózy spolu se snížením α-SMA (Yoshiji et al ., 2001). I když nebyly hodnoceny u pacientů s NASH, jak chymáza, tak angiotensin II-tvořící aktivity byly významně rozšířeny ve fibrotických oblastech jater od pacientů s cirhózou a byly pozorovány významné korelace mezi chymázou, aktivitou tvořící angiotensin II a jaterní fibrózou (Komeda et al., 2008). V modelu jaterní cirhózy vyvolané křečkem tetrachloridem bylo pozorováno významné zvýšení aktivity tvořící chymázu a angiotensin II, které byly významně oslabeny spolu s jaterní cirhózou po léčbě inhibitorem chymázy s nízkou molekulou (Komeda et al ., 2010).
tranilast stabilizátoru žírných buněk by mohl inhibovat aktivaci žírných buněk, blokovat uvolňování chymázy a tím zabránit rozvoji jaterní fibrózy u krysího diabetu a Nashova modelu vyvolaného dietou hfc (uno et al ., 2008). Chymáza podporuje proliferaci žírných buněk aktivací SCF svou enzymatickou funkcí (Longley et al ., 1997). V Nash zvířecích modelech inhibitor chymázy snížil zvýšení počtu žírných buněk v játrech, což mělo za následek sníženou aktivitu chymázy po přímé inhibici inhibitorem chymázy a nepřímé snížení exprese chymázy v žírných buňkách (Masubuchi et al ., 2013; Miyaoka a kol., 2017).
proto může inhibitor chymázy přispívat k prevenci jaterní fibrózy inhibicí aktivace TGF-β inhibicí chymázy a / nebo útlumem hladiny TGF-β snížením angiotensinu II a proliferace žírných buněk.
závěr
metabolický syndrom zahrnující obezitu, inzulínovou rezistenci, hyperlipidemii a hypertenzi úzce souvisí s vývojem NASH a byly provedeny studie antidiabetických, anti-hyperlipidemických a antihypertenzivních látek pro léčbu NASH. Koncept těchto látek je zmírnit příznaky metabolického syndromu (Georgescu et al ., 2009; Park a kol., 2010; Mahady a kol., 2011). Předchozí zprávy prokázaly, že inhibitor chymázy zmírňuje zánět a fibrózu bez ovlivnění hladin glukózy v krvi a lipidů a krevního tlaku u zvířecích modelů diabetu, hyperlipidémie a hypertenze (Inoue et al ., 2009; Takai a kol., 2014; Zhang et al., 2016). Koncept inhibice chymázy je proto přímo zmírnit zánět jater a fibrózu NASH. Navrhujeme, že metabolický syndrom zaměřený na inhibitor chymázy je potenciálně silnou strategií pro útlum Nash progrese.
autorské příspěvky
ST a DJ: napsal rukopis. Oba autoři přečetli a schválili konečný rukopis.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.