navzdory dramatickému poklesu morbidity a mortality související s virem lidské imunodeficience typu 1 (HIV-1) po objevení inhibitorů proteázy a nástupu kombinované vysoce aktivní antiretrovirové terapie (ARV) v polovině 90.let mnoho pacientů stále selhávalo kvůli rezistenci a/nebo nesnášenlivosti (1). Bylo zřejmé, že je zapotřebí více ARV působících na různé kroky v životním cyklu viru, aktivních proti rezistentním virům a lépe tolerovaných. Demonstrace klíčové role chemokinových receptorů CCR5 a CXCR4 ve vstupu HIV-1 vyvolala zájem o tento proces jako nový cíl ARV (2, 3). CCR5 je ko-receptor pro většinu kmenů HIV-1 a tyto viry se nazývají CCR5 tropic (R5). Virové kmeny, které používají CXCR4, se nazývají CXCR4-tropic (X4), zatímco kmeny, které mohou používat oba receptory, jsou dual-tropic (4). Virus od pacienta může často obsahovat směsi kmenů R5, X4 a dual-tropic, souhrnně nazývané CXCR4.
klíčová role CCR5 v vstupu HIV-1 spolu s demonstrací, že jedinci, kteří byli homozygotní pro deleci 32 bází v genu CCR5 (CCR5Δ32) a následně nevyjadřují funkční CCR5, byli vysoce chráněni před infekcí R5 HIV-1, zaměřili pozornost na CCR5 jako atraktivní cíl (5). Ačkoli některé studie prokázaly jemné účinky mutace CCR5Δ32 na imunitní funkci, jako je snížené skóre zánětu u jedinců infikovaných hepatitidou C a zotavení z hepatitidy B u heterozygotů; zatímco homozygoti jsou náchylnější k klíšťové encefalitidě a závažnému onemocnění Západonilským virem, tito jedinci trpí malými zjevnými nepříznivými účinky na jejich zdraví (5, 6). To spolu se skutečností, že členové nadrodiny receptorů vázaných na G protein jsou často sledovatelní k vývoji silných, selektivních a perorálně biologicky dostupných léků (7), vedlo k zahájení programů objevování ligandu CCR5 několika skupinami, včetně týmu z Pfizer Global Research and Development se sídlem v sendvičových laboratořích ve Velké Británii.
Maravirok (UK-427,857, MVC) byl objeven pomocí vysoce výkonného screeningu knihovny sloučenin Pfizer pomocí testu chemokinové radioligandové vazby. Nejslibnější sloučenina z screeningového procesu byla optimalizována pro účinnost proti receptoru, antivirovou aktivitu, Farmakokinetické vlastnosti a selektivitu proti lidským buněčným cílům díky velkému úsilí o léčivou chemii, ve kterém bylo charakterizováno téměř 1000 molekul (7). MVC se váže v transmembránové kapse CCR5 a je funkčním antagonistou s pomalým posunem, který zabraňuje internalizaci (7, 8). Má silnou antivirovou aktivitu proti širokému spektru izolátů HIV-1 (7). Spolu se svým vynikajícím předklinickým bezpečnostním profilem a přijatelnou farmakokinetikou to vedlo k tomu, že byl v prosinci 2000 nominován na klinického kandidáta [7].
vždy bylo jasné, že klinický vývoj antagonistů CCR5 bude náročný, protože by to byly první léky ARV zaměřené na hostitele, a proto jsme se odvážili na nezmapované území. Aby se předešlo klíčovým problémům, byl velmi brzy po zahájení programu discovery založen tým klinického vývoje a já jsem byl přijat do vedení týmu raného vývoje, který se připojil k Pfizer v únoru 1999. Identifikovali jsme několik klíčových výzev, které je třeba řešit při navrhování klinického programu, kromě prokázání bezpečnosti a účinnosti. První z nich bylo, že neexistuje žádný komerčně dostupný, klinicky ověřený test k identifikaci pacientů infikovaných R5 HIV-1. To bylo kritické, protože MVC je aktivní pouze proti kmenům R5 HIV-1 (7). Za druhé, navzdory zjevně zdravému fenotypu jedinců s CCR5Δ32 (5, 6) přetrvávaly obavy ohledně bezpečnosti dlouhodobé expozice antagonistům CCR5, protože blokování CCR5 se může lišit od vrozené absence receptoru CCR5, kde imunitní systém dozrál v nepřítomnosti CCR5 a mohly se vyvinout kompenzační mechanismy. Konečně u jedinců infikovaných HIV-1 se incidence kmenů HIV-1 užívajících CXCR4 zvyšuje s progresí onemocnění a snížením počtu buněk CD4 (9), ačkoli nebyla prokázána žádná příčinná souvislost mezi virem používajícím CXCR4 a deplecí buněk CD4. To vedlo k obavám, že selektivní tlak antagonisty CCR5 může vést populaci viru k použití CXCR4 a vést k poklesu buněk CD4.
Fáze 1 studie s jednorázovou a opakovanou dávkou u zdravých dobrovolníků provedené v roce 2001 a v první polovině roku 2002 prokázaly, že MVC je Bezpečný a dobře snášen při opakovaných dávkách až do 300 mg dvakrát denně( BID), měl farmakokinetický profil kompatibilní s perorálním dávkováním jednou denně (QD) nebo BID, mohl být kombinován s jinými ARV a že dávky ≥100 mg BID vedly k expozici vyšší než geometrický průměr antivirotik IC90 in vitro (7, 10). Pro prokázání důkazu farmakologie byla saturace receptoru CCR5 měřena pomocí internalizačního testu ex vivo MIP-1β na míru. Byla prokázána nasycení závislé na dávce s dávkami ≥25 mg QD, které vedly k téměř maximálním hladinám nasycení, což zvyšuje zajímavou možnost, že MVC může být účinná v dávkách až 25 mg QD. Nasycení receptorem zůstalo vysoké po několik dní po vysazení dávky, což odráželo pomalý posun od receptoru in vivo (11).
oba jsme byli nadšeni a povzbuzeni daty fáze 1 a rychle jsme přešli na program fáze 2a proof of concept. Pacienti infikovaní HIV-1 byli vyšetřeni pouze na přítomnost viru R5 pomocí nového fenotypového testu tropismu (Trofile®, Monogram Biosciences, South San Francisco, CA, USA) a dostávali MVC jako monoterapii po dobu 10 dnů (12). V této studii byla měřena saturace receptoru CCR5, aby se vyhodnotila možnost použití jako biomarkeru pro účinnost a terapeutické monitorování. Velmi očekávané údaje splnily naše očekávání a prokázaly, že dávky ≥100 mg dvakrát denně vedly k průměrnému maximálnímu snížení HIV-1 RNA o >1.5LOG10 (obrázek 1A), u všech pacientů s výjimkou jednoho pacienta s virem X4, který byl chybně zahrnut, bylo dosaženo snížení HIV-1 RNA alespoň o 1log10 (12). To nám dalo jistotu, že test správně identifikoval pacienty, kteří pravděpodobně reagují na MVC. HIV-1 RNA nadir se objevil 1-5 dní po poslední dávce MVC, což odpovídá prodloužené saturaci receptorů, jak bylo prokázáno ve studiích fáze 1 (12). U všech dávek kromě 25 mg QD receptoru byla po celou dobu podávání pozorována saturace >80%. Nebyla však žádná korelace mezi snížením virové zátěže a stupněm nasycení receptorem. Nejpravděpodobnějším vysvětlením je, že pro antivirovou účinnost je vyžadována velmi vysoká úroveň nasycení receptorem a inherentní variabilita testu neumožňuje diferenciaci do této míry (11, 12).
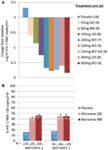
Obrázek 1. Maravirok proof of concept a výsledky účinnosti fáze 3. A) průměrná maximální změna HIV-1 RNA oproti výchozí hodnotě u pacientů léčených MVC v monoterapii. Na základě údajů fáze 1 a modelování a simulace byly vybrány dávky v rozmezí od 25 mg QD do 300 mg dvakrát denně (včetně 150 mg dvakrát denně a nalačno). Byla hodnocena HIV-1 RNA, bezpečnost a farmakokinetika MVC (12). B) motivujte 1 a 2-podíl pacientů, kteří dosáhli HIV-1 RNA <50 kopií/mL ve 48. týdnu. Pacienti infikovaní HIV-1 se zkušenostmi R5 HIV-1 a Triple class a / nebo rezistencí byli randomizováni do skupiny léčené MVC QD nebo BID nebo placebem v kombinaci s optimalizovaným antiretrovirovým režimem na pozadí (OBT). P < 0.001 (13, 14).
data fáze 2a vyvolala vzrušení v celé společnosti a my jsme chtěli pokročit v programu klinického vývoje co nejrychleji, protože byla vysoká lékařská potřeba nových ARV k léčbě pacientů bez nebo omezených možností léčby. Rozsáhlý program fáze 1 (včetně více studií lékových interakcí) a široké rozmezí dávek hodnocené ve studiích fáze 2a proof of concept, spolu s modelováním a simulací, nám poskytly velmi dobré pochopení pravděpodobné účinné dávky MVC v kombinaci s jinými ARV. Byli jsme proto schopni přejít přímo do fáze 3 studie účinnosti hodnotící MVC v dávce 300 mg (nebo ekvivalentní, v závislosti na současně podávaných lécích) QD a BID, aniž by bylo nutné provádět samostatné studie fáze 2b v rozmezí dávek, čímž se významně zkracuje časová osa vývoje. Koncem roku 2004 jsme zahájili čtyři velké studie; MOTIVATE 1 a 2 u pacientů již dříve léčených s R5 HIV-1 (13, 14), MERIT (studie fáze 3 s zavedením fáze 2b) u pacientů dosud neléčených s R5 HIV-1 (15) a studie a4001029, studie bezpečnosti fáze 2b u pacientů již dříve léčených s tropickým virem bez CCR5 (CXCR4 nebo nefenotypovatelný virus) (16).
jednalo se o masivní podnik s 4794 pacienty vyšetřenými na více než 200 místech v USA, Kanadě, Evropě, Austrálii, Jižní Africe, Mexiku a Argentině. Dva další antagonisté CCR5 s malou molekulou (aplavirok a vicrivirok) byli v této době hodnoceni také ve studiích fáze 2b (17, 18). Kromě obvyklých výzev při zvládání velkých klinických studií jsme byli hozeni dvěma křivkami, první z nich bylo vysazení aplaviroku z důvodu idiosynkratické hepatotoxicity. Spekulovalo se, že by to mohl být třídní účinek antagonistů CCR5, protože knockoutové myši CCR5 jsou citlivější na konkanavalin-zprostředkovanou hepatoxicitu (17). Navíc se u pacienta ve studii MERIT vyvinula závažná hepatotoxicita. Údaje naznačovaly, že pravděpodobně souvisely s isoniazidem nebo kotrimoxazolem, ale přispívající úloha pro MVC nemohla být vyloučena (15). Důkladný přehled všech údajů pro důkaz hepatotoxicity pro MVC a vysoká úroveň bdělosti pro jakékoli signály, nenalezl žádné důkazy pro systematické zvýšení jaterních enzymů nebo jiných markerů hepatotoxicity. Krátce poté se objevily obavy ohledně možného zvýšeného rizika některých malignit po výskytu lymfomu u čtyř pacientů léčených vicrivirokem ve studii ACTG5211 (18). Zpočátku existovaly obavy, že by to mohl být třídní účinek založený na imunitně-modulačním potenciálu antagonistů CCR5,ale přezkoumání údajů z jiných studií vicriviroku a probíhajících studií MVC tuto teorii nepodporovalo (18).
údaje z MOTIVATE 1 a 2 a A4001029 byly k dispozici před zásluhami, protože doba trvání studie je obvykle kratší pro studie u pacientů již dříve léčených. S velkým nadšením jsme očekávali průběžné analýzy 24. týdne pro studie MOTIVATE v říjnu 2006 a byli jsme nadšeni, když jsme zjistili, že významně více pacientů užívajících MVC mělo HIV-1 RNA <50 kopií / mL (klíčový marker účinnosti) ve srovnání s pacienty užívajícími placebo OBT. To bylo potvrzeno údaji z 48. týdne, které prokazují trvanlivost odpovědi (obrázek 1B) (13, 14). Naproti tomu u pacientů s tropickým HIV-1 bez CCR5, kteří dostávali MVC ve studii a4001029, se nezdálo, že by získali významný virologický přínos ve srovnání s placebem (16). Analýza údajů o bezpečnosti nevyvolala žádné významné obavy. Konkrétně nebyl prokázán žádný nepříznivý účinek na imunitní funkci, bez zvýšení epizod infekce nebo malignit u pacientů léčených MVC. Hodnocení virového tropismu při selhání prokázalo, že >50% pacientů, kteří selhali při léčbě MVC, mělo při selhání virus užívající CXCR4, ale nebyl prokázán škodlivý účinek na počty buněk CD4 (14). Virologické hodnocení prokázalo, že virus užívající CXCR4, který se objevil pod selektivním tlakem MVC, pocházel z již existující menšinové populace a nevznikl de novo (19). Celkově tyto výsledky jasně prokázaly přínos MVC v léčbě již dříve léčených pacientů s R5 HIV-1. Nejvyšší úsilí týmu vedlo k předložení dokumentace k registraci v USA i Evropě pouze 2 měsíce poté, co byly k dispozici průběžné údaje. MVC (300 mg BID) obdržel schválení k použití (v kombinaci s jinými ARV) v USA v srpnu 2007, pouze 6.5 let poté, co byl nominován jako kandidát na klinický vývoj. O měsíc později byl také schválen pro použití v této populaci v EU.
analýza studie MERIT ve 48. týdnu byla zklamáním, protože MVC plus zidovudin/lamivudin (HIV-1 RNA <50 kopií / mL, 65,3%) nesplňovaly předem stanovená kritéria pro non-inferioritu (dolní hranice 1stranné 97,5 intervalu spolehlivosti pod -10%) na efavirenz plus zidovudin/lamivudin (HIV – 1 RNA <50 kopií/mL, 69,3%) (15). Pacienti v této studii však byli vyšetřeni na virus R5 pomocí původního testu Trofile. Tento test byl mezitím vylepšen, aby byl citlivější pro detekci menšinových populací viru používajícího CXCR4. Všechny screeningové vzorky pro pacienty v zásluhách byly následně znovu testovány pomocí vylepšeného testu a post hoc analýzy provedené pouze u pacientů, kteří měli virus R5 pouze citlivějším testem. V této analýze byla míra odpovědi u MVC 68,3% a u efavirenzu 68,5%, přičemž dolní hranice 97,5% intervalu spolehlivosti byla vyšší než -10% (15). Na základě těchto údajů byl MVC také schválen pro použití u dosud neléčených pacientů v listopadu 2009 americkým Úřadem pro kontrolu potravin a léčiv.
MVC se nejen ukázalo jako cenný doplněk ke stále rostoucímu ARV drogovému armamentáriu, ale údaje z těchto studií zlepšily naše chápání tropismu HIV a vztahu mezi tropismem a progresí onemocnění. Pro mě osobně to představovalo období velkého vzrušení a spokojenosti, jak jako lékař, tak vědec.
autorské příspěvky
ER vypracovala tento rukopis na základě své osobní zkušenosti jako členka vývojového týmu MVC. Všechny údaje byly zveřejněny v plném rozsahu jinde. Všechny studie byly provedeny v souladu se zásadami Helsinské deklarace a se všemi pokyny Mezinárodní konference o harmonizaci správné klinické praxe a místními regulačními a právními požadavky. Všechny studie byly schváleny nezávislými etickými komisemi a všichni pacienti dali písemný informovaný souhlas.
Prohlášení o střetu zájmů
Elna Van Der Ryst byla zaměstnankyní Pfizer Global Research and development v době vývoje MVC. V současné době poskytuje poradenské služby společnosti Pfizer.
poděkování
chtěl bych poděkovat kolegům z Pfizer, kteří přispěli do programu MVC discovery and development program, jakož i vyšetřovatelům a pacientům, kteří se účastnili klinických studií.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF, et al. Prevalence antiretrovirové rezistence ve Spojených státech. AIDS (2004) 18: 1393-401. diváci: 10.1097 / 01.AIDS.0000131310.52526.c7
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. Vstup HIV-1 do buněk CD4+ je zprostředkován CHEMOKINOVÝM receptorem CC-CKR-5. Příroda (1996) 381: 667-73. doi: 10.1038 / 381667a0
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. Vstupní kofaktor HIV-1: funkční cDNA klonování sedm transmembránového receptoru spřaženého s G proteinem. Věda (1996) 272: 872-7. doi: 10.1126 / věda.272.5263.872
CrossRef Plný Text / Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Nová klasifikace pro HIV-1. Příroda (1998) 391: 240. doi:10.1038/34571
CrossRef Plný Text / Google Scholar
5. Samson M, Libert F, DORANZ BJ, Rucker J, Liesnard C, Farber C, et al. Rezistence na infekci HIV-1 U bělošských jedinců nesoucích mutantní alely genu pro chemokinový receptor CCR5. Příroda (1996) 382: 722-5. doi: 10.1038 / 382722a0
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. Klinické použití inhibitorů CCR5 u HIV i mimo něj. J Transl Med (2011) 9 (Suppl 1): S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney M, et al. Maravirok (UK-427,857), silný, perorálně biologicky dostupný a selektivní inhibitor malých molekul chemokinového receptoru CCR5 se širokospektrální aktivitou viru lidské imunodeficience typu 1. Antimikrobní Látky Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Plný Text / Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri S, et al. Molekulární interakce CCR5 s hlavními třídami antagonistů anti-HIV-1 CCR5 s malými molekulami. Mol Pharmacol (2008) 73: 789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Chemokinové receptory jako Ko-receptory HIV-1: role při vstupu viru, tropismu a nemoci. Annu Rev Immunol (1999) 17: 657-700. doi: 10.1146 / annurev.immunol.17.1.657
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
10. Abel S, van der Ryst E, Rosario MC, James I, Ridgway C, Medhurst C, et al. Hodnocení farmakokinetiky, bezpečnosti a tolerance maraviroku, nového antagonisty CCR5, u zdravých dobrovolníků. Br J Clin Pharmacol (2008) 65 (S1): 5-18. doi: 10.1111 / j. 1365-2125. 2008. 03130.x
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel S, et al. Farmakokineticko-farmakodynamická analýza obsazení receptoru CCR5 maravirokem u zdravých subjektů a HIV pozitivních pacientů. Br J Clinton (2008) 65 (S1): 86-94. doi: 10.1111 / j. 1365-2125. 2008. 03140.x
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
12. Fätkenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski S, Hoepelman AIM, et al. Účinnost krátkodobé monoterapie maravirokem, novým antagonistou CCR5 u pacientů infikovaných HIV-1. Nat Med (2005) 11: 1170-2. doi: 10.1038 / nm1319
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maravirok u dříve léčených pacientů s infekcí HIV-1 R5. N Engl J Med (2008) 359: 1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef Plný Text / Google Scholar
14. Fätkenheuer G, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Analýzy podskupin maraviroku u dříve léčené infekce R5 HIV-1. N Engl J Med (2008) 359: 1442-55. doi: 10.1056 / NEJMoa0803154
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maravirok versus efavirenz, oba v kombinaci se zidovudinem / lamivudinem, k léčbě subjektů dosud neléčených antiretrovirotiky s CCR5-tropickým HIV-1. J Infect Dis (2010) 201: 803-13. doi:10.1086/650697
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
16. Saag M, Goodrich J, Fätkenheuer G, Clotet B, Clumeck N, Sullivan J, et al. Dvojitě zaslepená, placebem kontrolovaná studie s maravirokem u již dříve léčených pacientů infikovaných non-CCR5-tropickým HIV-1: 24-týdenní výsledky. J Infect Dis (2009) 11: 1638-47. doi:10.1086/598965
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
17. Nichols WG, Steel HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Hepatotoxicita pozorovaná v klinických studiích s aplavirokem (GW873140). Antimikrobní Látky Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
18. Tsibris AM, Paredes R, Chadburn A, Su Z, Henrich TJ, Krambrink A, et al. Diagnostika lymfomu a zátěž viru Epstein-Barrové v plazmě během léčby vicrivirokem: výsledky skupiny klinických studií AIDS a5211. Clintonová (2009) 48: 642-9. doi:10.1086/597007
Pubmed Abstrakt / Pubmed Plný Text / CrossRef Plný Text / Google Scholar
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley M, et al. Virus užívající CXCR4 zjištěný u pacientů užívajících maravirok ve studiích fáze III MOTIVATE 1 a 2 pochází z již existující menšiny viru používajícího CXCR4. Antivir Ther (2007) 12:S65.
Google Scholar