- Úvod
- struktura a regulace ChREBP prostřednictvím domén LID / Grace
- aktivace ChREBP metabolity glukózy
- kofaktory a partneři ChREBP
- Role ChREBP v metabolismu uhlohydrátů a produkci Hepatokinu
- ChREBP jako regulátor syntézy jaterních mastných kyselin a sekrece VLDL
- regulace metabolismu fruktózy přípravkem ChREBP v játrech a střevech
- regulace BDK:Osa PPM1K v játrech
- ChREBP je vyžadován pro regulaci FGF21 zprostředkovanou glukózou
- Role ChREBP v Meziorgánové síti, která řídí energetickou homeostázu
- Role jaterního ChREBP v kontrole rovnováhy citlivosti na inzulín
- tuková ChREBP spojuje lipogenezi s citlivostí na inzulín
- Nová interakce mezi hormonálně citlivou lipázou a ChREBP v tukové tkáni
- závěr a budoucí směry
- autorské příspěvky
- financování
- Prohlášení o střetu zájmů
Úvod
zvýšená spotřeba jednoduchých cukrů, jako je sacharóza a kukuřičný sirup s vysokým obsahem fruktózy, vedla v posledních letech ke zvýšenému riziku metabolických onemocnění, jako je obezita, dyslipidemie, diabetes typu 2 a/nebo nealkoholické tukové onemocnění jater (NAFLD). Játra jsou hlavním orgánem odpovědným za přeměnu přebytečných dietních sacharidů na tuky. Výsledné triglyceridy (TG) mohou být zabaleny do lipoproteinů s velmi nízkou hustotou (VLDL) a buď vylučovány do oběhu, uloženy jako lipidové kapičky, nebo metabolizovány beta-oxidační cestou. Inzulín vylučovaný v reakci na zvýšenou hladinu glukózy v krvi stimuluje expresi genů de novo syntézy mastných kyselin (lipogeneze) prostřednictvím transkripčního faktoru sterol regulační prvek vázající protein-1c (SREBP-1c) (Foretz et al., 1999). SREBP-1c působí v synergii s jiným transkripčním faktorem zvaným protein vázající sacharidovou odezvu (ChREBP), který zprostředkovává reakci na uhlohydráty v potravě. Struktura proteinu ChREBP obsahuje doménu s nízkou inhibicí glukózy (LID) a konzervovaný prvek aktivace glukózové odpovědi (GRACE) umístěný v jeho N-konci (Li et al., 2006). Aktivace domény GRACE metabolity glukózy podporuje Transkripční aktivitu ChREBP a vazbu na vysoce konzervovanou sekvenci zvanou element odpovědi sacharidů(fuška). ChoRE je přítomen na promotorech cílových genů ChREBP, které kódují klíčové enzymy de novo lipogeneze včetně L-pyruvát kinázy (L-pk), enzymu omezujícího rychlost v glykolýze, syntáze mastných kyselin (Fas), acetyl-CoA karboxylázy (Acc) a stearoyl-CoA desaturázy (Scd1) (Kawaguchi et al., 2001). Nedávná studie uváděla vzájemnou závislost mezi ChREBP (aktivovaným glukózou) a SREBP-1c (aktivovaným inzulínem) pro úplnou indukci glykolytické a lipogenní genové exprese v játrech (Linden et al., 2018). Virové obnovení jaderné aktivní formy SREBP-1c v játrech myší s deficitem ChREBP (ChREBPKO) normalizovalo lipogenní genovou expresi, přičemž nemělo žádný vliv na záchranu glykolytické genové exprese. Zrcadlový experiment, ve kterém byla exprese ChREBP indukována v játrech knockoutových myší SREBP-1c, zachránil glykolytickou genovou expresi, ale překvapivě ne lipogenní genovou expresi, navzdory známé roli ChREBP v kontrole genů syntézy mastných kyselin. Nicméně tato studie naznačuje význam duálního působení ChREBP a SREBP-1c v kontrolních genech zapojených do regulace syntézy mastných kyselin (Linden et al., 2018).
ChREBP je vysoce obohacen v játrech a byl studován jako hlavní regulátor metabolismu lipidů (Iizuka et al., 2004; Osorio a kol., 2016). ChREBP je také významně exprimován v pankreatických ostrůvcích, tenkém střevě, kosterním svalu a v menší míře v ledvinách a mozku (viz Richards et al ., 2017 ke kontrole). Zajímavé je, že další izoforma ChREBP, ChREBPß, pocházející z alternativního prvního promotoru exonu, byla poprvé identifikována v tukové tkáni (Herman et al., 2012) a později popsané v jiných typech buněk (viz Abdul-Wahed et al., 2017 ke kontrole). Jak budeme diskutovat, ChREBPß je popsán jako konstitutivně aktivní izoforma. Doufáme, že budoucí práce se bude zabývat příslušnými úlohami ChREBP a ChREBPß v regulaci metabolismu glukózy a lipidů a také identifikuje jejich specifické a/nebo překrývající se cíle.
struktura a regulace ChREBP prostřednictvím domén LID / Grace
ChREBP patří do rodiny mondo transkripčních faktorů bHLH / Zip. N-terminální doména (1-251 rezidua) obsahuje dva jaderný exportní signál (NES) a jaderný lokalizační signál (NLS) regulující subcelulární lokalizaci interakcí s udržováním chromozomové oblasti 1 (CRM1) také označované jako exportin 1 a/nebo 14-3-3 proteiny (Sakiyama et al., 2008). Oblast C-konce obsahuje polyprolinovou doménu, doménu bHLH/LZ (660-737 reziduí) a leucinovou doménu podobnou zipu (zbytky podobné zipu, 807-847), které jsou spojeny s kofaktory a vazbou DNA (Yamashita et al ., 2001; Fukasawa a kol., 2010; Ge et al., 2012). Lokalizace a transkripční aktivace ChREBP jsou určeny dostupností živin. Regulace ChREBP zprostředkovaná glukózou probíhá většinou na úrovni modulu snímání glukózy (GSM) nebo mondo conserved region (MCR), který se skládá z domén LID a GRACE, jak je uvedeno v úvodu (obrázek 1A; Li et al., 2006; Singh a Irwin, 2016). V roce 2012 Herman et al. (2012) popsal další izoformu ChREBP, ChREBPß, která je přepsána z alternativního prvního promotoru exon 1b na exon 2 (Obrázek 1B). Tento přepis je přeložen z exonu 4 a vytváří kratší protein 687 aminokyselin (izoforma ChREBP po celé délce, přejmenovaná na α, obsahuje 864 aminokyselin, nazývaných ChREBP v rukopisu), ve kterých chybí dvě doména NES, NLS a LID. ChREBPß je vysoce aktivní v bílé tukové tkáni způsobem závislým na GLUT-4 a navrhuje se, aby byl přímo regulován ChREBPa, protože v promotoru exonu 1β byla identifikována sekvence Fušek (Herman et al., 2012; obrázek 1B). Regulace ChREBPß ChREBPa naznačuje existenci zpětné smyčky, která potenciálně zhoršuje odpověď na glukózu za hyperglykemických podmínek. Je však třeba objasnit regulační mechanismus(y) izoformy ChREBPß, a co je důležitější, její specifickou funkci.
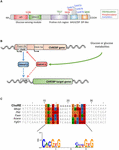
Obrázek 1. (A) struktura sacharidového reakčního prvku vazebného proteinu α (ChREBPa). ChREBPa se skládá z 864 aminokyselin a obsahuje několik regulačních domén. Na n-konci protein obsahuje modul pro snímání glukózy složený z domény s nízkou inhibicí glukózy (LID) a konzervovaného prvku aktivovaného glukózou (GRACE). Protein také obsahuje polyprolin-bohatý, bHLH / LZ a leucin-zip-like (Zip-like) doménu umístěnou na C-konci. Posttranslační modifikace jsou indikovány v příslušných reziduích, fosforylaci (červená), acetylaci (modrá) a nedávno identifikovaných o-Glcnacylacích (zelená). (B) genová struktura genu ChREBP a generace dvou izoforem chrebp α a β. ChREBPß je přepisován z alternativního prvního promotoru exonu 1b. tento přepis je přeložen z exonu 4 generujícího kratší protein 687 aminokyselin, ve kterých chybí dvě NES, NLS a lidová doména. Bylo navrženo, aby byla izoforma ChREBPß přímo regulována ChREBPa, protože v promotoru exonu 1b byla identifikována sekvence Fušek. zda se obě izoformy chrebp α a β váží na fušku, není v současné době známo. Obrázek převzatý od Herman et al. (2012). (C) Vícenásobné zarovnání konsenzuálních sekvencí Fušek představuje několik promotorů cílových genů ChREBP. Zarovnání založené na nukleotidech je uvedeno v horní části obrázku spolu s konsensovou sekvencí popsanou v Poungvarin et al. (2015). Logo odpovídající konsensuální sekvenci spojené s tímto konkrétním zarovnáním je také znázorněno.
aktivace ChREBP metabolity glukózy
za podmínek nalačno je aktivace proteinkinázy a (PKA) závislá na glukagonu (Kawaguchi et al., 2002) fosforyluje ChREBP na reziduích Ser196 a Thr666, což vede k vazbě ChREBP na protein 14-3-3 a jeho retenci v cytosolu (Kawaguchi et al ., 2001, 2002; Davies et al., 2008). AMP aktivovaná proteinkináza (AMPK), centrální snímač buněčné energie, také fosforyluje ChREBP na zbytku Ser568, což zase snižuje vazbu ChREBP na promotory jeho cílových genů (Kawaguchi et al ., 2002; Sato et al., 2016). Bylo prokázáno, že metabolity generované během půstu, jako jsou amp A ketonová těla produkovaná oxidací mastných kyselin, hrají alosterickou inhibiční roli změnou afinity proteinů ChREBP a 14-3-3, což zvyšuje komplexní stabilizaci a podporuje retenci cytosolů (Sakiyama et al ., 2008; Nakagawa a kol., 2013; Sato a kol., 2016). V reakci na sacharidy je ChREBP regulován na transkripční, translační a posttranslační úrovni. Zvýšené koncentrace glukózy po jídle podporují syntézu meziproduktů metabolitů, jako je xylulosa-5-fosfát (X5P), původně navržený jako aktivátor proteinové fosfatázy 2A (PP2A) (Kawaguchi et al., 2001; Kabašima a kol., 2003). PP2A bylo dříve popsáno, že defosforyluje ChREBP na zbytku Ser196, což umožňuje jeho translokaci do jádra, kde je dále defosforylován způsobem závislým na X5P a PP2A (na Thr666 a Ser568). Tento model byl však v průběhu let zpochybněn a jiné metabolity, jako je glukóza-6-fosfát (G6P), byly navrženy jako potenciální aktivátory translokace/aktivity ChREBP (Dentin et al ., 2012). McFerrin a kol. (2012) identifikoval domnělý motiv pro vazbu G6P (253-SDTLFT-258)na doméně GRACE, která je také zachována v mondoa, ChREBP/MondoB ortholog (viz Richards et al., 2017 ke kontrole). Podle této hypotézy by G6P mohl podporovat změnu alosterické konformace, která indukuje otevřenou konformaci pro ChREBP, což usnadňuje interakci s kofaktory a následnou translokaci do jádra (McFerrin et al ., 2012).
v jádře může být ChREBP modifikován O-Glcnacylací, posttranslační modifikací závislou na metabolismu glukózy, a identifikován jako důležitý pro Transkripční aktivitu ChREBP (Guinez et al., 2010). K O-Glcnacylaci dochází na serinových a threoninových zbytcích prostřednictvím aktivity o-GlcNAc transferázy (OGT), enzymu, který přidává zbytky N-acetylglukosaminu (GlcNAc) k cílení proteinů, čímž se mění jejich aktivita, stabilita a/nebo subcelulární umístění. Yang et al. (2017) nedávno odhalilo několik zbytků ChREBP modifikovaných O-Glcnacylací. Mutace těchto reziduí v doménách bHLH / ZIP a dimerizace a cytoplazmatické lokalizační domény (DCD) umožnily identifikaci Thr517 a Ser839 jako nezbytných míst pro aktivaci ChREBP závislou na glukóze (obrázek 1A). ChREBP může být také modifikován acetylací prostřednictvím aktivity histonové acetyltransferázy P300 (Bricambert et al., 2010). Glukózou aktivovaný p300 acetyluje ChREBP na Lys672 a zvyšuje jeho transkripční aktivitu zvýšením jeho náboru do sekvence práce, což je optimální konsensuální vazebná sekvence Caygycnnnncrcrtg(obrázek 1C). Poungvarin et al. (2015) analyzoval vazebná místa ChREBP pomocí ChIP-seq v játrech a bílé tukové tkáni myší znovu krmených dietou bez obsahu tuků s vysokým obsahem sacharidů. Uvedli, že vazba ChREBP je obohacena o dráhy zapojené do signalizace inzulínu, adherentní křižovatky a rakovina, což naznačuje nové zapojení ChREBP do tumorigeneze a progrese rakoviny. Dále nedávná studie uváděla význam ChREBP u hepatocelulárního karcinomu (HCC) (Ribback et al., 2017). Autoři zjistili, že genetická delece ChREBP (u myší ChREBPKO) narušila hepatokarcinogenezi řízenou nadměrnou expresí protein kinázy B/Akt u myší. Kromě toho inhibice ChREBP zprostředkovaná sirnou v myších a/nebo lidských HCC buňkách vedla ke snížení proliferace a apoptózy.
kofaktory a partneři ChREBP
v posledních letech bylo identifikováno několik kofaktorů a/nebo partnerů ChREBP (viz Richards et al., 2017 ke kontrole). Max jako protein x (Mlx), transkripční faktor bHLH/LZ, byl první identifikován jako společný vazebný partner rodiny Mondo (Stoeckman et al ., 2004). Dimerizace ChREBP s Mlx je nutná jak pro jadernou translokaci v reakci na glukózu, tak pro vazbu na prvky ChoRE. Jaderné receptory, jako je hepatocytární jaderný faktor 4α (HNF4a) a farnesoidní x receptor (FXR), byly také popsány jako partneři ChREBP. HNF4a fyzicky interaguje s ChREBP vazbou na oblast přímého opakování-1 (DR-1)na promotoru cílových genů ChREBP (Adamson et al ., 2006; Meng et al., 2016). Kromě toho bylo prokázáno, že transkripční koaktivační proteiny p300 / CBP stabilizují komplex ChREBP / HNF4a (Burke et al ., 2009). Transkripční koaktivační proteiny p300 / CBP hrají ústřední roli při koordinaci a integraci více událostí závislých na signálu s transkripčním aparátem. Další klíčovou vlastností p300 / CBP je přítomnost aktivity Histon acetyltransferázy (HAT), která poskytuje p300/CBP schopnost ovlivňovat aktivitu chromatinu modulací nukleosomálních histonů. V lidských hepatocytech FXR vazba na komplex ChREBP-HNF4a spouští uvolňování ChREBP z CBP / p300, což vede k náboru Histon deacetylázy SMRT na promotor Lpk, čímž působí jako co-represor transkripční aktivity ChREBP (Caron et al., 2013). Kromě toho aktivita CBP / p300 HAT modifikuje ChREBP na Lys 672, což vede k jeho transkripční aktivaci v reakci na glukózu (Bricambert et al ., 2010).
Bricambert et al. (2018) nedávno identifikoval homeodomain finger 2 (Phf2), který patří do rodiny histonové lysin demethylázy (KDM7), jako nový kofaktor ChREBP. Interakce mezi Phf2 a ChREBP zvyšuje Transkripční aktivaci ChREBP vymazáním methylových značek H3K9 na promotoru jeho cílových genů. Zajímavé je, že specifický společný nábor Phf2 a ChREBP na promotor jaderného faktoru erytroid 2 jako 2 (Nrf2) přispívá k ochrannému účinku Phf2 proti zvýšeným reaktivním druhům kyslíku (ROS) a progresi NAFLD v souvislosti s hyperglykémií (Bricambert et al., 2018).
Role ChREBP v metabolismu uhlohydrátů a produkci Hepatokinu
ChREBP jako regulátor syntézy jaterních mastných kyselin a sekrece VLDL
nealkoholické tukové onemocnění jater je charakteristickým znakem metabolického syndromu a studie u lidí ukazují, že de novo lipogeneze přispívá k přibližně 25% celkových jaterních lipidů u pacientů s NAFLD (Donnelly et al ., 2005). Ve stavech rezistentních na inzulín hyperglykémie a hyperinzulinémie zvyšují lipogenezi částečně aktivací ChREBP a SREBP-1c. Inhibice ChREBP v játrech obézních a inzulin rezistentních ob/ob myší, prostřednictvím RNAi nebo genetické ablace vede ke zvrácení jaterní steatózy (Dentin et al ., 2006; Iizuka a kol., 2006). Změněná sekrece VLDL játry také přispívá k patogenezi NAFLD. Mikrosomální protein pro přenos triglyceridů (MTTP)je protein odpovědný za shromažďování a vylučování lipoproteinů obsahujících apolipoprotein B. Nedostatek MTTP u myší a lidí způsobuje hypolipidemii a mastnou játra. Regulace tohoto proteinu byla spojena s několika vysoce konzervovanými cis prvky v jeho promotoru, včetně kritických pozitivních a negativních regulačních domén (Cuchel et al ., 2013; Hussain et al., 2011). Nedávno byl ChREBP zdůrazněn jako potenciální regulátor MTTP, protože nedostatek funkčního ChREBP v játrech potlačuje expresi Mttp a montáž a sekreci VLDL (Niwa et al ., 2018). Protože však na promotoru Mttp nebylo možné jasně identifikovat žádnou fušku, bude zapotřebí další analýzy k identifikaci mechanismu, kterým ChREBP reguluje Mttp.
regulace metabolismu fruktózy přípravkem ChREBP v játrech a střevech
souvislost mezi metabolismem ChREBP a fruktózy byla poprvé prokázána fenotypovou analýzou myší ChREBP knockout (myši ChREBPKO). Bylo hlášeno, že myši ChREBPKO zemřely během několika dnů po krmení dietou s vysokým obsahem fruktózy (HFrD) (Iizuka et al., 2004). Tato hlavní nesnášenlivost fruktózy byla přičítána snížení exprese fruktokinázy a trios kinázy, dvou enzymů potřebných pro metabolismus fruktózy (Iizuka et al., 2004). Kim a spol. (2016) později uvedl význam ChREBP pro účinnou přeměnu fruktózy na glukózu v jaterní a celotělové clearance fruktózy, ale také při požití fruktózy by ChREBP mohl přispět k hyperglykémii přímou transaktivací exprese G6pc, klíčového genu glukoneogeneze. Tento účinek by mohl vést k začarovanému cyklu, ve kterém spotřeba fruktózy zhoršuje produkci glukózy, i když je ChREBP aktivitou (Kim et al ., 2016). Následující rok studie Zhang et al. (2017) uvádí, že myši ChREBPKO krmené HFrD vyvinou závažné poškození jater v důsledku nadměrné aktivace stresu endoplazmatického retikula a apoptózy hepatocytů zprostředkované ccaat-Enhancer-binding protein homologous protein (CHOP). Apoptóza v hepatocytech u těchto myší byla s největší pravděpodobností spojena se zvýšenou biosyntézou cholesterolu, protože inhibice této cesty prostřednictvím HMG-CoA reduktázy (HMGCR) nebo inhibice SREBP2 zachránila myši ChREBPKO před poškozením jater vyvolaným HFrD. Nedostatek ChREBP byl také nedávno spojen s dysregulací metabolismu sacharózy a fruktózy vedoucí k intoleranci cukru a malabsorpci u myší (Kato et al., 2018). Tyto účinky byly spojeny se sníženou expresí střevní sacharózy-isomaltázy (SI), která štěpí sacharózu v glukóze a fruktóze, transportéry glukózy 5 (Glut5) a 2 (Glut2) a enzym ketohexokinázy (Khk), který reguluje fruktolýzu (Obrázek 2). Dysregulace těchto enzymů může vést k akumulaci nestrávené sacharózy a fruktózy s potenciálními důsledky ve složení střevní mikrobioty. Srovnání mezi ChREBPKO a játrově specifickými ChREBP knockout (ChREBPLiverKO) myší krmených HFrD dříve ukázalo, že samotný nedostatek jaterního ChREBP nevede k intoleranci fruktózy, ale že nedostatek ChREBP v tenkém střevě je s největší pravděpodobností zodpovědný za zhoršení tolerance fruktózy pozorované u těchto myší (Kim et al ., 2017). Celkově tyto studie zdůrazňují význam ChREBP v regulaci metabolismu fruktózy a zdůrazňují potřebu lepšího porozumění jeho úloze a regulaci v tenkém střevě.
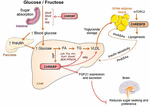
Obrázek 2. ChREBP reguluje násobky signálních / metabolických drah v reakci na glukózu a fruktózu. ChREBP je exprimován v několika tkáních včetně střeva, jater a bílé tukové tkáně. U těchto typů buněk se v reakci na glukózu a/nebo fruktózu aktivuje ChREBP a indukuje specifický genový program, jak je uvedeno na obrázku. Ve střevě byla popsána stimulace exprese si, Glut5, Glut2 a Ketohexokinázy (Khk) pomocí ChREBP (buď přímo nebo nepřímo) ke zlepšení tolerance sacharózy a absorpce fruktózy. V játrech je ChREBP klíčovým modulátorem genové exprese glykolytického, lipogenního a mikrosomálního triglyceridového proteinu (Mttp), čímž řídí akumulaci mastných kyselin i export VLDL z jater. ChREBP také reguluje produkci hepatokinů, jako je růstový faktor 21 fibroblastů (FGF21). Tato osa játra-mozek rozšiřuje funkci jaterního ChREBP z jaterního regulátoru na systémový modulátor ovlivňující nejen manipulaci se substrátem v játrech, ale také preference živin. Aktivace ChREBP v bílé tukové tkáni je spojena se zlepšenou metabolickou homeostázou vytvářením ochranných cirkulujících signálů. Nová třída savčích lipidů charakterizovaná rozvětvenou esterovou vazbou mezi mastnou kyselinou a hydroxy-mastnou kyselinou (kyselina palmitová hydroxylstearová kyselina) vykazuje příznivé účinky na homeostázu glukózy přímou a inkretinem zprostředkovanou modulací funkce β buněk, zvýšeným vychytáváním glukózy v tukové tkáni a sníženým zánětem. Zajímavé je, že mTORC2 byl nedávno identifikován jako nový regulátor izoformy ChREBPß v tukových buňkách.
regulace BDK:Osa PPM1K v játrech
první spáchaný krok katabolismu aminokyselin s rozvětveným řetězcem (BCAA) je regulován komplexem ketoacid dehydrogenázy (BCKDH) s rozvětveným řetězcem, který je řízen dvěma enzymy, alfa-ketokyselinovou dehydrogenázou s rozvětveným řetězcem (BDK) a proteinovou fosfatázou, Mg2+/Mn22+ dependentní 1K (PPM1K). White et al. (2018) nedávno spojil ChREBP s upregulací BDK a down-regulací PPM1K v játrech a identifikoval konzervovaný motiv Fušky v promotoru obou těchto genů. Pozitivní korelace mezi expresí BDK a dalšími typickými cílovými geny ChREBP (Fasn, Pklr, ChREBPß)byla pozorována u jater potkanů krmených dietou s vysokým obsahem glukózy nebo fruktózy. Na fyziologické úrovni vedlo zvýšení poměru BDK: PPM1K k fosforylaci a aktivaci ATP-citrát lyázy (ACLY), čímž stimulovala de novo lipogenezi. Tato zjištění ukazují, že BDK a PPM1K mohou být nové geny aktivující lipogenezi regulované ChREBPß. Vzhledem k jejich úloze v regulaci metabolismu lipidů, glukózy a aminokyselin by BDK a PPM1K mohly být v blízké budoucnosti považovány za potenciální terapeutické cíle v játrech (White et al., 2018).
ChREBP je vyžadován pro regulaci FGF21 zprostředkovanou glukózou
ChREBP byl nedávno spojen s produkcí a sekrecí hepatokinů, jako je růstový faktor 21 fibroblastů (FGF21) (Iizuka et al., 2009; Dushay et al., 2015, Iroz a kol., 2017). FGF21 je metabolický hormon syntetizovaný játry s mnoha příznivými účinky v periferních tkáních (Kharitonenkov et al ., 2005; Badman a kol., 2007; Markan et al., 2014). Až donedávna byl FGF21 považován za hormon nalačno, který zvyšuje oxidaci mastných kyselin, ketogenezi a lipolýzu pod transkripční kontrolou peroxisomového proliferátoru aktivovaného receptoru α (PPARa) (Inagaki et al ., 2007). Fuška na promotoru Fgf21 byla dříve identifikována jak u myší (-74 až -52 bp), tak u lidí (-380 až -366 bp) (Iizuka et al., 2009) ale funkční studie donedávna chyběly. Bylo hlášeno, že konzumace glukózy a fruktózy vede k rychlému zvýšení hladin FGF21 u zdravých dobrovolníků a pacientů s metabolickým syndromem (Dushay et al., 2015). Další studie také uváděly mechanistické spojení mezi FGF21 odvozeným od ChREBP a preferencí makronutrientů prostřednictvím osy játra-mozek (Talukdar et al ., 2016; von Holstein-Rathlou et al., 2016). Tato osa játra-mozek rozšiřuje funkci ChREBP z jaterního metabolického regulátoru na systémový modulátor, což ovlivňuje nejen manipulaci s jaterním substrátem, ale také globální chování při krmení (Abdul-Wahed et al., 2017).
Role ChREBP v Meziorgánové síti, která řídí energetickou homeostázu
Role jaterního ChREBP v kontrole rovnováhy citlivosti na inzulín
Naše Laboratoř dříve uvedla, že ChREBP působí jako klíčový modulátor složení mastných kyselin v játrech a citlivosti na inzulín v souvislosti s nealkoholickými a alkoholickými onemocněními jater (viz Abdul-Wahed et al ., 2017 ke kontrole). Myši s nadměrnou expresí ChREBP vyvinuly větší steatózu jater než kontroly, ale zajímavě zůstaly bez metabolických komplikací a nevyvinuly se inzulínové rezistence. Lipidomická analýza odhalila, že steatóza zprostředkovaná ChREBP je spojena se snížením nasycených mastných kyselin a zvýšením mononenasycených mastných kyselin, u nichž bylo prokázáno, že jsou spojeny s příznivými účinky zprostředkovanými ChREBP na citlivost na inzulín (Benhamed et al., 2012). Tyto výsledky ukazují roli ChREBP při dělení lipidů a naznačují, že specifické lipidové druhy, pokud jsou přítomny na správném místě a čase, mohou vyvolat signály, které modulují adaptaci na metabolický stres (Benhamed et al ., 2012; Bricambert a kol., 2018). Zajímavě, Jois et al. (2017) také navrhl ochrannou roli pro jaterní ChREBP, pokud jde o homeostázu glukózy v celém těle a citlivost na inzulín. Myši ChREBPLiverKO vykazují zhoršenou glukózovou toleranci, zatímco jsou chráněny před steatózou jater. Delece jaterního ChREBP také vedla ke změnám genové exprese v bílých a hnědých tukových tkáních, což naznačuje komunikaci mezi tkáněmi. Příspěvek ChREBP k energetické rovnováze celého těla se proto může spoléhat na jeho regulaci lipidových druhů a / nebo produkci hepatokinů přispívající k interakční koordinaci energetické homeostázy (Jois et al ., 2017).
tuková ChREBP spojuje lipogenezi s citlivostí na inzulín
zhoršená signalizace inzulínu v tukové tkáni je kritickým rysem inzulínové rezistence. Studie uvádějí, že aktivace ChREBP v bílé tukové tkáni může zlepšit metabolickou homeostázu produkcí ochranných cirkulujících signálů (Yore et al ., 2014; Tang a kol., 2016). Třída savčích lipidů charakterizovaná rozvětvenou esterovou vazbou mezi mastnou kyselinou a hydroxy-mastnou kyselinou, kyselinou palmitovou hydroxylstearovou (PAHSA), měla příznivé účinky na homeostázu glukózy přímou a inkretinem zprostředkovanou modulací funkce β buněk, vychytávání glukózy a snížení zánětu (Yore et al., 2014). Podobně, Knockout ChREBP specifický pro tuk (ChREBPadiposeKO), které vykazují nízkou míru lipogeneze v tukové tkáni, jsou rezistentní na inzulín se zhoršeným účinkem inzulínu v játrech, svalu a bílé tukové tkáni za podmínek stravy s vysokým obsahem tuku. Myši ChREBPadiposeKO mají nižší sérové hladiny Pahsa, zatímco suplementace PAHSA,zejména izomer 9-PAHSA, zachraňuje ChREBPadiposeKO globální inzulínovou rezistenci a zánět tukové tkáně, což potvrzuje, že ztráta tukové ChREBP je dostatečná k vyvolání inzulínové rezistence (Vijayakumar et al., 2017). Nedávná studie identifikovala mechanistický cíl rapamycinového komplexu 2 (mTORC2) jako nový regulátor ChREBP (zejména β izoformy) v tukových buňkách. Specifická ablace společníka mTOR necitlivého na rapamycin (Rictor)ve zralých adipocytech narušila absorpci glukózy stimulovanou inzulínem v tukové tkáni, což vedlo k down-regulaci ChREBPß a exprese cílového genu zapojené do kontroly lipogeneze (Tang et al ., 2016). Ve shodě s důležitým tukovým jaterním přeslem zprostředkovaným přípravkem ChREBP jsou tyto účinky spojeny s rezistencí na jaterní inzulín a zvýšenou glukoneogenezí. Celkově tyto studie podporují důležitou roli tukového ChREBP při spouštění signálů citlivých na inzulín (Tang et al., 2016).
Nová interakce mezi hormonálně citlivou lipázou a ChREBP v tukové tkáni
ChREBP byla nedávno identifikována jako partner lipolytického enzymu hormonálně citlivé lipázy (HSL)v tukové tkáni (Morigny et al ., 2019). Bylo prokázáno, že Knockdown HSL v lidských adipocytech a myších tukových tkáních zvyšuje citlivost na inzulín a indukuje prodloužení enzymu mastných kyselin s velmi dlouhým řetězcem (Elovl6). Elov16 je mikrozomální enzym, který reguluje prodloužení nasycených a mononenasycených mastných kyselin C12-16 způsobem závislým na ChREBP (Morigny et al ., 2019). Na mechanistické úrovni fyzická interakce mezi HSL a ChREBP narušila jadernou translokaci ChREBPa a následnou indukci ChREBPß a cílových genů, zejména Elovl6 (Morigny et al., 2019). Tato studie odhaluje novou regulaci pro ChREBP v tukové tkáni. Inhibice interakce mezi HSL a ChREBP může vést k potenciálním terapeutickým strategiím pro zlepšení citlivosti na inzulín v tukových buňkách.
závěr a budoucí směry
ChREBP je nyní dobře zavedeným sacharidovým senzorem. Ačkoli většina studií byla věnována jeho důsledkům při kontrole glykolytických a lipogenních drah, nedávné údaje také odhalily nové příspěvky ChREBP v hepatocytech a v tukových buňkách, kde by to mohlo být nápomocné při produkci hepatokinů a / nebo lipokinů spouštěcích meziorgánový přeslechy. Jak bylo uvedeno, nově identifikované kofaktory (epigenetické modifikátory) a/nebo partneři (tuková HSL) v těchto tkáních mohou také představovat potenciální terapeutické strategie pro NAFLD a/nebo pro zlepšení systémové citlivosti na inzulín. Nedávné studie také podpořily význam přípravku ChREBP při regulaci metabolismu fruktózy a zdůraznily potřebu lepšího porozumění jeho úloze a regulaci v tenkém střevě. A konečně, identifikace specifických a / nebo překrývajících se cílů ChREBPa a ChREBPß v klíčových typech buněk a stanovení jejich specifického dopadu na citlivost na inzulín bude mít v nadcházejících letech zvláštní význam.
autorské příspěvky
všichni uvedení autoři významně, přímo a intelektuálně přispěli k dílu a schválili jej k publikaci.
financování
laboratoř Postic (U1016-Institut Cochin) je podpořena granty ze sítě ChroME (Marie Curie Skłodowska Action H2020-MSCA-ITN-2015-675610), Nadace pro lékařský výzkum (FRM) (DEQ20150331744) a ANR-15-CE14-0026-Hepatokind.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.