Holger J Schünemann, Julian PT Higgins, Gunn E Vist, Paul Glasziou, Elie a Akl, Nicole Skoetz, Gordon H Guyatt; jménem skupiny Cochrane GRADEing Methods Group(dříve použitelnost a doporučení Methods Group) a skupiny Cochrane Statistical Methods
- klíčové body:
- 14.1 ‚souhrn nálezů‘ tabulky
- 14.1.1 Úvod do‘ souhrn nálezů ‚ tabulky
- 14.1.2 výběr výsledků pro tabulky „souhrn nálezů“
- 14.1.3 Obecná šablona pro tabulky „Shrnutí zjištění“
- 14.1.4 vytváření tabulek „Shrnutí zjištění“
- 14.1.5 statistické úvahy v tabulkách „souhrn nálezů“
- 14.1.5.1 dichotomické výsledky
- 14.1.5.2 výsledky Time-to-event
- 14.1.6 podrobný obsah tabulky „souhrn nálezů“
- 14.1.6.1 název a záhlaví tabulky
- 14.1.6.2 výsledky
- 14.1.6.3 nejlepší odhad rizika s komparátorovou intervencí
- 14.1.6.4 riziko s intervencí
- 14.1.6.5 rizikový rozdíl
- 14.1.6.6 relativní účinek (95% CI)
- 14.1.6.7 počet účastníků (studií)
- 14.1.6.8 jistota důkazů (stupeň)
- 14.1.6.9 Komentáře
- 14.1.6.10 vysvětlení
- 14.2 posouzení jistoty nebo kvality souboru důkazů
- 14.2.1 přístup ke známkám
klíčové body:
- tabulka „Souhrn zjištění“ pro dané srovnání intervencí poskytuje klíčové informace týkající se veličin relativních a absolutních účinků zkoumaných intervencí, množství dostupných důkazů a jistoty (nebo kvality) dostupných důkazů.
- tabulky „souhrn nálezů“ obsahují řádek pro každý důležitý výsledek (maximálně sedm). Přijaté formáty tabulek „shrnutí nálezů“ a interaktivních tabulek „shrnutí nálezů“ lze vytvořit pomocí softwaru Grade GRADEpro GDT.
- společnost Cochrane přijala přístup ke klasifikaci (hodnocení, vývoj a hodnocení doporučení) pro hodnocení jistoty (nebo kvality) souboru důkazů.
- přístup GRADE specifikuje čtyři úrovně jistoty pro soubor důkazů pro daný výsledek: vysoká, střední, nízká a velmi nízká.
- hodnocení jistoty je určeno zvážením pěti domén: riziko zkreslení, nekonzistence, nepřímosti, nepřesnosti a zkreslení publikace. Pro důkazy z nerandomizovaných studií a zřídka randomizovaných studií lze hodnocení Upgradovat zvážením dalších tří domén.
citujte tuto kapitolu jako: Schünemann HJ, Higgins JPT, Vist GE, Glasziou P, Akl EA, Skoetz N, Guyatt GH. Kapitola 14: vyplnění tabulek „Shrnutí zjištění“ a třídění jistoty důkazů. V: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions verze 6.2 (Aktualizováno únor 2021). Cochrane, 2021. Dostupné z www.školení.cochrane.org/handbook.
14.1 ‚souhrn nálezů‘ tabulky
14.1.1 Úvod do‘ souhrn nálezů ‚ tabulky
‚ souhrn nálezů ‚ tabulky představují hlavní závěry přezkumu v průhledném, strukturovaném a jednoduchém tabulkovém formátu. Poskytují zejména klíčové informace týkající se jistoty nebo kvality důkazů (tj. důvěry nebo jistoty v rozsahu odhadu účinku nebo přidružení), rozsahu účinku zkoumaných intervencí a součtu dostupných údajů o hlavních výsledcích. Cochraneova hodnocení by měla během plánování a zveřejňování zahrnovat tabulky „shrnutí nálezů“ a měla by obsahovat alespoň jednu klíčovou tabulku „shrnutí nálezů“ představující nejdůležitější srovnání. Některé recenze mohou zahrnovat více než jednu tabulku „Souhrn zjištění“, například pokud se přezkoumání týká více než jednoho významného srovnání, nebo zahrnuje podstatně odlišné populace, které vyžadují samostatné tabulky (např. proto, že se účinky liší nebo je důležité zobrazit výsledky Samostatně). V Cochrane Database of Systematic Reviews (CDSR) se na začátku, před pozadím, zobrazí hlavní tabulka „Shrnutí zjištění“. Mezi výsledky a diskusními oddíly se objevují další tabulky „Shrnutí zjištění“.
14.1.2 výběr výsledků pro tabulky „souhrn nálezů“
plánování tabulky „souhrn nálezů“ začíná na začátku systematického přezkumu, přičemž výběr výsledků bude zahrnut do: i) přezkumu a ii) tabulky „souhrn nálezů“. To je zásadní krok, a ten, který autoři recenze musí pečlivě řešit.
aby byla zajištěna tvorba optimálně užitečných informací, Cochrane recenze začínají vypracováním revizní otázky a seznamem všech hlavních výsledků, které jsou důležité pro pacienty a další osoby s rozhodovací pravomocí (viz kapitola 2 a Kapitola 3). Přístup známek k hodnocení jistoty důkazů (viz oddíl 14.2) definuje a zprovozňuje proces hodnocení, který pomáhá oddělit výsledky od těch, které jsou kritické, důležité nebo ne důležité pro rozhodování. Konzultace a zpětná vazba k Protokolu o přezkumu, včetně spotřebitelů a dalších osob s rozhodovací pravomocí, může tento proces zlepšit.
kritické výsledky pravděpodobně zahrnují jasně důležité cílové parametry; typické příklady zahrnují mortalitu a závažnou morbiditu (jako jsou mrtvice a infarkt myokardu). Mohou však také představovat časté menší a vzácné hlavní vedlejší účinky, příznaky, kvalitu života, zátěž spojenou s léčbou a problémy se zdroji (náklady). Zátěž představuje dopad pracovní zátěže zdravotní péče na funkci a pohodu pacienta a zahrnuje požadavky na dodržování zásahu, který pacienti nebo pečovatelé (např. rodina) nemusí mít rádi, jako je nutnost podstoupit častější testy nebo omezení životního stylu, které určité intervence vyžadují (Spencer-Bonilla et al 2017).
často při formulování otázek, které zahrnují všechny výsledky důležité pro pacienta pro rozhodování, autoři recenzí budou čelit zprávám studií, které nezahrnovaly všechny tyto výsledky. To platí zejména pro nepříznivé výsledky. Například randomizované studie mohou přispět k důkazům o zamýšlených účincích a častých, relativně menších vedlejších účincích, ale ne o vzácných nežádoucích výsledcích, jako jsou pokusy o sebevraždu. Kapitola 19 pojednává o strategiích řešení nepříznivých účinků. Pro získání údajů o všech důležitých výsledcích může být nezbytné prozkoumat výsledky nerandomizovaných studií (viz kapitola 24). Cochrane ve spolupráci s ostatními vyvinul pokyny pro autory recenzí, aby podpořili své rozhodnutí o tom, kdy hledat a zahrnout nerandomizované studie (Schünemann et al 2013).
pokud hodnocení zahrnuje pouze randomizované studie, nemusí se tyto studie zabývat všemi důležitými výsledky, a proto nemusí být možné tyto výsledky řešit v rámci omezení přezkumu. Autoři recenzí by měli tato omezení uznat a učinit je transparentními pro čtenáře. Autoři hodnocení se vyzývají, aby zahrnuli nerandomizované studie ke zkoumání vzácných nebo dlouhodobých nežádoucích účinků, které nemusí být adekvátně studovány v randomizovaných studiích. To zvyšuje možnost, že výsledky poškození mohou pocházet ze studií, ve kterých se účastníci liší od výsledků ve studiích používaných při analýze přínosů. Autoři hodnocení pak budou muset zvážit, do jaké míry tyto rozdíly pravděpodobně ovlivní zjištění, a to ovlivní jistotu důkazů kvůli obavám z nepřímosti související s populací (viz oddíl 14.2.2).
nerandomizované studie mohou poskytnout důležité informace nejen tehdy, když randomizované studie nehlásí výsledek nebo randomizované studie trpí nepřímostí, ale také když jsou důkazy z randomizovaných studií hodnoceny jako velmi nízké a nerandomizované studie poskytují důkaz o vyšší jistotě. Další diskuse o těchto otázkách se objevuje také v kapitole 24.
14.1.3 Obecná šablona pro tabulky „Shrnutí zjištění“
bylo vyvinuto několik alternativních standardních verzí tabulek „Shrnutí zjištění“, aby byla zajištěna konzistence a snadné použití napříč recenzemi, zahrnutí nejdůležitějších informací potřebných osobami s rozhodovací pravomocí a optimální prezentace (viz příklady na obrázcích 14.1 .a a 14.1.B). Tyto formáty jsou podporovány výzkumem zaměřeným na lepší porozumění informacím, které hodlají sdělit (Carrasco-Labra et al 2016, Langendam et al 2016, Santesso et al 2016). Jsou k dispozici prostřednictvím oficiálního softwarového balíčku GRADE vyvinutého na podporu přístupu GRADE: GRADEpro GDT (www.gradepro.org).
standardní tabulky Cochrane ‚Summary of findings‘ obsahují následující prvky používající jeden z přijatých formátů. Další pokyny ke každému z nich jsou uvedeny v bodě 14.1.6.
- stručný popis populace a prostředí, na které se vztahují dostupné důkazy(které mohou být mírně odlišné nebo užší než ty, které jsou definovány v přezkumné otázce).
- stručný popis srovnání popsaného v tabulce „shrnutí nálezů“, včetně experimentálních i srovnávacích intervencí.
- seznam nejkritičtějších a / nebo důležitých zdravotních výsledků, žádoucích i nežádoucích, omezených na sedm nebo méně výsledků.
- míra typické zátěže jednotlivých výsledků (např. ilustrativní riziko nebo ilustrativní průměr při srovnávací intervenci).
- absolutní a relativní velikost účinku měřená pro každý z nich (jsou-li oba vhodné).
- počty účastníků a studie přispívající k analýze jednotlivých výsledků.
- hodnocení stupně celkové jistoty souboru důkazů pro každý výsledek (které se mohou lišit podle výsledku).
- prostor pro Komentáře.
- vysvětlení (dříve známé jako poznámky pod čarou).
v ideálním případě jsou tabulky „Souhrn zjištění“ podporovány podrobnějšími tabulkami (známými jako „profily důkazů“), na které může být přezkum spojen a které poskytují podrobnější vysvětlení. Profily důkazů zahrnují stejné důležité zdravotní výsledky a poskytují podrobnější informace než tabulky „shrnutí nálezů“ jak o jednotlivých úvahách, které jsou součástí hodnocení jistoty, tak o výsledcích studií (Guyatt et al 2011a). Zajišťují, aby byl k hodnocení jistoty důkazů použit strukturovaný přístup. Ačkoli jsou zřídka publikovány v recenzích Cochrane, profily důkazů jsou často používány, například, vývojáři pokynů při zvažování jistoty důkazů na podporu doporučení pokynů. Pro autory hodnocení bude snazší vytvořit tabulku „Shrnutí zjištění“vyplněním hodnocení jistoty důkazů v profilu důkazů nejprve v GRADEpro GDT. Poté je mohou automaticky převést na jeden z formátů „shrnutí nálezů“ v GRADEpro GDT, včetně interaktivního „shrnutí nálezů“ k publikaci.
jako měřítko velikosti účinku pro dichotomické výsledky by tabulka „souhrn nálezů“ měla poskytnout relativní míru účinku (např. poměr rizika, poměr šancí, riziko) a míry absolutního rizika. U jiných typů dat může postačovat pouze absolutní míra (například rozdíl v prostředcích pro kontinuální data). Je důležité, aby velikost účinku byla prezentována smysluplným způsobem, což může vyžadovat určitou transformaci výsledku metaanalýzy (viz také Kapitola 15, oddíl 15.4 a oddíl 15.5). Hodnocení s více než jedním hlavním porovnáním by měla obsahovat samostatnou tabulku „Shrnutí zjištění“ pro každé srovnání.
obrázek 14.1.a uvádí příklad tabulky „Shrnutí zjištění“. Obrázek 15.1.B poskytuje alternativní formát, který může uživatelům dále usnadnit porozumění a interpretaci zjištění přezkumu. Důkazy hodnotící různé formáty naznačují, že tabulka „souhrn nálezů“ by měla jako měřítko absolutního účinku obsahovat rizikový rozdíl a autoři by měli přednostně používat formát, který zahrnuje rizikový rozdíl .
podrobný popis obsahu tabulky „souhrn nálezů“ je uveden v bodě 14.1.6.
obrázek 14.1.příklad tabulky „shrnutí nálezů“
souhrn nálezů (pro interaktivní verzi klikněte zde)
|
kompresní punčochy ve srovnání s bez kompresních punčoch pro lidi, kteří berou dlouhé lety |
||||||
|
pacienti nebo populace: každý, kdo trvá dlouhý let (trvající více než 6 hodin) nastavení: mezinárodní letecká doprava intervence: kompresní punčochysa srovnání: bez punčoch |
||||||
|
výsledky |
ilustrativní komparativní rizika* (95% CI) |
relativní účinek (95% CI) |
počet účastníků (studie) |
jistota důkazů (stupeň) |
||
|
předpokládané riziko |
odpovídající riziko |
|||||
|
bez punčoch |
s punčochy |
|||||
|
symptomatická hluboká žilní trombóza (DVT) |
viz komentář |
viz komentář |
nelze odhadnout |
(9 studie) |
viz komentář |
0 u účastníků se v těchto studiích vyvinula symptomatická DVT |
|
DVT bez příznaků |
nízkoriziková populaceb |
RR 0.10 (0.04 na 0.26) |
(9 studie) |
⊕⊕⊕⊕ vysoká |
||
|
10 za 1000 |
1 na 1000 (0 až 3) |
|||||
|
vysoce rizikové obyvatelstvob |
||||||
|
20 za 1000 |
2 na 1000 (1 až 8) |
|||||
|
povrchová žilní trombóza |
13 za 1000 |
6 na 1000 (2 až 15) |
RR 0.45 (0.18 až 1.13) |
(8 studie) |
⊕⊕⊕◯ Moderatec |
|
|
edém hodnoty po letu naměřené na stupnici od 0, žádný edém, do 10, maximální edém |
průměrné skóre edému se pohybovalo napříč kontrolními skupinami od 6 do 9 |
průměrné skóre edému v intervenčních skupinách bylo v průměru 4,7 nižší (95% CI -4,9 až -4.5) |
(6 studie) |
⊕⊕◯◯ Lowd |
||
|
plicní embolie |
viz komentář |
viz komentář |
nelze odhadnout |
(9 studie) |
viz komentář |
0 účastníci vyvinuli plicní embolii v těchto studiích |
|
smrt |
viz komentář |
viz komentář |
ne odhadnutelné |
(9 studie) |
viz komentář |
0 účastníci zemřeli v těchto studiích |
|
nežádoucí účinky |
viz komentář |
viz komentář |
nelze odhadnout |
(4 studie) |
viz komentář |
snášenlivost punčoch byla popsána jako velmi dobrá bez stížností na vedlejší účinky ve 4 studiíchf |
|
*základ pro předpokládané riziko je uveden v čára. Odpovídající riziko (a jeho 95% interval spolehlivosti) je založeno na předpokládaném riziku v intervenční skupině a relativním účinku intervence (a jeho 95% CI). CI: interval spolehlivosti; RR: poměr rizik; stupeň: stupeň pracovní skupiny stupně důkazů (viz vysvětlení). |
||||||
a všechny punčochy v devíti studiích zahrnutých do tohoto přehledu byly kompresní punčochy pod kolenem. Ve čtyřech studiích byla pevnost v tlaku 20 mmHg až 30 mmHg v kotníku. V ostatních čtyřech studiích to bylo 10 mmHg až 20 mmHg. Punčochy se dodávají v různých velikostech. Pokud je punčocha příliš těsná kolem kolena, může zabránit nezbytnému žilnímu návratu, který způsobí, že se krev spojí kolem kolena. Kompresní punčochy by měly být správně namontovány. Skladování, které je příliš těsné, by mohlo při dlouhém letu proniknout do kůže a potenciálně způsobit ulceraci a zvýšené riziko DVT. Některé punčochy mohou být o něco silnější než normální pokrývka nohou a mohou být potenciálně omezující při těsném opotřebení nohou. Je dobré nosit punčochy kolem domu před cestou, abyste zajistili dobré a pohodlné nošení. Účastníci si ve většině studií oblékli Punčochy dvě až tři hodiny před letem. Dostupnost a náklady na punčochy se mohou lišit.
b dvě studie zahrnovaly vysoce rizikové účastníky definované jako osoby s předchozími epizodami DVT, poruchami koagulace, těžkou obezitou, omezenou pohyblivostí v důsledku problémů s kostmi nebo klouby, neoplastickým onemocněním během předchozích dvou let, velkými křečovými žilami nebo v jedné ze studií účastníci vyšší než 190 cm a těžší než 90 kg. Incidence sedmi studií, které vyloučily účastníky s vysokým rizikem, byla 1.45% a incidence dvou studií, které zahrnovaly vysoce rizikové účastníky (s alespoň jedním rizikovým faktorem), byla 2, 43%. Použili jsme 10 a 30 na 1000 k vyjádření různých rizikových vrstev.
c interval spolehlivosti nepřekročí žádný rozdíl a nevylučuje malý nárůst.
d měření edému nebylo validováno (nepřímo výsledku) nebo zaslepeno intervencí (riziko zkreslení).
E pokud je velmi málo nebo žádné události a počet účastníků je velký, úsudek o jistotě důkazů (zejména úsudky o nepřesnosti) může být založen na absolutním účinku. Zde lze hodnocení jistoty považovat za „vysoké“, pokud byl výsledek vhodně posouzen a událost ve skutečnosti nenastala u 2821 studovaných účastníků.
f žádná z dalších studií nehlásila nežádoucí účinky, kromě čtyř případů povrchové žilní trombózy u křečových žil v oblasti kolena, které byly stlačeny horním okrajem punčochy v jedné studii.
obrázek 14.1.B příklad alternativní tabulky „Shrnutí zjištění“
|
shrnutí poznatků (pro interaktivní verzi klikněte zde): |
||||||
|
probiotika ve srovnání s žádnými probiotiky jako doplněk k antibiotikům u dětí |
||||||
|
pacient nebo populace: děti užívající antibiotika nastavení: hospitalizovaní a ambulantní intervence: probiotika srovnání: žádná probiotika |
||||||
|
výsledky počet účastníků (studie) |
relativní účinky |
předpokládané absolutní účinky* (95% CI) |
jistota důkazů |
|||
|
bez probiotik |
s probiotiky |
rozdíl |
||||
|
výskyt průjmu: dávka probiotika 5 miliard CFU / den sledování: 10 dní až 3 měsíce děti < 5 let |
děti < 5 let |
⊕⊕⊕⊝ moderateb kvůli riziku zkreslení |
pravděpodobně snižuje výskyt průjmu. |
|||
|
1474 (7 studie) |
RR 0,41 (0,29 až 0.55) |
22.3%v |
8.9% (6.5 K 12.2) |
13.4% méně dětí (10,1 až 15.8 méně) |
||
|
děti > 5 let |
děti > 5 let |
⊕⊕⊝⊝ lowb, c kvůli riziku zkreslení a nepřesnosti |
může snížit výskyt průjmu. |
|||
|
624 (4 studie) |
RR 0,81 (0,53 až 1.21) |
11.2%v |
9% (5.9 K 13.6) |
2.2% méně dětí (o 5,3 méně než 2.4 více) |
||
|
nežádoucí příhodyd sledování: 10 až 44 dní 1575 (11 studií) |
1.8%V |
2.3% (0.8 k 3.8) |
0.5% více nežádoucích příhod (1 méně až 2 více) |
⊕⊕⊝⊝ lowf, g kvůli riziku zkreslení a nekonzistence |
v nežádoucích účincích může být malý nebo žádný rozdíl. |
|
|
trvání průjmu sledování: 10 dní až 3 měsíce 897 (5 studií) |
průměrná doba trvání průjmu bez probiotik byla 4 dny. |
0.6 méně dní (1,18 až 0,02 méně dní) |
⊕⊕⊝⊝ lowh, i kvůli nepřesnosti a nekonzistenci |
může zkrátit dobu průjmu. |
||
|
stolice za den sledování: 10 dní až 3 měsíce 425 (4 studie) |
průměrná stolice denně bez probiotik byla 2, 5 stolice denně. |
0.3 méně stolice za den (o 0,6 až 0 méně) |
⊕⊕⊝⊝ lowj, k z důvodu nepřesnosti a nekonzistence |
ve stolici za den může být malý nebo žádný rozdíl. |
||
|
*základ pro riziko v kontrolní skupině (např. střední riziko kontrolní skupiny napříč studiemi) je uveden v poznámkách pod čarou. Riziko v intervenční skupině (a jeho 95% interval spolehlivosti) je založeno na předpokládaném riziku ve srovnávací skupině a relativním účinku intervence (a jeho 95% CI). CI: interval spolehlivosti; RR: poměr rizika. |
||||||
|
vysvětlení odhady rizik kontrolní skupiny pocházejí ze souhrnných odhadů kontrolních skupin. Relativní účinek na základě dostupné analýzy případů B vysoké riziko zkreslení v důsledku vysoké ztráty následného sledování. c nepřesnost způsobená několika událostmi a intervaly spolehlivosti zahrnují znatelný přínos nebo škodu. D nežádoucí účinky: vyrážka, nevolnost, plynatost, zvracení, zvýšený hlen, bolest na hrudi, zácpa, poruchy chuti a nízká chuť k jídlu. rizika byla vypočtena ze sdružených rizikových rozdílů. f vysoké riziko zkreslení. Pouze 11 z 16 studií uvádělo nežádoucí účinky, což naznačuje selektivní zkreslení hlášení. g vážná nekonzistence. Četné probiotika a dávky byly hodnoceny mezi relativně malým počtem studií, což omezuje naši schopnost vyvodit závěry o bezpečnosti mnoha probiotik a podávaných dávek. h závažná nevysvětlitelná nekonzistence (velká heterogenita I2 = 79%, hodnota P, bodové odhady a intervaly spolehlivosti se značně liší). i vážná nepřesnost. Horní hranice průjmu o 0, 02 dne méně se nepovažuje za pacientově důležitou. j závažná nevysvětlitelná nekonzistence (velká heterogenita I2 = 78%, hodnota P, bodové odhady a intervaly spolehlivosti se značně liší). k vážné nepřesnosti. 95% interval spolehlivosti nezahrnuje žádný účinek a dolní hranice 0, 60 stolice denně má sporný význam pro pacienta. |
||||||
14.1.4 vytváření tabulek „Shrnutí zjištění“
software pracovní skupiny GRADE, GRADEpro GDT (www.gradepro.org), včetně interaktivní příručky GRADE, je k dispozici, aby pomohla autorům hodnocení při přípravě tabulek „shrnutí nálezů“. GRADEpro může použít údaje o riziku srovnávací skupiny a odhadu účinku (zadané autory recenze nebo importované ze souborů generovaných v Revmanu) k vytvoření relativních účinků a absolutních rizik spojených s experimentálními intervencemi. Kromě toho vede uživatele procesem hodnocení stupně a vytváří tabulku, kterou lze použít jako samostatnou tabulku v recenzi (včetně přímého importu do softwaru, jako je RevMan nebo integrace s RevMan Web), nebo interaktivní tabulku „Shrnutí zjištění“ (viz zdroje nápovědy v GRADEpro).
14.1.5 statistické úvahy v tabulkách „souhrn nálezů“
14.1.5.1 dichotomické výsledky
„souhrn nálezů“ by měly zahrnovat absolutní i relativní míry účinku pro dichotomické výsledky. Rizikové poměry, kurzové poměry a rizikové rozdíly jsou různé způsoby porovnání dvou skupin s dichotomickými údaji o výsledcích (viz kapitola 6, bod 6.4.1). Kromě toho existují dva odlišné poměry rizika v závislosti na tom, na kterou událost (např. “ ano „nebo “ ne“) se analýza zaměřuje (viz kapitola 6, oddíl 6.4.1.5). V případě nenulového intervenčního účinku může každá změna ve studiích srovnávací skupiny rizik (tj. změna rizika události, ke které dojde bez zásahu zájmu, například u různých populací) znemožňuje, aby více než jedno z těchto opatření bylo v každé studii skutečně stejné.
v epidemiologii se dlouho předpokládalo, že relativní míry účinku jsou konzistentnější než absolutní míry účinku z jednoho scénáře do druhého. Existují empirické důkazy na podporu tohoto předpokladu (Engels et al 2000, Deeks and Altman 2001, Furukawa et al 2002). Z tohoto důvodu by metaanalýzy měly obecně používat jako měřítko účinku buď poměr rizika, nebo poměr šancí(viz kapitola 10, oddíl 10.4.3). V souladu s tím je pravděpodobné, že jediný odhad relativního účinku bude vhodnějším shrnutím než jediný odhad absolutního účinku. Pokud je relativní účinek ve všech studiích skutečně konzistentní, budou mít různá rizika srovnávacích skupin různé důsledky pro absolutní přínos. Například, pokud je poměr rizika trvale 0.75, pak by experimentální intervence snížila riziko srovnávací skupiny o 80% až 60% v intervenční skupině (absolutní snížení rizika o 20 procentních bodů), ale také by snížila riziko srovnávací skupiny o 20% až 15% v intervenční skupině (absolutní snížení rizika o 5 procentních bodů).
‚Souhrn zjištění‘ tabulky jsou postaveny na předpokladu konzistentního relativního efektu. Je proto důležité zvážit důsledky tohoto účinku pro různá rizika srovnávacích skupin (tato rizika lze odvodit nebo odhadnout z několika zdrojů, viz bod 14.1.6.3), což může vyžadovat posouzení jistoty důkazů pro prognostické důkazy (Spencer et al 2012, Iorio et al 2015). Pro každé riziko srovnávací skupiny je možné odhadnout odpovídající riziko intervenční skupiny (tj. absolutní riziko při intervenci) z metaanalytického poměru rizika nebo poměru šancí. Všimněte si, že čísla uvedená ve sloupci „odpovídající riziko“ jsou specifická pro „rizika“ v sousedním sloupci.
pro metaanalytický poměr rizik (RR) a předpokládané riziko komparátoru (ACR) se odpovídající intervenční riziko získá jako:
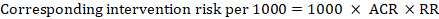 .
.
jako příklad, na obrázku 14.1.a, metaanalytický poměr rizika pro hlubokou žilní trombózu bez příznaků (DVT) je RR = 0, 10 (95% CI 0, 04 až 0, 26). Za předpokladu srovnávacího rizika ACR = 10 na 1000 = 0,01 získáme:
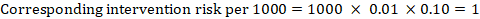 .
.
pro metaanalytický poměr šancí (OR) a předpokládané riziko komparátoru, ACR, se odpovídající intervenční riziko získá jako:
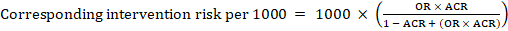 .
.
horní a dolní hranice spolehlivosti pro odpovídající intervenční riziko se získají nahrazením RR nebo nebo jejich horní a dolní mezí spolehlivosti (např. nahrazením 0.10 s 0,04, pak s 0,26, v příkladu). Tyto intervaly spolehlivosti nezahrnují nejistotu do předpokládaných srovnávacích rizik.
Při řešení rizikových poměrů je důležité, aby byla použita stejná definice „události“, jaká byla použita pro metaanalýzu. Pokud se například metaanalýza zaměřila na „smrt“ (na rozdíl od přežití) jako událost, pak odpovídající rizika v tabulce „shrnutí nálezů“ musí také odkazovat na „smrt“.
v (ojedinělých) případech, kdy existuje jasný důvod předpokládat konzistentní rozdíl rizik v metaanalýze, je v zásadě možné toto prezentovat pro relevantní „předpokládaná rizika“ a jejich odpovídající rizika a prezentovat odpovídající (odlišné) relativní účinky pro každé předpokládané riziko.
rizikový rozdíl vyjadřuje rozdíl mezi ACR a odpovídajícím intervenčním rizikem (nebo rozdíl mezi experimentální a srovnávací intervencí).
pro metaanalytický poměr rizik (RR) a předpokládané srovnávací riziko (ACR) se odpovídající rizikový rozdíl získá jako (všimněte si, že rizika lze také vyjádřit pomocí procentních nebo procentních bodů):
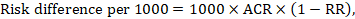
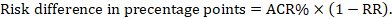
jako příklad, na obrázku 14.1.b metaanalytický poměr rizika je 0,41 (95% CI 0,29 až 0,55) u průjmu u dětí mladších 5 let. Za předpokladu rizika srovnávací skupiny 22,3% získáme:
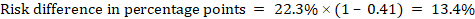 .
.
pro metaanalytický poměr šancí (OR) a předpokládané riziko komparátoru (ACR) se absolutní rizikový rozdíl získá jako (procentní body):
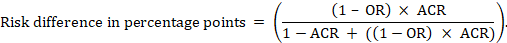
horní a dolní hranice spolehlivosti pro absolutní rizikový rozdíl se získají opětovným spuštěním výše uvedeného výpočtu při nahrazení RR nebo nebo jejich horní a dolní mezí spolehlivosti (např. nahrazení 0,41 za 0,28, pak za 0,55, v příkladu). Tyto intervaly spolehlivosti nezahrnují nejistotu do předpokládaných srovnávacích rizik.
14.1.5.2 výsledky Time-to-event
výsledky Time-to-event měří, zda a kdy dojde k určité události (např. Dopad experimentální intervence ve srovnání se srovnávací skupinou na výsledky doby od události se obvykle měří pomocí poměru rizik (HR) (viz kapitola 6, bod 6.8.1).
poměr rizik vyjadřuje odhad relativního účinku. Může být použit různými způsoby k získání absolutních rizik a dalších interpretovatelných množství pro konkrétní populaci. Zde popisujeme, jak znovu vyjádřit poměry nebezpečnosti z hlediska: i) absolutní riziko přežití bez příhod v určitém časovém období; ii) absolutní riziko příhody v určitém časovém období; a iii) střední doba do události. Všechny metody jsou postaveny na předpokladu konzistentních relativních účinků (tj.
(i) absolutní riziko přežití bez příhod v určitém časovém období přežití bez příhod (např. celkové přežití) je často hlášeno v jednotlivých studiích. K získání absolutních účinků na výsledky doby do příhody měřené jako přežití bez příhod lze souhrnný HR použít ve spojení s předpokládaným podílem pacientů, kteří jsou ve srovnávací skupině bez příhod (Tierney et al 2007). Tento podíl pacientů bude specifický pro dobu pozorování. Není však nezbytně nutné specifikovat toto časové období. Například podíl 50% pacientů bez příhod se může vztahovat na pacienty s vysokou četností příhod pozorovanou po dobu 1 roku nebo na pacienty s nízkou četností příhod pozorovanou po dobu 2 let.
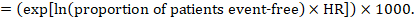
jako příklad předpokládejme, že metaanalytický poměr rizik je 0,42 (95% CI 0,25 až 0,72). Za předpokladu, že srovnávací skupina riziko přežití bez příhod (např. pro celkové přežití lidí, kteří jsou naživu) po 2 letech ACR = 900 na 1000 = 0,9 získáme:
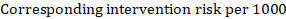
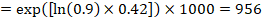
aby bylo 956 na 1000 lidí naživu s experimentálním zásahem za 2 roky. Odvození rizika by mělo být vysvětleno v poznámce nebo poznámce pod čarou.
(ii) absolutní riziko události v určitém časovém období k dosažení tohoto absolutního účinku lze opět použít souhrn HR (Tierney et al 2007):
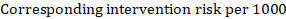
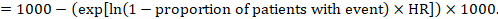
v příkladu předpokládejme, že předpokládáme riziko událostí ve srovnávací skupině (např. u úmrtnosti, úmrtí lidí) po 2 letech ACR = 100 na 1000 = 0,1. Získáváme:
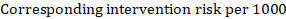
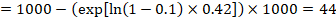
takže 44 na 1000 lidí bude mrtvých s experimentálním zásahem za 2 roky.
(iii) medián doby do příhody místo absolutních čísel lze čas do příhody v intervenčních a srovnávacích skupinách vyjádřit jako medián doby přežití v měsících nebo letech. K získání mediánu doby přežití lze souhrnnou HR aplikovat na předpokládanou střední dobu přežití ve srovnávací skupině (Tierney et al 2007):
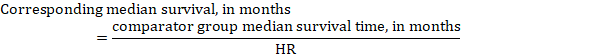
v příkladu, za předpokladu, že srovnávací skupina medián doby přežití 80 měsíců, získáme:
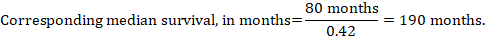
pro všechny tři z těchto možností opětovného vyjádření výsledků analýz času do události se horní a dolní hranice spolehlivosti pro odpovídající intervenční riziko získají nahrazením HR horní a dolní mezí spolehlivosti (např. nahrazení 0,42 0,25, pak 0,72, v příkladu). Opět platí, že pokud jde o dichotomické výsledky, takové intervaly spolehlivosti nezahrnují nejistotu do předpokládaných rizik srovnávací skupiny. To je zvláště důležité pro dlouhodobé přežití s nízkou nebo střední úmrtností a odpovídajícím vysokým počtem cenzurovaných pacientů(tj.
14.1.6 podrobný obsah tabulky „souhrn nálezů“
14.1.6.1 název a záhlaví tabulky
název každé tabulky „souhrn nálezů“ by měl specifikovat otázku zdravotní péče, která je rámována s ohledem na populaci a jasně ukazuje, jaké srovnání intervencí se provádí. Na Obrázku 14.1.a, populace jsou lidé, kteří podnikají dlouhé lety letounů, zásah je kompresní punčochy a kontrola není kompresní punčochy.
první řádky každé tabulky „souhrn nálezů“ by měly obsahovat následující informace „záhlaví“:
pacienti nebo populace to dále objasňuje populaci (a případně subpopulace) zájmu a v ideálním případě velikost rizika nejdůležitějšího nepříznivého výsledku, na který je intervence zaměřena. Například, lidé na dálkovém letu mohou být pro DVT vystaveni různým rizikům; ti, kteří užívají selektivní inhibitory zpětného vychytávání serotoninu (SSRI), mohou mít různé riziko nežádoucích účinků; zatímco u pacientů s fibrilací síní může být nízké (< 1%), střední (1% až 4%) nebo vysoké (> 4%) roční riziko mrtvice.
nastavení toto nastavení by mělo uvádět jakékoli specifické charakteristiky nastavení otázky zdravotní péče, které by mohly omezit použitelnost souhrnu zjištění na jiná nastavení (např. primární péče v Evropě a Severní Americe).
intervence experimentální intervence.
srovnání srovnávací intervence (včetně žádné specifické intervence).
14.1.6.2 výsledky
řádky tabulky „souhrn nálezů“ by měly obsahovat všechny žádoucí a nežádoucí zdravotní výsledky (uvedené v pořadí podle důležitosti), které jsou nezbytné pro rozhodování, až do maximálně sedmi výsledků. Pokud je v přehledu více výsledků, autoři hodnocení budou muset vynechat méně důležité výsledky z tabulky a rozhodnutí o výběru výsledků, které jsou pro přezkum kritické nebo důležité, by mělo být učiněno během vývoje protokolu (viz kapitola 3). Autoři hodnocení by měli poskytnout časové rámce pro měření výsledků (např. 90 dní nebo 12 měsíců) a typ skóre nástroje (např. v rozmezí od 0 do 100).
Všimněte si, že autoři hodnocení by měli do tabulky zahrnout předem specifikované kritické a důležité výsledky, ať už jsou data k dispozici nebo ne. Měli by však být upozorněni na možnost, že význam výsledku (např. závažný nepříznivý účinek) může být znám až po sepsání protokolu nebo provedení analýzy, a měli by přijmout vhodná opatření k jejich zařazení do tabulky „Souhrn zjištění“.
tabulka „souhrn nálezů“ může zahrnovat účinky v podskupinách populace pro různé srovnávací rizika a velikosti účinků odděleně. Například na obrázku 14.1.B účinky jsou uvedeny pro děti mladší a starší než 5 let Samostatně. Autoři hodnocení se také mohou rozhodnout vytvořit samostatné tabulky „shrnutí nálezů“ pro různé populace.
autoři hodnocení by měli zahrnout závažné nežádoucí účinky, ale mohlo by být možné kombinovat menší nežádoucí účinky jako jediný výsledek a popsat to ve vysvětlující poznámce pod čarou (všimněte si, že není vhodné přidávat události dohromady, pokud nejsou nezávislé, to znamená, že účastník, který zažil jednu nežádoucí příhodu, má neovlivněnou šanci zažít druhou nežádoucí příhodu).
výsledky měřené ve více časových bodech představují konkrétní problém. Obecně, aby byla Tabulka jednoduchá, autoři recenzí by měli prezentovat více časových bodů pouze pro výsledky kritické pro rozhodování, kde se výsledek nebo přijaté rozhodnutí pravděpodobně budou v průběhu času lišit. Zbytek by měl být předložen ve společném časovém bodě, pokud je to možné.
autoři hodnocení mohou v tabulce „Shrnutí zjištění“ prezentovat průběžná výsledková opatření a měli by se snažit, aby byla interpretovatelná pro cílové publikum. To vyžaduje, aby jednotky byly jasné a snadno interpretovatelné, například dny bolesti nebo frekvence bolesti hlavy, a měl by být uveden název a měřítko všech použitých měřicích nástrojů(např. vizuální analogová stupnice v rozmezí od 0 do 100). Nicméně, mnoho měřicích přístrojů není snadno interpretovatelné nespecializovanými klinickými lékaři nebo pacienty, například, body na inventáři deprese Beck nebo skóre kvality života. Pro tyto účely může interpretovatelnější prezentace zahrnovat převod kontinuálního na dichotomický výsledek, jako je >50% zlepšení (viz kapitola 15, ODDÍL 15.5).
14.1.6.3 nejlepší odhad rizika s komparátorovou intervencí
autoři hodnocení by měli poskytnout až tři typická rizika pro účastníky, kteří dostávali komparátorovou intervenci. U dichotomických výsledků doporučujeme, aby byly prezentovány ve formě počtu lidí, kteří prožívají událost na 100 nebo 1000 osob (přirozená frekvence) v závislosti na frekvenci výsledku. U kontinuálních výsledků by to bylo uvedeno jako střední nebo střední hodnota měřeného výsledku.
odhadovaná nebo předpokládaná srovnávací intervenční rizika by mohla být založena na hodnocení typických rizik u různých skupin pacientů odvozených ze samotného přezkumu, individuálních reprezentativních studií v přezkumu nebo rizik vyplývajících ze systematického přezkumu studií prognózy nebo jiných zdrojů důkazů, které mohou zase vyžadovat posouzení jistoty prognostických důkazů (Spencer et al 2012, Iorio et al 2015). V ideálním případě by rizika odrážela skupiny, které mohou lékaři snadno identifikovat na základě svých prezentačních vlastností.
vysvětlující poznámka pod čarou by měla uvádět zdroj nebo zdůvodnění pro každé riziko srovnávací skupiny, včetně časového období, kterému případně odpovídá. Na Obrázku 14.1.a, lékaři mohou snadno odlišit jedince s rizikovými faktory pro hlubokou žilní trombózu od osob bez. Pokud je známo, že počáteční riziko je malé, mohou autoři hodnocení použít medián rizika srovnávací skupiny napříč studiemi. Pokud nejsou známa typická rizika, je možné zvolit riziko ze zahrnutých studií, které poskytují druhé nejvyšší pro vysoce a druhé NEJNIŽŠÍ pro populaci s nízkým rizikem.
14.1.6.4 riziko s intervencí
pro dichotomické výsledky by autoři hodnocení měli poskytnout odpovídající absolutní riziko pro každé riziko srovnávací skupiny spolu s intervalem spolehlivosti. Toto absolutní riziko při (experimentální) intervenci bude obvykle odvozeno z výsledku metaanalýzy prezentovaného ve sloupci relativní účinek (viz bod 14.1.6.6). Vzorce jsou uvedeny v oddíle 14.1.5. Autoři hodnocení by měli uvést absolutní účinek ve stejném formátu jako rizika při komparátorovém zásahu (viz bod 14.1.6.3), například jako počet osob, které Událost zažily na 1000 osob.
pro kontinuální výsledky by měl být prezentován rozdíl v prostředcích nebo standardizovaný rozdíl v prostředcích s intervalem spolehlivosti. Ty budou obvykle získány přímo z metaanalýzy. Vysvětlující text by měl být použit k objasnění významu, jako na obrázcích 14.1.a a 14.1.b.
14.1.6.5 rizikový rozdíl
u dichotomických výsledků lze rizikový rozdíl poskytnout pomocí jednoho z formátů tabulky „shrnutí nálezů“ jako další možnost (viz obrázek 14.1.B). Tento rozdíl rizika vyjadřuje rozdíl mezi experimentální a komparátorovou intervencí a obvykle bude odvozen z výsledku metaanalýzy prezentovaného ve sloupci relativního účinku(viz bod 14.1.6.6). Vzorce jsou uvedeny v oddíle 14.1.5. Autoři hodnocení by měli uvést rizikový rozdíl ve stejném formátu, jak se předpokládalo, a odpovídající rizika s komparátorovou intervencí (viz bod 14.1.6.3); například jako počet osob, které zažily událost na 1000 osob, nebo jako procentní body, pokud jsou předpokládaná a odpovídající rizika vyjádřena v procentech.
pokud tabulka „Souhrn zjištění“ obsahuje tuto možnost, může být zde uveden průměrný rozdíl a sloupec „odpovídající riziko“ ponechán prázdný (viz obrázek 14.1.B).
14.1.6.6 relativní účinek (95% CI)
relativním účinkem bude obvykle poměr rizika nebo odds ratio (nebo příležitostně poměr rizika) s doprovodným 95% intervalem spolehlivosti, získaným z metaanalýzy provedené na základě stejného opatření účinku. Rizikové poměry a poměry šancí jsou podobné, pokud jsou rizika intervence srovnávače nízká a účinky jsou malé, ale mohou se značně lišit, pokud se rizika srovnávacích skupin zvýší. Metaanalýza může zahrnovat předpoklad fixních nebo náhodných účinků v závislosti na tom, co autoři hodnocení považují za vhodné, a z čehož vyplývá, že relativní účinek je buď odhad účinku intervence, nebo odhad průměrného účinku intervence napříč studiemi, resp.
14.1.6.7 počet účastníků (studií)
tento sloupec by měl zahrnovat počet účastníků hodnocených v zahrnutých studiích pro každý výsledek a odpovídající počet studií, které přispěly k těmto účastníkům.
14.1.6.8 jistota důkazů (stupeň)
autoři hodnocení by se měli vyjádřit k jistotě důkazů(také známý jako kvalita souboru důkazů nebo důvěra v Odhady účinku). Autoři přezkumu by měli používat specifický systém hodnocení důkazů vyvinutý pracovní skupinou pro hodnocení (Atkins et al 2004, Guyatt et al 2008, Guyatt et al 2011a), který je podrobně popsán v bodě 14.2. Přístup stupně kategorizuje jistotu v souboru důkazů jako „vysokou“, „střední“, „nízkou“ nebo „velmi nízkou“ podle výsledku. Je to výsledek úsudku, ale proces úsudku funguje v transparentní struktuře. Jako příklad, jistota by byla „vysoká“, pokud by souhrn byl z několika randomizovaných studií s nízkým rizikem zkreslení, ale hodnocení jistoty se sníží, pokud existují obavy z rizika zkreslení, nekonzistence, nepřímosti, nepřesnosti nebo zkreslení publikace. Jiná rozhodnutí než „vysoká“ jistota by měla být zprůhledněna pomocí vysvětlujících poznámek pod čarou nebo sloupce „komentáře“v tabulce“ Shrnutí zjištění “ (viz bod 14.1.6.10).
14.1.6.9 Komentáře
cílem pole „komentáře“ je pomoci interpretovat informace nebo data identifikovaná v řádku. Může se jednat například o platnost výsledného opatření nebo o přítomnost proměnných, které jsou spojeny s velikostí účinku. Důležité upozornění na výsledky by měly být označeny zde. Ne všechny řádky budou potřebovat komentáře a je nejlepší nechat prázdné, pokud neexistuje nic, co by opravňovalo komentář.
14.1.6.10 vysvětlení
podrobné vysvětlení by mělo být zahrnuto jako poznámky pod čarou na podporu rozsudků v tabulce „Shrnutí zjištění“, jako je Celkové hodnocení stupně. Vysvětlení by měla popisovat důvody pro důležité aspekty obsahu. Tabulka 14.1seznam pokyny pro užitečné vysvětlení. Vysvětlení by měla být stručná, informativní, relevantní, snadno srozumitelná a přesná. Pokud vysvětlení nelze dostatečně popsat v poznámkách pod čarou, autoři přezkumu by měli poskytnout další podrobnosti o problémech ve výsledcích a diskusních částech přezkumu.
tabulka 14.1.pokyny pro poskytování užitečných vysvětlení v tabulkách „Shrnutí zjištění“ (SoF). Převzato z Santesso et al (2016)
obecné pokyny
- pokud je to možné, zadejte informace pro čtenáře přímo do tabulky (např. informace o délce sledování nebo použité stupnici).
- obecně neuvádějte odkazy v části vysvětlení, pokud neexistují konkrétní důvody, například pro poskytnutí informací o zdrojích základních rizik (viz bod 3).
- uveďte zdroj informací o základních rizicích použitých pro výpočet absolutních účinků.
- po dokončení tabulky zkontrolujte všechna vysvětlení a zjistěte, zda by některá mohla být odkazována vícekrát, pokud by byla přepracována nebo kombinována.
- uveďte důvody pro upgrade a snížení hodnocení důkazů (viz pokyny specifické pro doménu níže) a použijte software GRADEpro GDT k dodržování pokynů pro známku.
- soubor důkazů pro konkrétní výsledek může být stanoven jako závažný nebo velmi závažný problém pro postiženou doménu (nebo kriticky závažný pro riziko zaujatosti při použití ROBINS-I). Proto může být užitečné uvést počet úrovní pro downgrading (např. downgraded o jednu úroveň pro riziko zkreslení), ale vyhnout se opakování toho, co je v tabulce (a dojem formulačního nebo algoritmického hlášení). V profilech důkazů jsou tyto informace již v buňkách tabulky.
- ačkoli vysvětlení jistoty v důkazech je vyžadováno především tehdy, když mění jistotu, zvažte přidání vysvětlení, pokud jistota v důkazech nebyla změněna, ale pokud toto rozhodnutí mohou ostatní zpochybnit. To pomůže pochopit důvody neshody.
- Zajistěte, aby tabulka nebyla použita jako popis metod přezkumu (např. nepopisujte důvody statistické analýzy).
- zadejte výsledky pro výsledky, které nemohly být statisticky kombinovány v metaanalýze (tj. narativní výsledky) přímo do tabulky SoF ve sloupcích výsledků. Vysvětlení nemusí být nutné pro sdělení těchto výsledků. Je-li to považováno za přínosné pro zamýšlené publikum, přidejte do sloupce komentářů doplňkové odhady intervenčních účinků (např. počet potřebný k léčbě ve prospěch a újmu, rozdíl rizik vyjádřený v procentech, nepřetržitý výsledek vyjádřený v jednotkách minimálních významných rozdílů).
- použijte informace uvedené ve vysvětleních o procesu hodnocení k informování dalších klíčových částí přezkumu, včetně souhrnných verzí a diskuse.
pokyny specifické pro doménu pro psaní užitečných vysvětlení
riziko zaujatosti
- popisují počet studií nebo množství informací, které poskytují v metaanalýze, které byly vystaveny vysokému riziku zaujatosti a pro které kritérium.
- používejte termíny jako většina, menšina, všechny, některé nebo žádné; nebo počet studií jako X/X studie.
- pro randomizované studie uveďte specifická kritéria včetně utajení alokační sekvence, selektivní hlášení výsledků atd. Pro nerandomizované studie popište kritérium v použitém nástroji (např. pomocí nástroje ROBINS-I).
- uveďte, zda byl účinek rizika zkreslení zkoumán v analýze citlivosti. Je-li to vhodné, uveďte příspěvek studií s vysokým rizikem zaujatosti k odhadům.
- informace o návrhu studie mohou být zahrnuty do vysvětlení, zejména v SoF, pokud jsou zahrnuty různé návrhy Studie.
nekonzistence
- označuje opatření použité k posouzení nekonzistence, jako je statistický test nebo míra (I2, Chi2, Tau) nebo překrývání intervalů spolehlivosti nebo podobnost bodových odhadů.
- pokud je nekonzistence založena na I2, popište ji jako značnou, podstatnou, střední nebo nevýznamnou.
- v případě potřeby uveďte, zda byla heterogenita zkoumána v analýzách podskupin společností PICO (pacienti, intervence, srovnání, výsledek) a zda existují další potenciální důvody heterogenity.
- v případě jediné studie pro výsledek uveďte, že neexistuje „žádná“, spíše než „nepoužije se“.
nepřesnost
- označuje, kde velikost vzorku nebo počet událostí nesplňuje vypočtenou optimální velikost informací, nebo „pravidla“ (např. 400 událostí). Vyhněte se odkazu na počet studií jako důvod nepřesnosti.
- uveďte, zda intervaly spolehlivosti zahrnují možnost malého nebo žádného účinku a významného prospěchu nebo poškození. Pokud je známo, uveďte číselnou hodnotu prahu důležitého přínosu.
- vyvarujte se hlášení výsledku jako statisticky nebo statisticky významného.
upgrade
- uveďte důvod pro upgrade: kvůli velkému účinku; gradient odezvy na dávku; nebo věrohodné zbytkové protichůdné zmatení zvyšuje jistotu důkazů.
- u velkých efektů oznamte, zda je relativní účinek >2 nebo >5. U gradientů odpovědi na dávku Uveďte úroveň intervence a účinek na výsledek. Pro doménu „věrohodné zbytkové protichůdné zmatení“ popište vliv matoucího faktoru na odhad.
14.2 posouzení jistoty nebo kvality souboru důkazů
14.2.1 přístup ke známkám
pracovní skupina pro doporučení, hodnocení, vývoj a hodnocení (pracovní skupina pro hodnocení) vyvinula systém pro hodnocení jistoty důkazů (Schünemann et al 2003, Atkins et al 2004, Schünemann et al 2006, Guyatt et al 2008, Guyatt et al 2011a). Více než 100 organizací včetně Světové zdravotnické organizace (WHO), American College of Physicians, American Society of Hematology (ASH), kanadské agentury pro drogy a technologie ve zdraví (CADTH) a National Institutes of Health and Clinical Excellence (NICE) ve Velké Británii přijaly systém hodnocení (www.gradeworkinggroup.org).
Cochrane také formálně přijal tento přístup a všechny Cochraneovy recenze by měly používat GRADE k vyhodnocení jistoty důkazů pro důležité výsledky (viz Mecir Box 14.2.a).
MECIR Box 14.2.relevantní očekávání pro provádění intervenčních přezkumů
|
C74: posouzení jistoty důkazního souboru (povinné) |
|
|
k posouzení jistoty souboru důkazů pro každý výsledek a k vyvození závěrů o jistotě důkazů v textu přezkumu použijte pět úvah stupně (riziko zaujatosti, důslednost účinku, nepřesnost, nepřímost a publikační zaujatost). |
stupeň je nejpoužívanějším přístupem pro shrnutí důvěry v účinky intervencí podle výsledku napříč studiemi. Je vhodnější použít nástroj online GRADEpro a používat jej, jak je popsáno v systému nápovědy softwaru. To by mělo pomoci zajistit, aby autorské týmy přistupovaly ke stejným informacím, aby informovaly své úsudky. V ideálním případě by dva lidé pracující nezávisle měli posoudit jistotu souboru důkazů a dosáhnout konsenzuálního názoru na jakákoli rozhodnutí o snížení ratingu. Pět úvah o stupni by se mělo zabývat bez ohledu na to, zda přezkum obsahuje tabulku „Shrnutí zjištění“. Je užitečné čerpat z těchto informací v diskusi, v závěrech autorů a sdělit jistotu v důkazech v abstraktním a přehledném jazykovém shrnutí. |
|
C75: odůvodňující posouzení jistoty důkazního souboru (povinné) |
|
|
zdůvodnit a zdokumentovat všechna hodnocení jistoty souboru důkazů (např. snížení nebo zlepšení pomocí stupně). |
přijetí strukturovaného přístupu zajišťuje transparentnost při formulování interpretace důkazů a výsledek je pro uživatele informativnější. |
pro systematické přezkumy, přístup stupně definuje jistotu souboru důkazů jako rozsah, v jakém si lze být jisti, že odhad účinku nebo asociace se blíží množství konkrétního zájmu. Posouzení jistoty souboru důkazů zahrnuje zvážení rizika zkreslení v rámci studie a napříč studií (omezení v návrhu a provedení studie nebo metodické kvalitě), nekonzistence (nebo heterogenity), nepřesnosti důkazů, nepřesnosti odhadů účinku a rizika zkreslení publikace (viz oddíl 14.2.2), jakož i oblastí, které mohou zvýšit naši důvěru v odhad účinku (jak je popsáno v bodě 14.2.3). Systém známek zahrnuje posouzení jistoty souboru důkazů pro každý jednotlivý výsledek. Rozsudky o doménách, které určují jistotu důkazů, by měly být popsány v části výsledky nebo diskuse a jako součást tabulky „Shrnutí zjištění“.
přístup stupně určuje čtyři úrovně jistoty (obrázek 14.2.a). Pro intervence, včetně diagnostických a dalších testů, které jsou hodnoceny jako intervence (Schünemann et al 2008b, Schünemann et al 2008a, Balshem et al 2011, Schünemann et al 2012), je výchozí bod pro hodnocení jistota důkazů je rozdělena do dvou typů:
- randomizované studie; a
- nerandomizované studie intervencí (NRSI), včetně observačních studií (včetně, ale bez omezení na kohortové studie a případové kontrolní studie, průřezové studie, série případů a kazuistiky, i když ne všechny tyto návrhy jsou obvykle zahrnuty do Cochraneových recenzí).
existuje mnoho případů, kdy autoři hodnocení spoléhají na informace z NRSI, zejména při hodnocení potenciálních škod (viz kapitola 24). Kromě toho mohou autoři recenze získat relevantní data z randomizovaných studií i NRSI, přičemž každý typ důkazů doplňuje druhý (Schünemann et al 2013).
ve stupni začíná soubor důkazů z randomizovaných studií hodnocením s vysokou jistotou, zatímco soubor důkazů z NRSI začíná hodnocením s nízkou jistotou. Nižší hodnocení s NRSI je výsledkem potenciálního zkreslení vyvolaného nedostatkem randomizace(tj.
Při použití nového rizika zkreslení v nerandomizovaných studiích intervencí (ROBINS-I) nástroj (Sterne et al 2016), nástroj pro hodnocení, který pokrývá riziko zkreslení v důsledku nedostatečné randomizace, mohou všechny studie začít jako vysoká jistota důkazů (Schünemann et al 2018). Přístup zahájení všech návrhů studií (včetně NRSI) jako vysoké jistoty není v rozporu s přístupem počátečního stupně zahájení hodnocení NRSI jako důkaz nízké jistoty. Je to proto, že soubor důkazů z NRSI by měl být obecně snížen o dvě úrovně kvůli inherentnímu riziku zkreslení spojenému s nedostatkem randomizace, jmenovitě matoucí a výběrové zkreslení. Nesnižování nrsi z vysoké na nízkou jistotu vyžaduje transparentní a podrobné zdůvodnění toho, co zmírňuje obavy z matení a zkreslení výběru (Schünemann et al 2018). V současné době existuje jen velmi málo příkladů, kdy není vhodné snížit hodnocení o dvě úrovně.
nejvyšší hodnocení jistoty je soubor důkazů, pokud neexistují žádné obavy v žádném z faktorů stupně uvedených na obrázku 14.2.a. autoři recenze často snižují důkazy na mírné, nízké nebo dokonce velmi nízké důkazy jistoty v závislosti na přítomnosti pěti faktorů na obrázku 14.2.a. hodnocení jistoty obvykle klesne o jednu úroveň pro každý faktor, maximálně o tři úrovně pro všechny faktory. Pokud existují velmi závažné problémy pro jednu doménu (např. při hodnocení rizika zaujatosti byly všechny studie neuzavřeny, nezaslepeny a ztratily více než 50% svých pacientů k následnému sledování), důkazy mohou klesnout o dvě úrovně kvůli tomuto faktoru samotnému. Není možné hodnotit důkazy nižší než „velmi nízká jistota“.
autoři recenze budou obecně Hodnotit důkazy ze zvukových nerandomizovaných studií jako nízkou jistotu, i když se používá ROBINS-I. Pokud však takové studie přinášejí velké účinky a neexistuje zjevná zaujatost vysvětlující tyto účinky, autoři hodnocení mohou důkazy hodnotit jako mírné nebo – pokud je účinek dostatečně velký-dokonce jako vysokou jistotu (obrázek 14.2 .a). Velmi nízká úroveň jistoty je vhodná pro studie s kritickými problémy a nesystematickými klinickými pozorováními (např. série případů nebo kazuistiky), ale není omezena pouze na tyto studie.