se zraněním zdravé tkáně se rozvíjí předvídatelná progrese fyziologických událostí. Tento postup lze rozdělit na fáze zánětu, proliferace a zrání. Každá fáze je charakterizována postupným zpracováním charakteristických cytokinů specifickými buňkami. Podívejte se na obrázky níže.
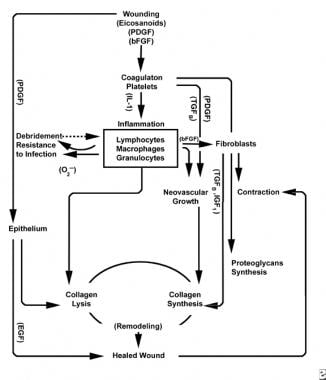 schémata procesu hojení ran.
schémata procesu hojení ran. 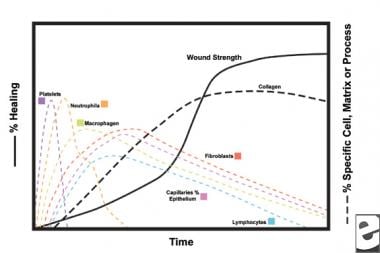 buněčné charakteristiky procesu hojení ran.
buněčné charakteristiky procesu hojení ran. zánětlivá fáze
zánětlivá fáze současně spouští hemostatické mechanismy a cesty, které vytvářejí klinicky rozpoznatelné kardinální příznaky zánětu: rubor (zarudnutí), calor (teplo), nádor (otok), dolor (bolest) a functio laesa (ztráta funkce).
poranění vaskulární tkáně iniciuje vnější koagulační kaskádu uvolněním intracelulárního vápníku a tkáňového faktoru, které aktivují faktor VII. výsledná fibrinová zátka dosahuje hemostázy podporované reflexní vazokonstrikcí. Tato zástrčka působí jako mřížka pro agregaci krevních destiček, nejběžnějšího a“ podpisového “ buněčného typu časné zánětlivé fáze.
krevní destičky zpracovávají řadu prozánětlivých látek, jako je adenosin difosfát, tkáňový růstový faktor beta (TGF-ß)a růstové faktory odvozené od krevních destiček (PDGF). Tyto růstové faktory působí na okolní buňky a stimulují chemotaxi neutrofilů, monocytů a fibroblastů do oblasti poranění.
poškozené tkáně prostřednictvím aktivované fosfolipázy a současně katalyzují kyseliny arachidonové za vzniku vazoaktivních prostaglandinů a tromboxanu, souhrnně známých jako eikosanoidy. Eikosanoidy zprostředkovávají aktivitu ovlivňující tvorbu destiček, vaskulární permeabilitu a buněčnou chemotaxi, aby ovlivnily hojení ran. Například tromboxan A2 zprostředkovává vazokonstrikci a agregaci krevních destiček.
po počáteční vazokonstrikci se klasické příznaky zánětu projevují zvýšenou vaskulární permeabilitou. Rubor je výsledkem vazodilatace zprostředkované prostacyklinem (PGI2), prostaglandinem a (PGA), prostaglandinem D (PGD) a prostaglandinem E (PGE). Nádor a kalorie se vyvíjejí, jak se zvětšují vaskulární endoteliální mezery, což umožňuje výstup plazmatických bílkovin a tekutin do intersticiálního prostoru. Tyto změny jsou potencovány PGE2 a prostaglandinem F2a (PGF2a) a umožňují pronikání zánětlivých buněk do oblasti poranění, včetně buněk, které se vyvíjejí. Dolor je vnímán jako PGI2, PGE a PGE2 působí na periferní nociceptory.
ve druhé fázi zánětlivé fáze leukocyty nahrazují krevní destičky jako dominantní buněčný typ, přitahovaný chemotaxií. Bílé krvinky (WBC) jsou převládajícími buňkami po dobu prvních 3 dnů po poranění; jejich počet vrcholí přibližně 48 hodin. Polymorfonukleocyty (PMN) jsou první, kdo zahájil baktericidní aktivitu pomocí zánětlivých mediátorů a metabolitů volných radikálů kyslíku. Normální hojení ran však může nastat bez PMNs. Další leukocyt, pomocná T buňka, zpracovává interleukin-2 (IL-2). IL-2 podporuje další proliferaci T buněk, aby se zvýšila imunogenní odpověď na poranění.
jak leukocyty PMN začnou ubývat po 24-36 hodinách, cirkulující monocyty vstupují do rány a dozrávají do tkáňových makrofágů. Tyto buňky debridují ránu na mikroskopické úrovni a produkují širokou škálu důležitých látek, jako je IL-1 a základní růstový faktor fibroblastů (bFGF). IL-1 stimuluje proliferaci zánětlivých buněk a podporuje angiogenezi replikací endotelových buněk. bfgf je chemotaktický a mitogenní faktor pro fibroblasty a endotelové buňky. Na rozdíl od PMN deplece makrofágů vážně narušuje hojení ran, protože debridement, proliferace fibroblastů a angiogeneze se snižují.
ke konci zánětlivého cyklu interaguje vyvíjející se prostředí eikosanoidů v ráně s přítomnými buněčnými typy, což vede k syntéze fibroblastů kolagenu a mleté látky (ze zvýšeného poměru PGF2a k PGE2). Kromě toho jsou růstové faktory odvozené od makrofágů nyní na optimální úrovni, což silně ovlivňuje příliv fibroblastů a poté keratinocytů a endotelových buněk do rány. Jak mononukleární buňky nadále nahrazují WBC a makrofágy, začíná proliferativní fáze.
proliferativní fáze
dva až tři dny po poranění fibroblasty migrují dovnitř z okrajů rány přes fibrinózní matrici vytvořenou během zánětlivé fáze. Během prvního týdne začnou fibroblasty produkovat glykosaminoglykany a proteoglykany, mletou látku pro granulační tkáň, stejně jako kolagen, v reakci na bfgf a TGF-ß syntetizované makrofágy, stejně jako PDGF.
fibroblasty se brzy stanou dominantním typem buněk a vrcholí 1-2 týdny. Generují nejen molekuly kolagenu, ale také cytokiny, jako jsou PDGF, TGF-ß,bFGF, keratinocytární růstový faktor a inzulinový růstový faktor-1. Fibroblasty také sestavují molekuly kolagenu do vláken, která jsou zesítěna a organizována do svazků. Kolagen je hlavní složkou pojivové tkáně akutní rány, přičemž čistá produkce pokračuje dalších 6 týdnů. Rostoucí obsah kolagenu rány koreluje se zvyšující se pevností v tahu.
keratinocyty a endotelové buňky také proliferují během této doby, nakonec produkují autokrinní růstové faktory, které udržují jejich růst. Endoteliální expanze přispívá k angiogenezi, protože intaktní cévy vytvářejí pupeny v granulační tkáni. Neovaskularizace usnadňuje růst postupující linie fibroblastů do rány a poskytuje jim potřebné živiny a cytokiny.
degradace fibrinové sraženiny a provizorní matrice je doprovázena ukládáním granulační tkáně (mletá látka, kolagen, kapiláry), která pokračuje až do zakrytí rány. Snížení hladiny kyseliny hyaluronové (v mleté látce) a zvýšení hladiny chondroitin sulfátu zpomalují migraci a proliferaci fibroblastů a zároveň indukují diferenciaci fibroblastů a přecházejí do fáze zrání hojení ran.
fáze zrání
po dobu prvních 6 týdnů dominuje nová produkce kolagenu v procesu hojení ran, náhodně uloženého v akutní granulační tkáni rány. Jak rána zraje, kolagen je přeměněn na organizovanější strukturu se zvýšenou pevností v tahu. Kolagen typu I postupně nahrazuje typ III, dokud není dosaženo normálního poměru kůže 4: 1. Jak remodelace pokračuje, kolagenolýza matrix metaloproteinázy dosahuje ustáleného stavu syntézou kolagenu. Pevnost v tahu plošiny na 80% původní pevnosti přibližně 1 rok postinjury.
povrchní k této aktivitě epiteliální buňky pokračují v migraci dovnitř od okraje rány, dokud není vada zakryta. V tomto okamžiku kontaktní inhibice indukuje transformaci fibroblastů na myofibroblasty, které obsahují kontraktilní aktinová vlákna. Následuje kontrakce rány, která nahradí zraněný objem tkáně novou tkání, i když přesná role myofibroblastu nebyla zcela objasněna.
odstrašující prostředky k hojení ran
akutní rány obvykle probíhají řádným a včasným opravným procesem, který má za následek trvalé obnovení anatomické a funkční integrity. Různé fyziologické a mechanické faktory však mohou zhoršit hojivou odpověď, což má za následek chronickou ránu, která neprobíhá obvyklým postupným postupem. Nejčastěji jsou odpovědné lokální infekce, hypoxie, trauma, cizí těla nebo systémové problémy, jako je diabetes mellitus, podvýživa, imunodeficience nebo léky.
všechny rány jsou kontaminovány, ale nejúspěšněji odolávají invazivní infekci. Když koncentrace přesáhne 100 000 (105) organismů na gram tkáně nebo dojde k ohrožení imunitního systému, často dochází k infekci. Celulitida prodlužuje zánětlivou fázi udržováním vysokých hladin prozánětlivých cytokinů a tkáňových proteáz, které degradují granulační tkáň a tkáňové růstové faktory, a zpožděním ukládání kolagenu.
Debridement (chirurgické, enzymatické a / nebo obvazové změny) a antibiotika jsou základem léčby antibiotiky. Debridement odstraňuje devitalizovanou tkáň, která může být zdrojem endotoxinů, které inhibují migraci fibroblastů a keratinocytů do rány. Cizí tělesa mohou také vyžadovat odstranění, protože přítomnost hedvábného stehu snižuje počet bakterií potřebných k podněcování infekce 10 000krát. (Podrobný popis techniky viz Medscape referenční článek odstranění cizího těla rány.)
buněčná hypoxie zpomaluje hojení ran různými způsoby. Síťování kolagenových fibrilů vyžaduje kyslík k hydroxylátu prolinu a lysinu a selhává, když je tlak tkáně nižší než 40 mm Hg. Baktericidní účinnost oxidační fosforylace leukocytů také trpí v hypoxickém prostředí, což snižuje prahovou hodnotu infekce. Opatření ke zlepšení dodávání kyslíku závisí na etiologii. Užívání tabáku, které způsobuje vazokonstrikci a zvyšuje přilnavost krevních destiček, by mělo být zastaveno. Pro onemocnění periferních cév může být vyžadována angioplastika nebo arteriální bypass. Mohou být indikována doplňková opatření ke zlepšení systémové perfúze v případě srdečního selhání. Hodnota hematokritu nižší než 15% by měla být léčena a podle potřeby obnovena euvolemie. Žilní staze nebo lymfatická nedostatečnost mohou být zlepšeny kompresními oděvy.
systémové onemocnění může výrazně prodloužit nebo přerušit hojení ran. Glykosylace u diabetes mellitus zhoršuje neutrofilní a makrofágovou fagocytózu bakterií a prodlužuje zánětlivou fázi. Proliferativní fáze je také prodloužena u stejného onemocnění, protože erytrocyty jsou méně ohebné a méně schopné dodávat kyslík do rány pro tkáňový metabolismus a syntézu kolagenu.
podvýživa má za následek sníženou proliferaci fibroblastů, zhoršenou neovaskularizaci a sníženou buněčnou a humorální imunitu. Rány mají zvýšené metabolické nároky, zejména v granulační tkáni. Aminokyseliny, jako je methionin, prolin, glycin a lysin, jsou nezbytné pro normální funkci buněk a opravu kožních ran. Mastné kyseliny jsou kritickými složkami buněčných membrán a jsou substrátem pro eikosanoidy, které zprostředkovávají zánětlivý proces. Esenciální mastné kyseliny linolenová a kyselina linolová musí být dodány ve stravě, protože lidské tělo není schopno de novo syntézy těchto molekul.
pro buněčný metabolismus musí být k dispozici dostatečné vitamíny a minerály, které působí jako buněčné signály a kofaktory. Vitamin C (kyselina askorbová) a železo jsou potřebné pro hydroxylaci lysinu a prolinu, které zesíťují a stabilizují strukturu trojité šroubovice kolagenu; měď také hraje roli při stabilizaci kolagenu. Vitamin A (kyselina retinová) hraje důležitou roli při modulaci produkce a degradace kolagenu a je zvláště důležitý při epitelizaci. Zdá se, že silný antioxidant, vitamin E (Alfa tokoferol) urychluje hojení kůže a kostí u zvířat a suplementace může mít roli u lidí. Nedostatek stopového kovu, zejména zinku, je také spojen se špatným hojením ran; to by mělo být podle potřeby doplněno.
Ovid údajně napsal, “ léky se někdy uzdravují.“, někdy zabít.“To je jistě pravda, pokud jde o hojení ran. Kortikosteroidy otupují procesy celé zánětlivé fáze. Vitamin A (lokálně nebo 25 000 IU/d perorálně) zmírňuje škodlivé hojivé účinky kortikosteroidů, ale hepatotoxicita může být důsledkem dlouhodobého užívání (tj. Nesteroidní protizánětlivé léky (NSAID) také narušují metabolismus kyseliny arachidonové a tím i hojení ran. NSAID navíc inhibují funkci krevních destiček, což je jeden z nejčasnějších procesů v zánětlivé fázi.
studie Sutcliffe et al navrhl, že upregulace gap junction proteinu connexin je společné pro chronické rány. Zkoumání connexinu ve třech typech ran-žilní noha, diabetická noha, a tlakové vředy-vyšetřovatelé zjistili, že každý typ rány vykazoval upregulaci epidermálního connexinu 43, connexin 26, a connexin 30, stejně jako dermální connexin 43.